恩格列净通过剂量依赖性调控自噬对心肌梗死大鼠室性心律失常的影响
2023-08-04丁艳玲敬玉玲
叶 强,丁艳玲,敬玉玲,李 涛,2
1.西南医科大学附属医院心血管内科(泸州646000);2.西南医科大学心血管医学研究所,医学电生理教育部重点实验室,四川省医学电生理重点实验室(泸州 646000)
心肌梗死(myocardial infarction,MI)是一种死亡率和致残率极高的心血管疾病。随着发病率的快速上升,使其成为全球关注的公共卫生问题[1]。室性心律失常(ventricular arrhythmias,VAs)是MI 后心脏骤停的主要原因,严重威胁患者的生命安全[2],减少MI后VAs对改善患者预后非常重要。抗心律失常药物是治疗VAs的基础,但目前抗心律失常药物缺乏特异性,且部分药物本身具有潜在致VAs 发生的作用,所以临床使用受限[3]。故探索抗VAs 药物的相关机制是预防MI后VAs发生和发展的关键。自噬在维持体内平衡中起着重要作用。心肌缺血时,自噬通过清除受损细胞器,导致氧化应激损伤、ROS 积累和线粒体通透性增加[4],从而增加心律失常的风险[5]。
钠-葡萄糖共转运蛋白2 抑制剂(sodium-glucose co-transporter 2 inhibitor,SGLT2i)是新型降糖药,通过抑制肾小管钠-葡萄糖共同转运体2 主动重吸收葡萄糖,降低肾糖阈,增加尿葡萄糖的排出,从而降低血糖。其在安全有效降糖的同时还发挥着显著的心血管保护效应[6],改善心衰作用显著,目前已被写入心衰指南[7]。有研究证实SGLT2i 可改善心律失常的发生和发展[8]。DECLARE-TIMI 58 试验显示,2 型糖尿病患者可被达格列净(dapagliflozin,DAPA)降低19%发生房颤/房扑的风险[6]。在二尖瓣反流小鼠中,DAPA 降低了房颤的诱导率和持续时间[9]。恩格列净(empagliflozin,EMPA)可缩短糖尿病大鼠Q-T 间期(QTc:190±4 msVS.160±3 ms,P <0.005),缩短动作电位持续时间[10]。SATO等研究发现DAPA 不改变2 型糖尿病患者的心率或QTc间期,但QTc离散度可显著降低[11]。在糖尿病小鼠中,EMPA 可影响心房传导时间,高剂量(30 mg/kg)可将房颤发生率从85%降低至36.8%[12]。目前关于SGLT2i 改善心律失常的报道几乎均是针对糖尿病患者,SGLT2i 是否通过降糖作用达到改善心律失常的作用仍不清楚,且目前关于SGLT2i改善心律失常及探索相关机制的报道仍较缺乏,尤其是基础实验更为缺乏。故本实验通过构建非糖尿病大鼠MI模型探讨EMPA是否可通过剂量依赖性调控自噬改善MI 大鼠VAs 的发生,并对其机制进行探索,旨在为临床上MI 后VAs 的预防和药物治疗提供实验室依据,对SGLT2i心血管保护作用的相关机制进行探索,对MI后VAs药物的研发提供新的思路。
1 材料与方法
1.1 实验动物
60只健康雄性SD大鼠,约200 g/只,SPF级。由西南医科大学动物实验中心提供。所有动物程序均符合美国国立卫生研究院出版的《实验动物护理和使用指南》(2011年第8版),并经西南医科大学动物伦理委员会审核通过(编号:20211115-019)。大鼠造模前进行1周适应性喂养。饲养室保持安静,饲养温度控制在25 ℃左右,湿度控制在40%左右,昼夜交替饲养12 h,不限制摄食饮水,定期更换垫料。
1.2 主要试剂
恩格列净(欧唐静10 mg/片,上海勃林格殷格翰药业有限公司)、兔P62 抗体(cell signaling technology,CST,5114S)、兔Beclin-1 抗体(cell signaling technology,CST,3738)、兔LC3 抗体(cell signaling technology,CST,4108)、GAPDH抗体(ELK biotechnology,EA015)、Omni-ECL™超灵敏化学发光检测试剂盒(EpiZyme/雅酶,SQ201-100ml)、羊抗兔二抗(ASPEN,AS1107)。
1.3 主要仪器
小动物呼吸机(成都泰盟)、BL-420F 生物机能试验系统(上海康为)、Vevo 2100 小动物超声心动图机(FUJIFILM)、电刺激仪(NIHON KOHDEN)、电泳仪(Biorad 公司)、WB 显影仪(Biorad 公司)、恒温烘箱(山东博科医疗有限公司)、石蜡包埋机(孝感亚光有限公司)、切片机(Leica 公司)、摊烤片机(孝感亚光有限公司)、摊烤片机(孝感亚光有限公司)、全自动数字切片扫描仪(KFBIO)。
1.4 动物模型建立及分组
SD 大鼠禁食禁饮12 h 后,腹腔注射戊巴比妥麻醉,经口腔行气管插管,插管成功后连接呼吸机进行机械通气(潮气量0.8 mL,呼吸频率80 次/min,呼吸时间比5:4),用标准导联I、II、aVF 记录心电图。50 只大鼠按照文献[13]方法进行心肌梗死模型制作,左室心肌颜色由红变白、心肌搏动变弱或心电图提示S-T 段抬高提示造模成功[14-15],然后逐层缝合胸壁肌肉,关胸。术中死亡4只,取下呼吸机后死亡7只,其余39只心肌梗死大鼠随机分为MI 组、low-EMPA 组(10 mg/kg·d)和high-EMPA 组(30 mg/kg·d),每组13只。Sham组10只大鼠,只开胸不结扎前降支。MI组和Sham组每天予以3 mL 生理盐水灌胃,low-EMPA 组每天予以10 mg/kg EMPA灌胃,high-EMPA组每天予以30 mg/kg EMPA 灌胃,灌胃4周。
1.5 超声心动图检测
大鼠灌胃4 周后,持续吸入异氟烷(维持浓度1.5%)保持麻醉状态。备皮后行M 型超声心动图检测左室前壁厚度(left ventricular anterior wall thickness,LVAWT)、室间隔厚度(interventricular septum thickness,IVST)、射血分数(ejection fraction,EF)、左室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左室收缩末期内径(left ventricular endsystolic diameter,lveds)、左室后壁厚度(left ventricular posterior wall thickness,LVPWT)等指标。
1.6 Burst刺激
腹腔注射戊巴比妥进行麻醉,开胸暴露心脏,将起搏器电极插入心肌梗死心肌周边区域心肌1 mm深,两电极之间间隔2 mm,电极距梗死边缘3 mm 内。使用电刺激仪行Burst刺激(周长60 ms,脉宽10 ms,持续时间30 s)[16],每两次电刺激间隔时间为1 min,以12 V 为刺激电压,每只大鼠刺激10 次。记录室性早搏(ventricular premature beat,VPB)、室速(ventricular tachycardia,VT)、室颤(ventricular fibrillation,VF)发生次数以及心脏骤停(vudden cardiac death,SCD)。VT被定义为持续的心室节律超过1 s或连续3次以上的室性期前收缩。VF 被定义为持续性室颤,伴有快速、严重不规则的心律。实行加分制,VPB:1 分/次;VT:2 分/次;VF:4分/次;SCD:6分。
1.7 HE染色
离体心脏被固定在4%多聚甲醛中48 h,用二甲苯置换出组织中的乙醇,后置于石蜡中冷却,再用切片机切成5~10 μm 的薄片,在摊片机上摊片后贴于玻片,放入62 ℃的烤箱中烤100 min 即可。将切片置于二甲苯中脱蜡10 min 后放入100%、95%、85%、70%酒精中各5 min,使用蒸馏水冲洗后进行HE 染色。将切片依次放入95%酒精I 5 min、95%酒精II 5 min、无水乙醇Ⅰ5 min、无水乙醇Ⅱ5 min、二甲苯Ⅰ5 min、二甲苯Ⅱ5 min中脱水透明。将切片从二甲苯拿出来稍晾干,中性树胶封片[17]。显微镜观察,图片采集分析。
1.8 Western Blot
从左室梗死边缘心肌组织中提取蛋白,使用BCA试剂盒检测样品蛋白浓度,检测方法遵照说明书。使用RIPA裂解液和6倍SDS-PAGE蛋白质加载缓冲液将样品中的蛋白质浓度稀释至5 mg/mL。样品100 ℃下煮沸10 min 后,分装于5 mL EP 管,分别置于-20 ℃及-80 ℃保存。然后制作10%凝胶,在running buffer中拔除梳子,每个样品孔中加入10 μL样品。先用80 V电压进行电泳,待蛋白质进入下层胶后,继续以150 V 电压电泳40 min。PVDF膜经过甲醇激活后,根据正负极制作转膜“三明治”,以250 mA 电流在tans-buffer 中转膜90 min 后使用无蛋白快速封闭液封闭15 min。PVDF 膜分别与P62抗体(1:2 000)、Beclin-1抗体(1:2 000)、LC3 抗体(1:1 000)、GAPDH 抗体(1:10 000)在4℃下孵育过夜。PVDF 膜经TBST 冲洗3 次后(10 min/次),室温下在低速摇床上与羊抗兔二抗(1:10 000)孵育1.5 h。TBST再冲洗3次(10 min/次)。免疫反应条带用化学发光法检测。用Image J 软件对蛋白条带进行定量。
1.9 统计学分析
运用SPSS 17.0统计软件进行数据处理,计量资料用均数±标准差()的形式表示,组间比较采用方差分析,以P <0.05为差异有统计学意义。
2 结果
2.1 大鼠死亡情况
Sham 组大鼠全部存活,MI 组大鼠死亡3 只,low-EMPA组死亡2只,high-EMPA组死亡1只。
2.2 超声心动图检测
如图1 所示,与Sham 组相比,MI 组大鼠LVAWT、IVST、EF 明显降低(P <0.05),LVEDD、LVEDS 明显升高(P <0.05),LVPWT 差异无统计学意义(P>0.05);与MI 组相比,low-EMPA 组和high-EMPA 组大鼠LVAWT、IVST、EF 显著升高(P <0.05),LVEDD、LVEDS 显著降低(P <0.05),LVPWT 差异无统计学意义(P>0.05);low-EMPA 组和high-EMPA 组相比,LVAWT、LVPWT、EF 差异没有统计学意义(P>0.05);low-EMPA组大鼠比high-EMPA组大鼠IVST明显增加(P <0.05),LVEDS、LVEDD明显降低(P <0.05)。
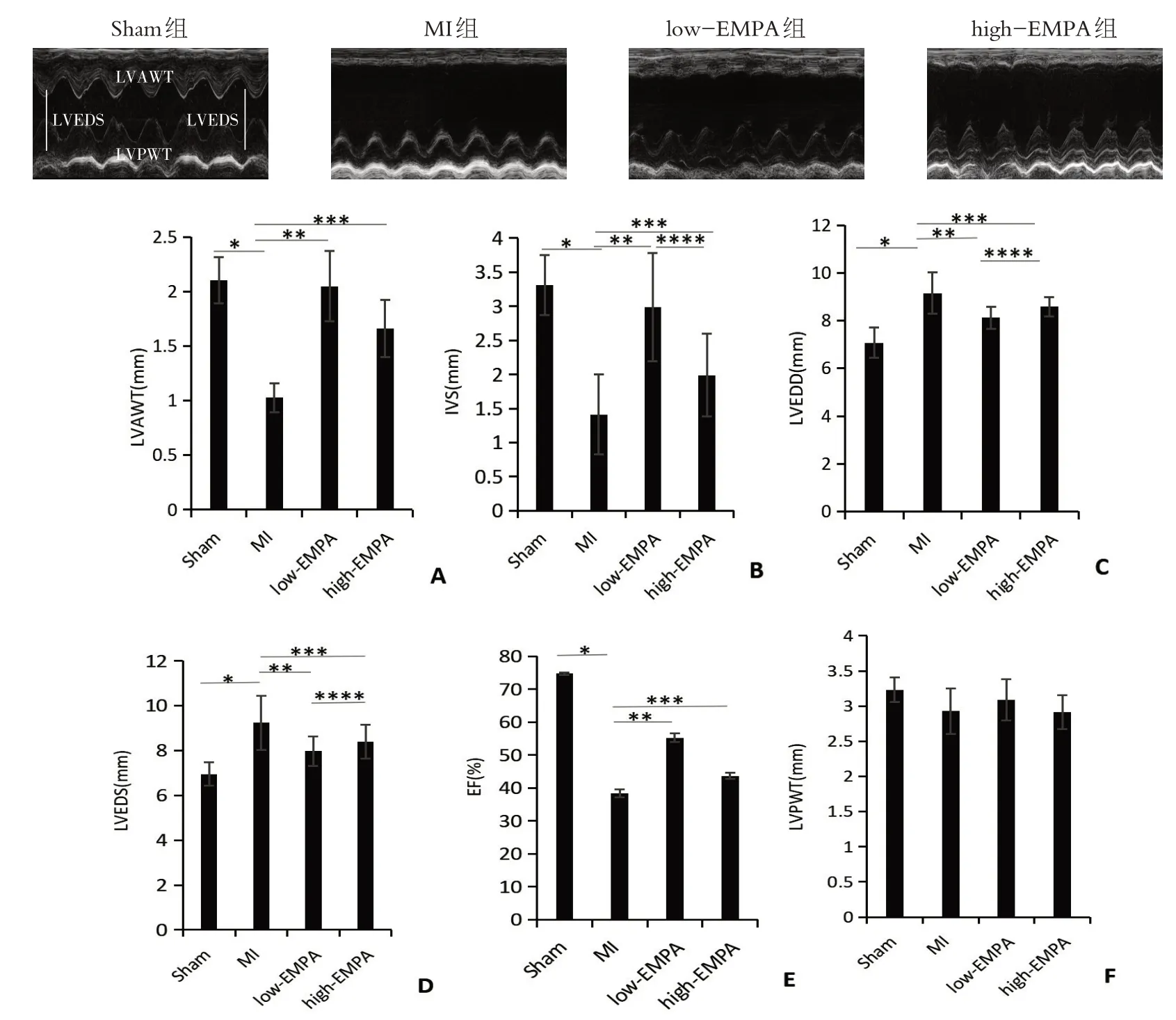
图1 药物干预4周后超声心动图检测结果Figure 1 Ultrasound of rats after 4 weeks of drug intervention
2.3 VAs得分情况
如图2 所示,与Sham 组相比,MI 组大鼠VAs 得分明显升高(P <0.05);与MI 组大鼠相比,low-EMPA 组和high-EMPA组大鼠VAs得分明显降低(P <0.05),其中high-EMPA 组得分降低更明显,但low-EMPA 组和high-EMPA组VAs得分差异无统计学意义(P>0.05)。
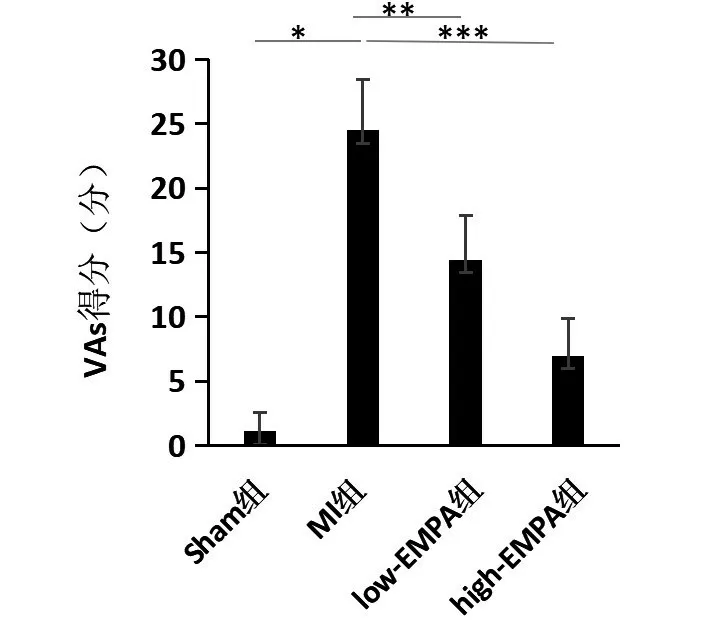
图2 VAs得分Figure 2 VAs scores
2.4 HE染色
如图3所示,Sham组心肌细胞排列规律整齐,炎性细胞浸润较少;MI组心肌细胞排列紊乱,核固缩,大量炎性细胞浸润,大量胶原纤维沉积。较MI 组,low-EMPA 组和high-EMPA 组大鼠心肌排列趋于整齐,炎性细胞浸润减少,且high-EMPA组浸润减少更明显。
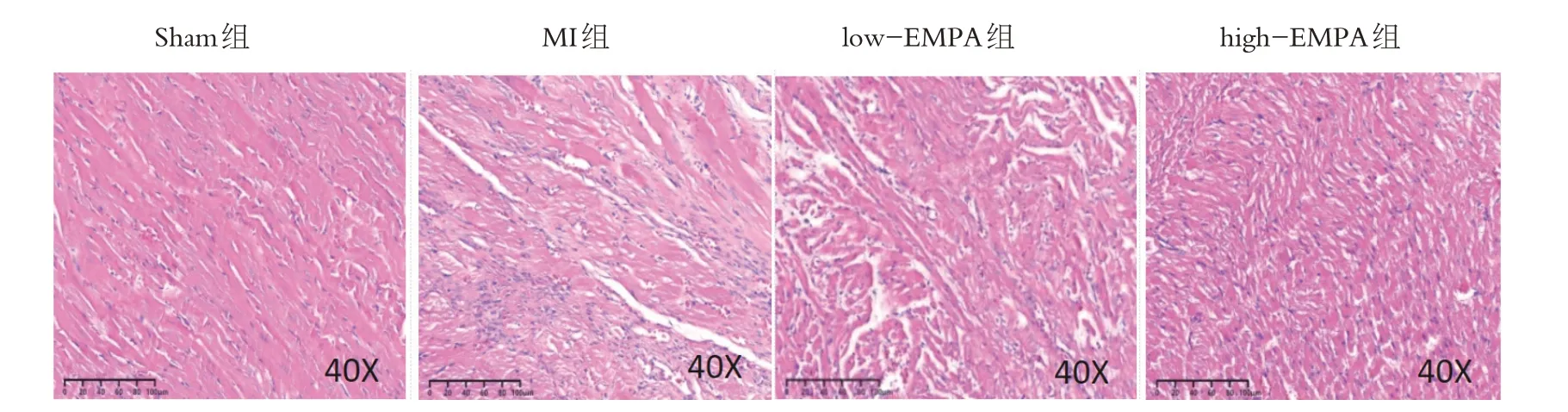
图3 HE染色Figure 3 HE staining
2.5 Western Blot
如图4 所示,与Sham 组相比,MI 组P62 表达增加(P <0.05),Beclin-1、LC3II 表达降低(P <0.05);与MI组相比,low-EMPA 组和high-EMPA 组P62 表达降低(P <0.05),Beclin-1、LC3II 表达增加(P <0.05);与low-EMPA 组相比,high-EMPA 组P62 表达降低(P <0.05),Beclin-1、LC3II表达增加(P <0.05)。

图4 自噬相关蛋白表达Figure 4 Expression of autophagy related proteins
3 讨论
本实验通过构建非糖尿病大鼠MI模型探讨EMPA是否可通过剂量依赖性调控自噬改善MI 大鼠VAs 的发生,并对其机制进行探索。药物干预4周后,超声心动图结果显示,EMPA 可显著改善MI 大鼠心功能及心脏形态,这与目前大多数研究报告是一致的[7,18-20]。但本实验结果显示low-EMPA 组较high-EMPA 组心功能及心脏形态改善更明显,这与本实验的预期稍有偏差。结合HE染色结果,EMPA治疗后MI大鼠心肌炎性细胞浸润、胶原纤维沉积得到改善,猜想EMPA改善心功能及心脏形态与心肌炎症及心肌纤维化相关,但是本文未对其进一步进行探索,这是本实验的局限性。
电刺激的结果显示EMPA可显著降低MI大鼠VAs得分,且high-EMPA组得分降低更明显,表明EMPA可剂量依赖性地改善MI 大鼠VAs 的发生。WANG 等也发现DAPA 可显著减少异丙肾上腺素诱导的心肌病大鼠VAs 的诱导率(5/7 VS.0/8)[21]。这与本研究得出的SGLT2i 可改善VAs 发生的结论是一致的。然而,FERNANDES 对14 项涉及49 963 例2 型糖尿病和(或)心衰患者的临床试验进行了荟萃分析,发现与对照组相比,VAs 的发生率并没有显著降低(OR 0.85;95%CI 0.66~1.11;P=5.23),但心源性猝死(sudden cardiac death,SCD)发生率下降28%[22]。
心肌缺血时,自噬通过清除受损细胞器,导致氧化应激损伤、ROS积累和线粒体通透性增加、炎症反应增强,从而加重心肌损害,导致VAs 的发生。本实验Western blot 结果显示EMPA 可显著降低P62 表达,增加Beclin-1、LC3II 表达,且此效应high-EMPA 组更明显,表明EMPA 可剂量依赖性的增加MI 大鼠心肌细胞自噬水平,与既往研究一致。有研究发现SGLT2i可通过上调线粒体自噬相关蛋白Bnip3 mRNA 水平来改善糖尿病MI 模型小鼠的心肌细胞自噬,从而提高Bnip3蛋白水平,防止自噬小体数量减少[23]。此外,SGLT2i在肝脏中也有改善自噬反应的作用。研究发现EMPA通过增强AMPK/mTOR 信号通路,增强肝脏巨噬细胞自噬,从而抑制IL-17/IL-23炎症轴,缓解炎症,显著改善T2DM 小鼠非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)的肝损伤[24]。Nasiri-Ansari N 等报道EMPA 可调控NAFLD 小鼠AMPK/mTOR 信号通路,同时上调自噬标志物LC3B 和Bcl2/Bax 的表达水平,导致肝细胞自噬增加[25]。
4 结论
EMPA 可剂量依赖性改善心肌梗死大鼠VAs 的诱导率,其机制可能是改善心功能及心脏结构重构、激活心肌细胞自噬。
