ERCC1蛋白的表达在胃癌患者病理诊断中的意义研究
2023-08-03杨丽英屠云娇
闵 文,杨丽英,闵 洁,屠云娇
(云南省红河州第一人民医院病理科,云南 红河 661199)
胃癌是消化系统常见、高发的恶性肿瘤之一,起源于胃黏膜细胞。早期胃癌患者无典型临床表现,随着病情进展可出现腹痛、厌食、呕血、黑便等症状,且患者随着出血量的增加可继发失血性休克,威胁生命安全[1]。统计显示,近年来随着我国居民生活习惯、饮食结构的变化,胃癌的发病率持续升高并趋于年轻化[2]。手术是目前临床治疗胃癌的主要方案,但不同时期开展手术的治疗效果不同,其中早期胃癌患者术后5 年生存率高达90% ~100%,而晚期胃癌缺乏有效的治疗手段,经综合治疗患者的5 年生存率不足30%。因此,临床需采取有效措施及早对胃癌进行诊断,确保患者尽早得到科学治疗[3]。剪切修复交叉互补修复缺陷偶联因子1(excision repair cross-complementation group 1,ERCC1)蛋 白 是 一种高度保守的DNA 核酸内切酶,是核苷酸切除修复(Nucleotide excision repair,NER)过程中的关键部件,但临床对其在胃癌病理诊断中的研究较少。为进一步分析ERCC1 蛋白的表达在胃癌患者病理诊断中的意义,本文特进行如下研究。
1 资料与方法
1.1 一般资料
遵循随机原则,选择2020 年5 月至2022 年5 月在我院确诊为胃癌的50 例患者为观察组,并选择同期的健康体检人群50 例作为对照组。纳入标准:(1)观察组患者的病情经病理学检查确诊为胃腺癌;(2)年龄≥20 岁;(3)精神及心理状态正常;(4)病理及随访资料完整。排除标准:(1)存在认知、精神或语言障碍;(2)观察组患者术前实施放疗或靶向治疗;(3)标本中组织蛋白降解,导致免疫组织化学(免疫组化)染色结果不满意;(4)临床病理及随访资料缺失;(5)观察组患者合并其他恶性肿瘤;(6)观察组患者无法耐受手术治疗;(7)观察组患者的肿瘤发生转移;(8)存在严重的心、肝、肾等器官功能不全。观察组中,男32 例,女18 例,中位年龄57(42,72)岁,中位病灶直径5.0(1,9)cm ;肿瘤分化程度:16 例高分化、20 例中分化、14 例低分化;肿瘤分期:30例Ⅰ~Ⅱ期、20 例Ⅲ~Ⅳ期;病变部位:10 例胃体癌、40 例胃窦癌。对照组中,男33 例,女17 例,中位年龄57.5(41,74)岁。两组的性别、年龄对比差异无统计学意义(P>0.05),可对比。
1.2 方法
检测方法:(1)取对照组正常胃部组织及观察组病灶组织、癌旁组织(距离病灶边缘>5 mm),将石蜡切片脱蜡至水,加入浓度为3% 的H2O2,室温下孵育10 min,以消除内源性过氧化物酶的活性。蒸馏水冲洗,PBS 缓冲液浸泡3 min×3 次,将最终获得的切片放置在0.01 mol/L 的枸橼酸盐缓冲液(pH 为6.0)中。高压锅加热至煮沸后,将玻片放入高压锅中,加上加压阀,高压锅达到最大压力(喷气)2 min 后关闭电源,常温下自然冷却处理。取出玻片,采用PBS缓冲液洗涤2 次,每次洗涤时间均控制为5 min。(2)洗涤结束后加入5%BSA 封闭液,甩干后加入一抗(人兔抗人ERCC1 蛋白抗体),置于湿盒中室温孵育2 h。(3)PBS 缓冲液冲洗3 min×3 次。(4)甩干玻片,加入生物素标记二抗工作液,室温孵育30 min,PBS缓冲液冲洗3 min×3 次。(5)DAB 显色3 ~10 min,以苏木素复染后封片,光学显微镜下观察,每份标本测定3 次后取均值。阳性判断方法[4]:参考奥尔雷德评分标准,分别从细胞的阳性数量、染色强度进行免疫组化染色评分,总分16 分,4 ~12 分为阳性,得分越高则阳性表达越强。其中阳性细胞数≤25% 为0分、26% ~50% 为1 分、51% ~75% 为2 分、>75%为3 分;染色后不着色为0 分,黄色为1 分,棕黄色为2 分,黄褐色为3 分。
1.3 观察指标
比较两组ERCC1 蛋白的阳性率。分析ERCC1 蛋白在不同病理中的表达。分析ERCC1 蛋白与胃癌患者性别、年龄、肿瘤大小、淋巴结转移、肿瘤分期、分化程度的相关性。
1.4 统计学方法
研究涉及数据采用SPSS 23.0 软件分析,计数资料以±s或中位数(用四分位数间距)表示,行t或非参数检验,计数资料以% 表示,行χ² 检验,P<0.05 为差异有统计学意义。采用Pearson 相关性检验对ERCC1 蛋白与胃癌患者性别、年龄、肿瘤大小、淋巴结转移、肿瘤分期、分化程度的相关性进行分析。
2 结果
2.1 两组ERCC1 蛋白阳性率的对比
观察组病灶组织中ERCC1 蛋白的阳性率(70.00%)相较于癌旁组织(4.00%)、对照组(2.00%)均更高(P<0.05);观察组癌旁组织中ERCC1 蛋白的阳性率与对照组相比无明显差异(P>0.05)。详见表1。
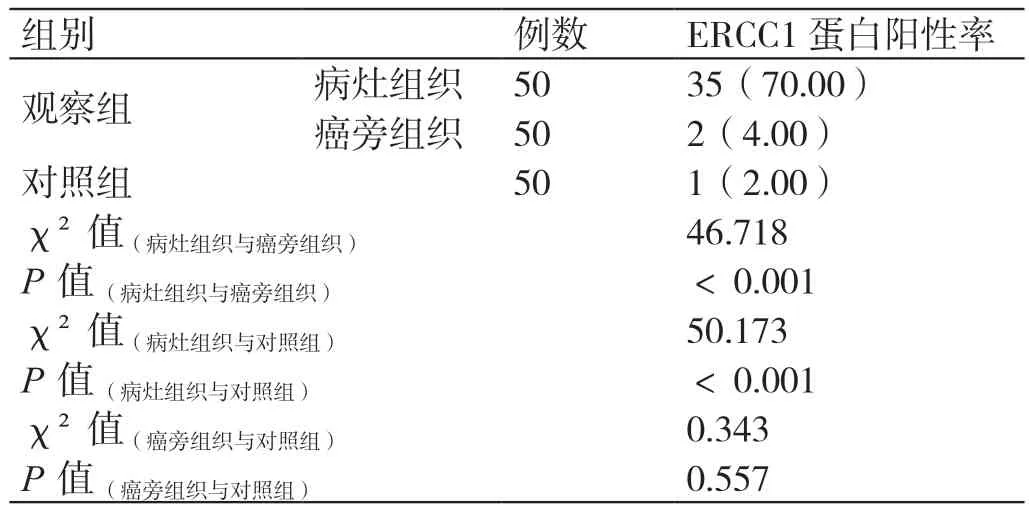
表1 两组ERCC1 蛋白阳性率的对比[例(%)]
2.2 ERCC1 蛋白在不同病理中的表达情况
观察组胃癌组织中ERCC1 蛋白的阳性率与肿瘤大小、淋巴结转移、肿瘤分期、分化程度密切相关,肿瘤大、有淋巴结转移、肿瘤分期Ⅲ~Ⅳ期、分化程度高的患者ERCC1 蛋白的阳性率更高,与肿瘤小、无淋巴结转移、肿瘤分期Ⅰ~Ⅱ期、分化程度低或中等患者相比差异显著(P<0.05)。详见表2。
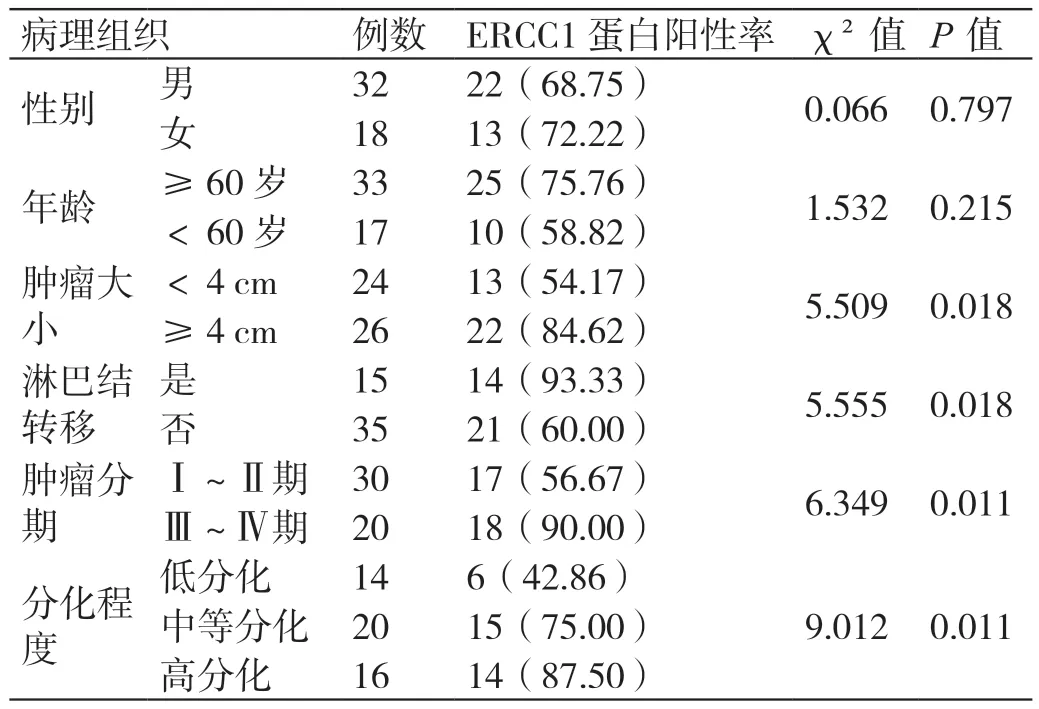
表2 ERCC1 蛋白在不同病理中的表达情况
2.3 ERCC1 蛋白阳性率与胃癌患者性别、年龄、肿瘤大小、淋巴结转移、肿瘤分期、分化程度的相关性
Pearson 程序中输入50 例胃癌患者的ERCC1 蛋白阳性率,分析ERCC1 蛋白阳性率与患者性别、年龄、肿瘤大小、淋巴结转移、肿瘤分期、分化程度的相关性,结果显示,ERCC1 蛋白阳性率与患者的年龄、性别无关,与肿瘤大小、淋巴结转移、肿瘤分期、分化程度呈正相关。详见表3。
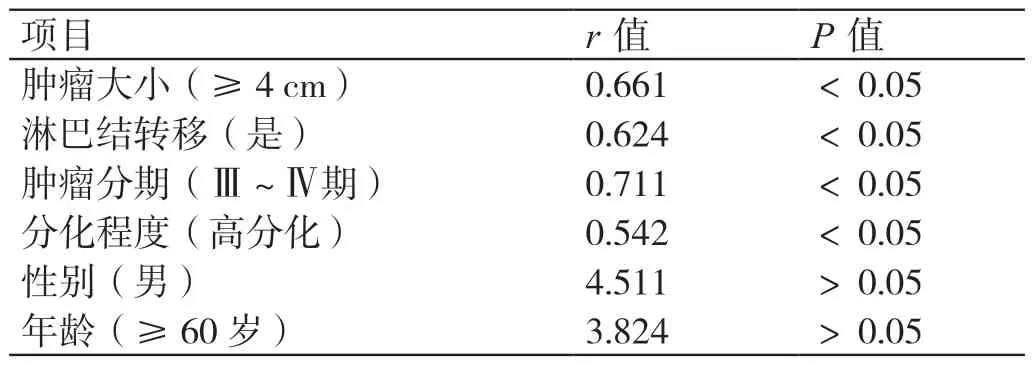
表3 ERCC1 蛋白阳性率与胃癌患者性别、年龄、肿瘤大小、淋巴结转移、肿瘤分期、分化程度的相关性
3 讨论
胃癌是起源于胃黏膜上皮细胞的恶性肿瘤,统计显示该病的发病率居恶性肿瘤首位[5]。胃癌可发生在胃的任何部位。本病的发生与幽门螺杆菌感染、遗传、环境、饮食、慢性胃炎等因素密切相关。大部分胃癌患者在发病早期均无明显症状,少数患者可出现轻微饱胀不适、消化不良等症状,因此患者的重视程度不高。在疾病进展过程中患者可出现上腹部疼痛、体重下降等症状,疾病晚期可出现贫血、厌食等症状,导致患者体重持续下降,形成恶病质[6]。近年来随着我国经济的发展,人们对自身健康的关注度越来越高,如何在胃癌早期实现诊断与治疗成为当前临床亟待解决的问题[7]。临床研究发现,NER 途径是修复DNA 损伤的途径之一,而ERCC1 为NER 途径中的重要分子[8]。从生理角度分析,ERCC1 蛋白位于染色体19q13-2 中,含有10 个外显子,该蛋白单独存在时并不十分稳定,但可以有效识别并切除损伤的DNA链5 端[9-10]。其次,ERCC1 蛋白可参与双链断裂修复途径,同时对链间交联进行修复。此外,有研究发现ERCC1 蛋白在机体中的表达可准确反映恶性肿瘤患者瘤体内DNA 损伤的修复能力。为进一步了解RCC1蛋白的实际应用价值,本文遴选50 例胃癌患者进行研究,结果显示,观察组病灶组织中ERCC1 蛋白的阳性率相较于癌旁组织、对照组均更高,但观察组癌旁组织中ERCC1 蛋白的阳性率与对照组相比无明显差异;Pearson 相关性分析显示,ERCC1 蛋白阳性率与胃癌患者的年龄、性别无关,与肿瘤大小、淋巴结转移、肿瘤分期、分化程度呈正相关。可见,ERCC1蛋白在胃癌组织中呈现高表达情况,可准确反映本病的发生、进展情况,为临床评估患者的病情提供参考。研究发现,基因损伤程度主要取决于致癌物的剂量及细胞修复受损基因的能力,细胞受损多比细胞受损少的患者更容易出现免疫逃逸现象,可避开正常免疫监管,因此肿瘤增殖速度越快其恶性程度越高[11]。ERCC1 转录、翻译的蛋白质可及时对受损的DNA 进行修复,确保机体内突变的基因得到修复,达到预防癌细胞持续进展的目的,从而可降低肿瘤的发生率或延缓肿瘤的进展[12-14]。查阅资料[15]发现,临床关于ERCC1 蛋白在癌症患者预后评估中的价值存在分歧,但近年来随着相关研究的深入,发现ERCC1 在辅助化疗中的预测效果理想,且在非小细胞肺癌中获得了良好的预测效果,因此后期可就ERCC1 蛋白预测胃癌患者预后的价值进行系统分析。
综上所述,ERCC1 蛋白在胃癌组织中呈高表达,可反映胃癌的严重程度、分期、分化程度等,为本病的临床诊治提供参考。但本研究设计方案较为简单,存在纳入样本数量有限、观察指标少等问题,通过对比虽可证实ERCC1 蛋白在胃癌病理诊断中的应用价值,但无法规避研究偏倚性,鉴于此,后期需优化研究设计方案,为相关研究及临床治疗提供参考和指导。
