安石榴苷调节AMPK/SIRT1信号通路对肺炎大鼠氧化应激损伤的影响
2023-08-02李德炎张创良李朝健卢茜
李德炎 张创良 李朝健 卢茜
肺炎的发病率和死亡率较高,其流行病学和临床异质性给诊断和治疗带来了巨大挑战[1]。肺炎的严重程度与患者的免疫力和治疗时机相关,治疗时机滞后,会出现肺炎并发症,如呼吸衰竭、低血压、休克等[2]。肺炎发病时产生大量炎性因子如TNF-α、IL-6等,炎症反应发生后产生氧化应激,引起肺部氧化损伤[3]。安石榴苷(punicalagin, Pun)提取自石榴皮中,具有抗炎[4]、抗氧化[5]作用,研究显示Pun可以抑制冠状病毒肺炎中SARS-CoV-2 3CL-蛋白酶的活性,从而对冠状病毒肺炎进行治疗[6]。AMPK/SIRT1信号通路在炎症和氧化应激中发挥重要作用,AMPK和SIRT1可以双向调节,研究发现激活该通路可以减轻肠道上皮细胞氧化应激、炎症和细胞凋亡[7-8]。本研究主要探讨Pun调节AMPK/SIRT1信号通路对肺炎大鼠氧化应激损伤的影响。
资料与方法
一、材料
1 实验动物 SPF级雄性SD大鼠60只,7周龄,(200±20)g,购自广东至远生物医药科技有限公司,生产许可证号SCXK(粤)2021-0057。所有大鼠均饲养于本院实验动物中心,正常昼夜光暗交替培养,自由饮食水,国家标准饲料喂养一周后,检查无异常,用于后续实验,经本院实验动物中心伦理委员会批准(2021-076)。
2 试剂与仪器 Pun(HPLC≥98%,西格玛奥德里奇(上海)贸易有限公司),TNF-α、IL-6、IL-1β的ELISA试剂盒(上海酶联生物科技有限公司),SOD、GSH-Px、MDA试剂盒(北京索莱宝科技有限公司);HE染色试剂盒(上海沪震实业有限公司),抗体p-AMPK、AMPK、SIRT1、Mn SOD、p-NF-κB、NF-κB(艾博抗(上海)贸易有限公司)。
全自动血气分析仪(上海涵飞医疗器械有限公司),凝胶成像系统、全自动酶标仪(赛默飞世尔科技中国有限公司),光学显微镜(OLYMPUS奥林巴斯)。
二、方法
1 造模与分组 取SD大鼠,随机选择10只作为对照组(NC组),其余50只建立肺炎大鼠模型,造模参考文献[9]进行:造模大鼠麻醉后,注射器吸取0.2 mL铜绿假单胞菌悬液(2×108cfu/L)注入到气管中,将大鼠固定在手术台上,左右晃动手术台1 min。造模大鼠接种铜绿假单胞菌悬液24 h后出现呼吸急促,胸廓呼吸振动幅度加大,精神倦怠,食欲不振,对外部刺激不敏感,体毛粗糙等现象,视为造模成功。将造模大鼠随机分为模型组(M组)、安石榴苷低、中、高剂量组(Pun-L、M、H,10、20、40 mg/kg)[10]、安石榴苷高+AMPK抑制剂Compound C组(Pun-H+CC组,40 mg/kg+0.2 mg/kg)[11]。对照组大鼠使用同样的方法注入等量灭菌生理盐水。给药干预:Pun-L、M、H组按照各自对应的剂量给予Pun灌胃,Pun-H+CC组给予对应剂量的Pun和Compound C灌胃,M组和NC组按照生理盐水灌胃,1天1次,连续给药1周。
2 样本采集 给药结束后24 h麻醉大鼠,腹主动脉取血。处死大鼠,结扎右侧气管,收集肺泡灌洗液,使用PBS缓冲液润洗左侧肺泡,反复冲洗3次,合并缓冲液,离心后上清用于炎性因子测定,残渣沉淀用于炎性细胞观测,剥离右肺组织,用于病理学观察、氧化应激指标检测、蛋白检测。
3 血气分析 取方法2中采集的腹主动脉血,利用全自动血气分析仪测定各组大鼠动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)、动脉血氧饱和度(SaO2)。
4 肺组织病理学观察 取方法2中剥离的右肺组织中叶,冲洗干净后,加入多聚甲醛固定过夜,乙醇脱水、石蜡包埋、4 μm连续切片,根据HE染色试剂盒进行染色,再次脱水,二甲苯透明,中性树胶封片后,光学显微镜下观察拍照。
5 肺泡灌洗液中白细胞观察 将方法2中收集的肺泡灌洗液沉淀用PBS重悬后,Wright-Giemsa染色细胞后,中性树胶封片,显微镜观察并拍照,记录白细胞的数目。
6 肺泡灌洗液中炎性因子水平 取方法2中收集的肺泡灌洗液上清液,按照ELISA试剂盒说明书操作,检测TNF-α、IL-6和IL-1β水平。
7 氧化应激GSH-Px、SOD、MDA水平表达 将方法2中取得的右肺组织上叶液氮研磨、匀浆、离心后,收集上清,根据对应的氧化应激因子试剂盒操作说明,测定MDA、SOD、GSH-Px水平。
8 Western Blot法检测蛋白表达 取方法2中取得的右肺组织下叶研磨匀浆,加入RIPA裂解液提取总蛋白,BCA试剂盒对蛋白进行定量,10 μL蛋白上样,将蛋白加热变性,电泳、转膜、脱脂牛奶封闭后,加入一抗p-AMPK(1 ∶1 000)、AMPK(1 ∶1 000)、SIRT1(1 ∶1 000)、Mn SOD(1 ∶1 000)、p-NF-κB(1 ∶1 000)、NF-κB(1 ∶1 000),以β-actin(1 ∶1 000)为内参,4 ℃过夜,洗膜,加入二抗(1 ∶2 000),室温孵育2 h,加入显影液显影,凝胶成像仪观察拍照。
三、统计分析

结 果
一、Pun对大鼠血气分析的影响
结果如(表1)所示,与NC组比较,M组大鼠PaCO2显著升高,PaO2和SaO2显著下降(P均<0.05);与M组比较,Pun-L、M、H组的PaCO2值依次下降,PaO2和SaO2值依次上升(P<0.05);Pun-H+CC组与Pun-H组比较,PaCO2值显著升高,PaO2和SaO2值显著下降(P<0.05)。
二、Pun对大鼠肺部病理学变化的影响
如(图1)所示,NC组大鼠肺组织结构正常;M组大鼠肺组织结构损坏严重,出现中性粒细胞浸润,肺泡壁增厚,肺泡萎缩等病理学变化;Pun各处理组随着浓度增大,炎性细胞浸润逐渐减少,肺泡间隔增大,肺泡壁增厚现象减少,其中Pun-H组肺组织炎症改善最明显,Pun-H+CC组与M组呈现相当水平的病理变化。
三、Pun对大鼠肺泡灌洗液白细胞的影响
如(表2)所示,M组大鼠肺泡灌洗液中白细胞数目较NC组显著增加(P<0.05);与M组比较,Pun-L、M、H组白细胞数目依次减少(P<0.05);Pun-H+CC组与Pun-H组比较,白细胞数目显著增加(P<0.05)。
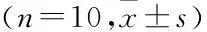
表2 各组大鼠血气值肺泡灌洗液白细胞数量比较
四、Pun对大鼠肺泡灌洗液中炎性因子的影响
如(表3)所示,M组大鼠肺泡灌洗液中炎性因子TNF-α、IL-6、IL-1β水平较NC组显著升高(P<0.05);与M组比较,Pun-L、M、H组TNF-α、IL-6、IL-1β水平依次降低(P<0.05);Pun-H+CC组与Pun-H组比较,TNF-α、IL-6、IL-1β水平显著上升(P<0.05)。
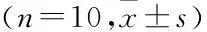
表3 各组大鼠血气值比较
五、Pun对大鼠肺组织氧化应激水平的影响
如(表4)所示,与NC组比较,M组大鼠SOD、GSH-Px活性显著降低,MDA含量显著升高(P<0.05);与M组比较,Pun-L、M、H组的SOD、GSH-Px活性显著升高,MDA含量显著降低(P<0.05),与Pun-H组比较,Pun-H+CC组的SOD、GSH-Px活性显著下降,MDA含量显著升高(P<0.05)。
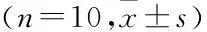
表4 各组大鼠氧化应激因子水平比较
六、Pun对大鼠肺组织AMPK/SIRT1通路蛋白表达的影响
如(图2、表5)所示,与NC组比较,M组大鼠p-AMPK/AMPK、SIRT1、Mn SOD蛋白表达显著降低,p-NF-κB/NF-κB蛋白表达显著升高(P<0.05);与M组比较,Pun-L、M、H组的p-AMPK/AMPK、SIRT1、Mn SOD蛋白表达显著升高,p-NF-κB/NF-κB蛋白表达显著降低(P<0.05),与Pun-H组比较,Pun-H+CC组的p-AMPK/AMPK、SIRT1、Mn SOD蛋白表达显著降低,p-NF-κB/NF-κB蛋白表达显著升高(P<0.05)。

图2 Western Blot检测大鼠肺组织AMPK、SIRT1蛋白条带
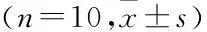
表5 各组大鼠肺组织AMPK、SIRT1蛋白表达比较
讨 论
肺炎是由微生物感染或多种理化因素介导的肺组织病变,常见的肺炎多为细菌性肺炎[12]。铜绿假单胞菌是革兰氏阴性菌,是一种致命病原体,它的III型分泌系统(T3SS)介导该病原体引起肺炎患者诸多不良反应,在免疫功能低下和危重患者中导致高发病率和死亡率[13]。铜绿假单胞菌由抗渗透、抗吞噬的生物膜包被,并且耐药性强[14],是肺炎的治疗难点之一。本研究利用铜绿假单胞菌进行肺炎大鼠造模,以期为临床治疗铜绿假单胞菌所致肺炎提供更多的参考依据。在本研究结果中,造模成功大鼠肺组织出现明显病理学变化,炎性细胞浸润明显,血气值PaCO2升高,PaO2和SaO2下降。
肺炎属于呼吸道感染的炎性疾病,在发病后,肺泡灌洗液中会出现大量中性粒细胞、嗜酸性粒细胞、淋巴细胞等白细胞(炎性细胞),炎症因子也大量释放,是患者病情发生发展的关键因素[15]。有研究指出,在铜绿假单胞菌致肺炎小鼠的血清中检测到高水平的IL-1β、IL-6、IL-17A、TNF-α和IL-8[16]。本研究结果显示肺泡灌洗液中白细胞数目显著增多,炎性因子TNF-α、IL-6和IL-1β也大量释放,与前人研究一致。氧化应激和炎症是密切相关的病理生理过程,物理和生物因素可以单独或协同地引起肺组织中氧化应激的过度产生,随后出现肺部病变和肺炎,在机体中主要表现为自由基过度积累,超出了机体自身的清除力,引起炎性因子释放,机体氧化还原平衡受到破坏,导致肺组织氧化损伤[17]。MDA是脂质过氧化的产物,GSH耗尽会引起氧化应激,SOD是抗氧化酶,通过清除线粒体代谢产生的ROS抑制脂质氧化,可维持机体的氧化与抗氧化平衡[18]。本研究中,M组大鼠MDA含量上升,GSH-Px和SOD活性下降,出现高氧化应激状态,经过Pun处理后,大鼠恢复氧化平衡状态,说明Pun发挥了对肺炎大鼠的抗氧化作用,同时降低炎性因子水平,发挥了抗炎作用。
AMPK/SIRT1通路是介导氧化应激的经典通路,AMPK和SIRT1可以互相激活,从而抑制氧化应激,有大量研究证明此观点,如激活AMPK/SIRT1通路下调氧化应激介导的内质网应激和线粒体功能障碍和体内椎间盘退行性变[19];通过抑制AMPK/SIRT1通路,促进氧化应激从而促进关节炎成纤维细胞样滑膜细胞的线粒体功能障碍和细胞凋亡,减轻关节炎的炎症损伤[20]。本研究中M组大鼠在感染铜绿假单胞菌后产生高氧化应激反应,同时AMPK/SIRT1信号通路相关蛋白p-AMPK/AMPK、SIRT1、Mn SOD蛋白表达降低,p-NF-κB/NF-κB蛋白表达升高,炎症因子大量产生。经过Pun处理后,p-AMPK/AMPK、SIRT1、Mn SOD蛋白表达上升,介导炎症因子的NF-κB磷酸化水平下降,机体恢复氧化还原平衡。通过添加AMPK抑制剂Compound C,发现Pun-H+CC组大鼠出现了与Pun-H相反的结果,说明Pun-H组对于肺炎大鼠氧化损伤的保护作用被AMPK抑制剂Compound C所逆转,提示Pun发挥对肺炎大鼠的抗氧化和抗炎作用是通过AMPK/SIRT1通路实现的。
综上所述,Pun可以通过上调AMPK/SIRT1信号通路,抑制铜绿假单胞菌致肺炎大鼠的氧化损伤和炎症反应。提示Pun具有临床治疗细菌性肺炎的潜力,关于Pun治疗肺炎的深层机制有待进一步研究,以期为发掘药物临床治疗肺炎提供更多的理论支持。
