TXNDC5 siRNA靶向纳米微粒对胃癌模型动物抑瘤作用的实验研究
2023-07-31李相辉侯艳红吴凯杨汨张林
李相辉 侯艳红 吴凯 杨汨 张林
1中国人民解放军总医院第八医学中心消化内科(北京 100091);2河北北方学院(河北张家口 075132)
胃癌是严重威胁国人健康与生命的一种恶性肿瘤,近年来该疾病发病率及病死率在欧美国家已经呈下降趋势[1],在日本及韩国,由于消化内镜检查的推广,早期诊断率大幅提升,总体预后也明显转好[2]。但在我国胃癌仍然呈快速上升的趋势,且早期诊断率较低,预后较差。根据CHEN等[3]的研究显示,胃癌、食道癌和肝癌如今被确定为癌症死亡的主要原因。农村地区居民发病率和死亡率明显高于城市居民。进展期胃癌的治疗效果极差,临床5 年生存率低于40%,临床急需治疗效果更好且毒副作用更小的治疗方法。根据国内外研究发现一些潜在的抑癌基因及RNA,如硫氧还蛋白5(TXNDC5)基因、长链非编码RNA(LncRNA)RP11-356I2.2[4]、粪便miRNA[5]等,它们对癌症尤其是消化系统癌症具有潜在的抑制作用。本研究组前期的基础研究中[6-9]证实:TXNDC5 基因在胃癌前病变及胃癌组织中的表达显著高于正常胃黏膜组织,且该分子高表达与不良的预后关系密切。进一步通过体外细胞实验证实:在正常胃黏膜上皮细胞中上调该基因的表达可使之出现恶性生物学行为表现,而在该分子高表达的胃癌细胞中采用RNA 干扰技术降低其表达可抑制细胞生长,改善恶性生物学表现。这些结果提示TXNDC5 具有作为胃癌靶向治疗潜在目标分子的可能。为了验证干预该分子表达对体内胃癌的抑制作用,我们在本研究中采用纳米微球包载TXNDC5 RNA 干扰核酸片段导入胃癌模型动物体内,观察其对移植瘤模型动物的体内抑瘤作用,进一步评估TXNDC5 作为胃癌治疗靶点的意义。
1 材料与方法
1.1 材料α-氰基丙烯酸正丁酯(BCA)(北京瞬康医用胶有限公司);TXNDC5 单抗(Abnova 公司);其他试剂为国产分析纯。85-2 恒温加热磁力搅拌器(上海志威电器有限公司);微孔滤膜(欣惠泽奥有限公司),Zeta sizerNano ZS90 型激光粒径分析仪(英国马尔文公司);人胃腺癌细胞株SGC7901(解放军总医院第八医学中心消化内科保存),细胞培养于含胎牛血清、青霉素、链霉素的DMEM培养液中。IVIS·Lumina LT 小动物活体成像系统(美国PerkinElmer);Living Image 4.3 图像分析软件(美国PerkinElmer)。细胞及动物实验由中国人民解放军总医院第八医学中心动物实验室进行。
1.2 方法
1.2.1 实验动物BALB/c 裸鼠45 只,全部建模,40 只入实验组5 只后备。雌性,6~8 周龄,体质量18~22 g。实验条件:实验室温度(22~25)℃,相对湿度40%~70% RH,相对空气压力10~20 Pa,空气交换频率10~15 次/h,备有中央空调和空气过滤机械设备,动物笼具、垫料、饮用水等均经高压蒸汽消毒,每笼3 只鼠,饲以SPF 级专用颗粒饲料,自由饮水。裸鼠移植瘤模型建立参见李春梅等[10]报道的方法,取对数生长期的人胃腺癌细胞系SGC7901 细胞,PBS 洗涤3 次,重悬于PBS 中并调整浓度为6 × 107/mL。于每只裸鼠右侧腋部皮下注射0.2 mL 细胞悬液,观察成瘤情况。约8~12 d 成瘤(瘤体直径>0.5 cm)后开始治疗实验。
1.2.2 TXNDC5siRNA-PBCA-NP的制备TXNDC5 siRNA 核酸片段参见本研究组张林等[8]报道的核酸序列合成,具体序列为:5'-cgacctggatgctgcagacactggagtactgcagtgtctgcagcatccagttttt-3',3'-ggacctacgacgtctgtgacctcatgacgtcacagacgtcgtaggtcaaaaagatc-5'。TXNDC5 siRNA双链体DNA合成后参照张林等[8]报道的方法将此双链DNA 片段插入IMG800 RNAi 载体XbaI 和ScaI 酶切位点之间,完成构建TXNDC5 siRNA载体。TXNDC5 siRNA-PBCA-NP的具体制备方法参考本研究组李春梅等[11]的实验方法。称取Dxtran-70 100 mg、PluronicF-127 75 mg 及TXNDC5 siRNA 载体5 mg 溶于无菌水,浓度为5 μmol/L 置于10 mL 烧杯中加无菌水,用0.1 mol/L 盐酸溶液调节pH 至1.4,定容至5 mL,在25 ℃600 r/min 电磁搅拌下缓加入0.06 mL BCA 单体,搅拌5 h 后,用0.1 mol/L NaOH 溶液调节pH 至7.0,继续搅拌0.5 h,用微孔滤膜过滤,即得乳白色胶体溶液。将微球稀释到合适的浓度后,用激光散射粒度分析仪来观察微球粒径的大小及分布。TXNDC5 siRNA-PBCA-NP 的包封率和载药率由下述公式分别计算:载药率=纳米粒子中TXNDC5 siRNA质量/纳米粒子质量×100%,包封率=纳米粒子中TXNDC5 siRNA质量/TXNDC5 siRNA投药量×100%。透射电镜观察纳米颗粒形态。
1.2.3 体内抑瘤实验荷瘤裸鼠随机分为4 组,每组10 只,按以下分组情况进行实验:A 组:按2.5 mg/kg 等剂量的TXNDC5 siRNA-PBCA-NP 经尾静脉注射;B 组:等量PBCA-NP 经尾静脉注射;C组:5-Fu 2.5 mg/kg 量经尾静脉注射;D 组:等量生理盐水经尾静脉注射。每3 天重复治疗1 次,每3天测量1 次肿瘤长径(a)和短径(b)。第15 天及第30 天行活体生物发光检测成像并记录,生物发光实验方法参考王剑超等的研究方法[12]。肿瘤体积V=a×b2/2,按照每组每个测量时间点平均肿瘤体积绘制生长曲线。第30 天处死裸鼠,剥离瘤体称重,抑瘤率=[(对照组瘤重一实验组瘤重)/对照组瘤重]×100%,比较各组间抑瘤率的差异。
1.2.4 各处理组动物肿瘤组织TXNDC5 表达情况检测按上述分组情况进行实验,第30 天处死裸鼠,剥离瘤体称重后,肿瘤组织留取部分进行福尔马林固定,组织石蜡包埋后切片进行HE 染色和TXNDC5 免疫组化检测,按照常规SP 免疫组化法进行。采用免疫组化阳性细胞计数法分析,在40 倍光镜下随机选择10 个不重叠视野,计数阳性着色细胞数,每个组织选3 张切片,每组10 个样本全部计数,而后求出每张切片平均阳性细胞数进行组间比较。各组动物取部分肿瘤组织提取总RNA 和总蛋白行RT-PCR 和Western blot 检测。RT-PCR 检测:取各组鼠肿瘤组织100 mg 左右,使用异硫氰酸胍一步法提取总RNA(Code:D9108,TaKaRa 大连宝生物有限公司),所提取总RNA 液经紫外分光光度计测定A260/A280 值,计算RNA的纯度。使用PrimeScript TMRT reagent Kit(Code:DRR037A,TaKaRa 大连宝生物有限公司)反转录合成cDNA,所有操作均严格按照说明书进行,将所得25 μL 产物冻存于-20 ℃冰箱以备进行PCR。采用常规PCR 法检测,扩增标本以β-actin 作为内参对照,计算检测结果以生理盐水空白对照组标本作为对照。PCR 扩增引物由北京塞百盛基因技术有限公司合成。扩增片段为359 bp。以DNA Marker(DL2000)作为标准分子量标记,以相应的内参电泳条带作为参照,结果以两者之吸光度的比值表示,而后求各组平均值进行组间比较。Western blot 检测:常规提取各组肿瘤组织总蛋白,Bradford 法测定蛋白质含量。常规制备10%分离胶和5%积层胶,按每孔50 μg 的蛋白量加样,样品加等体积的5×蛋白上样缓冲液,上样前将样品在沸水中加热10 min,进行SDS-PAGE 电泳。电泳后进行转膜,将分离蛋白质转移至PVDF 膜上。PVDF 膜于5%脱脂奶粉TBS 中室温孵育2 h 封闭非特异性抗原。而后加1∶1 000 PBS 稀释的一抗4 ℃孵育过夜。用TBS 洗膜3 次,每次10 min,滴加二抗工作液室温下孵育2 h,再TBS 洗膜3 次,每次10 min。随后滤纸吸干残液,完成显色及显影定影。Western blot 检测以β-actin 为内参对照,用图像分析软件IPP6.0 对图像进行灰度分析,结果以目的条带与内参条带灰度的比值表示,而后求各组平均值进行组间比较。
1.3 统计学方法使用SPSS 17.0 统计软件计数资料以率表示,率的比较采用χ2检验;计量资料以(±s)表示,组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 TXNDC5 siRNA-PBCA-NP 的制备按前述方法所得到的纳米颗粒电镜下观察形态表现为光滑的球形,药物均匀地分散在聚合物基质中。TXNDC5 siRNA-PBCA-NP 纳米粒的平均尺寸分别为(79.45±11.24)nm。TXNDC5 siRNA的包封率和载药量分别为(46.68±7.66)%、(8.14±0.69)%,电镜观察纳米颗粒为较为规则的球形分散性良好。成功制备了TXNDC5 siRNA-PBCA-NP 载药纳米粒子(图1)。
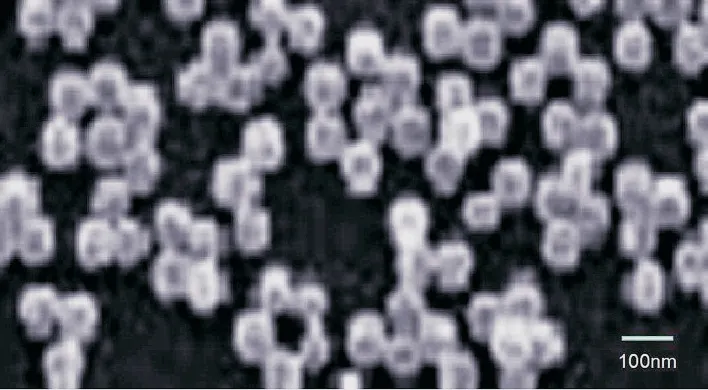
图1 TXNDC5 siRNA-PBCA-NP 载药纳米粒子透射电镜检测图Fig.1 Transmission electron microscopic examination of TXNDC5 siRNA-PBCA-NP drug loaded nanoparticles
2.2 各处理组动物肿瘤组织TXNDC5 表达情况检测
2.2.1 免疫组化检测结果TXNDC5 蛋白阳性主要为肿瘤细胞胞质的棕色颗粒(图2),与其余各组比较,A 组动物肿瘤组织TNXDC5 免疫组化染色强度明显降低(P<0.05),其余各组间差异无统计学意义(表1)。
表1 免疫组化检测各组肿瘤组织TNXDC5 蛋白表达Tab.1 Expression of TXNDC5 protein in tumor tissues of each group detected by immunohistochemistry ±s
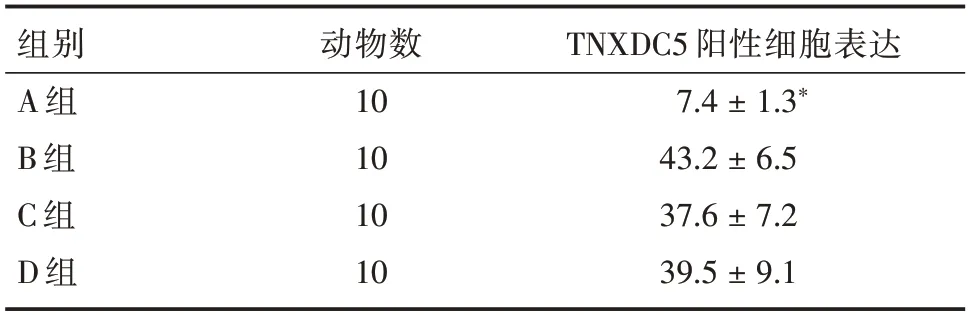
表1 免疫组化检测各组肿瘤组织TNXDC5 蛋白表达Tab.1 Expression of TXNDC5 protein in tumor tissues of each group detected by immunohistochemistry ±s
注:与其他各组比较,*P<0.05
组别A 组B 组C 组D 组动物数10 10 10 10 TNXDC5 阳性细胞表达7.4±1.3*43.2±6.5 37.6±7.2 39.5±9.1

图2 各组动物肿瘤组织TNXDC5 免疫组化检测结果(×200)Fig.2 Immunohistochemical detection results of TXNDC5 in tumor tissues of animals in each group
2.2.2 RT-PCR 检测结果与其余各组比较,A 组动物肿瘤组织TNXDC5 mRNA 表达显著降低(P<0.05),其余各组间差异无统计学意义。见表2、图3。
表2 RT-PCR 检测各组肿瘤组织TNXDC5mRNA 的表达Tab.2 TXNDC5 mRNA expression in tumor tissues of each group detected by RT-PCR ±s

表2 RT-PCR 检测各组肿瘤组织TNXDC5mRNA 的表达Tab.2 TXNDC5 mRNA expression in tumor tissues of each group detected by RT-PCR ±s
注:与其余各组比较,*P<0.05
组别A 组B 组C 组D 组动物数10 10 10 10 TNXDC5 mRNA 表达0.126±0.071*0.510±0.139 0.463±0.115 0.418±0.133

图3 各组动物肿瘤组织TNXDC5 mRNA 表达RT-PCR检测Fig.3 RT-PCR detection of TXNDC5 mRNA expression in tumor tissues of animals in each group
2.2.3 Western blot 检测结果与其余各组比较,A 组动物肿瘤组织TNXDC5 蛋白质表达显著下降(P<0.05)。其余各组间差异无统计学意义。见表3、图4。
表3 各组动物肿瘤组织TNXDC5 蛋白质表达Western blot检测Tab.3 Western blot detection of TXNDC5 protein expression in tumor tissues of animals in each group ±s
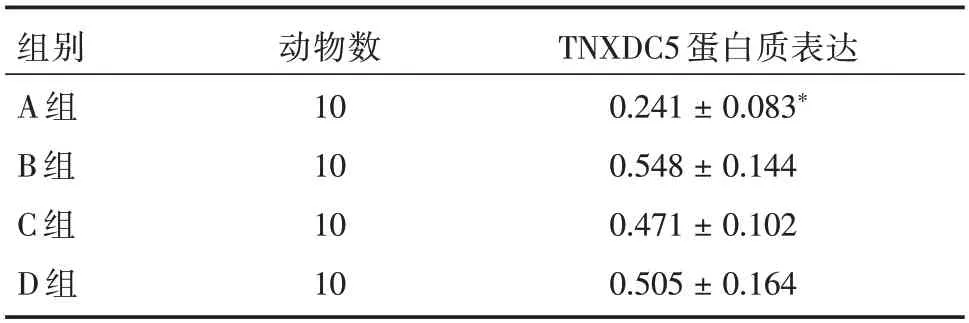
表3 各组动物肿瘤组织TNXDC5 蛋白质表达Western blot检测Tab.3 Western blot detection of TXNDC5 protein expression in tumor tissues of animals in each group ±s
注:与其余各组比较,*P<0.05
组别A 组B 组C 组D 组动物数10 10 10 10 TNXDC5 蛋白质表达0.241±0.083*0.548±0.144 0.471±0.102 0.505±0.164

图4 各组动物肿瘤组织TNXDC5 蛋白质表达Western blot检测Fig.4 Western blot detection of TXNDC5 protein expression in tumor tissues of animals in each group
2.3 TXNDC5 siRNA-PBCA-NP 体内抑瘤实验结果以各组裸鼠移植瘤体积均值绘制肿瘤生长曲线(图5)。治疗后30 d 各治疗组肿瘤质量计算抑瘤率,A 组、C 组抑瘤率显著高于B、D 两组,差异均有统计学意义(P<0.05),A、C 两组及B、D 两组间差异无统计学意义,见表4。
表4 各组裸鼠治疗后肿瘤质量Tab.4 Tumor mass of nude mice in each group after treatment ±s,mg
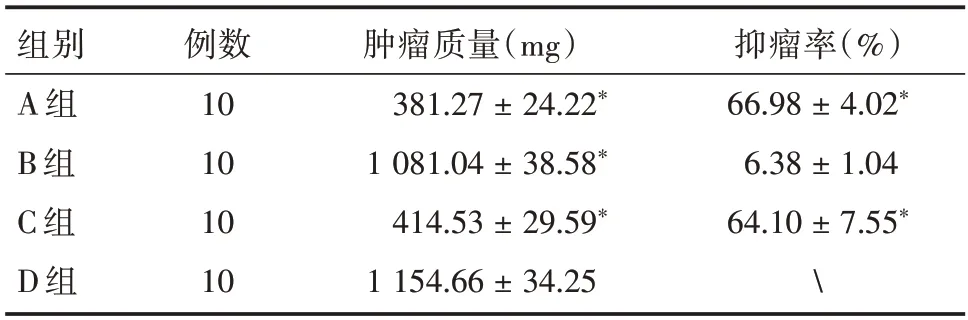
表4 各组裸鼠治疗后肿瘤质量Tab.4 Tumor mass of nude mice in each group after treatment ±s,mg
注:*表示与B、D 组两两比较差异有统计学意义,P<0.05
组别A 组B 组C 组D 组例数10 10 10 10肿瘤质量(mg)381.27±24.22*1 081.04±38.58*414.53±29.59*1 154.66±34.25抑瘤率(%)66.98±4.02*6.38±1.04 64.10±7.55*

图5 实验动物肿瘤生长曲线Fig.5 tumor growth curve of experimental animals
2.4 体内抑瘤实验活体生物发光检测结果生理盐水空白对照组和单纯纳米颗粒治疗组荷瘤裸鼠肿瘤范围和光子量随时间进行性升高,而采用TXNDC5 siRNA-PBCA-NP 和5-Fu 干预组荷瘤裸鼠肿瘤范围和光子量均受到不同程度的抑制。各组处理前肿瘤光子量差异无统计学意义(P>0.05)。给药第15 天和30 天行生物发光检测时,TXNDC5 siRNA-PBCA-NP 和5-Fu 组裸鼠肿瘤光子量显著低于其他各组(P<0.05),结果见图6、7。

图7 生物活体发光检测胃癌荷瘤裸鼠肿瘤光子量Fig.7 Bioluminescence detection of tumor photons in nude mice bearing gastric cancer
3 讨论
胃癌绝大多数起源于胃黏膜腺上皮细胞,起初生长于人体胃黏膜层,早期无明显症状,直至侵犯周边组织脏器后方可引起症状。常规体检血常规、生化及肿瘤标志物检测和普通的腹部超声及CT 检查难以发现,以日本为代表的西方发达国家近年来推广了消化内镜普查,明显提升了胃癌的早期发现率,继而提高了该肿瘤的治愈率。但按照目前我国的整体医疗水平、国民认知水平和传统观念尚无法推广全面的消化内镜普查,因此国内大多数胃癌发现时均为进展期,缺乏有效的治疗手段,故预后极差[13-14]。因此针对进展期胃癌有效而低副反应的治疗方法是目前研究的热点。分子靶向治疗和生物免疫治疗开启了恶性肿瘤治疗的新时代,其中胃癌分子靶点问题是一个研究热点,本研究组近年来进行了胃癌前炎症性病变恶性转化的分子机制研究。通过差异蛋白组学研究我们发现TXNDC5 蛋白分子可能在癌前病变向胃癌的演变中具有重要意义[7]。随后又采用基因转染及RNAi 方法建立TXNDC5 表达上调胃黏膜上皮细胞系及下调的胃癌细胞系,检测这些细胞系生长、增殖、细胞周期及凋亡、迁徙能力等恶性相关生物学特性,研究[8]结果提示TXNDC5 表达上调可明显促进生长、增殖及迁徙能力,而下调则有相反作用。在此基础上我们进行了TXNDC5 蛋白分子在较大人群样本胃癌组织中的表达,免疫组织化学检测并分析其与患者临床生存情况和病理学特征的相关性。结果也提示TXNDC5 高表达可能与肿瘤更高的恶性程度及更差的预后相关[9]。国外的一些研究[15-25]表明TXNDC5 基因在宫颈癌、胃癌、肺癌、肝癌及神经胶质瘤等多种人类肿瘤组织或细胞中表达上调,并且均提示TXNDC5 分子在多种肿瘤中可能均有较明显的促癌作用,具有作为恶性肿瘤治疗分子靶点的潜力。纳米载药系统是另一个近年来热点方向,国内外已经有采用纳米载药系统进行恶性肿瘤治疗的研究[26-34],如碳纳米束、金纳米粒子、纳米二氧化硅和超顺磁性、氧化铁纳米粒子等无机纳米粒子以及白蛋白纳米粒子、壳聚糖纳米粒子等有机纳米粒子,在恶性肿瘤诊断及治疗中已取得一定成绩。其中聚氰基丙烯酸正丁酯纳米微粒(PBCA-NP)作为药物载体具有颗粒大小适中可避免内皮网状系统吞噬快速分布于组织,具有优良的药物缓释作用,尤其具有透过血脑、血胰等一些屏障的良好作用,在前期的体外细胞学实验中我们已经证实其良好的载药及药物释放作用[35-36]。杨西晓等[37]通过MTT 染色、乳酸脱氢酶释放量的测定,研究丝裂霉素聚氰基丙烯酸正丁酯纳米粒对正常肝细胞株生长毒性的关系,证明聚氰基丙烯酸正丁酯纳米粒可作为抗癌药物丝裂霉素的载体,载药后可降低丝裂霉素的细胞毒性。刘建军等[38]使用SD 大鼠进行慢性毒性试验,对新型抗肿瘤复合材料表阿霉素α-聚氰基丙烯酸正丁酯纳米粒生物安全性进行初步评价,结果证实其生物安全性良好。马淑燕等[39]通过制备硫酸长春碱聚氰基丙烯酸正丁酯纳米粒,检测其对大鼠C6 脑神经胶质瘤细胞及正常大鼠星形胶质细胞的毒性作用,纳米粒可以很好的降低长春碱原料药的毒性。综上,根据既往实验研究证实,本实验中所用的siRNA 靶向纳米微粒属于生物安全性良好的载药纳米材料。
本研究结果显示TXNDC5 siRNA-PBCA-NP 对于裸鼠胃癌移植瘤的抑制作用明显优于空纳米粒子PBCA-NP 且与化疗药物5-Fu 基本持平,而PBCA-NP 空纳米颗粒未体现出明显的抑制作用。这一结果与我们前期体外胃癌细胞干预结果[7]一致,提示:(1)TXNDC5 siRNA 在体内条件下依然可以对模型动物胃癌种植瘤组织TXNDC5 基因的表达水平进行有效的抑制,并通过干扰该基因的表达起到抑制肿瘤生长的治疗作用。(2)PBCA-NP 纳米微粒在动物体内对TXNDC5 siRNA 载体核酸具有明显的保护作用,可以作为物理屏障保护核酸片段不被体内广泛存在的各类核酸酶所降解,并导向其进入治疗靶组织细胞内达到抑制肿瘤的作用。本研究中采用了肿瘤生长曲线法、肿瘤质量评估及活体生物发光法对抑瘤效果进行评估,各方法总体结果基本一致,其中以肿瘤质量法计算的TXNDC5 siRNA 组和5-Fu 抑瘤率略高于活体生物发光光子量计算的抑瘤率,但相差不大,这种情况可能反应了两种实验方法的精确性不同。活体生物发光法检测动物肿瘤生长情况在后15 d 出现肿瘤生长普遍减缓的情况,可能与此时间段动物疾病消耗明显出现了营养状况普遍不佳的情况,对肿瘤生长支持不足,造成肿瘤组织代谢降低影响生物发光情况。本研究结果初步证实了装载TXNDC5 siRNA 的纳米微粒在模型动物体内能够完成组织吸收再分布并血行转运,能够初步克服内皮网状系统吞噬等诸多不利因素的影响,而对动物体内的胃癌移植瘤产生良好的抑制作用。
本研究仍存在诸多不足,首先本实验是以模型动物为基础的前临床水平研究,结果具有局限性,尚不足以说明人体的情况,纳米微粒在人类机体的情况更为复杂,与免疫缺陷的裸鼠有很大不同。其次本研究中采用的载药纳米颗粒并不具有对于肿瘤的再导向性,这种情况造成了载药纳米颗粒广泛分布于各器官组织,特异性较差。因此对纳米微粒进行优化和修饰使之具有靶向作用并在更为高等模型动物体内实验研究将是我们下一步的研究工作重点。通过进一步完善的实验研究,将为装载TXNDC5 siRNA 的纳米微粒治疗胃癌进入临床打下坚实的基础。
