非洲猪瘟病毒感染相关调控基因以及毒力基因初步筛选
2023-07-31丁晓艳何久香周晓杨周伃欣李晋涛
丁晓艳,何久香,周晓杨,周伃欣,李晋涛
(陆军军医大学基础医学院军事生物安全教研室,重庆 400038)
非洲猪瘟(African swine fever, ASF)是由非洲猪瘟病毒(African swine fever virus, ASFV)感染导致的一种急性、出血性、烈性传染病,各品种及不同年龄的猪群均易感,其发病率和死亡率均可达到100%。ASFV是双链DNA病毒,包含外膜、衣壳、双层内膜、核心壳层和基因组5层结构,全长为170~190 kb,有151个开放阅读框(open reading frame,ORF),编码了多种病毒蛋白参与调控宿主的免疫应答,维持其在宿主中的长时间存活,导致非洲猪瘟的发生[1-3]。研究表明,在ASFV易感细胞表面存在许多病毒结合位点,比如细胞脂质胆固醇和CD163受体等,而病毒自身蛋白p54和p72在病毒的吸附中也发挥了一定的作用[4-6]。另外,ASFV可通过动力素依赖性和网格蛋白介导的内吞机制进入宿主细胞,并利用囊膜和内吞泡膜融合机制将病毒释放到细胞质中,其中肌动蛋白和磷酸肌醇3-激酶(phosphoinositide 3-kinase,PI3K)在这个过程中发挥了重要作用[7]。一旦进入细胞内,ASFV从早期内涵体移动到晚期大囊泡体,在酸性环境中完成脱壳释放出基因组进行复制,pE248R参与膜融合[7-10]。虽然,关于非洲猪瘟病毒编码蛋白的研究很多,但由于ASFV属于高致病性病原微生物,其生物学特性复杂,基因组庞大,超过一半基因功能仍未知。同时,ASFV对宿主的调控机制复杂多样,ASFV逃逸宿主的免疫应答致使弱毒活疫苗免疫保护力低以及造成病毒持续感染,导致现在尚无安全有效的疫苗面世[11-12]。因此研究ASFV逃逸宿主天然免疫分子机制,筛选并鉴定关键致病基因,对疫苗以及抗病毒靶向药物的研发具有重要的科学意义和应用价值。
1 材料与方法
1.1 材料
3D4/21猪肺泡巨噬细胞购自重庆巴而思生物有限公司。Lipofectamine®3000试剂购自Invitrogen(USA);组织/细胞快速提取试剂盒购自BOER(China);PrimeScriptTMRT Reagent Kit、TB Green® Premix ExTaqTMII购自TaKaRa(Japan);LightCycler® 96 system购自Roche (USA);Opti-MEM I培养基等材料为实验室保存。
1.2 方法
1.2.1 数据集的下载与分析 从基因表达综合数据库(Gene Expression Omnibus,GEO)下载ASFV强毒株Pig/Heilongjiang/2018(Pig/HLJ/18)感染单核巨噬细胞不同时相点RNA-seq测序数据。使用R软件包“edgR”,筛选出P≤0.05,log2FC≥1的差异基因。利用R v. 3.6.1(R Core Team,Vienna,Austria)和Graphpad prism 6.0软件对数据进行分析和可视化分析。使用在线工具进行维恩分析(计算并绘制自定义维恩图,http://bioinformatics.psb.ugent.be/webtools/Venn/)。强毒株Georgia 2007/1(GRG)和弱毒株OURT88/3感染全血转录组差异基因数据来源于文献[13]。
1.2.2 可视化热图分析 通过在线工具Morpheus(https://software.broadinstitute. org/morpheus/)对差异基因进行热图可视化分析。
1.2.3 基因功能富集分析 使用Metascape数据库(https://metascape.org/gp/index.html#/main/step1)对差异基因进行基因本体论(GO)类别进行可视化。
1.2.4 蛋白质相互作用(PPI)网络构建 PPI网络数据使用交互基因检索工具(STRING)数据库(http://string-db.org)获得,并使用Cytoscape v. 3.6.1(https://cytoscape.org/download.html)进行可视化。
1.2.5 体外瞬时转染 强毒株Georgia 2007/1与弱毒株OURT88/3的差异基因交付于生工生物工程(上海)股份有限公司进行合成,并构建至pCDNA3.1(+)载体上。构建好的质粒或pCDNA3.1空载质粒在3D4/21猪肺泡巨噬细胞细胞中过表达的体外瞬时转染采用Lipofectamine®3000(Invitrogen,USA)试剂。按照试剂盒说明书进行。操作步骤如下:将细胞以2×105·mL-1接种于6孔细胞培养板,每孔接种2 mL,置于含体积分数5%CO2的37 ℃培养箱培养过夜,待细胞密度为80%时进行转染。将2 μg质粒和5 μL P3000 reagent 加入125 μL Opti-MEM I培养基,将7.5 μL Lipofectamine 3000 reagent转染试剂加入125 μL Opti-MEM I培养基。将转染试剂加入稀释后的质粒中,轻轻混匀室温放置15 min。将细胞培养板中的完全培养基换成无血清培养基,然后将混合液加入到细胞培养板中。转染24 h后收集细胞进行检测。
1.2.6 实时定量PCR(RT-qPCR)检测基因相对表达量 上述收集的细胞使用组织/细胞快速提取试剂盒进行提取,严格按照说明书操作。随后使用PrimeScriptTMRT Reagent Kit进行逆转录。使用TB Green® Premix ExTaqTMII和LightCycler® 96 system进行荧光定量PCR检测。反应条件:预变性 95 ℃ 30 s;变性95 ℃ 5 s, 60 ℃ 30 s,40个循环;熔解曲线反应条件为逐渐升温至95 ℃。PCR反应结束后,检查熔解曲线与扩增曲线是否异常,导出试验数据,目的基因的表达水平使用-ΔΔct方法计算。目的基因检测所使用的引物为UBB-F:5′-TTGTTGGCGGTTTCGCTGTT-3′;UBB-R: 5′-TTTGACCTGTGAGTGAAGGCA-3′。GAPDH-F:5′-TCGGAGTGAACGGATTTGGC-3′;GAPDH-R:5′-TGACAAGCTTCCCGTTCTCC-3′。
1.2.7 数据分析 使用GraphPad Prism v6.0软件对所有统计数据进行分析。组间统计分析采用双尾未配对学生t检验;P≤0.05表示组间显著性差异。
2 结 果
2.1 ASFV感染宿主差异基因分析
使用数据集GSE145954,对ASFV强毒株Pig/Heilongjiang/2018 (Pig/HLJ/18)感染猪外周血单核巨噬细胞不同时相点的差异基因进行分析,筛选出757个共同的差异基因(图1A)。结合之前报道的强毒株Georgia 2007/1(GRG)感染全血转录组差异基因进行维恩分析[13],结果显示,在高致病的ASFV感染细胞模型和动物模型中,共有差异基因36个(图1B)。仅有10个基因在ASFV感染细胞模型和动物模型中表达一致,其中ECE1、CCL2、CTSB、SCARB2和CD14在ASFV感染单核巨噬细胞和动物全血中均明显上调,HMBS、DYNLL1、UBB、EZH2和SERPINE1则明显下调(图1C和D)。
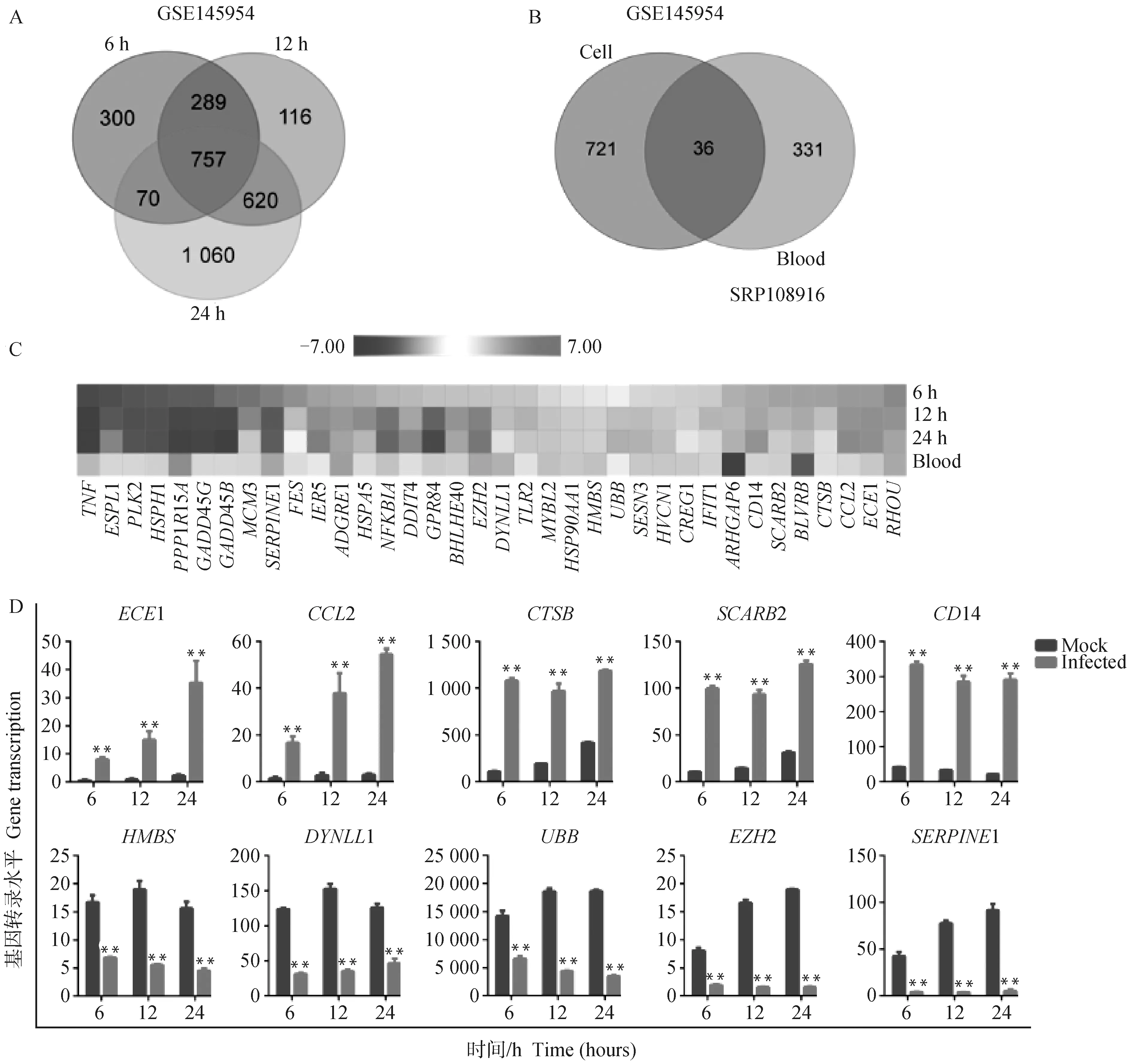
A. ASFV (Pig/HLJ/18)感染猪肺泡巨噬细胞(PAMs)不同时间点DEGs维恩图;B.ASFV (Pig/HLJ/18)感染PAMs和ASFV(Georgia 2007/1)感染猪全血DEGs维恩图;C.ASFV(Pig/HLJ/18)感染猪肺泡巨噬细胞和ASFV(Georgia 2007/1)感染猪全血的共同差异基因的相对表达量热图;D.基因在GSE145954数据集中的表达情况。结果以表示 (n=3),星号表示显著差异(t-test,**.P<0.01)。扫描文章首页OSID码可查看彩图A. Venn diagram of DEGs in pig alveolar macrophages (PAMs) infected by ASFV (Pig/HLJ/18) at different time points; B. Venn diagram of DEGs in ASFV (Pig/HLJ/18) infected PAMs and ASFV (Georgia 2007/1) infected pig whole blood; C. Heatmap of common differential genes of ASFV (Pig/HLJ/18) infected pig alveolar macrophages and ASFV (Georgia 2007/1) infected pig whole blood; D. Gene expression in GSE145954 dataset. Data represent the (n=3). Asterisks indicate significant differences (t-test, **. P<0.01).The color pictures can be found by scanning the OSID code on the front page of the article图1 ASFV感染后宿主关键差异表达基因筛选Fig.1 Screening of key differentially expressed genes in host during ASFV infection
2.2 ASFV感染宿主差异表达基因GO富集通路分析
采用维恩图分析上述强毒株感染所引起的宿主差异表达基因与报道的弱毒株OURT88/3感染的宿主差异表达基因(图2A),结果显示,只有CTSB在强毒株和弱毒株感染后具有差异表达,然而CTSB在强毒株感染宿主后表达上调,在弱毒株感染后表达下调(图1C和图2B)。这表明利用数据挖掘所筛选出来的ECE1、CCL2、SCARB2、CD14、UBB、HMBS、DYNLL1、EZH2、SERPINE1和CTSB均同ASFV致病相关。进一步使用Metascape数据库对这些基因生物学过程的富集分析显示(图2C),这些基因大多集中在正向调控内吞作用(GO: 0045807)以及TLRs信号通路(GO: 000224)生物学进程。其中CD14、CCL2、SCARB2可正向调控内吞作用,这些宿主分子在ASFV感染后上调。UBB、SERPINE1和DYNLL1则参与了TLRs信号通路生物学进程,在ASFV感染后下调。CTSB它既能激活NLRP3炎症小体,参与免疫响应,又与内吞途径相关,在病毒感染中具有重要作用,其上调表达加强了多种病毒感染。以上结果说明ECE1、CCL2、SCARB2、CD14、UBB、HMBS、DYNLL1、EZH2、SERPINE1和CTSB同非洲猪瘟病毒强毒株的致病性密切相关。

A.强毒株感染和弱毒株OURT88/3感染猪DEGS维恩图;B. CTSB基因在强、弱毒株中感染猪和未感染猪全血的表达量分析;C.宿主差异基因生物学过程富集分析。OURT. 弱毒株OURT88/3; GRG. 强毒株Georgia 2007/1A. Venn diagram of the DEGs in the strong virulent strain and the attenuated strain OUT88/3 infected pig; B. Analysis of CTSB gene expression in whole blood of infected and uninfected pigs in strong and weak virus strains; C. Enrichment analysis of biological processes of DEGs. OURT represents the attenuated strain OURT88/3, GRG represents the virulent strain Georgia 2007/1图2 ASFV强毒株和低毒株感染宿主差异表达基因比较Fig.2 Comparison of differentially expressed genes in host during strong and low virulent ASFV strains infection
2.3 ASFV感染宿主差异表达基因关键基因筛选
利用STRING数据库对所获得的36个差异基因进行蛋白质相互作用分析,结果显示TNF、UBB、TLR2和HSP90AA1可能是宿主抗病毒的关键基因(图3)。在细胞水平和动物水平的转录组学分析中,仅有UBB具有相同的表达趋势。因此认为UBB是非洲猪瘟病毒感染的核心宿主基因。另外具有相同的表达趋势的CCL2、CTSB、EZH2、SERPINE1、CD14和DYNLL1同为病毒感染宿主调控网络关键基因。

蛋白相互作用网络预测的枢纽基因,按degree值进行排序,颜色越深代表值越大。扫描文章首页OSID码可查看彩图The hub genes predicted by the protein interaction network are sorted according to the degree value. The darker the color is, the greater the value is.The color picture can be found by scanning the OSID code on the front page of the article图3 ASFV强毒株感染宿主关键基因筛选Fig.3 Screening of hub gene in host cells during strong virulent ASFV strain infection
2.4 非洲猪瘟病毒关键毒力基因的筛选
进一步分析ASFV强毒株Georgia 2007/1(GRG)和弱毒株OURT88/3(OURT)编码病毒功能蛋白的基因与多基因家族基因发现,EP153R、EP402R、M1249L、B119L、B169L、B407L、CP204L、CP312R和I215L在强毒株和弱毒株中均编码了有功能的病毒蛋白,但其氨基酸序列具有很大的差异。另外,ASFV强毒株Georgia 2007/1(GRG)编码了多基因家族蛋白MGF110-12L、MGF360-6L、MGF360-10L、MGF360-11L、MGF360-12L、MGF360-13L、MGF360-14L、MGF505-1R和MGF505-6R,而这些基因在弱毒株OURT88/3缺失。表明这些分子可能是非洲猪瘟病毒感染关键的毒力基因。为筛选出非洲猪瘟病毒编码的关键致病基因,本文将这些病毒蛋白在3D4/21猪肺泡巨噬细胞中表达,并检测这些蛋白对前期筛选出的非洲猪瘟病毒感染核心宿主基因UBB的调控作用。结果显示,与对照组PcDNA3.1及弱毒株OURT比较,强毒株GRG的病毒功能蛋白编码基因B119L、I215L均能显著抑制宿主UBB的表达(图4A)。与对照组pcDNA3.1相比,强毒株GRG多基因家族仅MGF360-13L显著调控UBB的表达,其它多基因家族基因对UBB的调控无显著差异或者促进其表达(图4B)。因此认为强毒株中的B119L、I215L以及MGF360-13L为非洲猪瘟病毒重要的致病基因,并与UBB下调相关。
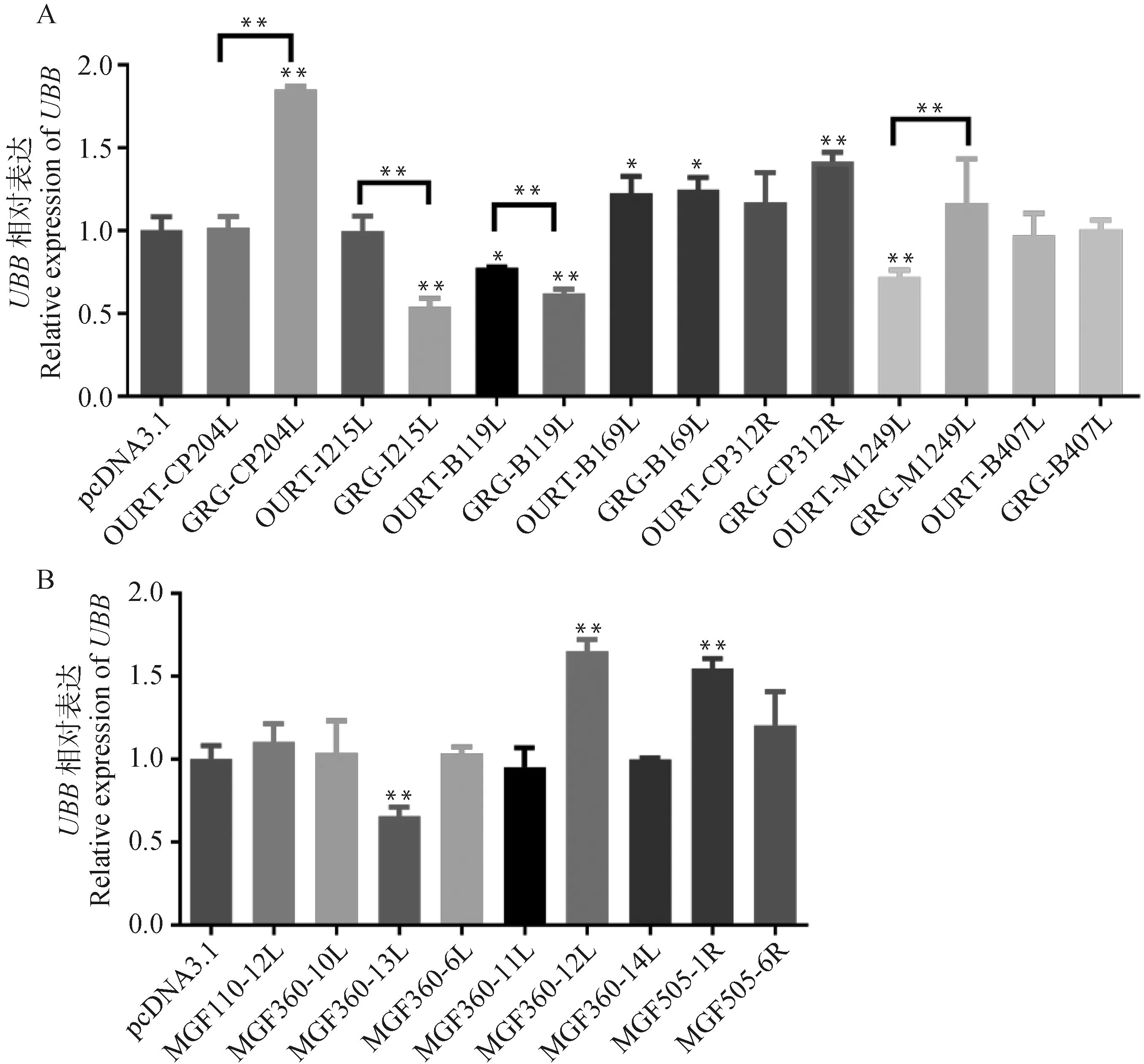
A.抑制3D4/21 细胞中UBB表达的非洲猪瘟病毒功能蛋白的筛选;B.强毒株多基因家族对UBB表达调控分析。OURT. 弱毒株OURT88/3; GRG. 强毒株Georgia 2007/1。GADPH为内参,结果以表示 (n=3)。星号表示显著差异(t-test,*.P<0.05, **.P<0.01)A. Screening of ASFV genes that inhibited UBB expression by comparing high or low virulent ASFV genes that expression in 3D4/21 cells; B. Analysis of the regulation of UBB expression by high strain polygene family. OURT represents the attenuated strain OURT88/3, GRG represents the virulent strain Georgia 2007/1. GADPH is an internal parameter, and the result is expressed in Data represent the (n=3). Asterisks indicate significant differences t-test,*.P<0.05, **.P<0.01)图4 抑制UBB表达的非洲猪瘟病毒蛋白筛选Fig.4 Screening of ASFV protein which repress UBB expression
3 讨 论
ASFV感染与宿主之间互作所引起的保护性免疫机制尚不清楚,严重制约了非洲猪瘟疫苗的研发。本文利用公共资源平台的生物医学大数据挖掘,发现UBB在非洲猪瘟病毒感染过程中占据了核心的地位。无论是在ASFV感染细胞模型中,还是在ASFV致病株感染的动物模型中,UBB的表达量均明显下调,PPI互作网络显示UBB是病毒感染调控的核心基因(图1和图3)。有研究也发现UBB和病毒转录本以相反的速率积累[14],说明UBB同病毒转录复制密切相关。UBB编码了一种泛素蛋白,这些泛素蛋白可结合到底物蛋白质分子特定位点上发生泛素化,与蛋白质特异性降解密切相关。因此宿主UBB的表达受到抑制,或许同ASFV致病性相关。
本文进一步对非洲猪瘟病毒强弱毒株编码的差异蛋白对ASFV感染宿主的核心基因UBB的调控作用进行了比较,发现高致病性的强毒株B119L、I215L以及MGF360-13L与宿主UBB表达受到抑制密切相关(图4)。前期已有研究发现ASFV编码的I215L基因同宿主E2泛素(UBC)结合酶同源,在病毒感染期间表达,并在感染后期积累[15-16]。蛋白质泛素化修饰主要通过泛素激活酶E1在ATP供能的情况下黏附在泛素分子尾部,随后E1将激活的泛素分子转移到泛素结合酶E2上,此时E2酶和不同的泛素连接酶E3共同识别靶蛋白,并对其进行泛素化修饰。因此,I215L编码的泛素结合酶可能参与了宿主的蛋白酶泛素化降解途径,扰乱宿主正常蛋白酶降解系统,从而逃逸宿主的免疫监视。然而I215L如何去调控UBB的表达,还需要进一步的研究。本文发现强毒株(Georgia 2007)的B119L也可抑制宿主UBB的表达。B119L同病毒粒子在巨噬细胞的成熟和复制密切相关,该蛋白的缺失可降低病毒毒力[17]。缺失B119L的重组ASFV毒株低剂量注射时,导致病毒在猪体内衰减,可诱导对同源性毒株攻击的有效保护[18]。而序列比较显示,强毒株(Georgia 2007)同弱毒株(OURT88/3)的B119L仅有一个氨基酸的差异,即强毒株第18位为苯丙氨酸,弱毒株第18位为丝氨酸,该氨基酸的突变或许同病毒调控宿主泛素化途径密切相关。
强毒株和弱毒株基因组最大的差异位于多基因家族(MGFs)区域,已有研究证明多基因家族MGF360和505/530是非洲猪瘟病毒毒力决定因素,并通过抑制Ⅰ型IFN的产生发挥毒力作用[19-20]。例如,MGF360-11L通过半胱氨酸、泛素-蛋白酶体和自噬途径降解TBK1和IRF7,抑制Ⅰ型干扰素的表达[21];MGF360-14L可竞争性结合线粒体抗病毒信号蛋白(MAVS),抑制TRIM21对MAVS的泛素化,从而下调Ⅰ型IFN的产生[22]。这些研究均表明多基因家族通过调控宿主泛素化途径从而抑制宿主的天然免疫反应。本文发现,MGF360-13L的表达会抑制UBB转录,说明该基因可能同样参与病毒调控宿主泛素化的途径。最近的研究发现ASFV多基因家族的MGF360-13L能够抑制细胞的炎性因子(IL-1β、IL-6和TNF-α等)表达[23],也可通过cGAS-STING 信号通路抑制宿主Ⅰ型干扰素的产生。本文推测ASFV的MGF360-13L可能通过影响宿主体内泛素化基因从而调控宿主Ⅰ型干扰素的产生,但其如何发挥作用还需进一步研究。
4 结 论
本研究初步筛选获得了系列参与ASFV感染的宿主调控网络关键基因,包括UBB、CCL2、CTSB、EZH2、SERPINE1、CD14和DYNLL1基因,其中UBB是宿主调控的核心基因。由于ASFV的B119L、I215L以及MGF360-13L基因都调控了宿主泛素化信号通路关键分子UBB,因此本文推测ASFV的这三个基因与其免疫逃逸密切相关,是研发ASF的特效药和疫苗的关键靶标分子。
