基于流式细胞术分选绵羊分泌型IgA包裹的消化道细菌
2023-07-31贺志雄谭支良
米 慧,彭 灿*,贺志雄,2*,谭支良,2
(1.中国科学院亚热带农业生态研究所 亚热带农业生态过程重点实验室 畜禽养殖污染控制与资源化技术国家工程实验室 湖南省畜禽健康养殖工程技术研究中心 农业部中南动物营养与饲料科学观测实验站 动物营养生理与代谢过程湖南省重点实验室 中国科学院亚热带农业生态研究所公共技术中心,长沙 410125;2.中国科学院大学,北京 100049)
动物消化道定居着数量庞大的、动态的、高度复杂的微生物群落[1]。消化道微生物对宿主体内的营养代谢和免疫稳态具有重要的调节作用,影响着宿主健康和疾病生理的各个方面[2]。分泌型免疫球蛋白A(secretory immunoglobulin A, sIgA)是动物消化道内主要的免疫球蛋白,具有保护宿主免受病原体和毒素侵袭、塑造肠道菌群结构、调控细菌行为等功能,在消化道内宿主-细菌稳态维持中发挥着重要作用[3]。sIgA可以通过经典抗原特异性识别、非抗原特异性聚糖介导的相互作用以及微生物编码超抗原结合等多种机制结合并“包裹”微生物[4-7]。研究表明,sIgA可同时包裹有益共生菌和病原菌,针对不同菌种和菌株表现出不同的包裹水平,例如与疾病相关的致病菌表现为高水平的sIgA包裹,而有益共生菌表现为较低水平的包裹[8-10]。同时,sIgA包裹对不同菌种和菌株的定植具有相反的影响:sIgA包裹能够通过调节共生菌基因表达、增强黏膜适应能力以及提供微生物所需聚糖的方式增强有益共生菌的定植和生长,而通过中和作用、免疫排斥、调节代谢等途径限制病原菌的定植或扩张[5,11-15]。sIgA缺乏或功能障碍可导致消化道微生物群落结构的改变,并与多种肠道疾病的发生发展密切相关[16-17]。因此,对动物消化道内sIgA包裹细菌进行分选,利于对其中组成和功能的研究,从而有助于提升宿主-消化道微生物互作的理论认知。
目前,文献报道的sIgA包裹细菌分选方法主要有流式细胞术[18]和免疫磁珠分离技术[19]。免疫磁珠分离技术具有操作简单、且能有效消除脂肪和蛋白质等杂质干扰等特点[20-21],但分离过程需要准确把握磁响应时间,对人员操作要求高且磁珠捕获率不稳定[22]。流式细胞术(flow cytometry,FCM)是一种依托流式细胞仪,综合了流体力学、免疫学、荧光化学技术和计算机技术的多学科的定量分析和分选方法。早期由于微生物细胞体积过小,细胞信号难以捕捉,FCM主要应用于动物细胞的分析检测。近几年,随着荧光染料的发展,通过检测染料放大的分子信号,FCM逐渐在微生物分析和分选中得以应用[18,23]。目前,基于不同种类细菌展现出的菌体大小、营养需求、菌体内特异抗原等特定生物学特性通过FCM进行分选,已成为微生物学的重要研究手段。
已有研究在小鼠和人类中利用FCM成功描述了总体细菌、sIgA包裹细菌以及未包裹细菌之间的差异[8-9],但在反刍动物中相关研究较少。因此,基于目前成熟的抗IgA抗体体系,本研究旨在开发一种有效且能从反刍动物消化道内容物样本中分离sIgA包裹细菌的分选方法,以期为深入理解宿主sIgA如何影响消化道微生物,提升人们对反刍动物宿主-消化道微生物互作方面的理论认知。
1 材料与方法
1.1 试验材料
试验用绵羊回肠内容物由中国科学院亚热带农业生态研究所畜禽健康养殖研究中心提供。选取4只健康成年绵羊,经颈静脉放血致死后剖开腹部,迅速结扎食管和直肠,待胃肠道与胴体分离后,在各个部位分界点两段结扎,分离胃肠道,取回肠中适量内容物样品,分别迅速投入液氮中,之后存入-80 ℃冰箱保存备用。
1.2 试验试剂及仪器
主要试剂:生物素标记兔抗山羊抗IgA抗体(Novusibio,美国),Alexa Fluor 488标记链霉亲和素(Alexa Fluor 488-Streptavidin)染料(Bioss,北京),蛋白酶抑制剂(Solarbio,北京),兔血清(Solarbio,北京)、牛血清白蛋白(BSA)(Solarbio,北京),DAPI(Solarbio,北京),超纯水为中国科学院亚热带农业生态过程重点实验室自制。
主要仪器:流式细胞仪(Beckman Coulter,Moflo XDP,美国);多功能台式离心机(Eppendorf,5804R,德国);涡旋仪(Scientific Industries,Vortex-Genie 2,美国)。
1.3 菌液制备
将回肠内容物以100 mg·mL-1的浓度悬浮于蛋白酶抑制剂溶液,并置于涡旋仪剧烈涡旋5 min进行均质化处理。均质化后在4 ℃条件下以400×g离心5 min,收集上清液并通过40 μm细胞过滤器转入新离心管,随后在4 ℃条件下以10 000×g离心10 min,收集细菌沉淀重新悬浮于染色缓冲液(1% BSA-PBS),获得细菌悬液。
1.4 sIgA包裹细菌染色
取100 μL“1.3”中制备的细菌悬浮菌液在4 ℃条件下用5%兔血清封闭1 h;封闭结束加入生物素标记的兔抗山羊抗IgA抗体,在4 ℃条件下孵育20 min;抗体孵育结束,使用染色缓冲液洗涤细菌2~3次,加入Alexa Fluor 488-Streptavidin染料,在4 ℃条件下避光孵育20 min;染色完成的菌液使用染色缓冲液洗涤细菌3次,重悬于DAPI溶液中,避光保存,30 min内待上机检测。
1.5 试验条件优化
1.5.1 门的设定 在流式分选过程中,首先要在流式图谱中区分生物活性颗粒和非生物颗粒,因此设置PBS溶液作为阴性对照,以获得背景信号,随后通过前向散射光(forward scatter, FSC)和侧向散射光(side scatter, SSC)建立FSC/SSC图,将阈值设在SSC(0.04%)上,剔除背景噪音干扰和杂质(图1A);随后,利用核酸染料DAPI的荧光信号设门,建立DAPI/SSC图(图1B),区分样品中的细菌颗粒和非生物颗粒,剔除非细菌颗粒,确定细菌群落信号;最后,利用兔抗山羊抗IgA抗体和Alexa Fluor 488-Streptavidin染料特异结合所产生的荧光信号设门,建立FITC/SSC图(图1C),圈出sIgA阳性信号即sIgA包裹菌群。

A. FSC/SSC圈门剔除杂质信号;B. DAPI/SSC圈门确定细菌信号;C. FITC/SSC圈门确定sIgA包裹细菌信号A. FSC/SSC gate to removed from the impurities signal; B. DAPI/SSC gate to determine the bacterial signal; C. FITC/SSC gate to determine the sIgA-coated bacteria signal图1 流式检测图谱获取sIgA包裹菌群流程Fig.1 The flow chart of sIgA-coated bacteria was obtained by flow cytometry
1.5.2 样品上样浓度的确定 将采集的4份回肠内容物采用“1.3”描述方法制备菌液,将菌液分别进行0、1∶10、1∶20、1∶50、1∶100以及1∶1 000倍稀释,保持其他试验条件一致,按照“1.5.1”方法操作,根据FSC/SSC图、DAPI/SSC图和FITC/SSC分别检测各稀释比例下的总信号颗粒数(TS)、细菌信号颗粒数(BS)和sIgA包裹细菌信号颗粒数(SS),计算细菌信号百分比与sIgA细菌包裹率,明确菌液最佳上样浓度。同时,根据FITC/SSC图谱确定不同稀释比例下sIgA阳性细菌信号区位置。
细菌信号百分比=细菌信号颗粒数/总信号颗粒数×100%(BS/TS×100%)
sIgA细菌包裹率=sIgA包裹细菌数量/总细菌数量×100%(SS/BS×100%)
1.5.3 DAPI最佳工作浓度的确定 将采集的4份回肠内容物选用“1.5.2”确定的最佳样本上样浓度制备菌液,保持其他试验条件一致,每份菌液平行取样4次,分别加入1、5、10、20 μg·mL-1的DAPI溶液,上机将样品依次选至FSC/SSC和DAPI/SSC图谱,检测细菌信号分布范围及细菌信号百分比,评估DAPI细菌染色效率,选定DAPI最佳工作浓度。
1.5.4 抗体最佳使用量的确定 将采集的4份回肠内容物选用“1.5.2”确定的最佳样本上样浓度制备菌液,保持其他条件一致,每份菌液平行取样4次,分别加入1、2.5、5、7.5 μL浓度为1 mg·mL-1的生物素标记的兔抗山羊抗IgA抗体,检测sIgA阳性信号和sIgA细菌包裹率,评估抗体最佳用量。
1.6 方法的稳定性和可重现性
取3份回肠内容物,分别平行取样3次,根据“1.3”制备菌液,选用“1.5.2”、“1.5.3”和“1.5.4”确定的试验条件,测定每个样本的sIgA细菌包裹率,计算变异系数(CV),比较其重复性。
CV(%)= 标准误差/平均值×100。
1.7 数据统计与分析
所有数据采用Excel 2019进行初步统计后,采用SPSS 22.0软件的单因素ANOVA进行差异显著性分析。试验结果以平均值和均值标准误表示,统计差异显著性定义为P<0.05。
2 结 果
2.1 样品上样浓度
如图2所示,除原液和10倍稀释菌液外,其余样本sIgA阳性细菌信号与阴性信号区分明显;超过50倍稀释菌液的sIgA阳性信号超出图谱分析范围,存在结果偏差。由表1可知,原液的TS、BS和SS显著高于其余稀释菌液(P<0.05),但20倍稀释和40倍稀释显著提高了BS/TS和SS/BS比值(P<0.05)。上述结果表明,配制菌液时,可将浓度为100 mg·mL-1的原液稀释20至40倍,即为2.5~5.0 mg·mL-1进行上样。

表1 不同菌液浓度对流式图谱总信号颗粒数、细菌信号颗粒数和sIgA阳性细菌信号颗粒数的影响Table 1 Effects of different bacterial sample concentration on the total number of signal particles, the number of bacterial signal particles and the number of sIgA-coated bacterial signal particles in flow chromatogram

图2 sIgA阳性细菌信号区随菌液浓度变化Fig.2 Changes of sIgA-coated bacterial signal with increasing bacterial concentration in a sample
2.2 DAPI最佳工作浓度优化结果
如图3所示,DAPI浓度为5 μg·mL-1时检测出的细菌比例最高(图3B),同时细菌信号与非细菌信号区分明显(图3A)。因此,DAPI最佳工作浓度5 μg·mL-1。
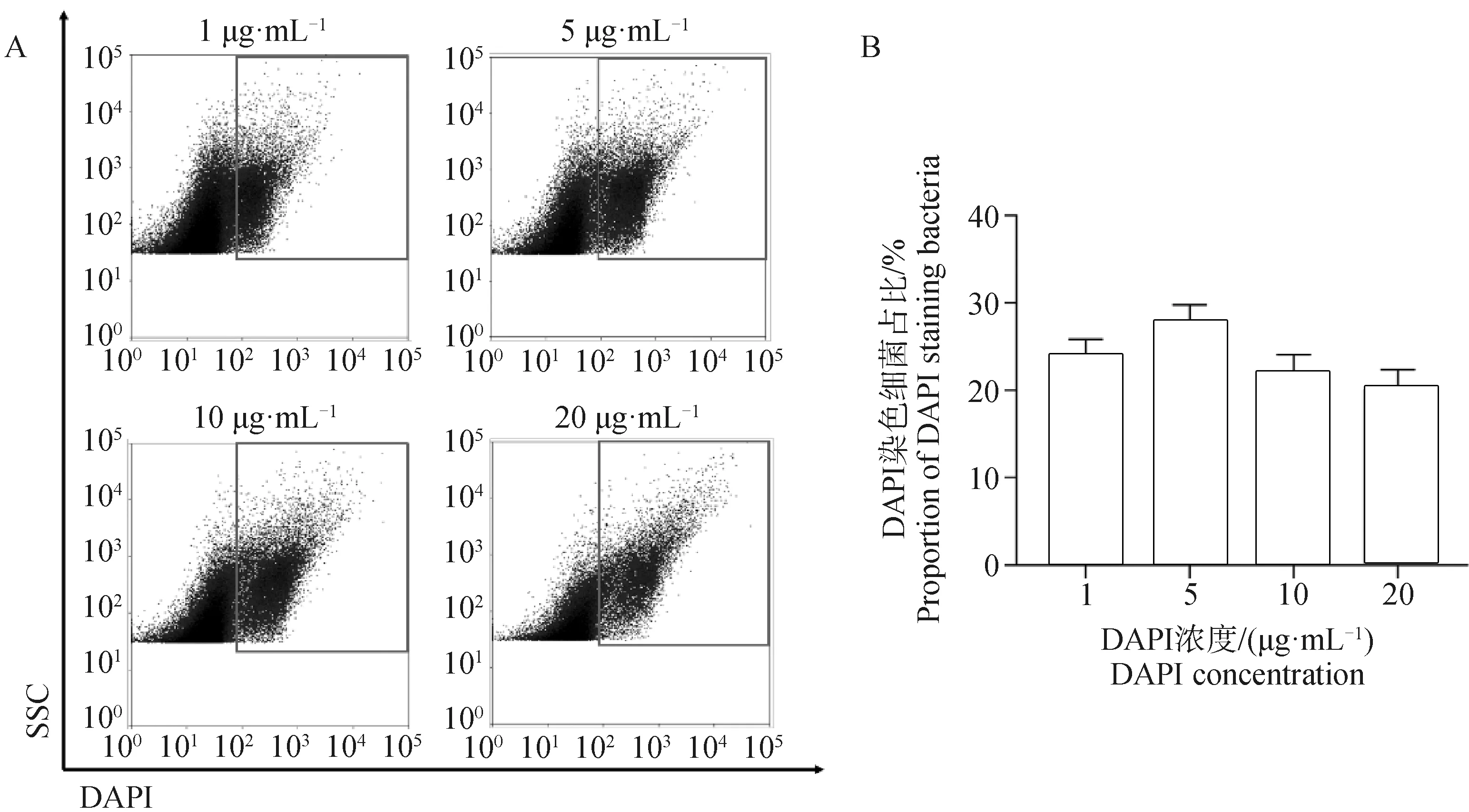
A. 细菌信号分布范围;B. 细菌比例A. Bacterial signal distribution; B. Proportion of bacteria 图3 DAPI最佳工作浓度的确定Fig.3 Determination of optimal working concentration of DAPI
2.3 抗体最佳使用量优化结果
如图4所示,sIgA阳性信号与阴性信号分群随着抗体用量的增加而更加清晰(图4A)。当抗体用量为5 μg时,可观察到sIgA细菌包裹率显著高于1和2.5 μg(P<0.05),同时sIgA细菌包裹率不再随着抗体量增加提高(图4B)。因此,抗体的最佳使用量为5 μg。

A. sIgA阳性信号分布;B. sIgA细菌包裹率。柱上不同字母表示差异显著(P<0.05),相同字母或无字母标注表示差异不显著(P>0.05)A. Distribution of sIgA-coated bacterial signal area; B. The percentage of sIgA-coated bacteria. Bars with different letters indicate significant differences (P<0.05), while with the same letter or no letter mark means no significant difference (P>0.05)图4 抗体最佳使用量确定Fig.4 Determination of the optimal amount of antibody
2.4 方法的稳定性和可重现性
如表2表明,在同等试验条件下,3个回肠样品的CV值均在5%以内,表明FACS稳定性和重现性较好。
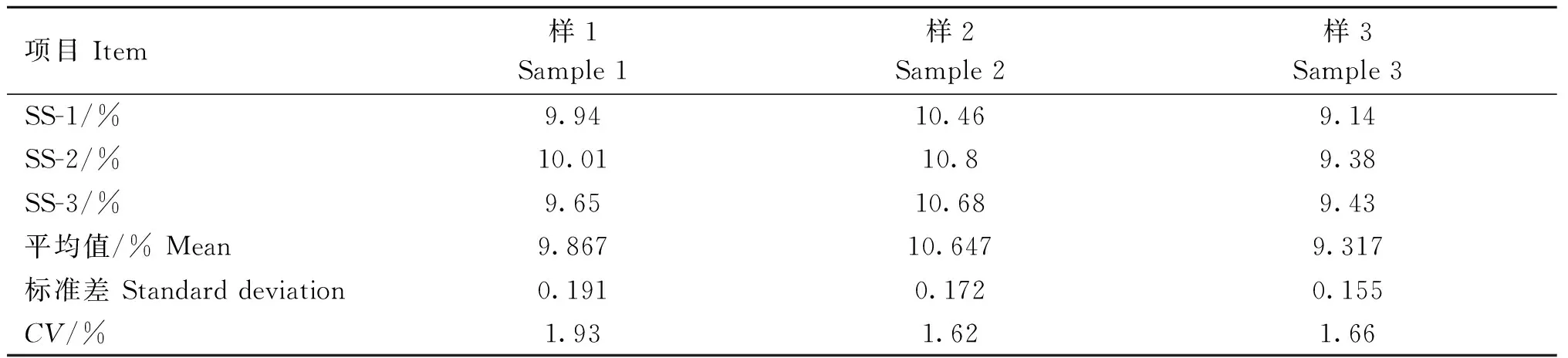
表2 方法的稳定性和可重现性Table 2 Stability and reproducibility of the method
3 讨 论
动物出生后随着与母体和外界环境的接触,各类微生物逐渐在动物消化道内定植,并随着动物机体的发育、年龄增长以及日粮等多种因素的驱动,逐渐形成一个数量庞大的微生物群落。sIgA是消化道获得性免疫的重要标志物,在消化道黏膜表面显著分泌,并已证实能够覆盖一部分消化道微生物群,消化道的稳态维持很大程度上依赖于sIgA的作用[11]。流式细胞仪是目前使用最为广泛的细菌/细胞分选仪器,能够通过利用免疫荧光对标记的细胞或细菌等微小颗粒作出分选,具有效率高、准确率高、易操作等特点[24]。目前,已有大量研究人员利用流式细胞术对人和小鼠胃肠段内sIgA包裹细菌进行研究,但分选过程中重要分选参数如门的设定及关键试剂的用量未见报道[25-27]。因此,建立绵羊sIgA包裹微生物分选方法并量化流式分选参数,有助于加深宿主-微生物间共生关系的理解,同时有利于sIgA包裹细菌的分析与分选的推广应用。
在流式细菌分选过程中,流式细胞仪接收细菌样品的荧光信号并通过转换器转换为数字信号以散点图等形式呈现,最后可通过散点图设门来获得目标菌群[28]。因此,细菌样品浓度对流式图谱形成具有重要影响。刘倩和刘小杰[29]使用流式细胞术检测水环境中细菌时发现,当样品浓度过高时,水样中菌体抱团,导致菌体计数存在误差。梅仕良[30]对豆制品中菌落总数的检测中,发现当上样的浓度较大时,流式图谱显示的颗粒密集,各信号区边界模糊,易造成设门不够准确而使杂质设在门中;上样浓度过低,图谱中颗粒零散分布,则导致目标细菌不能全部设在门中,造成结果不足偏小存在误差。鉴于这一特性,本试验通过对菌液进行梯度稀释,确定了内容物以2.5~5 mg·mL-1悬浮于染色缓冲液时,能兼顾设门的精确性和目标菌群数量,满足后续试验需求,为最佳的样品上样浓度。
一般情况下,流式图谱主要采用散射光信号对样品颗粒中的细菌信号进行初级区分和分析。但在实际检测过程中,仅凭借散射光信号往往难以将颗粒外形与目标细菌非常接近或相似的物质或杂质区分[31]。因此,需要利用荧光染色技术来精确区分目标菌群。DAPI是一种核酸荧光染料,可以穿透细胞膜与双链DNA结合产生比自身强20多倍的蓝色荧光而发挥标记的作用[32]。一般而言,低浓度的DAPI溶液不容易穿透细胞膜,且在样品量大的情况下需要足够浓度的DAPI对目标细菌进行覆盖。如Piriyakarnsakul等[33]研究发现,使用DAPI对酵母菌进行染色,酵母菌荧光信号强度随着DAPI浓度升高而升高。在本方法中基于激发光波长和荧光染料之间的紧密关系[34],利用DAPI对内容物菌群染色。通过流式图谱分析发现,DAPI工作浓度为5 μg·mL-1时,能够有效覆盖菌液样品中菌群,并对样品中的细菌信号和非细菌信号进行明确区分。同时,由于菌液中sIgA包裹菌群含量较多,需要加入合适的抗体含量保证检测的准确性。在本方法中添加不同抗体量,发现当抗IgA抗体量设置为5 μg时,能够覆盖菌液的目标菌群,且能够在对样品中的sIgA阳性信号和阴性信号进行明确区分的同时避免过多抗体消耗。
4 结 论
本研究确立了一种流式细胞术细菌分选方法,对绵羊消化道sIgA包裹细菌进行标记并分选。对试验结果进行分析得出:1)内容物最佳上样浓度为2.5~5 mg·mL-1;2)DAPI最佳工作浓度为5 μg·mL-1;3)抗IgA抗体最佳使用量为5 μg。该方法专一性强、灵敏度高,可为研究反刍动物消化道sIgA包裹菌群以及宿主-微生物互作提供新的研究方法。
