基于转录组学研究双酚A对猪睾丸支持细胞炎症和氨基酸代谢通路的影响
2023-07-31张永红侯晓林崔德凤潘早早张凌宇张家希
胡 婷,张永红,侯晓林,姚 华,崔德凤,潘早早,张凌宇,张家希,吴 琼
(北京农学院动物科学技术学院,北京 102206)
猪的繁殖性能关乎生猪出栏量以及生猪供需稳定。现代化猪场中广泛采用人工授精方式,公猪出现繁殖障碍造成的经济损失远远超过母猪[1]。公猪处于不良环境时,精子生理功能受损,造成公猪繁殖力降低。引起公猪繁殖障碍的因素包括日粮中的能量、微量元素、蛋白质、矿物元素的水平、饲养管理不当、环境因素、遗传因素、传染病等[2]。公猪繁殖与精子发生、成熟、获能、顶体反应、受精等过程密不可分,精子的发生与睾丸生殖细胞相关[3]。睾丸支持细胞(sertoli cell,ST细胞)是睾丸生殖细胞的一种,呈不规则的高锥体形,细胞基部附着在基膜上,顶部伸至曲精小管腔面[4]。ST细胞参与构成血睾屏障,创造了相对稳定的生精环境[5],ST细胞能够支持、营养、促进生精细胞的产生[6],分泌雄激素结合蛋白,维持较高的雄激素水平[7],分泌睾丸液,有助于精子运送[8]。此外,ST细胞能够吞噬消化精子形成过程脱落的残余胞质[9]。
环境雌激素是一种环境内分泌的干扰化学物质,具有与生物激素相似的性质[10],可干扰体内正常内分泌物质的合成、释放、运输、结合和代谢,从而激活或抑制内分泌系统的功能[11]。在众多环境雌激素中,双酚A(BPA)结构与雌激素相似,具有拟雌激素和抗雄激素的作用因而具有重要的生殖发育毒性[12-15],广泛存在于塑料制品及涂料中,主要通过消化道、呼吸道和皮肤接触进入机体[16]。多项研究结果显示,大多数受检者的体液和组织中均可检测到BPA[17]。试验动物和人类研究证实,BPA对间质细胞发育和功能具有内分泌干扰作用[18]。BPA破坏间质细胞的发育和功能,引起相关的生殖疾病,如睾丸发育不全综合征,青春期延迟和不育[19]。成年大鼠皮下注射0.5% BPA,睾丸重量显著减轻,精子发生降低[20]。小鼠在孕期暴露于BPA,其雄性后代每日产生的精子数量减少,生殖器官明显变小[21]。BPA诱导活性氧产生,干扰ST细胞类固醇的生成[22],诱导ST细胞凋亡,生殖细胞成熟中断,导致睾丸发育缺陷[23]。然而,BPA影响猪睾丸支持细胞功能并造成公猪生殖障碍的机制目前还不清楚。
为探究环境雌激素双酚A影响公猪繁殖能力的作用机制,本研究分析了不同时间BPA暴露下猪睾丸支持细胞转录组学变化,进一步通过富集分析明确BPA暴露下猪睾丸支持细胞信号通路的变化。
1 材料与方法
1.1 试验材料与设备
猪睾丸支持细胞(ST细胞)由东北农业大学徐世文教授馈赠,冻存于本实验室。胎牛血清、青/链霉素双抗、DMEM培养基、胰酶、DMSO溶液、Tri-zol试剂购自美国赛默飞世尔科技公司,BPA粉末购自罗恩公司。ST细胞在含10%胎牛血清、100 μg·mL-1链霉素和100 IU·mL-1青霉素的DMEM完全培养基中培养,置于5% CO2的37 ℃恒温培养箱中。测序平台使用美国Ilumina公司的Novaseq 6000。
1.2 BPA工作液配制
BPA粉末溶解于DMSO溶液中配制为1 mol·L-1原液,然后倍比稀释为10-3mol·L-1BPA溶液,-20 ℃保存备用。细胞暴露前,取500 μL的10-3mol·L-1BPA溶液溶于10 mL的DMEM完全培养基,制备成终浓度为50 μmol·L-1的BPA工作液,0.22 μm滤膜过滤备用。
1.3 BPA暴露处理
ST细胞培养于6孔板,浓度为2.5×106个·孔-1,试验分为两组:空白对照组(C)和BPA暴露组(B)。贴壁后更换培养基为无血清DMEM培养基+1%双抗培养基,饥饿处理12 h,BPA处理组细胞更换含50 μmol·L-1的BPA的DMEM完全培养基,空白对照组细胞更换为含与处理组细胞等量0.1% DMSO的DMEM完全培养基。每种处理条件设置3个重复孔,BPA暴露6、24 h后收取细胞样品进行后续RNA提取。C组以及B组细胞重复孔按照不同培养时间命名为C6-1、C6-2、C6-3,C24-1、C24-2、C24-3,B6-1、B6-2、B6-3,B24-1、B24-2、B24-3。
1.4 RNA提取、文库构建、库检及上机测序
每个细胞处理孔加入1 mL Trizol进行RNA提取,利用NanoDrop 2000与Qubit对提取的细胞RNA浓度及纯度进行检测。质检合格的RNA制备文库,对核糖体RNA进行酶切,随机分成250~300 bp片段。利用Novaseq 6000测序平台对RNA文库进行双端150 bp高通量转录组测序,将测序图像信号经CASAVA碱基识别转换成文字信号,以Fastq格式储存为原始数据。
1.5 数据比对组装与功能注释
利用FastQC去除原始Fastq数据中低质量和污染的reads后,获得clean reads通过Tophat v2.1.1与猪参考基因组Sus scrofa11.1进行比对,利用StringTiev1.3.3b进行转录组组装。对获得的基因分别基于NR、Swiss-Prot、Pfam、COG、GO和KEGG数据库进行BLAST功能注释。
1.6 基因表达与差异基因分析
利用表达定量软件RSEM v1.3.1对基因表达水平进行定量分析,定量指标为TPM。使用DESeq2 v1.24.0鉴定空白对照组与BPA暴露组细胞之间的差异表达基因(DEGs),使用Benjamini和Hochberg方法(BH)调整P值控制错误发现率,两组之间表达倍数变化(FC)≥ 2或≤0.5,且adjustedP<0.05的基因名被认定为DEGs。
1.7 功能富集分析
基于使用Goatools v0.6.5的Fisher精确测试进行GO富集分析,用以确定DEGs的潜在作用。使用KOBAS v2.1.1进行KEGG富集分析,用以评估显著富集的代谢或信号转导途径。经BH调整的P<0.05的GO功能或KEGG通路被认为显著富集。
1.8 荧光定量PCR
应用Trizol法对处理后的细胞进行总RNA提取后,应用核酸浓度检测仪进行RNA质量检测,使用 Promega RT reagent Kit(Perfect Real Time)进行RNA反转录,用7500 FAST PCR仪进行qPCR。mRNA引物序列见表1。

表1 mRNA引物序列Table 1 mRNA primers sequence
2 结 果
2.1 测序质控和样本间相关性分析
本次转录组测序12个样品共获得87.63 Gb高质量读取条带用于后续组装和分析,每个样品数据量平均为5.94 Gb。所有样本的Q20和Q30平均值分别为97.4%和93%,GC含量平均为53.7%,表明测序获得的读取条带质量高。基于Spearman相关性分析对所有12个样本的TPM分布构建相关矩阵,结果表明,不同BPA暴露时间下的细胞与空白对照组细胞样品明显分离,组内重复样品能够聚集在一起,表明各组测序结果一致性高,测序数据的再现性高(图1)。
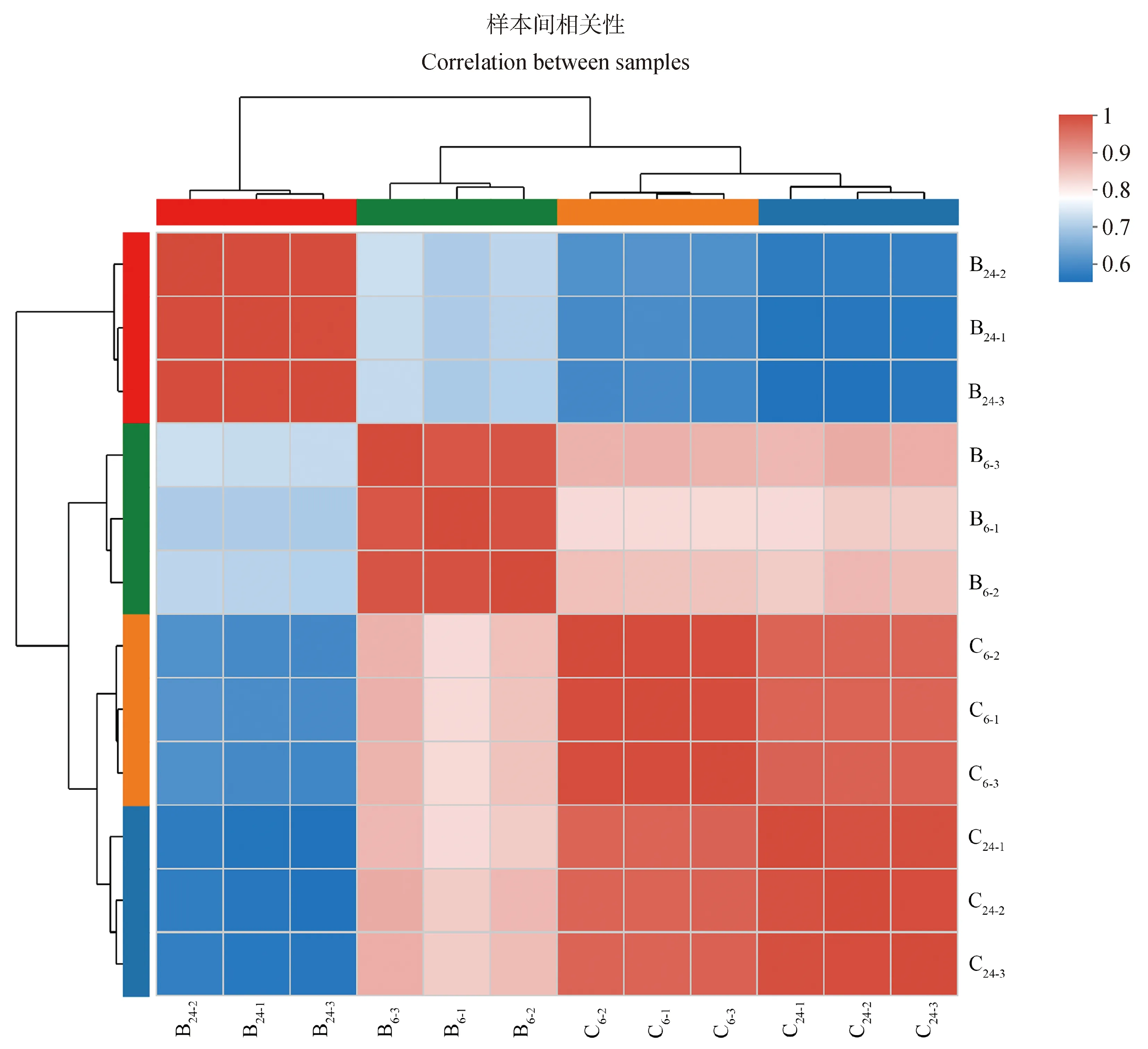
不同颜色的方块代表两个样本的相关性The squares with different colors represent the correlation between the two samples图1 样本间相关性热图Fig.1 Correlation heatmap between samples
2.2 参考基因功能注释分析
从所有样本中共发现33 004个基因,包括31 908个参考基因(96.7%)和1 096个未注释的新基因(3.3%)。在31 908个参考基因中,共22 279(69.8%)个基因能够通过COG(18 137)、GO(18 528)、KEGG(13 218)、NR(21 166)、Swiss Prot(19 103)和Pfam(15 947)数据库进行注释(图2A)。
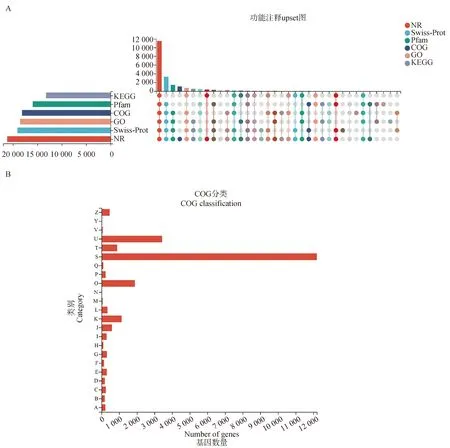
A.基于不同数据库功能注释的Upset图;B.COG功能注释A.Upset diagram based on different database function annotations;B. COG function annotation图2 参考基因功能注释图Fig.2 Function annotation diagram of referenced genes
随后将参考基因比对到COG数据库中,结果显示共获得18 137个COG功能注释信息,划分为23个功能分类(图2B)。与细胞内运输、分泌和囊泡运输相关的基因分布最多(U),有3 431个基因。涉及翻译后修饰、蛋白质周转、分子伴侣蛋的功能基因(O)数量次之,有1 887个基因。基因功能尚未可知的基因(S类)数量最多,达到12 198个,这说明BPA暴露后ST细胞应答反应仍需深入挖掘。
GO注释结果显示,共有18 528个基因能够被注释为58个GO分类(图3)。在生物学过程类别中,细胞过程、生物调节相关基因最多,分别为13 998和11 790个。在细胞成分类别中,注释到细胞膜结构和细胞组成成分相关基因最多,分别为15 988和9 927个。在分子功能类别中,与结合和催化活性相关基因最多,分别为12 354、8 852个。
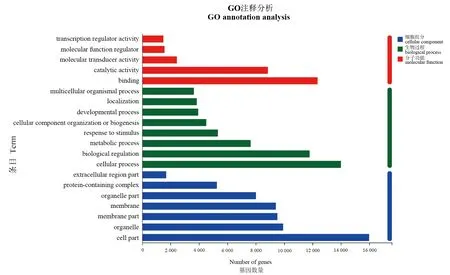
图3 GO注释分析Fig.3 GO annotation analysis
KEGG注释结果表明(图4),注释到环境信息处理的信号转导的参考基因数量最多(2 036个),注释到免疫系统相关的参考基因有1 130个,与内分泌系统相关基因有1 024个。

图4 KEGG注释分析Fig.4 KEGG annotation analysis
2.3 新转录本预测与样本间Venn分析
对新转录本进行功能注释(图5A),与内含子链完全匹配的转录本数量最多,达63 041个。至少有一个剪接与参考转录本共享的潜在新转录本片段(j)数量为16 753个,未知的转录本(u)数量为1 328个,与参考转录本外显子所处链的反义链有交集的转录本(x)数量为727个,完全落入参考转录本内含子区的转录本(i)有611个,与参考转录本的外显子有一定的交集的转录本(o)数量为458个。
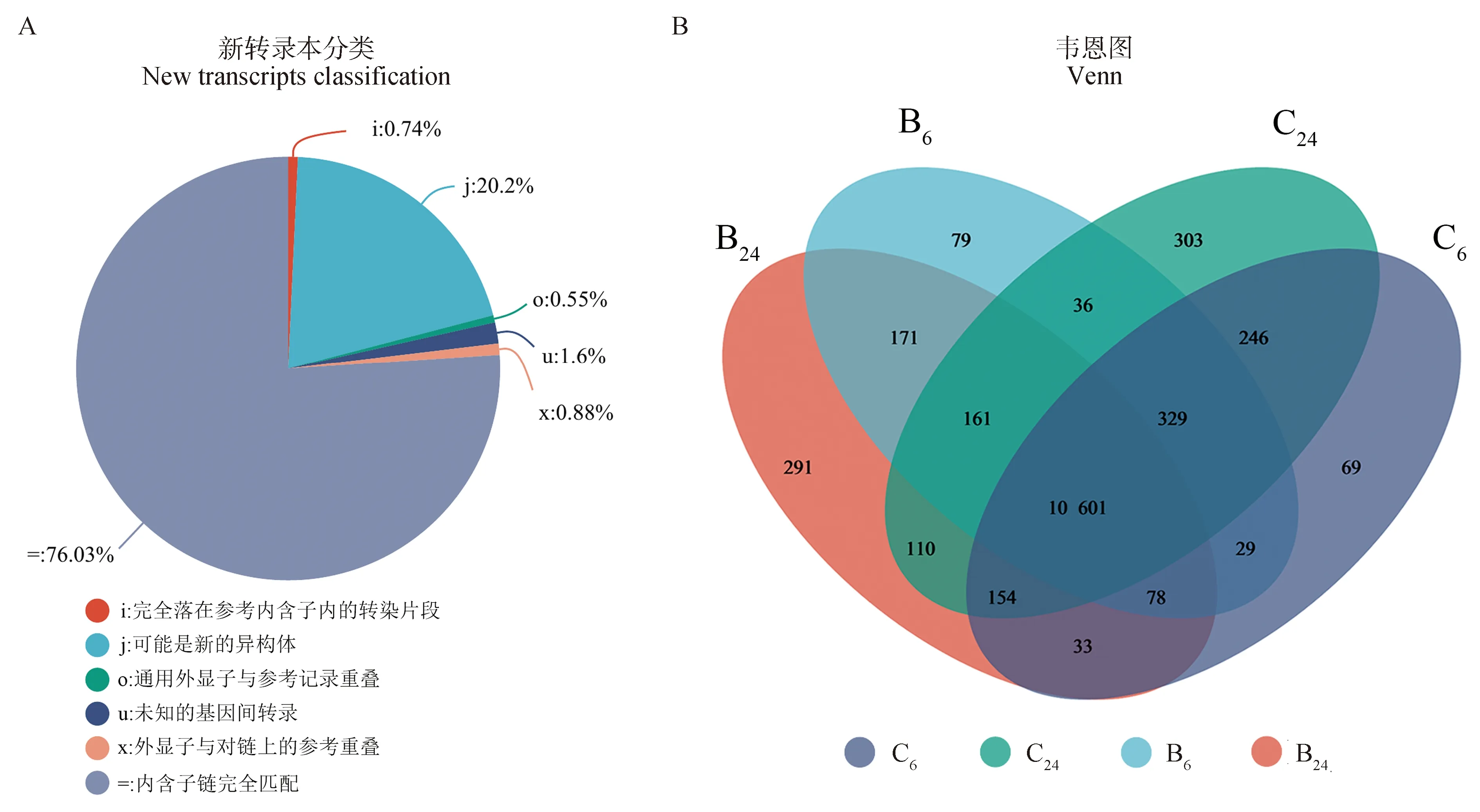
A.新转录本类型分布图;B. 组间参考基因Venn图A. The novel transcript types distribution; B. Venn analysis of reference genes between groups图5 新转录本预测和Venn分析Fig.5 Prediction of novel transcripts and Venn analysis
对参考基因进行Venn分析获取不同处理组间共有或特有的基因(图5B)。BPA暴露6、12 h的细胞与空白对照组细胞共有基因10 601个,BPA暴露6 h后的B6组细胞特有基因79个,而BPA暴露24 h后的B24组细胞特有基因增加到291个。
2.4 差异基因分析
与空白对照组细胞相比,BPA暴露6 h导致3 940个基因表达显著差异(图6A),其中2 261个基因表达上调,1 679个基因表达下调。BPA暴露6 h后,基因表达上调差异倍数前10的基因为ACTG1、SPP1、TSP1、BIP、TF、PAI-1、UPA、ODC1、UBC和UBB,基因表达下调差异倍数前10基因为TUBA1B、HSPG2、SOD3、S100A6、EMILIN2、TUBB2B、P311、LGALS1、AHCY和FAT1。

BPA暴露6 (A)和24 h(B)的差异基因散点图Scatter plots of DEGs from cells exposed to BPA for 6 (A) and 24 h (B)图6 差异基因散点图Fig.6 Scatter plots of DEGs
BPA暴露24 h后,差异基因数量达到6 928个,包括3 222个上调基因和3 706个下调基因(图6B)。上调差异倍数前10基因分别为FTL、BIP、HSPA8、UBB、UBC、Hsp90、ODC1、CLU、ANXA1和RBP4,下调差异倍数前10的基因分别为MT-CO1、FN1、GAPDH、ACTG1、SPP1、ENO1、APLP2、COIII、LDHA和TMSB10。从结果可以看出,SPP1基因在BPA暴露6 h后表达增加,但在BPA暴露24 h后表达降低。在BPA暴露6和24 h后,BIP、UBB、UBC、ODC1四个基因表达均明显升高。
2.5 差异基因GO富集分析
对BPA暴露6、24 h的差异基因进行GO富集分析。如图7A所示,展示了富集差异倍数前20的信号通路。ST细胞BPA暴露6 h后,与泛素依赖性蛋白质分解代谢过程调节相关的差异基因最多,达到46个,其次是T细胞分化调节(42个)。BPA暴露6 h的差异基因GO富集弦图结果显示(图7B),参与泛素依赖性蛋白质分解代谢过程调节过程上调差异倍数前10的差异基因有IL-23、p35、p21、SOX9、TRIB3、SOCS1、PI3K、NLRP3、TBX20和NF-κB,下调差异倍数前10的基因有SLA-DQB1、CDKN2C、SMAD6、SASH3、MYB、DDA3、CDC20、PLK1、CCNB2和NR2F2。
ST细胞BPA暴露24 h后差异基因GO富集分析显示(图7C),富集通路与BPA暴露后6 h明显不同,糖酵解过程富集差异倍数最高(adjustedP-value=3.78×10-4),富集基因23个。细胞外基质组织、有机酸分解代谢过程、羧酸分解代谢过程富集差异基因数量最多,分别为101、94、94个。GO富集弦图显示(图7D),在参与糖酵解过程的基因中,除PFKFB2基因上调外,其他富集的22个基因均下调,下调差异倍数前10的差异基因有GPI、PGK1、PGAM1、HKDC1、TPI1、PFKL、HK1、ENO1、GAPDH、ALDOC。
2.6 差异基因KEGG富集分析
如图8A所示,在KEGG富集分析中展示了富集差异倍数前20的信号通路。BPA暴露6 h后,TNF信号通路(adjustedP-value=5.90×10-15)、癌症相关microRNA(adjustedP-value=1.40×10-11)、p53信号通路(adjustedP-value=6.94×10-9)、IL-17信号通路(adjustedP-value=7.52×10-8)、MAPK信号通路(adjustedP-value=2.88×10-7)等炎症信号通路富集差异倍数较高。KEGG富集弦图显示(图8B),参与TNF信号通路上调差异基因包括PTGS2、LIF、CREB5、NF-κB、CCL2、IL6、BIRC2、CREB3L3、CXCL10。BPA暴露24 h后,富集差异倍数前3的通路为精氨酸和脯氨酸代谢、组氨酸代谢、糖酵解途径等代谢通路(图8C),而MAPK信号通路等炎症信号通路在BPA暴露后24 h富集并不明显。KEGG富集弦图显示(图8D),参与精氨酸和脯氨酸代谢通路上调差异基因包括ARG1、SMOX、SAT1、ODC1,下调差异基因包括AGMAT、DAO、AOC1、GATM、GAMT、L3HYPDH。
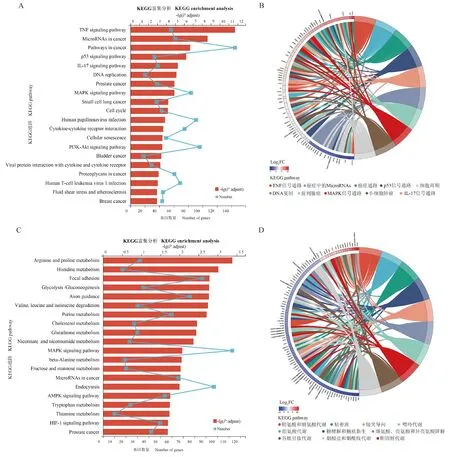
BPA处理6 h后KEGG富集分析气泡图(A)和富集弦图(B);BPA处理24h后KEGG富集分析气泡图(C)和富集弦图(D)KEGG enrichment analysis bubble map (A) and chordograms (B) after BPA exposure for 6 h; KEGG enrichment analysis bubble map (C) and chordograms (D) after BPA exposure for 24 h图8 KEGG富集分析Fig.8 KEGG enrichment analysis
2.7 关键差异基因表达验证
用Real-time PCR对转录组测序结果进行验证。BPA暴露后6 h,TNF等炎症信号通路相关差异基因PTGS2、LIF、NF-κB、IL-6、CCL2、TRAF3表达显著升高(图9)。BPA暴露后24 h,精氨酸和脯氨酸等代谢通路相关差异基因ARG1、SMOX、SAT1、ODC1、FTL、PFKFB2表达显著上调(图9B)。

Real-time PCR分析BPA处理6(A)、24 h(B)关键差异基因表达Real-time PCR analysis of DEGs after BPA exposure for 6 (A) and 24 h (B)图9 差异基因表达Real-time PCR分析Fig.9 Real-time PCR analysis of DEGs
3 讨 论
BPA属低毒性化学物,动物试验发现BPA有模拟雌激素的效果[24],低剂量也能导致动物雌性早熟、精子数下降、前列腺增长等。此外,双酚A 具有一定的胚胎毒性和致畸性,可明显增加动物卵巢癌、前列腺癌、白血病等癌症的发生。生殖系统是BPA作用的主要靶器官,BPA对生殖系统的损伤作用体现在抑制间质细胞中睾丸类固醇生成酶和类固醇生成,增加炎症细胞数量,导致睾丸发育缺陷,破坏生殖细胞的成熟,改变雌激素相关基因表达,精子生成受限,降低精子质量及运动能力。本研究使用转录组测序分析了猪睾丸支持细胞暴露于BPA不同时间后的基因表达谱变化。与小鼠试验模型相比,猪与人体在生理结构上更加接近,本研究结果也为探究BPA对人生殖系统的作用提供了参考。
3.1 BPA对炎性反应通路的作用
本研究发现,猪睾丸支持细胞BPA暴露6 h后差异基因功能富集在TNF、MAPK、IL-17等炎性信号通路。TNF是细胞凋亡以及炎症和免疫的主要介质,TNFα 受体分为2种(TNFRⅠ和TNFRⅡ),存在于多种细胞表面,TNF-α 与 TNFR的结合激活了多种信号通路,通常会引起细胞凋亡、炎症和肿瘤的发生等。BPA暴露诱导PK-15细胞TNF-α 表达升高,利用qRT-PCR技术检测其他炎性因子IL-6、IL-8、IL-1β等均表达增高,证实BPA引起猪肾细胞的炎性反应[25]。
MAPK信号通路是TNF/TNFR1信号下游通路。MAPK是信号从细胞表面传导到细胞核内部的重要传递者,MAPK通路有MAPK激酶激酶、MAPK激酶和MAPK三种重要的关键酶,3种酶共同调节细胞的生长分化、炎症反应、对环境的应激适应等重要的细胞生理过程。研究证实,双酚类化合物能够激活人卵巢皮质细胞的ERβ/GPR30-MAPK信号通路,导致细胞炎症的发生[26]。本研究发现,BPA诱导TNF通路中TFNR1以及TRAF2/5、TAK1显著上调,进而激活MKK4/7、MKK3/6和JNK高表达。
IL-17是一种促炎因子,能够诱导上皮细胞、内皮细胞、成纤维细胞分泌合成IL-6、IL-8等。JNK/NF-κB信号通路是典型的细胞炎症反应通路。巨噬细胞敲除IL-17A基因后,BPA激活JNK/NF-κB以及诱导脂肪组织炎症的作用明显减弱[27]。研究表明,血清双酚A水平与IL-23和IL-17呈正相关,诱导全身炎症反应[28]。本研究发现,BPA诱导IL-17基因上调,IL-17通路下游的NF-κB和炎症因子IL-23表达均明显增加。
研究发现,IL-17与TNF-α共同作用可上调皮肤角质形成细胞系HaCaT细胞表达IL-17R和p-p38 MAPK,进一步促进IL-6、IL-8、MIP-3α等炎症因子的分泌[29]。四氯化碳通过TNF/MAPK/NF-κB信号通路协同作用诱导小鼠细胞炎症,促进TNF-α、IL-6等促炎症因子上调,加剧了NF-κB、ERK、MAPK蛋白的磷酸化,导致小鼠肝纤维化的发生[30]。BPA和BPS通过MAPK/JUN通路诱导绵羊卵巢颗粒细胞的炎症反应,降低了类固醇的分泌,影响生殖系统的功能[31]。硫氢化钠通过抑制ERK/JNK/MAPK通路缓解BPA导致的鼠肺泡上皮细胞炎症反应的发生[32]。这些研究表明,不同促炎细胞通路之间互相联系影响。本研究结果表明,BPA暴露通过促进TNF、p53和MAPK通路协同激活诱导细胞炎症。
3.2 BPA对细胞增殖的作用及致癌机制
作为环境雌激素的一种类型,已经有大量的研究证实BPA具有促进细胞增殖的作用及致癌效应。本研究发现,猪睾丸支持细胞暴露于BPA后,p53信号通路显著富集。p53是一种抑癌蛋白,p53基因是细胞周期中的负调节因子,在周期调控、细胞分化、细胞凋亡、DNA修复等重要的生物学过程中发挥着重要作用,p53蛋白的过表达与肿瘤的转移复发等相关[33]。研究发现,BPA通过ERK、EGFR、AR和ERβ等信号途径,导致p53磷酸化,进而激活EGFR/ERK/p53信号通路,诱导原发性和前列腺癌细胞的细胞周期阻滞[34],证实生殖细胞暴露于BPA后,p53表达异常激活了p53相关的信号通路导致生殖细胞增殖,诱发生殖系统癌症。p53在细胞凋亡过程发挥了重要的作用,BPA暴露于小鼠精原细胞GC-2后,p53和Bcl-2基因上调,细胞凋亡率升高[35]。羊生殖细胞暴露于BPA后,p53通路激活,凋亡蛋白Caspase-3、p53和Bcl-2表达量显著上调,细胞发生凋亡,生殖细胞功能降低[36]。BPA暴露也上调细胞凋亡和p53通路相关基因表达[37]。
3.3 BPA对糖酵解途径的作用
KEGG富集分析显示,BPA暴露24 h后,猪ST细胞糖酵解和氨基酸代谢显著富集。研究表明,高浓度的BPA暴露会增加基础葡萄糖摄取,促进糖酵解,但较低水平的双酚A没有此类效果[38]。亚毒性浓度的BPA暴露不仅促进癌细胞系OVCAR-3细胞的增殖,同时促进糖酵解代谢,增加细胞内ATP、乳酸和丙酮酸产生[39]。短期或长期暴露双酚类化合物也可以增加中性粒细胞糖酵解功能[40]。
3.4 BPA对氨基酸代谢的作用
氨基酸代谢是BPA暴露24 h后富集差异倍数最高的信号通路。大量研究证明,BPA暴露是导致氨基酸代谢紊乱的原因之一。代谢组学研究表明,50 μg·kg-1的BPA暴露可诱导SD大鼠血浆中19种代谢物表达上调,32种代谢物表达下调,其中柠檬酸循环、丁酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢以及甘油磷脂代谢显著紊乱[41]。妊娠期母鼠BPA暴露可以导致子代公鼠谷氨酸转运体GLAST以及GLT-1蛋白的上调表达,谷氨酸代谢酶GS、GLS、GDH下调表达[42]。
4 结 论
本研究利用转录组分析技术探究了猪睾丸支持细胞暴露于BPA不同时间后的基因表达谱。BPA暴露6 h后,猪睾丸支持细胞表现出明显的促炎反应,TNF信号通路富集差异倍数最高。与BPA暴露6 h不同的是,猪睾丸支持细胞在BPA暴露24 h后氨基酸及糖代谢通路富集,包括精氨酸和脯氨酸、组氨酸、糖酵解途径等代谢通路。本研究初筛了BPA损伤猪睾丸支持细胞功能的信号通路及关键基因,为进一步探究BPA诱导公猪生殖障碍的作用机制奠定了基础。
