2个猪笼草品种耐冷性比较研究
2023-07-31阮继伟杨春梅余蓉培瞿素萍单芹丽金春莲吴丽芳
阮继伟,杨春梅,余蓉培,瞿素萍,单芹丽,2,金春莲, 吴丽芳*
(1.云南省农业科学院 花卉研究所/国家观赏园艺工程技术研究中心,云南 昆明 650205;2.玉溪云星生物科技有限公司,云南 玉溪 652604)
猪笼草(Nepenthaceae)现已成为引人注目的观赏植物,其由叶片变化而来的笼状变态叶造型独特,同时具有食虫特性,是目前食虫植物中最受人们青睐的种类之一。近年来,云南从美国独家授权引入了一批猪笼草新品种Brice[Nepenthes.Khasiana×(ventricosa×maxima)],系葫芦猪笼草(Nepenthes ventricosa)、大猪笼草(Nepenthes maxima)和卡西猪笼草(Nepenthes Khasiana)的杂交品种,其笼状变态叶较大、颜色丰富、观赏性更佳,但在滇中地区栽培冬天易发生冷害。从福建引入的毛猪笼草(Nepenthes. fusca×maxima),系暗色猪笼草(Nepenthes fusca)和大猪笼草(Nepenthes maxima)的杂交品种,在国内栽培较多,在滇中地区栽培表现出一定的耐冷性。为了促进猪笼草新品种在生产上的推广应用,有必要针对新品种开展耐冷性的评价研究,以便为实际生产提供指导。刘学庆等[1-4]研究认为,可溶性糖含量、可溶性蛋白含量、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量等可作为花卉等植物耐冷性强弱的判断依据。有关猪笼草发生冷害的下限温度未见报道,因此本研究针对耐冷性表现差异的Brice和毛猪笼草2个品种,利用夏季养护在大棚内的植株作为试验材料,在不同温度(15/0、15/2和25 ℃/15 ℃)处理下,调查2个品种植株的冷害发生症状及耐冷相关指标,并明确2个猪笼草品种耐冷性差异以及冷害发生的温度点和时间点,阐述耐冷相关指标(活性)的变化规律,以期为生产中变温调控提供理论指导,并为需要精确时间点取样的代谢和分子试验提供取样时间点依据。
1 材料与方法
1.1 供试材料
从美国引入的Brice和从福建引入的毛猪笼草,于2020年4月按常规栽培技术种植于云南省玉溪市江川区九溪镇的云南农业科技园内(24°18′N,海拔1760 m)。
1.2 试验设计
夏季棚内种植的猪笼草植株于2021年6月26日晚放入光照培养箱,在光照/黑暗时间为12 h/12 h条件下设置不同的温度处理,即T1(15 ℃/0 ℃)、T2(15 ℃/2 ℃)、T3(25 ℃/15 ℃)。以T1为例,光照时温度为15 ℃,黑暗时温度为0 ℃。每天在暗处理结束后2 h内(8:00~10:00),连续8 d,分别对2个品种植株进行叶片取样0.2 g,用于测定可溶性糖、可溶性蛋白和丙二醛(MAD)含量,以及过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性,并对其变化趋势进行分析。
分别按上海优选生物科技有限公司的植物可溶性糖试剂盒说明书(微量法)、CA法蛋白含量测定试剂盒说明书(微量法)、过氧化氢酶活性检测试剂盒说明书(微量法)、过氧化物酶活性检测试剂盒说明书(微量法)、超氧化物歧化酶试剂盒说明书(微量法)、丙二醛含量试剂盒说明书(微量法)测定和计算各耐冷指标的含量与活性。
1.3 试验方法
2020年4月16日将猪笼草品种Brice和毛猪笼草各100株小钵(直径55 mm、高55 mm)苗种植于12 cm×12 cm营养钵内,钵内填充栽培基质,按泥炭∶红土=8∶2(v/v)的比例混合。植株按常规栽培技术养护于塑料大棚内。冬季夜间最低温小于10℃后,日落前关闭大棚顶膜、侧膜及盆内遮阳网保温,日出后首先打开遮阳网,棚内温度高于25 ℃后再打开大棚顶膜、侧膜。2020年越冬后,存活的植株正常管理(植株放入培养箱前1周的棚内气温在20~32 ℃之间),于6月26日晚20:00放入不同温度的光照培养箱(恒宇HGZ-H400,上海跃进医疗器械有限公司)内,设置20:00至次日8:00无光照,8:00~20:00有光照(12000 lx)。本试验的3个处理均包括毛猪笼草5株、Brice 4株。取样时间为6月27日—7月4日。期间适时给基质补水,以保证植株水分充足;观察各处理植株冷害发生情况并记录拍照。T1、T2和T3处理的日平均温度分别为7.5、8.5和20.0 ℃,处理前1周大棚内的平均温度为25.6 ℃。
1.4 数据处理
观察记录的原始数据采用Excel 2007软件进行处理,用SigmaPlot 10.0软件作图。
2 结果与分析
2.1 植株冷害表现
由图1可以看出:T1温度条件下,处理2 d后(6月28日上午9:00),Brice的叶片已经出现了明显的冷害,而毛猪笼草的叶片没有出现冷害。

图1 猪笼草2个品种在低温处理2 d后的植株冻害情况
由图2可知:低温处理5 d后(7月1日),对于耐寒品种毛猪笼草,夜温在T1、T2、T3温度条件下,A1、A2、A3处理的植株均没有表现出明显的冷害。而对于Brice而言,在T1温度条件下,B1处理的4株植株全部发生了严重的冷害;在T2温度条件下,B2处理的4株植株中有2株发生了冷害;在T3温度条件下,B3处理的植株均未发生任何冷害。

图2 猪笼草2个品种在低温处理5 d后的植株冻害情况
由图3可知:低温处理18 d后(7月14日),对于耐寒品种毛猪笼草,在T1和T2温度条件下,A1、A2处理的植株均表现出老叶有冷害,但植株仍存活;在T3温度条件下,A3植株没有表现出明显的冷害。而对于Brice而言,在T1温度条件下,B1处理的4株植株全部因冷害死亡;在T2温度条件下,B2处理的4株植株中有2株存活,但老叶已发生冷害;在T3温度条件下,B3植株没有表现出任何冷害。

图3 猪笼草2个品种低温处理18 d后的植株冻害情况
2.2 植株叶片组织耐冷性生化指标
2.2.1 可溶性糖含量分析 随着低温处理周期的增加,植株叶片中可溶性糖含量也在增加。在T2温度处理下,毛猪笼草可溶性糖含量明显增加(图4A),植株叶片中可溶性糖含量从7月27日(处理1 d)的31.18 mg/g增加到8月4日(处理8 d)的33.93 mg/g;Brice的含量也表现出同样的增加趋势(图4B),从7月27日(处理1 d)的29.22 mg/g增加到8月3日(处理7 d))31.92 mg/g。由图4可知,毛猪笼草在T1温度处理4 d后(7月30日),植株叶片中可溶性糖含量明显高于其他2个温度处理(T2和T3)的;而Brice在T1温度处理4 d后(7月30日),植株叶片中可溶性糖含量也明显高于T2和T3处理的,但处理6 d后差异消失。在相同的取样时间点,毛猪笼草植株叶片的可溶性糖含量显著高于Brice的。
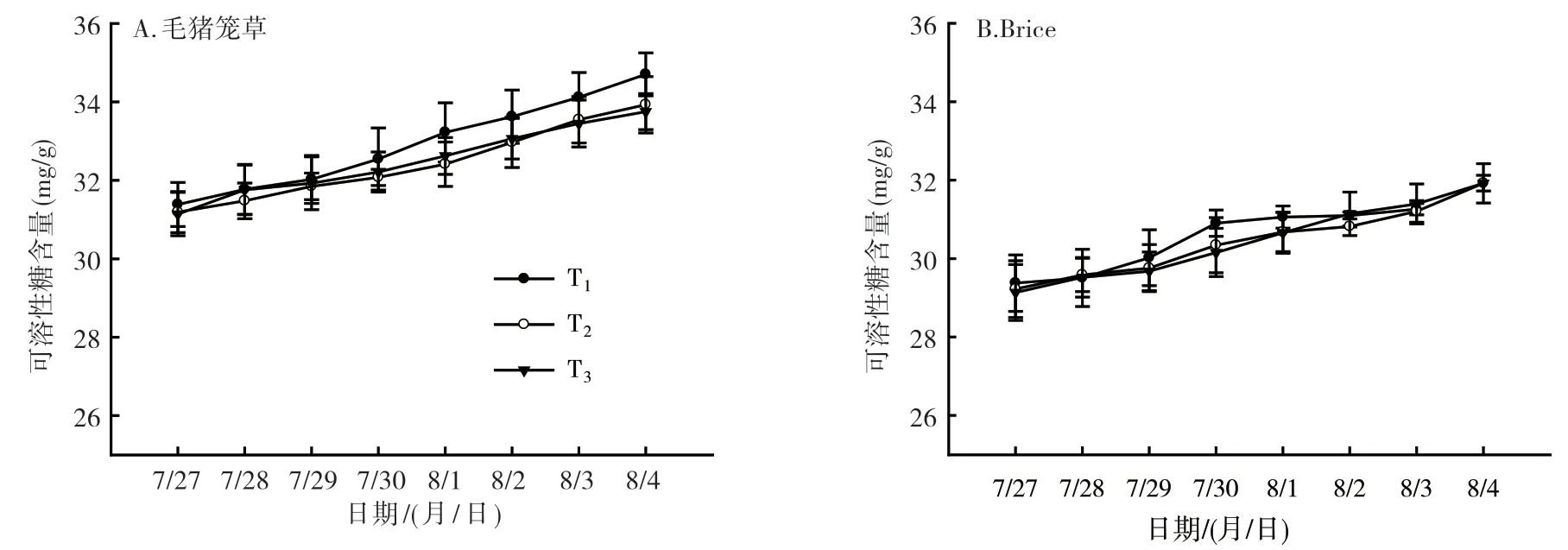
图4 猪笼草2个品种低温处理后叶片中可溶性糖含量变化情况
2.2.2 可溶性蛋白含量分析 从图5可以看出,随着低温处理天数的增加,植株叶片中可溶性蛋白含量逐渐降低,处理5 d后又逐渐上升。在T2温度处理下,毛猪笼草的可溶性蛋白含量从7月27日(处理1 d)的24.01 mg/g降低到7月30日(处理4 d)的22.99 mg/g,再增加到8月4日(处理8 d)的24.97 mg/g(图5A);Brice也表现出同样的增加趋势(图5B),从7月27日(处理1 d)的22.27 mg/g降低到7月30日(处理4 d)的21.17 mg/g,再增加到8月4日(处理8 d)的23.52 mg/g。由图5可知,毛猪笼草在各低温条件下,植株叶片中可溶性蛋白含量无明显差异,而Brice在T1温度处理4 d后(7月30日),植株叶片中可溶性蛋白含量明显低于T2和T3处理的。毛猪笼草植株叶片中可溶性蛋白含量整体高于Brice的。
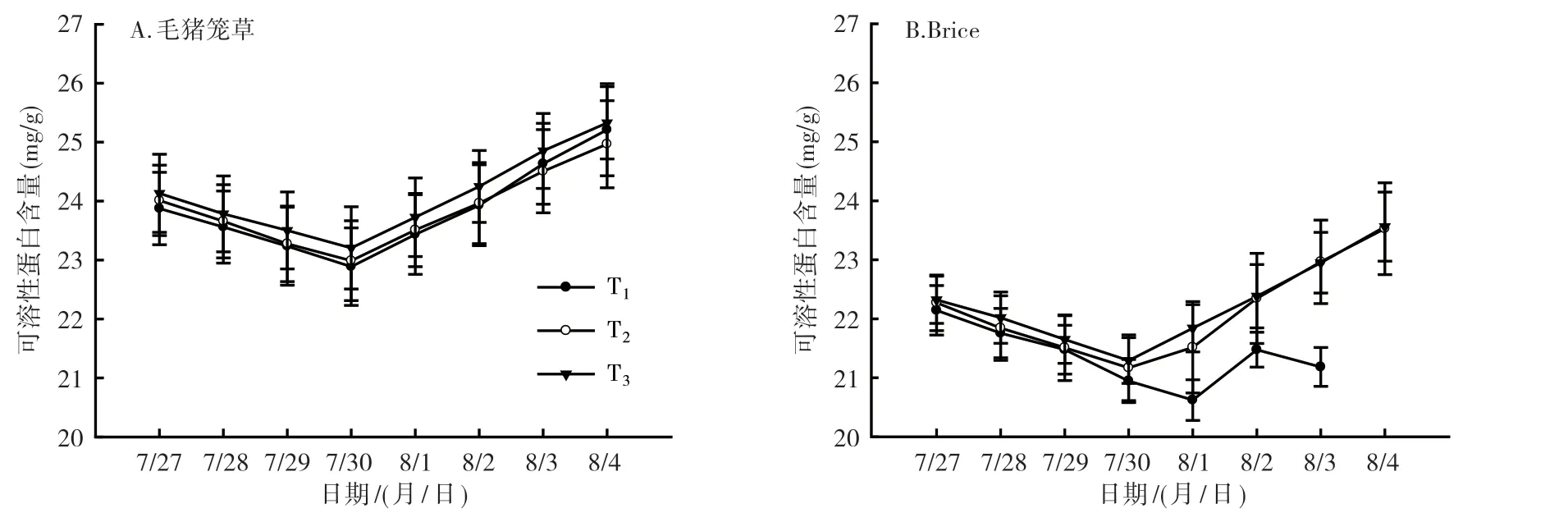
图5 猪笼草2个品种低温处理后叶片中可溶性蛋白含量变化情况
2.2.3 过氧化氢酶活性分析 从图6可以看出,随着低温处理天数的增加,植株叶片中过氧化氢酶活性逐渐增加,在处理4 d后进入比较平稳的水平。在T2温度处理下,毛猪笼草过氧化氢酶活性从7月27日(处理1 d)的9.58 U/mg上升到7月30日(处理4 d)的11.59 U/mg,之后进入平稳期(图6A);Brice也表现出同样的增加趋势(图6B),从7月27日(处理1 d)的9.25 U/mg上升到7月30日(处理4 d)的10.92 U/mg,之后进入平稳期。由图6可知,毛猪笼草在T1温度处理下,植株叶片中过氧化氢酶活性明显低于T2和T3处理的,而Brice在T3温度条件下,植株叶片中过氧化氢酶活性明显高于T1和T2处理的。
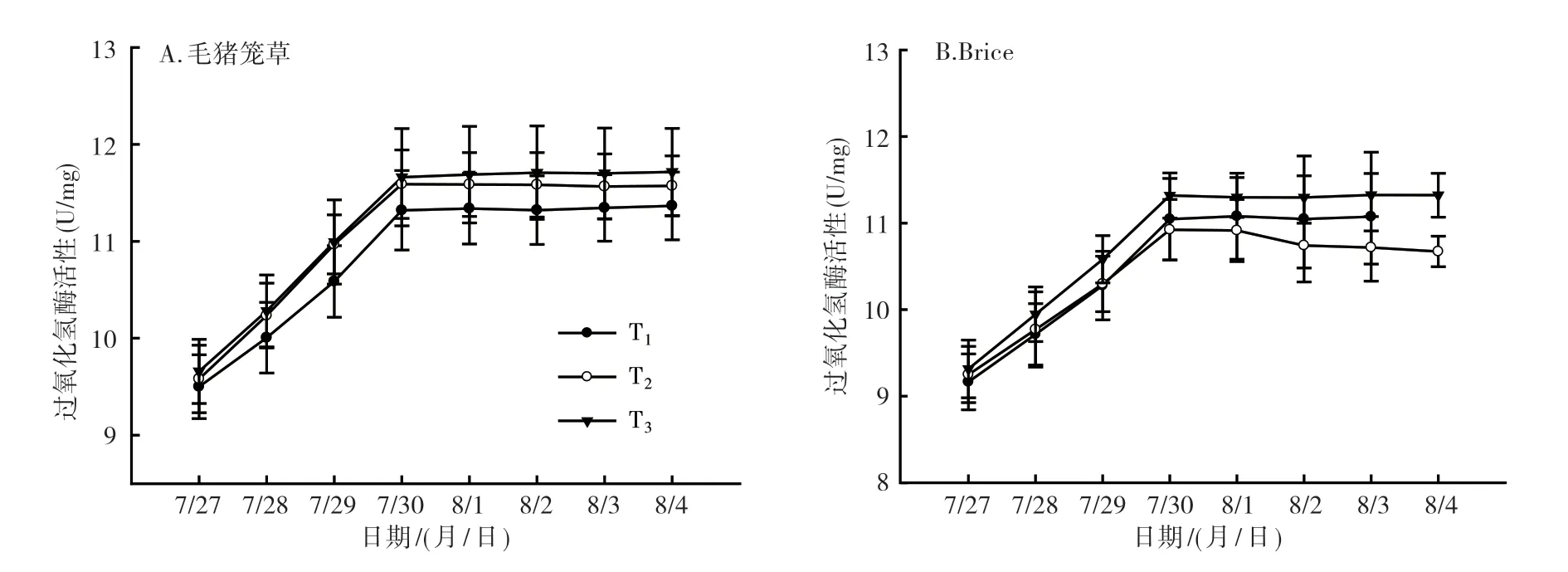
图6 猪笼草2个品种低温处理后叶片中过氧化氢酶活性变化情况
2.2.4 过氧化物酶活性分析 从图7可以看出,随着低温处理天数的增加,植株叶片中过氧化物酶活性逐渐增加,并在处理4 d后达到比较平稳的水平。在T2温度处理下,毛猪笼草过氧化氢酶活性从7月27日(处理1 d)的206.65 U/mg上升到7月30日(处理4 d)的246.31 U/mg,之后进入平稳期(图7A);Brice也表现出同样的增加趋势(图7B),从7月27日(处理1 d)的220.88 U/mg上升到7月30日(处理4 d)的262.40 U/mg,之后进入平稳期。由图7可知,毛猪笼草在T1温度处理下,植株叶片过氧化物酶活性明显低于T2和T3处理的,而Brice在T3温度处理下,植株叶片中过氧化氢酶活性明显高于T1和T2处理的。Brice植株叶片中过氧化物酶活性整体高于毛猪笼草的。

图7 猪笼草2个品种低温处理后叶片中过氧化物酶活性变化情况
2.2.5 超氧化物歧化酶分析 由图8可以看出,随着低温处理天数的增加,植株叶片超氧化物歧化酶活性逐渐增加,并在处理4 d后达到比较平稳的水平。在T2温度处理下,毛猪笼草过氧化氢酶活性从7月27日(处理1 d)的1.03 U/mg上升到7月30日(处理4 d)的1.12 U/mg,之后进入平稳期(图8A);Brice也表现出同样的增加趋势(图8B),从7月27日(处理1 d)的1.06 U/mg上升到7月30日(处理4 d)的1.17 U/mg,之后进入平稳期(T1处理除外)。由图8可知,Brice叶片组织超氧化物歧化酶活性整体高于毛猪笼草(T1处理除外)的。
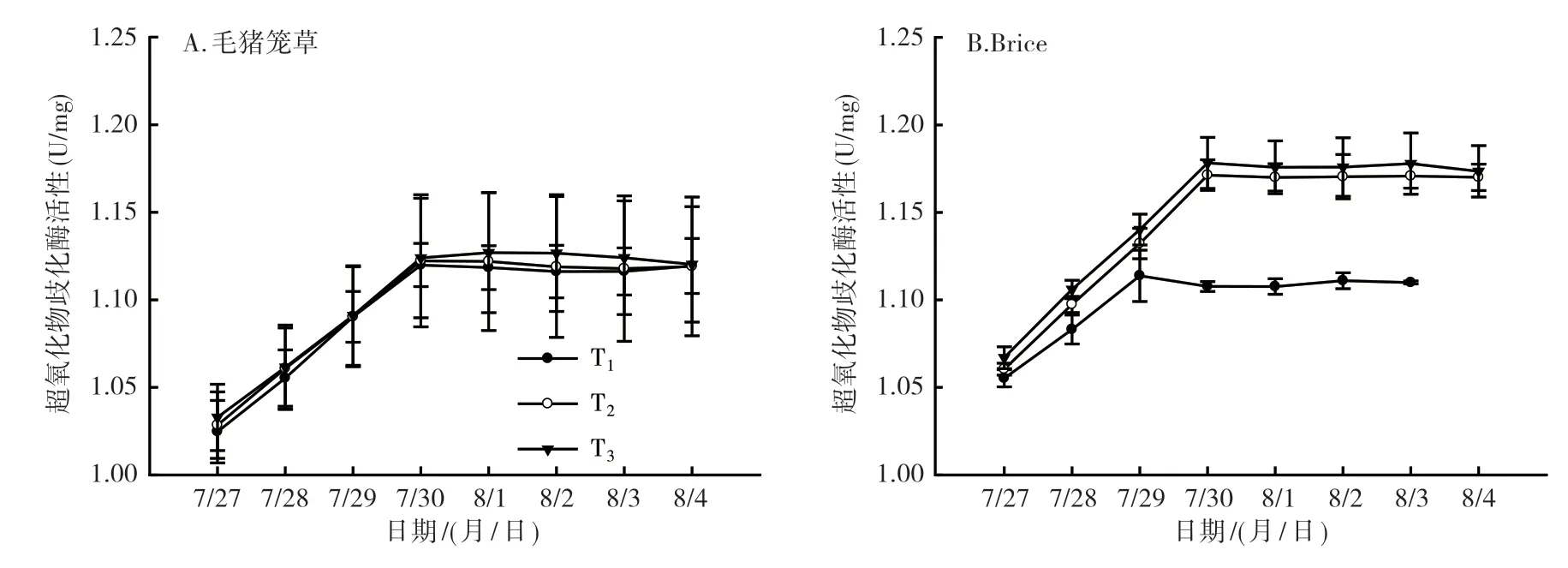
图8 猪笼草2个品种低温处理后叶片中超氧化物歧化酶活性变化情况
2.2.6 丙二醛含量分析 从图9可以看出,随着低温处理天数的增加,植株叶片中丙二醛含量逐渐增加,其中处理前4 d的增加速率较后4 d的大。在T2温度处理下,毛猪笼草丙二醛含量从7月27日(处理1 d)的1.06 nmol/mg上升到8月4日(处理8 d)的1.64 nmol/mg(图9A);Brice也表现出同样的增加趋势(图9B),从7月27日(处理1 d)的0.94 nmol/mg上升到8月4日(处理8 d)的1.44 nmol /mg。毛猪笼草植株叶片中丙二醛含量整体高于Brice的。
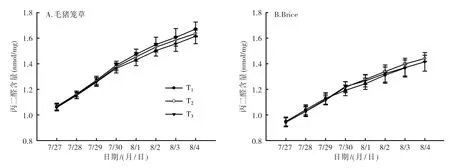
图9 猪笼草2个品种低温处理后叶片中丙二醛含量变化情况
3 讨 论
本研究表明,毛猪笼草的耐冷性显著高于Brice的。Brice在T1和T2处理2 d后,植株叶片均出现了冷害;处理5 d后,T1处理的4株植株全部死亡,T2处理的4株植株中有2株死亡。毛猪笼草在18 d后,T1和T2处理均在老叶上表现出冷害。冬季生产上为保障猪笼草植株不受冷害,对于耐寒品种毛猪笼草应保证大棚温度短期(10 d)内不低于0℃,长期应保证温度在2 ℃以上;对于不耐寒品种Brice,应保证大棚温度高于2 ℃,否则4~5 d的夜间低温就会有超过一半的植株发生冷害并死亡。
可溶性糖含量、可溶性蛋白含量、过氧化氢酶活性、过氧化物酶活性、超氧化物歧化酶活性和丙二醛含量均被报道过与植株耐冷性有关[1,3,5-6]。本研究表明,以上全部指标均随着低温处理天数的增加而发生了明显变化。植物体内糖含量与抗性密切相关,罗娅[5]研究认为,低温胁迫后草莓体内可溶性糖含量增加,从而减轻了胁迫对草莓造成的损伤。本试验中,随着低夜温处理天数的增加,植株叶片中可溶性糖含量也在增加,其中毛猪笼草增加明显,且增幅显著高于Brice的,这在一定程度上可解释毛猪笼草的耐冷性强于Brice的。
随着低温处理天数的增加,植株叶片中可溶性蛋白含量逐渐降低,处理5 d后又逐渐上升。其中毛猪笼草可溶性蛋白含量显著高于Brice的。可溶性蛋白质含量与植物的耐寒性存在密切关系,蛋白质含量的增加,有助于提高细胞内的束缚水含量,降低冰点,从而防止细胞内结冰、避免细胞冰冻死亡[7-9]。本研究中可溶性蛋白含量先降后升,说明植株遇冷后耐冷性下降,经过4 d调整后耐冷性逐渐恢复。毛猪笼草的可溶性蛋白含量显著高于Brice的,这也解释了毛猪笼草具有较好的耐冷性。
过氧化氢酶、过氧化物酶、超氧化物歧化酶是植物抗氧化酶的主要类别[11-12]。植物受到环境胁迫时会导致活性氧的积累,积累到一定程度植物会受到伤害。SOD是植物抗氧化酶系统的第一道防线,SOD活性升高,且维持较高的水平, 就能够清除大部分的氧自由基, 减轻对细胞膜的伤害, 使植株具有较强耐受低温的能力。本研究中,随着低温处理天数的增加,植株叶片中SOD活性逐渐增加,在处理4 d后进入比较平稳的水平。不耐寒品种Brice在T1温度条件下,SOD活性显著低于其他温度处理的,植株发生冷害的程度也更严重(甚至死亡)。POD可以催化由过氧化氢参与的各种还原剂的氧化反应,清除由逆境和胁迫诱发的H2O2[13]。本研究中,随着低温处理天数的增加,植株叶片中POD活性逐渐增加,在处理4 d后进入比较平稳的水平。CAT在清除植物体内的氧自由基时起着重要的作用[14]。本研究中,随着低温处理周期的增加,植株叶片中CAT活性逐渐增加,在处理4 d后进入比较平稳的水平。
随着低温处理天数的增加,植株叶片中MDA含量逐渐增加,其中前4个低温周期的增加速率较后4个低温周期的大,且与可溶性糖含量的变化趋势一致,相关性较高。Janska等[14-15]研究表明,植物受到干旱或者低温胁迫时,都会导致细胞内活性氧的增加。细胞膜系统在受到氧化伤害后会产生MDA,其含量可表征细胞膜脂过氧化的程度,也常用来表征细胞膜受破坏的程度。王冠群等[9]在针对鸢尾的耐寒性研究中发现,其MDA含量先上升后下降,说明叶片在适应低温锻炼通过内部代谢调整提高了耐寒性。本研究有限的取样时期内未见MDA含量下降拐点的出现,这与万玲等[2]的研究结论基本一致。
本研究中可溶性蛋白含量、过氧化氢酶活性、过氧化物酶活性、超氧化物歧化酶活性变化趋势均在低温处理4 d后出现拐点,这说明猪笼草植株叶片组织在低温处理下耐寒相关生理代谢调整的周期是4 d,这也可以解释Brice在T2(夜温2℃)处理下,5 d后没有再出现新增死亡植株。这一时间点的明确有助于下一步精细化取样分析研究代谢及分子水平的变化趋势,也有助于明确生产中变温处理的最低间隔时间,以便猪笼草植株有充足的调整适应时间。
本研究中,T3处理平均温度较处理前(养护大棚内)仅降低了5.6℃,但叶片组织相关代谢物的变化趋势与T1(降低18.1℃)和T2(降低17.1℃)处理的一致,而且数值也比较接近,说明猪笼草植株在养护的过程中,只要平均温度下降超过5.6 ℃,就会引起叶片组织内代谢物质的明显变化,且变化趋势与降低到冻害温度点(15 ℃/0 ℃或15 ℃/2℃)的一致。
