富马酸二甲酯对过氧化氢诱导心脏微血管内皮细胞铁死亡的影响
2023-07-31王赛高静
王赛 高静
胜利油田中心医院心内科(山东东营 257000)
心房颤动(atrial fibrillation,AF)是最常见的心律失常之一,多见于器质性心脏病或其他器质性疾病患者[1]。AF 引起的血栓栓塞并发症(尤其是脑栓塞)是AF 患者致死、致残的最主要原因之一[1]。近年来随着对AF 的生理及病理研究的深入,发现AF 患者存在内皮细胞功能障碍,且与AF的预后相关[2]。过氧化氢(H2O2)诱导的内皮细胞损伤已被证实在AF 中发挥重要作用,保护内皮细胞损伤可作为AF 治疗的潜在干预措施,因此揭示AF 患者内皮细胞损伤的具体机制、寻找有效的改善药物具有重要临床意义。
目前国内外对AF 的治疗集中在抗凝、控制心室率、并发症处理等,并且药物与导管消融策略大多数是经验性的[3],治疗手段局限、手术并发症及术后复发等一系列因素仍存在较大的争议[4]。富马酸二甲酯(dimethyl fumarate,DMF)是FDA 自1994 年以来批准用于治疗严重银屑病和复发性多发性硬化症的药物。DMF 主要通过激活核因子红细胞2(Nrf2)抗氧化途径发挥保护作用[5]。已有研究[6-8]报道DMF 具有保护心肌梗死、缺血再灌注损伤和脓毒症引起的心功能不全的作用。DMF 还能够减轻小鼠动脉粥样硬化斑块的形成[9],但截至目前,并未有研究探索DMF 对AF 患者内皮细胞损伤的作用及其可能机制。因此,本研究使用DMF 干预H2O2处理的内皮细胞,探索DMF 保护内皮细胞的潜在机制,为DMF 治疗AF 提供实验室依据。
1 材料与方法
1.1 实验相关材料人心脏微血管内皮细胞(HCMEC)(中国科学院细胞库);DMEM 培养基、胎牛血清(美国Gibco公司);DMF(上海MCE公司);H2O2(上海阿拉丁公司);胰蛋白酶-EDTA 消化液(0.25%)、CCK-8试剂盒(上海MCE公司);Nrf2、HO-1、p-JAK2、JAK2、p-STAT1、STAT1、GPX4、ACSL4 和GAPDH 抗体购自美国Abcam 公司;ML385 均购自上海MCE 公司;Western bolt 相关试剂、辣根过氧化酶标记的山羊抗兔二抗均购于上海碧云天生物技术有限公司。
1.2 仪器细胞培养箱(美国Thermo 公司);全自动酶标仪(ELX-808,美国BioTek 公司);Western blot 电泳及转膜装置(美国Bio-Rad 公司);低温高速离心机(美国Thermo 公司);凝胶成像及图像分析系统分析仪(美国Bio-Rad 公司)。
1.3 方法
1.3.1 细胞培养HCMEC 培养在含10%胎牛血清、青霉素(100 U/L)/链霉素(100 mg/L)的DMEM培养基中,于37 ℃、5% CO2的细胞培养箱中培养。当细胞融合至90%左右时,使用0.25%胰蛋白酶按1∶3 的比例进行传代。
1.3.2 细胞分组取10 μg 的DMF,用DMEM 培养基溶解为10 mg/mL 的母液,置于-80 ℃冰箱中保存。使用时稀释为10、100、1 000 ng/mL 的DMF,分别干预HCMEC 细胞24 h 和48 h,评估DMF 对HCMEC 细胞的毒性作用,筛选最佳药物浓度。
参考先前的文献,使用DMEM培养配置10 mmol/L的H2O2,干预HCMEC 细胞24 h[10],设为Control 组、H2O2组、H2O2+1 μmol/L DMF、H2O2+10 μmol/L DMF和H2O2+ 20 μmol/L DMF 组,评估DMF 对H2O2诱导的细胞损伤的保护作用。
使用Nrf2 抑制剂ML385(10 μmol/L)干预HCMEC 细胞24 h,随后再加入相应的干预因素,分为对照组、H2O2组、H2O2+ DMF 组和H2O2+ DMF +ML385 组,检测细胞通路和铁死亡的改变,评估Nrf2 通路在DMF 保护内皮损伤中的作用。
1.3.3 CCK-8 法测细胞增殖取生长状态良好的HCMEC,每孔5 × 103个细胞接种于96 孔板,待细胞融合至80%左右时加入不同的干预因素干预相应的时间。待检测时每孔加入10 μL 的CCK-8 溶液,将96 孔板放入37 ℃、5% CO2恒温培养箱中孵育2 h 后,用酶标仪测定在450 nm 处的吸光度(OD)值,以表示细胞增殖能力的改变。
1.3.4 Western blot 检测蛋白表达量各组细胞干预后提取细胞总蛋白,BCA 法进行定量,分别取30 μg 蛋白行SDS-PAGE 电泳,湿转法90 min 将蛋白转印至0.45 μm 孔径的PVDF 上。转膜后TBST洗膜3 次,5%脱脂牛奶封闭1 h,加入Nrf2、HO-1、p-JAK2、JAK2、p-STAT1、STAT1、GPX4、ACSL4 和GAPDH 抗体(浓度均为1∶1 000)4 ℃孵育过夜。次日,TBST 洗膜,加入二抗室温摇床孵育1 h(浓度1∶5 000)。采用底物化学发光法,凝胶成像系统分析。以目的蛋白与相应非磷酸化蛋白的灰度值比表示相对表达量。
1.3.5 ELISA 测炎症指标的改变收集干预后的各组细胞上清5 mL,按照ELISA 说明书检测上清中TNF-α、IL-1β 和IL-18 的表达量,绘制标准曲线,计算炎症因子的浓度。
1.4 统计学方法采用SPSS 22.0 软件和GraphPad Prism 9.0 软件进行统计分析。各组数据以均数±标准差表示,各组之间比较用单因素方差分析,两两比较采用SNK-q检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度DMF 对H2O2诱导的HCMEC 损伤的影响体外成功培养HCMEC,细胞生长良好,呈长梭形(图1)。低浓度(1~20 μmol/L)DMF 对HCMEC 活力无明显影响,高浓度(50 μmol/L)DMF降低了细胞活力,具有一定细胞毒性。于是选择1~20 μmol/L 的DMF 进行后续实验。见表1。
表1 DMF 对HCMEC 增殖的影响Tab.1 Effects of different concentrations of DMF on cell proliferation of HCME ±s
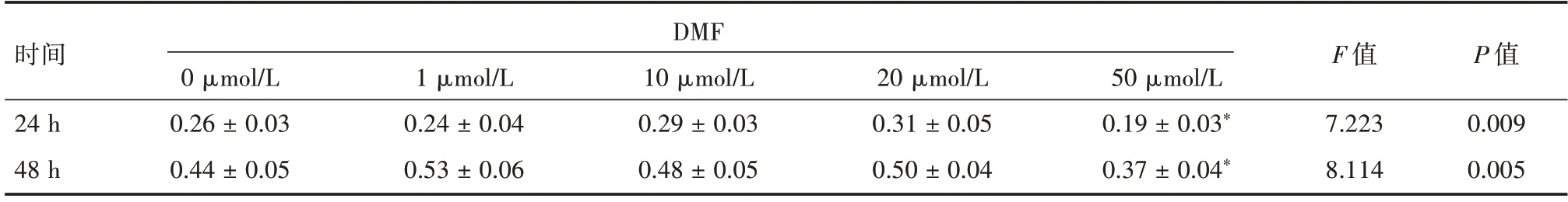
表1 DMF 对HCMEC 增殖的影响Tab.1 Effects of different concentrations of DMF on cell proliferation of HCME ±s
注:与0 μmol/L 组比较,*P<0.05
时间24 h 48 h DMF 0 μmol/L 0.26 ± 0.03 0.44 ± 0.05 1 μmol/L 0.24 ± 0.04 0.53 ± 0.06 10 μmol/L 0.29 ± 0.03 0.48 ± 0.05 20 μmol/L 0.31 ± 0.05 0.50 ± 0.04 50 μmol/L 0.19 ± 0.03*0.37 ± 0.04*F 值7.223 8.114 P 值0.009 0.005
图1 光镜下HCMEC生长状态(200×)Fig.1 Growth state of HCMEC under light microscope(200×)
10 mmol/L 的H2O2干预HCMEC 细胞24、48、72 h 后,细胞增殖能力较对照组均下降,差异有统计学意义(P<0.05);与H2O2组相比,不同浓度DMF 处理组HCMEC 增殖能力增加(P<0.05)。见表2。
表2 不同浓度DMF 对H2O2诱导的HCMECs 增殖的影响Tab.2 The role of different concentration of DMF on H2O2-induced cell proliferation of HCMECs ±s
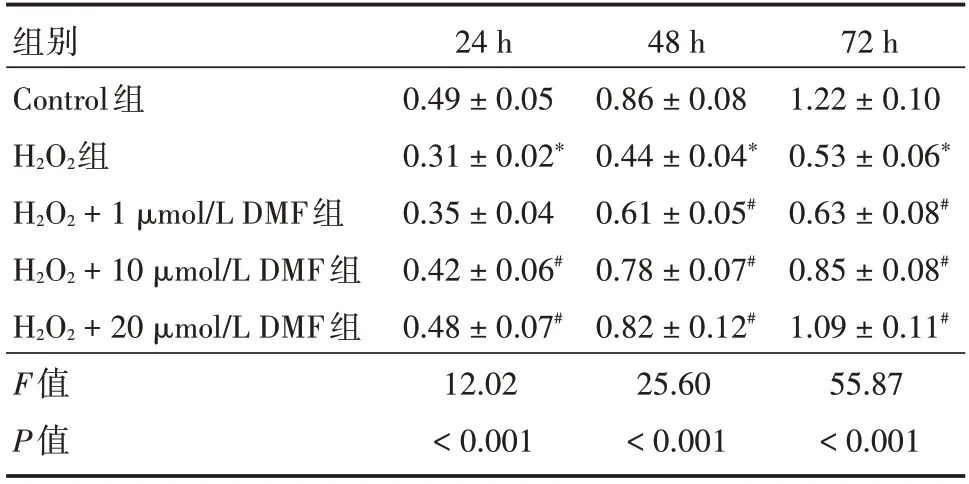
表2 不同浓度DMF 对H2O2诱导的HCMECs 增殖的影响Tab.2 The role of different concentration of DMF on H2O2-induced cell proliferation of HCMECs ±s
注:与Control 组比较,*P<0.05;与H2O2组比较,#P<0.05
组别Control组H2O2组H2O2+1 μmol/L DMF组H2O2+10 μmol/L DMF组H2O2+20 μmol/L DMF组F值P值24 h 0.49±0.05 0.31±0.02*0.35±0.04 0.42±0.06#0.48±0.07#12.02<0.001 48 h 0.86±0.08 0.44±0.04*0.61±0.05#0.78±0.07#0.82±0.12#25.60<0.001 72 h 1.22±0.10 0.53±0.06*0.63±0.08#0.85±0.08#1.09±0.11#55.87<0.001
表3 DMF 对H2O2诱导的HCMEC 炎症因子的影响Tab.3 The influence of DMF on the content of TNF-α,IL-1β,and IL-18 in cell supernatant of HCMECs damaged by H2O2 ±s,pg/mL

表3 DMF 对H2O2诱导的HCMEC 炎症因子的影响Tab.3 The influence of DMF on the content of TNF-α,IL-1β,and IL-18 in cell supernatant of HCMECs damaged by H2O2 ±s,pg/mL
注:与对照组比较,#P<0.01;与H2O2组比较,*P<0.05,**P<0.01
组别Control组H2O2组H2O2+1 μmol/L DMF组H2O2+10 μmol/L DMF组H2O2+20 μmol/L DMF组F值P值TNF-α 25.23±4.03 46.39±10.68#41.39±10.68 35.75±6.89**25.55±9.60**6.952<0.001 IL-1β 14.65±3.20 37.37±6.40#34.14±2.54 25.57±2.28**19.91±3.14**27.35<0.001 IL-18 32.37±6.40 72.88±6.28#62.96±8.00**50.94±4.16**41.49±2.84**46.48<0.001
2.2 不同浓度DMF 对H2O2诱导的HCMEC 炎症因子的影响ELISA 结果显示,H2O2处理细胞后,细胞上清液中TNF-α、IL-1β 和IL-18 水平显著增加(P<0.05);使用不同浓度的DMF 干预细胞,上述炎症因子的水平较H2O2组具有明显下降,差异有统计学意义(P<0.05)。
2.3 DMF 对H2O2处理的HCMECs 细胞铁死亡的影响Western blot结果显示,H2O2处理HCMECs后,GPX4 较对照组显著下降,ACSL4 蛋白水平较对照组显著增加(P<0.05),表明H2O2可诱导HCMECs发生铁死亡。不同浓度的DMF 干预细胞后,DMF组的细胞中GPX4 表达下降,ACSL4 蛋白的水平较H2O2组逐渐上升,成浓度依赖性(P<0.05),见图2。

图2 不同浓度DMF 对H2O2处理的HCMEC 中GPX4 和ACSL4 蛋白表达的影响Fig.2 The effect of different concentrations of DMF on the protein expression of GPX4 and ACSL4 in H2O2 treated HCMEC
2.4 DMF 干预对Nrf2/HO-1 和JAK2/STAT1 通路的影响H2O2处理引起Nrf2 和HO-1 蛋白表达水平下降,不同浓度DMF 组中Nrf2 和HO-1 蛋白表达较H2O2组升高,差异有统计学意义(图3A,P<0.05)。H2O2组JAK2 和STAT1 磷酸化水平的下降(P<0.05),不同浓度IGF1 可刺激HCMEC 细胞内JAK2 和STAT1 的磷酸化水平的增加,差异有统计学意义(图3B,P<0.05)。
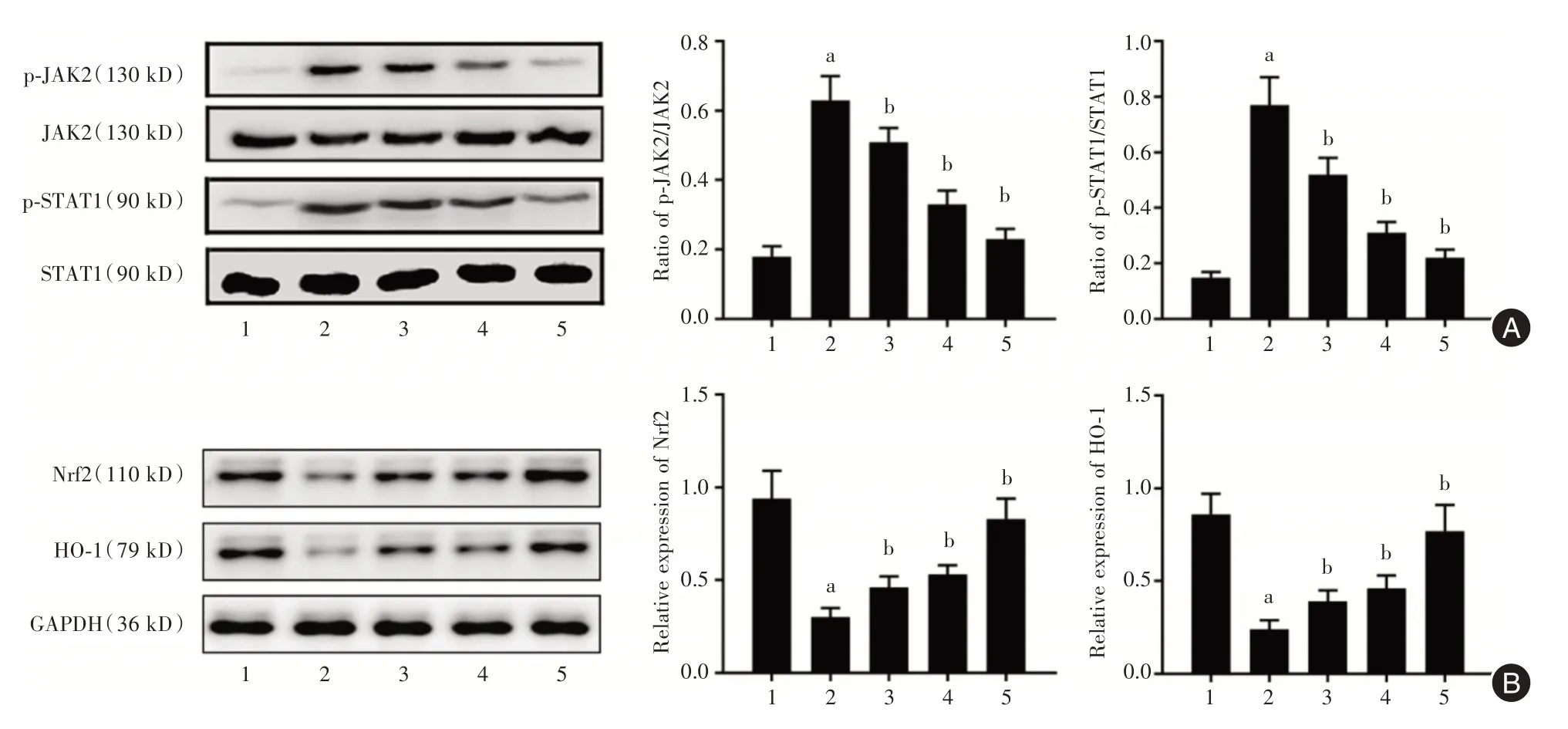
图3 DMF 对H2O2处理的HCMEC 中Nrf2/HO-1 和JAK2/STAT1 通路的影响Fig.3 The effect of DMF on Nrf2/HO-1 and JAK2/STAT1 pathways in H2O2-treated HCMEC
2.5 Nrf2/HO-1 和JAK2/STAT1 通路在DMF 改善HCMECs 损伤中的作用与H2O2+ DMF 组比较,H2O2+DMF+ML385 组中铁死亡蛋白GPX4 蛋白下降,ACSL4蛋白升高,差异有统计学意义(P<0.05)。见图4。
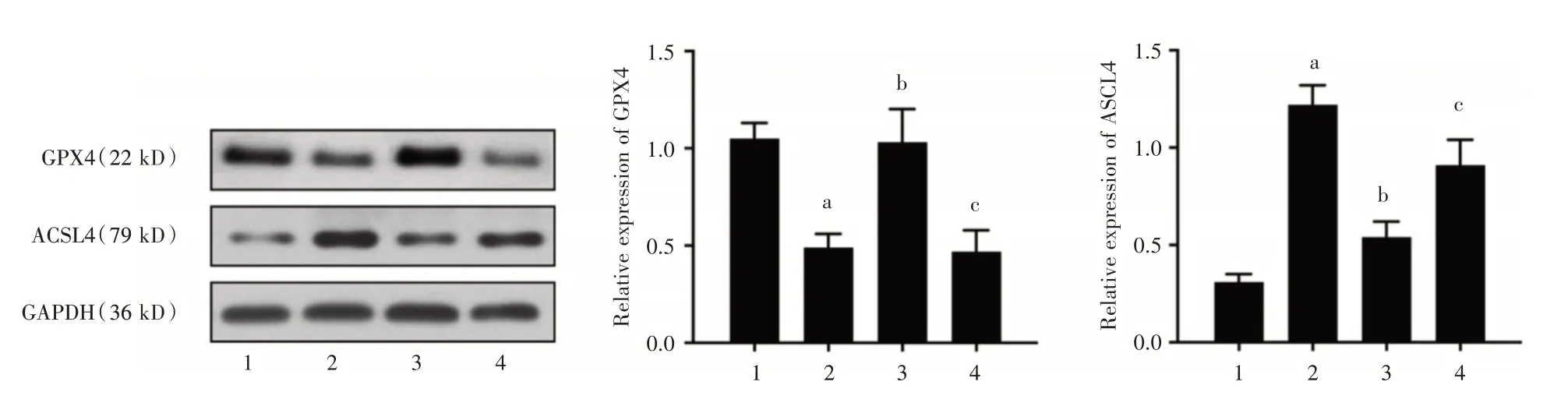
图4 使用Nrf2 抑制剂后DMF 对GPX4 和ACSL4 蛋白表达的影响。Fig.4 The effects of DMF on GPX4 and ACSL4 protein expression after using an Nrf2 inhibitor
24、48 和72 h 时,与H2O2+DMF 组比较,H2O2+DMF + ML385 组的HCMECs 细胞增殖水平均明显下降,差异有统计学意义(P<0.05)。见表4。
表4 JAK2/STAT1 通路在H2O2介导的HCMEC 细胞增殖中的作用Tab.4 The role of JAK2/STAT1 signaling pathway in H2O2-induced cell proliferation in HCMEC ±s
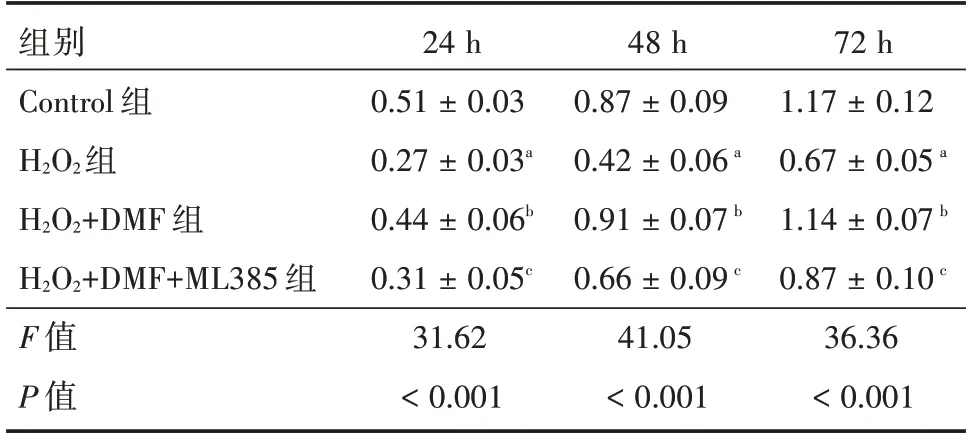
表4 JAK2/STAT1 通路在H2O2介导的HCMEC 细胞增殖中的作用Tab.4 The role of JAK2/STAT1 signaling pathway in H2O2-induced cell proliferation in HCMEC ±s
注:与对照组比较,aP<0.05;与H2O2组比较,bP<0.05;与H2O2+DMF 组比,cP<0.05
组别Control 组H2O2组H2O2+DMF 组H2O2+DMF+ML385 组F 值P 值24 h 0.51 ± 0.03 0.27 ± 0.03a 0.44 ± 0.06b 0.31 ± 0.05c 31.62<0.001 48 h 0.87 ± 0.09 0.42 ± 0.06a 0.91 ± 0.07b 0.66 ± 0.09c 41.05<0.001 72 h 1.17 ± 0.12 0.67 ± 0.05a 1.14 ± 0.07b 0.87 ± 0.10c 36.36<0.001
3 讨论
AF 最大的危害是左心房形成附壁血栓,血栓脱落后导致脑栓塞和外周血管栓塞。内皮损伤后暴露的胶原激活凝血因子引起血小板聚集,引发凝血过程,导致机体促凝/抗凝失衡,诱导血栓形成[11]。因此,寻找有效的AF 治疗药物迫在眉睫。本研究以AF 内皮细胞损伤为切入点,细胞铁死亡和Nrf2 基因为靶点,揭示内皮损伤的机制并寻找有效的干预措施。本研究发现H2O2可以诱导HCMEC 炎症和铁死亡,DMF 干预可通过激活Nrf2/HO-1 和JAK2/STAT1 通路,减轻H2O2诱导的HCMEC 损伤。
铁死亡是一种铁离子依赖的由脂质过氧化引起的程序性细胞坏死形式;被描述为一种自噬性细胞死亡过程[12-13]。铁死亡在动脉粥样硬化、心肌缺血再灌注损伤和心律失常中发挥着重要作用[14-15]。然而,目前有关铁死亡与AF 发生发展的研究较少。FANG 等[16]发现铁转运蛋白介导的铁死亡通过恶化钙转运蛋白失调参与脂多糖诱导的内毒素血症相关新发AF 的发生。在快速心房起搏构建的犬AF 动物模型中,心脏成纤维细胞起源的外泌体能够通过分泌miR-23a-3p 来调控SLC7A11 促进铁死亡,参与AF 的持续发展[17]。本研究首次报道H2O2可以诱导HCMEC 铁死亡。H2O2诱导的HCMEC 细胞TNF-α、IL-1β 和IL-18 等炎症因子升高的同时,引起GPX4 下降和ACSL4 上升。细胞发生铁死亡时引起GPX4 下降,ACSL4 上升[18]。心血管保护性多肽Elabela 也能够抑制血管紧张素Ⅱ介导的HCMEC 铁死亡,减轻高血压心肌结构损伤和功能障碍[19]。上述研究均提示内皮细胞铁死亡在内皮细胞损伤中的调控作用。因此靶向改善HCMEC 铁死亡可作为AF 潜在治疗的干预靶点。
DMF 可作为Nrf2 通路的调节剂在多种疾病中发挥抗氧化和抗炎作用[20-21]。DMF 有缓解心肌缺血再灌注损伤,改善动脉粥样硬化等作用[22-23],但是并未有研究报道DMF 对H2O2介导的HCMEC 损伤的作用及潜在机制。本研究首次发现DMF 可显著改善H2O2诱导的HCMEC 铁死亡。DMF 在抑制弥漫性大B 细胞淋巴瘤中JAK/STAT 信号通路的同时,还诱导了细胞的铁死亡[24]。JAK2/STAT1 通路已被报道具有改善细胞衰老和抑制炎症的作用,且我们的前期研究证实TNFSF18 蛋白通过调节STAT1 的磷酸化改善冠脉内皮细胞功能障碍[25]。为明确DMF 在H2O2诱导的内皮细胞损伤和铁死亡中的作用,使用Nrf2 抑制剂ML385 干预细胞。发现ML385 可有效逆转DMF 对H2O2介导HCMEC 的细胞增殖和铁死亡,表面DMF 通过调节Nrf2/HO-1和JAK2/STAT1 通路保护HCMEC 铁死亡的发生。
同时本研究也存在一定局限性。只对HCMEC细胞进行造模,没有直接从AF 患者心脏中获得组织来提取原代细胞,这一定程度上限制了我们细胞实验证据的可靠性。此外,我们使用了Nrf2 的抑制剂来下调Nrf2/HO-1 和JAK2/STAT1 的表达。尽管也能证明DMF 通过Nrf2 来发挥生物学作用,但仍可能需要对Nrf2 基因进行敲除[26],或者动物模型中来进一步明确DMF 对AF 内皮细胞的保护作用是通过激活Nrf2 来实现的。
综上所述,本研究发现H2O2通过诱导细胞炎症和铁死亡介导HCMEC 损伤,而DMF 可能通过调节Nrf2/HO-1 和JAK2/STAT1 通路改善H2O2介导HCMEC 的细胞铁死亡,可能是潜在的治疗AF 的药物。后续可进一步探索DMF 是否具有改善AF电生理机制的作用。
