乳腺癌类器官疾病模型的构建及其对化疗药物的敏感性试验
2023-07-31吴铭初新宇付阳王雪薇王欢肖洋陈栋何劲松
吴铭 初新宇 付阳 王雪薇 王欢 肖洋 陈栋 何劲松
1安徽医科大学北京大学深圳医院临床学院(广东深圳 518036);2安徽医科大学第五临床医学院(合肥 230000);3北京大学深圳医院乳腺甲状腺外科(广东深圳 518036)
乳腺癌(breast cancer,BC)是全世界女性最常见的恶性肿瘤之一。根据2019 年发布的数据,乳腺癌占女性新诊断恶性肿瘤的30%,并导致15%的女性死于乳腺癌[1]。目前乳腺癌的治疗方法主要包括手术治疗,常规放化疗,内分泌治疗,以及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达时使用的靶向治疗。近年来,乳腺癌靶向治疗取得了较大进步,但大部分乳腺癌仍缺乏针对性治疗靶点,影响临床疗效[2]。虽然乳腺癌已经被广泛研究,但我们仍然迫切需要一种新的临床前疾病研究模型来指导患者的个性化治疗。
传统二维(two-dimensional,2D)培养的肿瘤细胞系和肿瘤异种移植动物模型(patient-derived xenografts,PDX)作为临床前研究模型被广泛使用。然而2D 培养的肿瘤细胞无法还原患者体内肿瘤的复杂结构和病理特征,PDX 模型构建效率低、耗时长、费用昂贵、存在种属差异,不适合高通量药物筛选[3]。近年来,肿瘤类器官技术的出现与发展,为我们提供了新型的临床前研究模型。类器官是在体外对干细胞或器官祖细胞进行诱导分化形成的在结构和功能上类似目标器官或组织的三维细胞复合体,其具有稳定的表型和遗传学特征,能够在体外长期传代培养。患者衍生的癌症类有机物允许癌细胞在三维基质中生长,并以及时且具有成本效益的方式从患者体内培养癌症细胞的能力取得了重大进展[4-7],不仅概括了原始肿瘤的组织学和遗传特征,还允许高通量药物筛选,并可能促进个性化治疗[8]。目前,肺癌[9]、肝癌[10]、胰腺癌[11]、膀胱癌[12]、胃癌[13]、子宫内膜癌[14]及鼻咽癌[15]等多种肿瘤类器官模型已成功建立,乳腺癌类器官也已成为一种有用的临床前模型,本研究拟建立不同分子分型的乳腺癌类器官模型,并进行化疗药物筛选,为乳腺癌基础研究与临床个性化治疗提供新型的实验模型。
1 材料与方法
1.1 乳腺癌组织本研究于2021 年7-12 月采集北京大学深圳医院收治的4 例乳腺癌患者新鲜肿瘤组织标本,其中2 例组织学分型为HER2(+)型乳腺癌,1 例为三阴性乳腺癌(TNBC),1 例为激素受体阳性型(LuminalB)乳腺癌。获取的新鲜肿瘤组织将分成几部分,分别进行类器官培养与病理石蜡切片形态学染色。本研究已获得北京大学深圳医院伦理委员会的批准[北大深医伦审(研)[2019]第(062)号]。
1.2 实验试剂主要包括:AdvancedDMEM/F12 培养基(Gibco,美国),Ⅱ型胶原酶(Gibco,美国),Matrigel(Corning,美国),Ki67、ER、PR、HER2 免疫组化抗体(Abcam,英国),浓缩型DAB 试剂盒(MXB,中国),抗菌剂(Gibco,美国),HEPES(Gibco,美国),GlutaMAX(Gibco,美国),TrypLEExpress(Gibco,美国),Y-27632 二盐酸盐(AbmoleBioscience,美国),CellTiter-Glo®3DReagent(Promega,美国),细胞回收液(康宁,美国),维生素烟酰胺(SigmaAldrich,美国),抑制剂Noggin(Peprotech,美国),表皮生长因子(EGF),成纤维细胞增长因子10(FGF-10,Peprotech,美国),激活素受体样激酶(ALK)抑制剂A83-01(SigmaAldrich,美国),p38丝裂原活化蛋白激酶抑制剂SB202190(SigmaAldrich,美国)。
1.3 设备主要包括:二氧化碳培养箱(赛默飞,美国),生物安全柜(ESCO,美国),水浴锅,高压灭菌锅,石蜡切片机(Leica,德国),全自动脱水机(Epredia,美国),石蜡包埋机(赛默飞,美国),病理组织漂烘仪(郝思琳,中国),正置显微镜(ZEISS,德国),低速离心机(Eppendorf,德国),多功能全波长酶标仪(BioTek,美国)。
1.4 方法
1.4.1 乳腺癌类器官培养基的配制AdDMEM/F12+++培养基中加有维生素烟酰胺(10 mmol/L),抑制剂Noggin(100 ng/mL),EGF(50 ng/mL),FGF-10(10 ng/mL),A83-01(500 nmol/L),SB202190(10 μmol/L),Y-27632(10 μmol/L),Wnt-3A 以及Matrigel 胶。
1.4.2 乳腺癌类器官的培养将新鲜标本冰上运送至实验室立即处理。使用PBS 清洗标本3~5 次,部分组织固定在甲醛中进行后续实验,剩余组织用来建立类器官模型。在超净台内用眼科剪将乳腺癌组织剪碎,使用Ⅱ型胶原酶,在37 ℃水浴锅中消化40~60 min 后使用含10% FBS 的AdDMEM/F12+++培养基终止,离心弃上清,洗涤一次后使用70 μm 的细胞筛过滤以去除未消化的组织块,将得到的细胞悬浮液离心后弃上清,再用移液枪吸取预冷的Matrigel 胶混合细胞悬液,以45 μL每个胶滴接种于37 ℃预热的6 孔板中,每孔6 胶滴,置于培养箱20 min 使基质凝胶聚合后,每孔加入2.5 mL 乳腺癌类器官培养基,放至37 ℃培养箱中培养。光学显微镜下观察类器官的形成和生长状态。每2~3 天换液,视类器官生长速度每1~3 周以1∶2~1∶4 的稀释度进行传代。
1.4.3 乳腺癌组织及类器官石蜡切片的制备新鲜的乳腺癌组织置于10%中性甲醛中固定24 h。收集乳腺癌类器官,弃去培养基,向每孔中加入1 mL 4 ℃预冷的细胞回收液解聚基质凝胶,收集每个孔的类器官离心弃上清,加200 μL 液态的琼脂糖凝胶,将类器官沉淀从底部吹起,待琼脂糖凝胶凝固后,置于10%中性甲醛中固定12 h。乳腺癌组织及类器官固定结束后,按照常规程序进行脱水、石蜡包埋、切片(4 μm)。
1.4.4 HE 及免疫组织化学染色HE 染色:石蜡切片脱蜡至水后,苏木素染细胞核,伊红溶液染细胞质,脱水透明后中性树脂封片,干燥后使用正置显微镜进行拍摄。
免疫组化染色:石蜡切片经脱蜡复水、过氧化氢酶阻断、抗原修复及血清封闭,将Ki-67、ER、PR和HER-2 抗体按照1∶300 浓度稀释后,于4 ℃下孵育切片过夜。次日,用PBS 冲洗3 遍后按照浓缩型DAB 试剂盒说明书操作步骤染色,然后使用苏木精复染,中性树脂封片干燥后使用正置显微镜进行拍摄。
1.4.5 药物敏感性实验实验前将CellTiter-Glo®3D 检测置于室温平衡30 min,轻微翻转混匀;使用TrypLE Express消化乳腺癌类器官,用含2%Matrigel的类器官培养基重悬类器官,然后均匀分配到透明的低吸附性的96 孔板中,100 μL/孔;预培养2 d后,加入100 μL 按5 倍浓度梯度稀释的化疗药物,再继续培养5 d。药物分别为:紫杉醇、多西他赛、长春瑞滨、卡巴他赛、多柔比星,顺铂和吉西他滨,药物浓度分别为:10 μm、2 μm、0.4 μm、8 × 10-2μm、1.6 × 10-2μm、3.2 × 10-3μm;设置只加DMSO 的孔作为对照组。药物孵育结束后,将孔板室温平衡30 min 后,吸去上层100 μL 培养基,然后加入100 μL CellTiter-Glo®3D 试剂,避光置于摇床上反应30 min。在多功能全波长酶标仪上读取化学发光值,体外试验重复3 次。使用GraphPad Prism 9分析数据。
2 结果
2.1 乳腺癌类器官模型的建立本研究从接受外科手术的4 例乳腺癌患者(表1)的手术标本中获取部分肿瘤组织,经过剪切、消化、过滤后得到乳腺癌细胞(图1),使用Matrigel 胶悬浮后接种在培养皿中,均成功培养成类器官。在Matrigel 胶作为生长支架和类器官培养基细胞因子的作用下,乳腺癌细胞团能够持续生长分裂,形成乳腺癌3D 细胞团(图2)。此乳腺癌类器官可持续生长,并可以持续传代5 代以上。
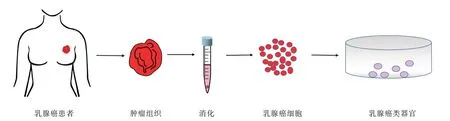
图1 乳腺癌类器官模型的建立Fig.1 Establishment of a breast cancer organoid model

图2 乳腺癌类器官光镜图Fig.2 Photomicrographs of breast cancer organoids

表1 乳腺癌患者临床信息Tab.1 Clinical information for breast cancer patients
2.2 乳腺癌类器官组织学特征将乳腺癌类器官脱水包埋制成石蜡切片,与类器官来源的亲本肿瘤组织的切片同批次进行HE 染色。见图3,乳腺癌类器官表现出与其来源的原发肿瘤组织相似的组织学特征。来自不同患者的乳腺癌类器官的组织学特征上存在差异。例如,我们观察到BC-2_O和BC-3_O 表现为由多层细胞组成的致密球体,而BC-1_O 表现出较为分散的细胞状态。

图3 乳腺癌组织与对应类器官HE 染色特征对比Fig.3 Comparison of HE staining characteristics of breast cancer tissues with corresponding organoid
2.3 乳腺癌类器官免疫组织化学染色ER、PR、HER2 和Ki67 被认为是乳腺癌临床诊断和实验室测试的潜在标志物。我们在免疫组化染色后使用显微镜观察发现HER2(+)模型乳腺癌组织(BC-2_T、BC-3_T)中HER2 呈阳性表达,与之对应的乳腺癌类器官(BC-2_O、BC-3_O)HER-2 免疫组化呈强阳性,提示乳腺癌类器官可能富集了亲本肿瘤组织中HER2 的乳腺癌干细胞(图4)。ER 与Ki67在激素受体阳性乳腺癌组织(BC-4_T)与衍生类器官(BC-4_O)都高度表达,而PR 在肿瘤组织及对应的类器官的表达不完全对称。BC 组织类器官对中,激素受体和HER2 状态得以维持。值得注意的是,TNBC 模型乳腺癌组织(BC-1_T)Ki67 热点区达90%,对应类器官(BC-1_O)有轻微表达。可以认为乳腺癌组织类器官对中,激素受体和HER2 状态得以维持。但不可否认肿瘤类器官可以概括其原始肿瘤的组织学特征和标记物表达。

图4 乳腺癌组织及其对应类器官ER、PR、HER-2 和Ki-67 免疫组化染色Fig.4 Immunohistochemical staining of breast cancer tissue and its corresponding organoid for ER,PR,HER-2 and Ki-67
2.4 乳腺癌类器官药敏检测图5 展示了入组的4 例乳腺癌类器官在紫杉醇、多西他赛、长春瑞滨、卡巴他赛、多柔比星、顺铂和吉西他滨作用后随药物浓度变化的细胞活力。不同分子亚型的乳腺癌对同一种药物的敏感性不尽相同,同一患者对不同化疗药物的敏感性也不同。其中,三阴性乳腺癌类器官(BC-1_O)对紫杉醇和多柔比星呈剂量依赖关系,但是敏感度欠佳。激素受体阳性模型乳腺癌类器官(BC-4_O)对多柔比星高度敏感,对其余药物表现出明显的抵抗力,尤其是卡巴他赛和顺铂。我们可以发现随着药物浓度的增加,细胞活力未见明显变化,甚至呈增加的趋势。BC-2_O、BC-3_O 类器官系因为HER2 阳性,目前临床上主要使用靶向药物治疗。在本研究中,可以发现它们都对多柔比星高度敏感,多柔比星通过抑制肿瘤细胞DNA 的复制从而起抑制肿瘤的作用。随着药物浓度的增加,HER2(+)型乳腺癌类器官的细胞活力呈明显的下降趋势。

图5 乳腺癌类器官的药敏结果Fig.5 Drug sensitivity results of breast cancer organoid
3 讨论
肿瘤异质性被认为是癌症治疗失败的主要原因。乳腺癌患者对化疗药物的耐药性与其具有的高度异质性有着密不可分的关系。耐药性的表现与癌症的变化一样具有多样性,不管给药机制如何(靶向药物治疗、化疗或免疫治疗),癌症患者几乎普遍存在耐药性且预后较差。因此建立个体化的临床前模型对于预测乳腺癌的药物反应和制定有效的治疗策略至关重要。
类器官是一种复杂的三维结构,在结构和功能上与体内器官相似,能够很大程度上还原亲本肿瘤的组织学特征。与传统2D 培养的肿瘤细胞系和PDX 模型相比,患者来源的肿瘤类器官具有个体化、培养周期短、与来源组织差异小的优势,可以快速进行高通量筛药得出药敏结果,还可以预测患者对新的治疗方案的反应,包括化疗与靶向药物的组合或是可添加到患者首轮治疗中的多种靶向药物[16],可以真正实现肿瘤的个体化治疗。
研究数据表明,类器官培养是研究乳腺癌风险和药物开发的宝贵平台[8,17]。乳腺癌类器官模型可以从接受新辅助化疗和多重耐药的乳腺癌患者的残余肿瘤,以及同一患者的原发肿瘤和转移性腋窝淋巴结及远处器官转移成功建立[8,18]。然而乳腺癌具有多种分子分型,其治疗方法及预后均有显著差异。本研究选择不同分子亚型乳腺癌组织,构建乳腺癌类器官模型作为药物测试平台。对于三阴性乳腺癌和激素受体阳性乳腺癌,我们可以观察到肿瘤和衍生类器官之间的对应性并不十分强烈,这可能跟肿瘤组织取样和类器官的培养过程有关。除此之外,肿瘤的内在特征可能会影响类器官的生长效率[19],导致某些肿瘤亚克隆的丢失,从而导致肿瘤-衍生类器官匹配不良。尽管类器官能够还原体内肿瘤发展过程中的关键特征,但类器官本质是体外模型,缺乏与肿瘤微环境成分(如基质、血管、免疫细胞、微生物群等)的相互作用,取得的结果可能并不尽如人意。如果从乳腺癌针刺活检中产生类器官,药物试验与相应患者临床治疗并行,可以作为乳腺癌患者有效的筛药平台,有望为实现乳腺癌患者的个性化精准治疗提供试验数据。
我们筛选了7 种药物,发现类器官对多柔比星(一种蒽环类化疗药物)和吉西他滨这两种药物的敏感性显著。研究证实使用含帕妥珠单抗方案对HER2 阳性乳腺癌患者进行新辅助治疗有明显疗效,联合含蒽环类药物有更好获益可能,且安全性良好[20]。
本研究中入组患者按照指南和病情制定合适临床化疗方案,对应类器官使用同样的药物进行筛药,筛药结果与患者治疗情况基本一致。我们的结果表明这些药物在治疗乳腺癌方面具有潜在的应用价值。
综上所述,本研究开发了类器官模型作为实时平台,以指导不同分子亚型乳腺癌的临床药物治疗,表明使用类器官作为药物测试平台指导癌症患者的个性化治疗具有潜在的可行性。下一步需要招募更多的患者进行前瞻性临床研究这对于乳腺癌的早期筛查及早期治疗具有重大意义。
