基于网络药理学及分子对接分析蒙药嘎日迪-13治疗脑卒中的作用机制*
2023-07-30郝肖琼付旭阳石瑞丽
郝肖琼,付旭阳,刘 宇,石瑞丽
(1.包头医学院生理学教研室,内蒙古 包头 014040;2.包头医学院神经科学研究所;3.内蒙古包钢医院)
脑卒中是由脑血管破裂或梗阻造成的一系列脑损伤疾病,其中缺血性脑卒中占80 %,具有高致病率、高死亡率、高复发率和高致残率的特点,对人类的健康和生存造成极大危害,给患者家庭和社会带来沉重的负担。由于其发病机制复杂,因此从单一因素、单一角度对其治疗往往不能获得良好的治疗效果。近年来中蒙药在脑缺血防治方面的效果越来越受到人们的重视,其主要是从益气活血、通经活络的角度,通过多层次、多靶点、多环节发挥作用,毒副作用相对较小。
脑卒中在蒙医中属“萨病”范畴,蒙药嘎日迪-13出自《四部医典》,由诃子、石菖蒲、制草乌、木香、珊瑚、珍珠、麝香、丁香、沉香、磁石、甘草、禹粮土、肉豆蔻组成,具有祛风通窍、舒筋活血、镇静安神、杀黏等作用,是治疗萨病的经典复方。一些临床相关报道发现,嘎日迪-13能够明显改善卒中患者生活质量,治疗效果明确[1-3]。有关基础实验中发现嘎日迪-13能够对大脑中动脉梗塞模型大鼠发挥抗炎作用,且对一些炎症靶标发挥调节作用[4-5]。
网络药理学是根据系统生物学理论,研究生物活性成分及作用靶点的一种方法。由于蒙药复方制剂成分复杂,且作用机制尚不明确,而网络药理学整合多种数据库,利用生物信息学手段桥接药物与疾病,适用于中蒙药复方分析,因此本研究采用网络药理学手段全面解析蒙药经典复方嘎日迪-13治疗脑卒中的作用机制。
1 材料与方法
1.1嘎日迪-13活性成分及其作用靶点的获取 登录TCMSP(http://lsp.nwu.edu.cn/tcmsp.php,Version: 2.3)数据库[6]获得诃子、石菖蒲、制草乌、木香、珊瑚、珍珠、麝香、丁香、沉香、磁石、甘草、禹粮土、肉豆蔻化合物信息,并以“经口服生物利用度(OB) ≥30 %、类药性指数(DL) ≥0.18、血脑屏障(BBB) ≥ - 0.3[7]”为条件筛选化合物。将筛选出的化合物以Smile ID格式输入到Swiss Target Prediction数据库[8],预测潜在靶点,保留靶点Uniprot ID、名称等信息。
1.2脑卒中相关靶点的获取 在DisGeNET数据库[9]中输入“Stroke”,获取脑卒中相关靶点。将各化合物作用靶点与脑卒中相关靶点进行比对,筛选出的共同部分即嘎日迪-13治疗脑卒中的潜在靶点。
1.3蛋白-蛋白相互作用网络构建分析 通过String数据库[10]获得嘎日迪-13治疗脑卒中的靶点间蛋白-蛋白相互作用(protein-protein interaction, PPI)网络关系,并将数据导入Cytoscape软件中,构建PPI网络,根据自由度将节点设置为不同大小及颜色。
1.4GO和KEGG富集分析 将嘎日迪-13治疗脑卒中的潜在靶点的Uniprot ID导入到Cytoscape软件的GO插件中,设置种属为“Homo sapiens”,设置P≤0.05,选择GO分析及KEGG分析,应用气泡图对GO分析结果进行可视化处理;根据KEGG分析结果应用Cytoscape软件制作成分-靶点-通路图。
1.5Hub节点选择及分子对接验证 根据成分-靶点-通路网络图中的拓扑参数,Hub节点选择采用Zhang等[11]的方法,筛选出自由度在平均值2倍以上的关键靶点,找到与其对应的化合物,应用Maestro软件,对化合物的2D分子结构式进行柔性处理,在PROTEIN DATA BANK数据库中下载关键靶点的结构式,对靶点蛋白进行预处理,找到对接区域,将小分子配体与蛋白进行对接,根据对接结果的吉布斯自由能分析结合能力。
2 结果
2.1嘎日迪-13治疗脑卒中的预测靶点 通过TCMSP数据库获得嘎日迪-13的化合物成分信息,根据口服生物利用度、类药性及血脑屏障通透性筛选成分,找到其中能够发挥中枢治疗意义的活性成分58个,预测到潜在作用靶点114个,通过Uniprot数据库标准化名称。见表1。

表1 嘎日迪-13抗脑卒中的潜在靶点
2.2PPI网络构建与分析 为了全面分析嘎日迪-13治疗脑卒中的靶点机制,将嘎日迪-13治疗脑卒中的114个潜在靶点导入到String数据库,下载靶点间相互作用关系,应用 Cytoscape 软件对数据进行可视化处理。根据自由度将节点设置为不同大小及颜色,构建PPI网络(图1)。其中包含节点112个,边线1 151条,每个节点代表蛋白,边线代表靶点之间相关性,内圈为自由度排序前40的节点。
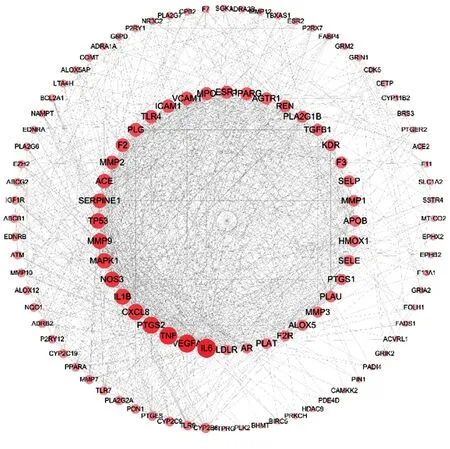
图1 嘎日迪-13抗脑卒中潜在靶点蛋白相互作用网络
2.3GO和KEGG富集分析 将114个潜在靶点的Uniprot ID导入Cytoscape的GO插件中,进行GO及KEGG通路分析。结果表明,嘎日迪-13治疗脑卒中的潜在靶点主要参与磷脂酶活性、肾上腺素受体活性、G蛋白偶联肽受体活性等多种生物功能(图2),参与调节组织重塑、血管重塑、细胞对细胞外刺激的反应等生物过程(图3)。图中横坐标代表参与基因占比,纵坐标代表功能/过程名称,节点大小代表参与的基因数量,颜色代表P值。KEGG通路分析表明,靶点参与核因子κB(nuclear factor kappa-B, NF-κB)信号通路、白介素17(interleukin 17, IL17) 信号通路、低氧诱导因子-1(hypoxia inducible factor-1, HIF-1) 信号通路等与脑卒中密切相关的信号通路27条。根据自由度将节点设置为不同大小及颜色,图4中黄色为嘎日迪-13的活性成分,橙色为靶点,绿色为信号通路。

图2 嘎日迪-13潜在作用靶点参与的生物功能

图3 嘎日迪-13潜在作用靶点参与的生物过程

图4 活性成分-靶点-信号通路网络图
2.4Hub节点选择及分子对接验证 基于嘎日迪-13靶点信号通路网络中各靶点蛋白的拓扑参数对靶点进行排序,筛选出自由度大于平均自由度2倍的靶点,包括:一氧化氮合酶3(nitric oxide synthase 3, NOS3)、血管紧张素转换酶(angiotensin-converting enzyme , ACE)、白介素6(interleukin 6, IL6)、肿瘤坏死因子(tumor necrosis factor, TNF)、人纤溶酶原激活物抑制剂1(human plasminogen activator inhibitor-1, SERPINE1)、血管内皮生长因子A(vascular endothelial growth factor-A, VEGFA)、白介素1β(interleukin 1β, IL1β)、基质金属蛋白酶9(matrix metallopeptidase 9 , MMP9)、白介素-8(interleukin-8, CXCL8)、肿瘤P53蛋白(tumor Protein P53, TP53)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase1, MAPK1)和Toll样受体4(toll like receptor 4, TLR4),其中TNF、IL6及IL1β已有实验证明,不再进行对接验证。通过PROTEIN DATA BANK数据库找到蛋白的3D结构式6av7、6en5、1lj5、4zff、1l6j、4g8a、1qe6、3q05和3sa0,对关键蛋白对应的小分子进行柔性处理,对接后计算结合自由能,结果用热图表示,结合能力越强得分越低,以吉布斯自由能绝对值大于5为标准,筛选对接成功的潜在靶点。对接结果中,除TLR4与药物活性成分不能结合外,其他靶点均可被药物中的不同成分所作用,结合能均大于5,此结果提示ACE、CXCL8、MAPK1、MMP9、NOS3、SERPINE1、TP53及VEGF可作为嘎日迪-13的潜在治疗靶点[12]。见图5。
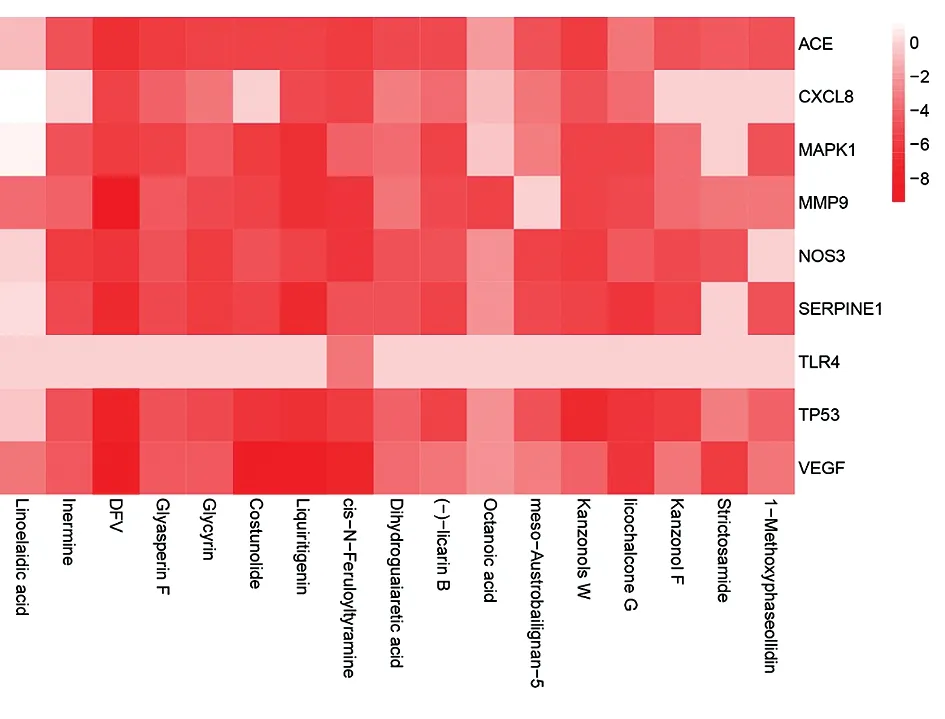
图5 分子对接
3 讨论
本研究通过数据库检索,获得蒙药嘎日迪-13成分中能够通过血脑屏障,发挥中枢系统治疗意义的药物,最终确定治疗脑卒中的潜在靶点114个。蛋白-蛋白相互作用分析发现,潜在靶点间存在多种调控机制,且IL6、VEGFA、TNF、前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2, PTGS2)、CXCL8等靶点自由度较高;GO分析发现靶点参与肾上腺素受体活性、G蛋白偶联肽受体活性、胆固醇转运蛋白活性、跨膜受体蛋白激酶活性、谷氨酸受体活性等多种生物功能,参与生物过程包括:调节组织重塑、血管重塑、细胞对细胞外刺激的反应、淋巴细胞凋亡过程的正调控、对氧气水平的反应、对缺氧的反应等,均与脑卒中密切相关;KEGG分析表明嘎日迪-13可能通过NF-κB信号通路、IL17信号通路、HIF1信号通路等发挥保护作用。最终基于网络参数确定关键靶点包括NOS3、ACE、IL6、TNF、SERPINE1、VEGFA、IL1β、MMP9、TLR4、CXCL8、TP53以及MAPK1,其中TLR4不能与活性成分结合,不能作为关键潜在靶点。
脑卒中发病后,存在严重炎症反应、循环破坏、氧化应激、血脑屏障破坏等。由于脑卒中发病机制复杂,涉及病理过程较多,因此,从单一因素或单一靶点治疗脑卒中疗效欠佳。传统医药具有多角度、多靶点治疗疾病的特点,从传统医药中研发治疗脑卒中的有效药物成为热点。通过网络分析发现嘎日迪-13可能发挥促进血管组织重塑、抗氧化、抗炎等作用,这表明嘎日迪-13可能是从多途径治疗脑卒中的一种具有潜在研究意义的药物。
已有实验报道[13-14],关键靶点中TNF、IL6和IL1β可被嘎日迪-13调控发挥抗炎作用;VEGFA作为VEGF家族成员之一,是促进血管生成及神经保护的关键蛋白[15],VEGFA可促进内皮细胞的增殖和迁移,使血管重塑恢复缺血区血供,挽救更多的半暗带组织;MMP家族成员众多,其中MMP9在脑卒中的相关研究最为常见,它能够降解细胞外基质中的多种成分[16],MMP9不仅涉及脑卒中后的BBB破坏,还参与脑卒中溶栓治疗后的出血转化、血管源性水肿等[17-19],这些因素均参与脑水肿发生,脑水肿是脑卒中严重的临床并发症,与患者死亡率及不良预后直接相关,因此MMP9可能是嘎日迪-13发挥有效治疗作用的关键靶点;CXCL8是重要的中性粒细胞趋化因子[20],而TNF和IL1β可通过内皮细胞产生CXCL8进而趋化中性粒细胞[21],诱导炎症及BBB破坏,其中TNF、IL1β及CXCL8均为嘎日迪-13的潜在靶点,说明嘎日迪-13可能通过抑制TNF、IL1β及CXCL8的表达发挥抗炎及神经保护作用。
临床研究证明[3],嘎日迪-13联合西药治疗脑卒中能够发挥较好的疗效,但其作用机制尚不明确。通过多种网络分析发现嘎日迪-13可发挥抗炎、促进血管重塑、减少血脑屏障破坏等作用,而关键靶点包括NOS3、ACE、IL6、TNF、SERPINE1、VEGFA、IL1β、MMP9、CXCL8、TP53以及MAPK1,其中IL6、TNF和IL1β已有实验验证[12, 13]。本研究全面分析了蒙药嘎日迪-13治疗脑卒中的潜在分子机制,为后续的药物研发提供了更多的理论支持。
