基于不同基质纯化重组蛋白的研究进展
2023-07-29张飞飞朱睿姜学权胡俊毅方逸超汪浩勇
张飞飞,朱睿,姜学权,胡俊毅,方逸超,汪浩勇
湖北工业大学生物工程与食品学院(武汉 430068)
近年来,重组蛋白用于晶体学研究、免疫学特性探究、酶学和医学应用(如药物蛋白)及蛋白质特性(如功能、活性和结构)的一般性研究[1]。重组蛋白的生产和纯化密切相关,蛋白质生产宿主的选择不仅影响蛋白质的扩增和分离,而且影响纯化产物的方式,基因工程技术的不断进步增加宿主细胞,如细菌、哺乳动物、昆虫和酵母等中生产的大量重组蛋白的可用性,其中大肠杆菌仍是最广泛使用的菌株[2-3]。然而,在重组蛋白质纯化过程中依然要克服许多技术难题才能获得高质量的蛋白质样品,满足既定的纯度和构象要求,这对重组蛋白的纯化和表征可能要求高、昂贵且耗时,但可以确定蛋白质的质量,因此,重组蛋白的成功应用很大程度取决于其高效的下游加工,包括蛋白质纯化、质量验证、量化和储存等条件[4]。
蛋白质工程功能材料的应用前景十分广阔,在固体材料和生物元素之间建立特定的非共价/共价相互作用的显著能力,促进定制和先进功能材料的开发,以及下一代杂交材料的应用。在蛋白纯化过程中标签介导的重组蛋白可与多种材料结合,最适合用于蛋白质纯化过程,因此获取高质量的蛋白质样品被运用于各个领域。主要综述有关蛋白质纯化过程中基于不同基质材料对目的蛋白的纯化最新研究进展。
1 重组蛋白标签的概述
目前,有许多蛋白质表达的系统,例如大肠杆菌、毕赤酵母等可以为各种肽和蛋白质提供对应的表达宿主,最终将目的肽或蛋白纯化出来进行研究。因此,从其他细胞内容物中快速且经济地纯化活性生物重组蛋白被认为是生物技术领域的最大挑战之一,通过将遗传序列与亲和标签整合,可以促进目标蛋白或酶的纯化。在这种情况下,目标蛋白质的标签和蛋白质作为单个单元表达,并且可以通过标签纯化方法从其他细胞内容物中分离蛋白质。亲和标签通常被广泛用于试验研究,因为它们应用广泛,亲和标签的重要限制之一是标签对蛋白质的自然功能、其物理化学性质及后续应用的意外影响,所以目标蛋白纯化后的标签分离必不可少,虽然该过程是通过特定的内肽酶完成,但随之而来的成本阻碍该技术的大规模应用。此外,应用的内肽酶应在分离过程中与蛋白质分离,进一步增加劳动力成本并阻止这些标签在工业规模上的应用[5]。
使用不同重组蛋白标签可对重组蛋白有不同的回收效果,在生化蛋白方面,其主要作用是提高蛋白质产物进入高质量水平,抑制蛋白质水解反应,促进目标蛋白的折叠过程,保护抗原性集成蛋白,增强蛋白质的溶解度,以及提高单链抗体标记结合技术的敏感性。但是重组蛋白标签缺点是影响修饰目标蛋白构象(蛋白质的溶解度和活性),降低蛋白质产品的可用性,由于最终切割过程中的缺陷,抑制酶活性,改变蛋白质的生物活性,结构研究混乱造成不必要的蛋白质灵活性,最后分离标签是昂贵的[5]。因此,快速、可靠、高性价比的重组蛋白分离纯化技术是生物技术和生物医学领域的重要前提,获得高产、高纯度和高活性的重组蛋白对于下游不同和多种应用是必不可少的[6],尤其在蛋白质纯化过程中标签的类型、大小和位置是至关重要的选择标准。
1.1 标签类型
在重组蛋白标签可根据性能分为两大类。一是溶解度标签。这些标签增加了目的蛋白的溶解度,提高了靶蛋白表达和稳定性,这种类型的标签主要有GST、MBP、NusA、Trx和SUMO等。二是亲和标签。这些标签使用结合亲和基质捕获目标蛋白,主要有Poly、His、Flag、HA、Strep II、CBP1、CBD2等。在单独使用结合亲和标签就足以表达完全可溶性,Histag仍是使用最多的亲和标签,无论作为单个标签,还是作为非传统串联亲和净化标签的靶向目标[7],它在蛋白质检测和结晶方面的效果已得到很好证实[8]。然而,它可以干扰蛋白质的结构及功能属性,为解决不溶性问题,亲和性标签有时也可作为溶度增强剂使用,但对于溶解度低或表达水平低的蛋白质,应同时使用可溶性标签和结合标签以实现蛋白质的正确表达和纯化。如可通过谷胱甘肽和直链淀粉树脂有效地使用结合亲和力标签纯化MBP和GST融合蛋白。
1.2 标签尺寸
通常选择小标签是为了不容易影响目的蛋白的折叠、生物活性和免疫原性。然而,较大的标签由于其强烈的翻译启动信号,可以提供更高的蛋白质生产水平,此外,如果目标蛋白体积较小,如多肽,则选择大标签以防止宿主表达问题[9]。所有的蛋白质标签,无论大小,都可能对蛋白质的生物学功能、理化性质的改变、免疫和防止蛋白质结晶产生干扰作用,因此标签的开发必须在蛋白质纯化的最后阶段进行,这种整合过程一直被认为是蛋白纯化成功的关键,这个问题的重要性在于蛋白质的大规模生产,去除与蛋白质结合的标签的成本就会越来越大。融合蛋白标签的分离主要有3种方法,即化学法、酶法和自切割标记,标签大小也取决于蛋白质的整体构象[1,10]。
1.3 标签的位置
编码N或C端序列的基因与靶蛋白结合并最终与靶蛋白表达,通过融合标记与靶蛋白分离纯化[11]。第一步是纯化与标签合并的蛋白质,通过一系列蛋白酶从目标蛋白中分离出标签,该技术简单可靠,可用于目的蛋白的纯化,目的是保持蛋白质的自然特性。而蛋白质的N端/或C端要想进行标记,需要通过使用密切相关蛋白质的解析结构作为结构模板的基于同源性的建模来进行评估,融合蛋白连接物可用于提高纯化标记的可及性[12]。也可以使用较大的标记代替较小的标记,同时显著提高其溶解度和稳定性[13]。如果游离的(天然的)N端是蛋白质活性的决定因素,则应选择C端作为标记位置。或者,由于C端标记更有利于高效表达,标签可以放置在这一端,用蛋白酶裂解,在蛋白质的N端不留下任何或少量附加残基,因此可以考虑作为一种成本更低的标签去除方式,标签及其裂解对蛋白质特性的影响应该通过功能和结构分析评估[7]。
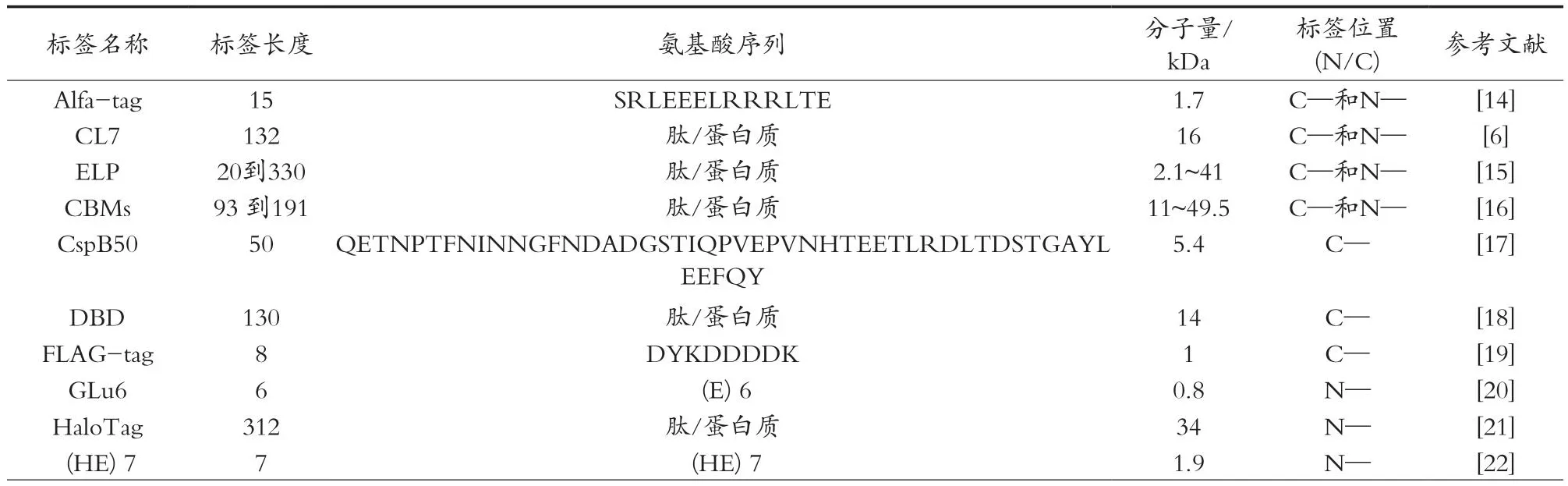
表1 来自不同蛋白质纯化/固定化纯化标签
2 基于不同基质纯化标签蛋白
蛋白质纯化/固定标签可以在固体材料和生物元素之间建立特定非共价/共价相互作用的显着能力,促进对先进的功能材料及下一代混合材料的创造。亲和标签可与多种材料(合成、天然或混合)结合,最适合蛋白质纯化。已报道过的基质材料有基于金属和非金属材料为基质纯化标签蛋白、基于碳基材料纯化标签蛋白、基于聚合物/多糖材料纯化标签蛋白、基于复合材料纯化标签蛋白。其中,共价结合标签最适合长期固定蛋白质,但只能与蛋白质材料自然结合。混合亲和共价结合标签允许高效的一步纯化和将蛋白质固定在不同材料上,以及开发创新的蛋白质工程材料。自聚集标签与其他标签组合特别有用,可用于生成具有自组装、柔性、响应特性的蛋白质工程材料。虽然这些标签主要被探索用于独立的蛋白质纯化、固定化或功能化目的,将标签介导的纯化和固定化、功能化结合在一个步骤中的有效策略对于保证先进蛋白质工程材料的可持续制造至关重要。亲和肽标签被证明对固定化/纯化过程非常有用,并有望通过从其他污染物中一步回收重组蛋白作为黏附单元[34]。许多可用的亲和标签可与目标蛋白融合以提供亲和力,从而推动目标蛋白固定到基质上。
2.1 基于金属和非金属材料为基质纯化标签蛋白
常见的金属和非金属材料纯化标签蛋白的基质主要分为2种,即未改性的二氧化硅和裸氧化铁颗粒,2种材料都在生物技术和生物医学方面广泛应用。
二氧化硅低成本,易于提取或合成,纯度非常高且可重复使用,地球资源丰富且生态友好型的一种基质材料,可成为蛋白质纯化/固定化方案最佳选择之一,由于表面的硅醇基团使其表面非常通用,可用于表面化学修饰,该类特性的材料正被高度开发为替代基质,从而为新的下游加工策略铺平道路[35]。已报道利用二氧化硅为基质纯化目的蛋白的有通常利用绿色荧光蛋白(GFP/EGFP)[33,36-37]作为靶蛋白(图1 SiO2纯化目的蛋白示意图),以His6、Car9、SB7、R5等标签纯化荧光蛋白,通过该基质提高目的蛋白的回收率及纯度。还利用转肽酶分选酶A(SrtA)通过LPXTG分选信号规范识别底物,被用于介导蛋白A在二氧化硅和石墨烯上的单步纯化和定向固定用亲核供体基团功能化的氧化物纳米颗粒,更好纯化目的蛋白[38]。
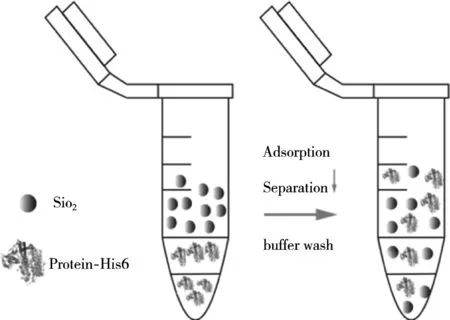
图1 以Sio2为基质纯化带有His6标签的蛋白,通过吸附、分离、洗涤等步骤回收目标蛋白示意图[35]
裸氧化铁颗粒低成本,通常由磁铁矿、磁赤铁矿、介于两者之间的过渡态或两种材料的混合物组成,必须在20~30 nm范围内才能具有超顺磁性[39]。文献报道的利用裸氧化铁颗粒纯化目的蛋白以绿色荧光蛋白(GFP)[20,39]、重组大肠杆菌物素连接酶[40]、ω-转氨酶[41]、革兰阳性细菌巨芽孢杆菌产重组蛋白A[42]、生物素蛋白连接酶(BPL)与其生物素化的底物蛋白生物素羧基载体蛋白[43]作为靶蛋白,通过His6、Glu6、Q6等标签将蛋白固定在裸氧化铁颗粒对目的蛋白进行纯化回收,同样提高目的蛋白的回收率及回收的纯度。
2.2 基于碳基材料纯化标签蛋白
碳基材料主要通过非共价相互作用,属于单步功能化材料,已报道有关碳基材料纯化蛋白的文献较少,Díaz-Ayala等[25]将重组HbI与聚赖氨酸标签Lys6融合,用于在2个碳纳米管换能器表面(即粉末和垂直排列的碳纳米管)上的特定位点共价固定,固定方式是通过2个步骤实现:一是从表面的羧酸基团生成胺反应性酯,二是将这些基团与Lys-tag的胺基团偶联,因此纯化目的蛋白。Tao等[44]使用不同的条件和技术分析固定化过程,以区分蛋白质共价连接和物理吸附,即描述一种新颖的二维层状材料(2DLM)剥离和功能化一步策略,以促进2DLM的生产和性能,基于生物相关和分子吸附的实际应用,该方法对溶解在疏水蛋白水溶液中的2DLM进行超声处理,在此过程中,疏水蛋白渗入夹层并自动结合到2DLM的表面,从大块材料中剥离单层/少层,剥离的2DLM自发包裹着致密有序的疏水蛋白单层,形成独特的生物纳米复合材料,具有大幅增强的生物相容性和分子吸附能力。Qafari等[38]还通过化学修饰的二氧化硅和氧化石墨烯(GO)纳米粒子上的短C末端连接区域,展示分选酶A转肽反应的特异性对蛋白A作为模型蛋白的共价和定向附着的应用,这种结合可在多种环境条件下发生,而不需要额外的化学反应。
2.3 基于聚合物/多糖基材料纯化标签蛋白
已报道有关聚合物/多糖为材料纯化蛋白的材料众多,大多数聚合物是以树脂为载体对目的蛋白进行纯化,如Khairil等[45]和Keeble等[46]利用SpyDock树脂,通过合理的工程设计,可以捕获SpyTag标签融合并允许高效洗脱目的蛋白。葡聚糖凝胶G-100树脂也是一种聚合物材料载体,Wu等[18]利用葡聚糖结合结构域将工程链霉亲和素固定到葡聚糖凝胶上的生物偶联方法,具有可逆生物素结合能力的工程化链霉亲和素(SAVSBPM18)已成功应用于纯化生物素化和链霉亲和蛋白结合肽(SBP)标记的蛋白质,产生的亲和柱有效地纯化SBP标记的和生物素化的蛋白质。Im7树脂是一种典型的标签介导的单步纯化蛋白质工程先进材料,Vassylyeva等[6]通过Im7树脂基质材料,通过突变CE7标签构建CL7标签,采用的方法就是一步纯化复杂蛋白质的高效超高亲和层析,由于蛋白质纯化需要一个高效的净化标准,因此,该标签保持与Im7的完全结合的亲和力。肝素琼脂糖树脂和Im7树脂有相似之处,都是采用亲和层析,亲和层析是纯化在不同表达宿主中表达的重组蛋白的一种广泛使用的方法[47],AlfA选择树脂同样是一种蛋白质工程先进材料,它的特点源自设计标签的广泛性,Götzke等[14]利用纳米抗体结合来自天然或固定标本的ALFA标签蛋白,具有低皮摩尔亲和力。另外,利用多糖为基质纯化目的蛋白主要包括纤维素、壳聚糖及淀粉。纤维素是最丰富的植物细胞壁多糖,其解构需要大量微生物酶的协同作用。Pires等[48]利用的模块化纤维素酶包含非催化A型碳水化合物结合模块(CBM),A型CBM标签在纤维素回收中起关键作用,含有特异性结合纤维素的结晶区域,从而通过接近和靶向效应提高酶的功效。
2.4 基于复合材料纯化标签蛋白
复合材料是基于纳米或分子尺度上对蛋白进行固定纯化,被广泛应用于生物技术、生物医药等方面。目前报道与复合材料结合的标签主要以His6及SBP、CBM等。如甲基汞(MeHg)化合物可以自然形成,具有剧毒,某些细菌已经进化出能够耐受甲基汞的机制,因此,Mccarthy等[49]通过对甲基汞化合物进行去甲基化,从质子分解反应中由单一有机汞裂解酶控制的去甲基化机制的启发,使用产生这种裂解酶的重组基因加上选择性结合沸石颗粒的额外多肽SBP,有效地将酶束缚在固体基质上。Zhou等[50]合成一种高效便捷的用于纯化和固定His标记的β-葡萄糖苷酶的Fe3O4/PM-G/IDA-Ni2+纳米颗粒,采用蒸馏-沉淀聚合法合成核/壳微球,用亚氨基二乙酸(IDA)打开微球壳上的环氧环以结合Ni2+(图2),固定化的β-葡萄糖苷酶可多次循环利用,并保留原有活性的65%以上,该材料在酶的纯化和固定化方面显示出巨大潜力。Dhar等[51]利用一种仿生复合材料,该复合材料使用基于弹性蛋白的杂化蛋白聚合物,具有用于还原氧化石墨烯(RGO)和纳米原纤化纤维素(NFC)的选择性结合顺序,融合蛋白的黏合和弹性结构域,显示出协同效应,同时提高合成珍珠层的强度和韧性,用于工程蛋白质的生物合成途径,为开发具有所需特性的材料提供新前景。
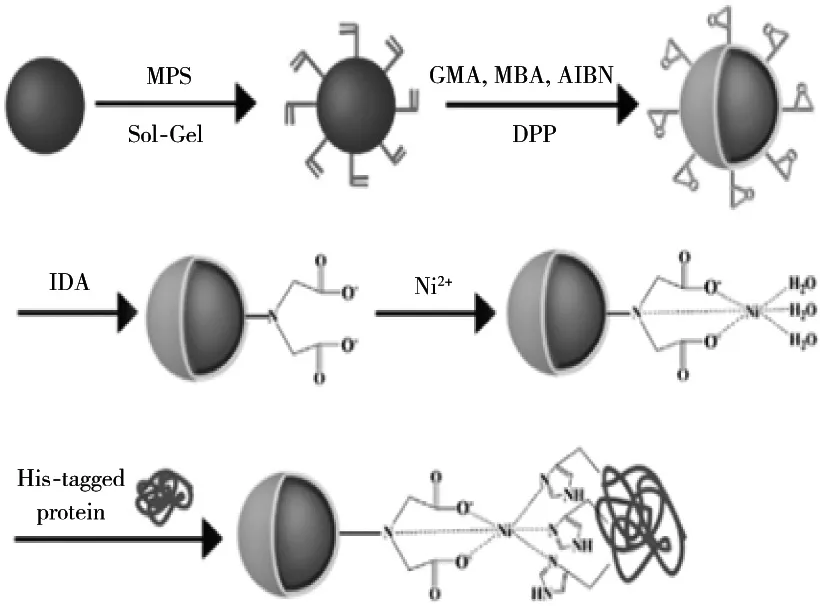
图2 基于Fe3O4/PMG/IDA纳米材料的制备及其结合蛋白示意图[50]
3 结语与展望
蛋白质工程材料的出现对蛋白质纯化过程提供参考,可认为是一种材料科学的未来。基于感兴趣的肽、蛋白质特异性连接到有机或无机材料表面的标签的单步纯化和固定方法为一系列不同的新型蛋白质、肽应用开辟了道路,通过该方法,在蛋白质纯化过程中蛋白质标签是关键,并显示出在基于锚肽、蛋白质纯化技术方面的巨大潜力,它们可单独使用,或与其他肽或蛋白质结合,作为共价或非共价接头用于材料表面功能化,而不影响材料的性质或干扰融合伴侣。开发此类材料所需的蛋白质、肽的可持续供应依赖于重组蛋白质的生产及在过去几年中已显著发展的纯化和固定化技术,标签介导的蛋白质纯化、固定化策略成为传统化学固定化方法的环保且具有成本效益的替代方案,允许在一个步骤中将蛋白质、肽结合纯化和固定化到天然、合成或杂合材料上,简化蛋白质工程材料的制造过程,因此,基于不同基质材料纯化重组蛋白的方案有待进一步深入探索。
