野生灵芝生物学特性及种子液发酵时间对出芝的影响
2023-07-29纪伟刘晓梅苏文英任立凯胡曙鋆陈克龙
纪伟 ,刘晓梅,苏文英,任立凯,胡曙鋆,陈克龙
1.连云港市农业科学院(连云港 222000);2.连云港市园艺蔬菜指导站(连云港 222000);3.青海师范大学(西宁 810000)
灵芝在广义上是灵芝属(Ganoderma lingzhi)的总称,是一种大型食药用真菌[1],有“仙草”“瑞草”等美称,是驰名中外的珍稀中药材之一[2],在日本、巴基斯坦和其他一些国家及地区均有发现[3],根据生物多样性信息数据库(Global Biodiversity Information Facility,GBIF)检索及分析,在已上传的8 179个数据中,除了南极洲,其他六大洲均有发现,欧洲上传的灵芝样本数据最多。
灵芝具有丰富的药理成分,且无毒副作用,有效成分包括灵芝多糖[4]、多肽[5]、三萜类[6]及16种氨基酸[7]等。灵芝能降低中枢神经系统的兴奋性,有一定镇痛作用[8],有解毒[9]、降血糖[10]及抗辐射[11]等效应,灵芝多糖更是能提高机体免疫力[12],有一定治疗哮喘[13]和抗肿瘤作用[14]。灵芝还拥有极高的文化观赏价值[15],自古被人视为吉祥、富贵之物,可将之培育成外形美观的观赏植物[16]。
花果山位于江苏省连云港市南云台山中麓[17],是江苏省诸山的最高峰[18],是连云港市生物多样性、丰富性和典型性代表区域之一,区域内具有丰富的野生菌物资源,尤其以野生灵芝资源最为丰富。通过对连云港花果山采集的野生灵芝进行分离、ITS分子鉴定、灵芝菌株生物学特性及种子液发酵时间对出芝的影响研究,在加强野生灵芝资源研究和保护的基础上,挖掘优质种质资源,为灵芝在食品工业的产品开发提供一定参考。
1 材料与方法
1.1 主要材料与试剂
菌株来源:于2021年9月在连云港市花果山(北纬34°62′493′,东经119°27′808′)采集获得,标本编号lynk2103。将采集的野生灵芝进行组织分离得到菌株,保存于连云港市农业科学院食用菌种质资源库。
马铃薯葡萄糖水培养基、马铃薯葡萄糖琼脂(PDA)培养基、酵母浸粉、磷酸二氢钾、无水硫酸镁、蔗糖、D(+)-麦芽糖、蛋白胨、琼脂糖等。
YDS-10-80液氮罐(乐山市东亚机电工贸有限公司);凝胶成像系统(上海培清科技有限公司);PCR仪(德国Eppendorf公司);CX43显微镜(日本Olympus公司);超净工作台(德国Airtech);MD-550离心机(德国Eppendorf公司)。
1.2 野生灵芝菌株分离及保存
记录野生灵芝的生境及其形态特征,寄生的植被的位置,子实体的形状、颜色、轮纹、菌盖厚度和菌肉颜色等形态特征。采用组织分离法,选取幼嫩未散粉野生灵芝子实体,用含有75%酒精浓度的酒精棉球擦拭灵芝菌盖表面,灭菌后的手术刀切除表层,再用灭菌后的镊子夹取内部组织,接种于PDA平板上,于25 ℃暗培养5 d,挑取萌发的菌丝,获得纯培养菌株,将菌丝接种于PDA试管斜面上,待斜面长满置于4 ℃冰箱保存。
1.3 菌株的ITS分子鉴定
采用康维世纪真菌基因组DNA快速提取试剂盒提取DNA,提取的DNA进行1%琼脂糖凝胶电泳检测,采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增,引物由生工生物工程(上海)股份有限公司合成。扩增条件为94 ℃预变性5 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环,72 ℃延伸10 min。PCR产物交由生工生物工程(上海)股份有限公司进行测序,所测得ITS序列与GenBank数据库进行Blast比对,采用软件MEGA 7.0对所测ITS序列进行比对、近邻相接法(neighbor-joining method,NJ)构建系统发育树[19]。
1.4 液体培养基碳氮源筛选
以20 g/L的葡萄糖、蔗糖、淀粉、麦芽糖和甘露醇为液体培养基的唯一碳源,以10 g/L的蛋白胨、硝酸钾、硝酸铵、硝酸钠和硫酸铵为液体培养基的唯一氮源,在pH 6.8~7.0、25 ℃,160 r/min条件下避光培养,分别探究不同碳氮源对灵芝菌株液体发酵产生的生物量(菌丝体干重)的影响。
液体发酵菌丝体干重的测定方法:量取50 mL灵芝发酵液倒入离心管中,以10 000 r/min离心5 min,将离心后获得的菌丝体转移到恒重的称量瓶中,于80℃烘干,称定,计算其菌丝体干重,每个试验设定2个重复。
1.5 液体发酵条件单因素试验
将发酵液分别放置于转速为50,100,150,200和250 r/min的恒温振荡器中培养,考察转速对灵芝菌株液体发酵产生的生物量(菌丝体干重)的影响;将发酵液分别放置于温度为15,20,25,30和35 ℃的恒温振荡器中培养,考察温度对灵芝菌株液体发酵产生的生物量(菌丝体干重)的影响;在500 mL摇瓶中将发酵液装液量分别设定为50,100,15,200和250 mL,考察摇瓶装液量对灵芝菌株液体发酵产生的生物量(菌丝体干重)的影响;将发酵液接种量分别设置为2%,4%,6%,8%和10%,考察接种量对灵芝菌株液体发酵产生的生物量(菌丝体干重)的影响,每个试验设定2个重复。
1.6 液体培养基配方不同因素和水平正交试验
培养温度25 ℃,初始pH自然,接种量5%、接种菌龄5 d,摇床转速160 r/min,无水硫酸镁与磷酸二氢钾含量均为1 g/L,选定常规和适于规模化生产的碳源、氮源和无机盐,进行3个因素4个水平[L16(43)]正交试验设计考察,具体设计见表1。统计发酵液中菌丝体干重,以此为考察指标,经统计学分析,找出最优配方。

表1 液体培养基的L16(43)正交试验设计 单位:g/L
1.7 液体发酵过程曲线
以筛选出的最优碳源、氮源、最佳发酵条件和最优培养基配方来探究灵芝菌株液体发酵过程中生物量(菌丝体干重)、pH和胞外多糖含量变化规律,每10 h取1次发酵液进行测定,取样16次,每个试验设定2个重复。
液体发酵液pH测定方法:在超净台中,无菌操作取样发酵液15 mL于50 mL烧杯中,使用pH计进行测定,测定前pH计需要校准。
液体发酵胞外多糖测定:使用100 mL离心管取样发酵液25 mL,每个试验设定2个重复,向装有发酵液的每个离心管中加入无水乙醇75 mL,震荡后静置12 h,使用离心机以10 000 r/min离心5 min,倒掉上清液,收集沉淀,使用70 ℃烘干,称定,计算其胞外多糖含量[20]。
1.8 液体菌种不同发酵时间菌丝吃料速度及对出芝影响
选取不同发酵时间的种子液,时间为90~160 h,每10 h作为1个试验组,分别接种至固体培养基中,测定菌丝吃料速度和满袋时间,每个试验设定2个重复,并记录最后灵芝子实体出芝情况。
1.9 统计方法
采用SPSS和Excel软件对数据处理分析,采用Duncan新复极差法对组间差异显著性进行分析,以P<0.05为差异具有统计学意义,采用Photoshop软件处理图片,利用Origin 9.1软件对所得数据作图,采用MEGA 7.0对ITS序列构建系统发育树。
2 结果与分析
2.1 野生灵芝分离及保存
由图1(A)可知,野生灵芝菌株生境植被主要为麻栎、板栗等阔叶树种。由图1(B和C)可知,幼嫩灵芝子实体近半圆形,成熟灵芝子实体近圆形,菌盖较厚,轮纹明显,半径3.6~6.4 cm;菌柄红褐色,侧生,长度4.5~10.7 cm,幼嫩子实体菌盖边缘淡黄色,边缘肥厚。由图1(D)可知,在PDA培养基中菌落近圆形,菌落中心菌丝有凸起轮纹、菌落周边菌丝表面平整,菌丝色泽为白色,菌丝平伏、浓密、均匀,无白色气生菌丝。由图1(E)可知,通过奥林巴斯显微镜观察发现菌丝粗壮,分枝密度不高,有隔膜,可见锁状联合,无杂菌。分离获得的菌株使用试管斜面(见图1 F),菌株命名为lynk2103,保存于4 ℃冰箱。

图1 野生灵芝子实体及菌落形态
2.2 菌株lynk2103的ITS分子鉴定
经PCR扩增和凝胶电泳检测,获得 ITS序列片段612 bp,如图2所示。由电泳图结果中可以看到条带介于500~750 bp之间,与ITS测序结果一致,测序数据已上传至NCBI数据库中,GenBank登录号为OP784796。测序结果在GenBank中进行Blast比对,可以判定菌株lynk2103为Ganoderma lingzhi。使用邻位相连法构建系统发育树。从进化树可以看出,根据分支信息lynk2103与已报道灵芝近交程度较低。
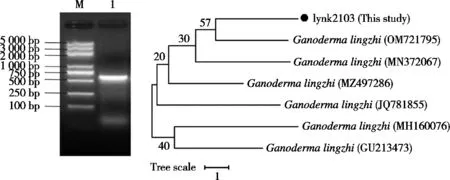
图2 灵芝ITS序列DNA电泳图和系统发育树
2.3 液体培养基碳氮源筛选
由图3可知,在不同碳源(葡萄糖、蔗糖、麦芽糖、甘露醇和淀粉)的培养下,菌株lynk2103的液体发酵产生的生物量(菌丝体干重)呈先增加后平稳趋势,碳源为葡萄糖时,液体发酵产生生物量最多(菌丝体干重),达到12.34 g/L,培养5 d的发酵液开始进入平稳期;麦芽糖和蔗糖作为碳源时,液体发酵产生生物量次之;随后依次为淀粉和甘露醇。故选择葡萄糖作为碳源。

图3 碳源和氮源对菌株lynk2103发酵的影响
在不同氮源(蛋白胨、硝酸钾、硝酸钠、硝酸铵和硫酸铵)的培养下,菌株lynk2103的液体发酵产生的生物量(菌丝体干重)呈先增加后平稳趋势,氮源为蛋白胨时,液体发酵产生生物量最多(菌丝体干重),达到11.94 g/L,培养6 d的发酵液开始进入平稳期;硝酸铵作为氮源时,液体发酵产生生物量次之;随后依次为硝酸钾和硝酸钠;硫酸铵作为氮源时液体发酵产生生物量最少。故选择蛋白胨作为氮源。
2.4 液体发酵条件单因素试验
由图4可知:灵芝液体发酵的最佳转速为150 r/min,对应菌丝体干重达10.50 g/L,较转速200和250 r/min对应菌丝体干重分别提高1.89%和8.76%,差异不显著,但显著高于转速100和50 r/min对应菌丝体干重(P<0.05);灵芝液体发酵的最佳接种量为10%,对应菌丝体干重达10.55 g/L,显著高于其他4种接种量对应的菌丝体干重(P<0.05),较菌丝体干重第二高的8%接种量提高10.70%;灵芝液体发酵的500 mL摇瓶的最佳装液量为100 mL,对应菌丝体干重达10.45 g/L,较菌丝体干重第二高的装液量150 mL提高3.36%,差异不显著,但显著高于其他3种装液量对应菌丝体干重(P<0.05);灵芝液体发酵的最佳温度为30 ℃,对应菌丝体干重达11.18 g/L,显著高于其他4种发酵温度对应的菌丝体干重(P<0.05),较菌丝体干重第二高的25 ℃发酵温度提高12.88%。
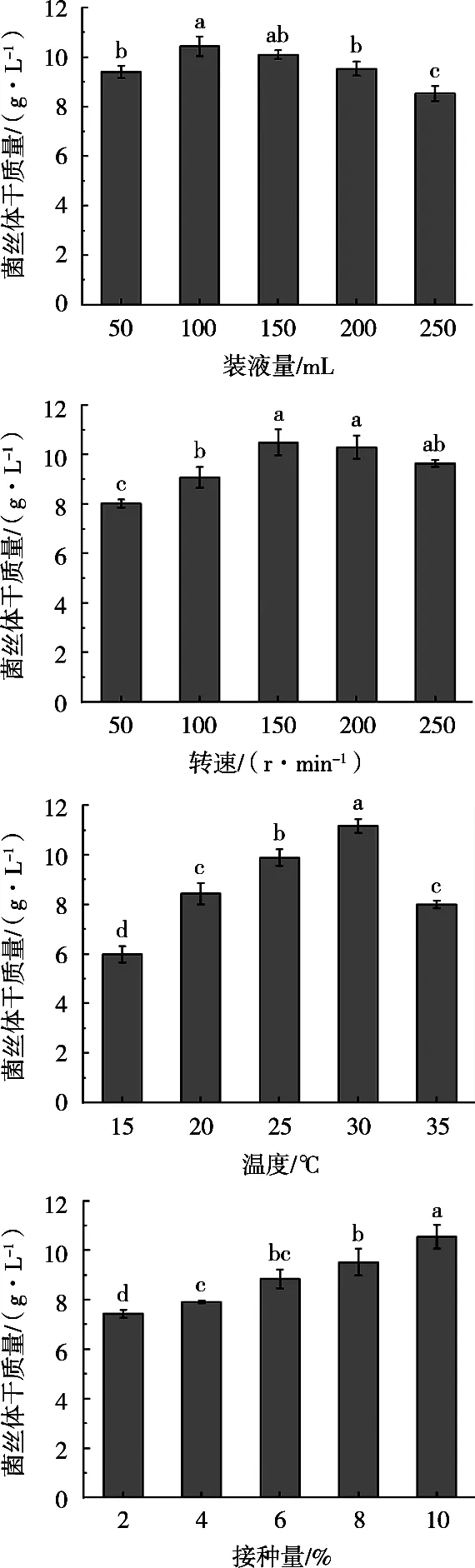
图4 灵芝菌株lynk2103的液体发酵菌条件优化
2.5 灵芝菌株lynk2103的液体培养基配方不同因素和水平正交试验
由表2可知:因素A(葡萄糖)极差R值最大为3.31,其次是因素C(蛋白胨)极差R值为3.23,因素B(酵母浸粉)极差R值最小为0.78,说明培养基成分对灵芝液体发酵产生生物量(菌丝体干重)的影响大小顺序为葡萄糖含量>蛋白胨含量>酵母浸粉含量;因素A(葡萄糖)4水平数据的综合平均最高为10.83,因素B(酵母浸粉)2水平数据的综合平均最高为9.44,因素C(蛋白胨)3水平数据的综合平均最高为10.42,说明最优水平为A4B2C3,即葡萄糖40 g/L、酵母浸粉10 g/L、蛋白胨15 g/L加上固定的磷酸二氢钾1 g/L、无水硫酸镁1 g/L,为该正交试验最优发酵配方。

表2 L16(43)正交试验结果
2.6 优化后灵芝菌株lynk2103的液体发酵菌过程曲线
经160 h的发酵培养,结果如图5所示。根据菌丝体干重变化曲线可知,0~50 h为迟缓期,50~130 h为对数生长期,130~150 h为平稳期,而从150 h开始进入衰亡期。在150 h灵芝生物量(菌丝体干重)达到最高为18.19 g/L;根据发酵液pH和胞外多糖变化曲线可知,发酵液pH随着发酵时间的延长而降低,与菌丝体干重变化存在一定的负相关,pH从150 h开始趋于稳定。根据菌丝体干重和pH发酵过程曲线的规律,可作为调控发酵的依据。
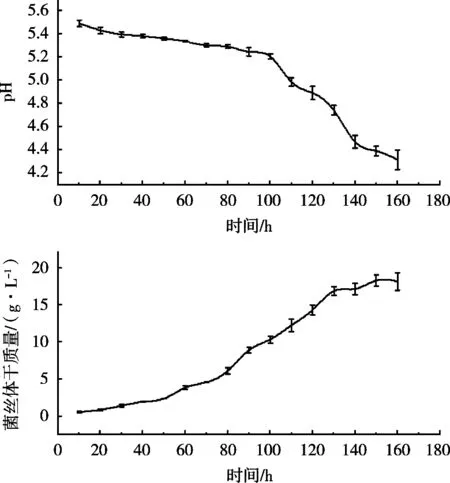
图5 灵芝菌株lynk2103的原种液体发酵过程曲线
2.7 液体菌种不同发酵时间菌丝吃料速度及对出芝影响
选取不同发酵时间的种子液分别接种至固体培养基中,测定菌丝吃料速度和满袋时间,如图6所示,因液体菌种不同的发酵时间菌丝浓度不同,对菌丝吃料速度和菌袋长满时间产生影响。液体发酵时间120 h时,菌丝吃料速度最高,吃料速度为0.56 cm/d,其次是110 h,液体发酵时间90 h对应的吃料速度最低为0.40 cm/d,其中液体菌种发酵时间110和120 h对应的吃料速显著高于发酵时间90 h对应的吃料速度(P<0.05)。对菌袋长满时间进行统计,液体菌种发酵时间90 h长满菌袋时间最长为35 d,显著长于其他组别(P<0.05),菌袋长满时间与前期菌丝吃料速度有一定的对应关系,但不完全一致。

图6 液体菌种不同发酵时间菌丝吃料速度和满袋时间
不同发酵时间种子液因菌丝浓度的影响,菌丝吃料速度和固体培养基满袋时间存在着差异,但后期对子实体的形成影响并不大,如图7所示,不同发酵时间的种子液对应的出芝情况,均可以正常形成灵芝子实体,从经济角度考虑种子液发酵时间应选择菌丝生长速度快和满袋时间最快的参数,菌株lynk2103对应最佳发酵时间为120 h。
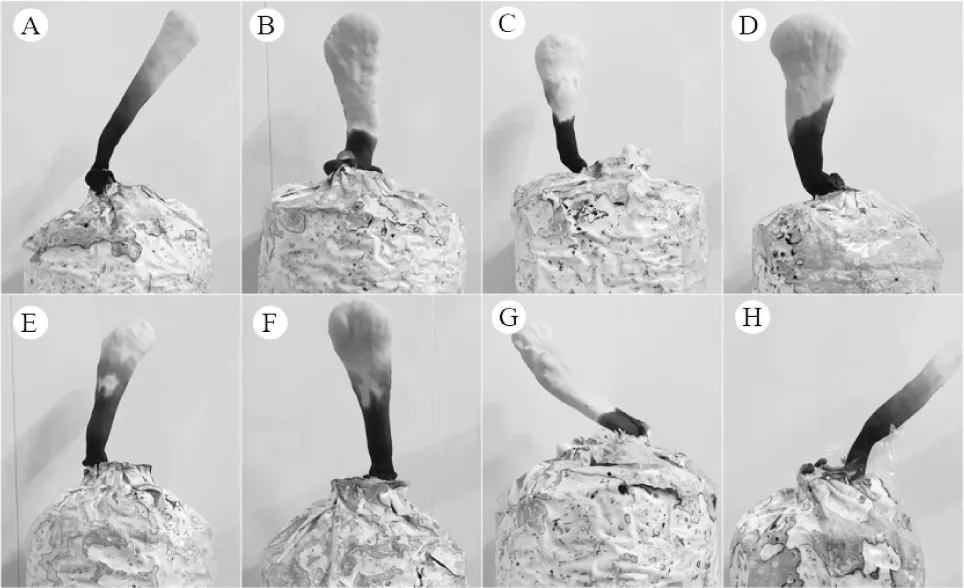
图7 液体菌种不同发酵时间灵芝子实体出芝情况
3 讨论
通过对采集的野生标本进行形态学鉴定及分离后的菌株进行ITS分子鉴定,确定菌株lynk2103为灵芝属真菌。从进化树可以看出,根据分支信息lynk2103与已报道灵芝近交程度较低,说明该菌株具有较好的遗传多样性,测序数据已上传至NCBI数据库中,GenBank登录号为OP784796,菌丝具有锁状联合,说明为双核菌丝,具备子实体形成条件。在碳源对灵芝液体发酵产生生物量影响的研究发现葡萄糖是该菌株最优碳源,这与邢源月等[21]研究结果存在一定差异,这可能因为不同菌株在不同碳源利用效率方面存在一定差异所致,葡萄糖是一种单糖,是传统的速效碳源,采购方便,价格低廉,更有利于生产推广。氮源对灵芝液体发酵产生生物量影响研究发现有机氮源和无机氮源均可以被该菌株利用,蛋白胨是该菌株最优氮源,有机氮源效果更佳,这可能与有机氮源中还含有一定的微量元素和其他营养成分有关。
液体发酵条件单因素试验研究发现:灵芝液体发酵的最佳转速为150 r/min,最佳接种量为10%,这与多数食药用真菌要求一致;最佳装液量为100 mL,对应菌丝体干重达10.45 g/L,较菌丝体干重第二高的装液量150 mL提高3.36%,差异不显著,但显著高于其他3种装液量对应菌丝体干重(P<0.05),如果从生产效率角度考虑,可采用150 mL的装液量,同时也说明灵芝发酵过程耗氧量较高,在工业化发酵罐发酵灵芝液体菌种时需要提高发酵的通气比;灵芝液体发酵的最佳温度为30 ℃,相较于其他食用菌最佳发酵温度25 ℃要高,这与野生灵芝在夏季高温季山林中最为丰富刚好对应,另外刘月琴等[22]发现灵芝在发酵温度32℃时可以提高灵芝活性成分黄酮的含量与本试验结果类似。
灵芝菌株液体发酵配方正交试验研究中发现培养基成分对灵芝液体发酵产生生物量的影响顺序为葡萄糖含量>蛋白胨含量>酵母浸粉含量,说明碳源是首要影响因素,同时发现过高或过低的氮源均不利于灵芝菌丝体的合成,这可能是因为氮源过低时候很快被消耗,而氮源过高时一方面改变了培养基碳氮比,另一方面浓度过高影响渗透压,而不利于灵芝发酵液生物量的积累,通过正交试验科学的确定菌株lynk2103的最佳配方。
在优化后的条件下,通过对菌株lynk2103的液体发酵过程进行跟踪,根据发酵液生物量变化曲线发现在150 h灵芝生物量(菌丝体干重)达到最高为18.19 g/L,高于何伟等[23]研究结果;根据发酵液pH变化曲线可知,发酵液pH随着发酵时间的延长而降低,与菌丝体干重变化存在一定的负相关,根据菌丝体干重和pH过程曲线的规律,可作为发酵终点的综合判定和发酵过程调控的依据[24],另外菌丝体在培养过程由于新陈代谢产生的有机酸积累,对菌丝体的生长起到一定的抑制作用,因此菌丝体发酵起始pH要适当调高,已报道对发酵初始pH的研究主要在酸性及中性条件下,唐晨旻等[25]探究灵芝在初始pH 2~11较广范围内的发酵情况,通过试验发现发酵后菌丝体干重最高在初始pH为10,贺新生等[26]报道树舌灵芝菌丝体发酵的最适宜pH为8.5,这些现象均与此次研究的试验现象相吻合。
不同发酵时间种子液因菌丝浓度不同影响菌丝在固体培养基中的生长速度,但并不是菌丝浓度越高,菌丝在固体培养基中速度越快[27],所以在菌种发酵时间选择上,一方面需要参照液体菌种发酵曲线,另一方面还要考虑菌丝在固体中吃料速度,菌丝浓度过高或者过低都对菌丝生长速度有影响,菌丝量过低,菌丝在固体培养基中的生长点过少,菌丝量过高,老化菌丝较多,菌种活力不够[28],试验中灵芝菌株对应的最佳发酵时间为120 h,不仅吃料速度快,而且满袋时间最短。另外,试验发现不同发酵时间的种子液对出芝情况影响较小,但对后期代谢产物含量、子实体生物量和产孢量仍需进一步研究。
4 结论
此次研究采集分离获得的菌株lynk2103通过形态学和ITS基因序列分析,确定菌株为灵芝属真菌,测序数据上传至NCBI数据库中,GenBank登录号为OP784796,从进化树可以看出,lynk2103与已报道灵芝近交程度较低,说明该菌株具有较好的遗传多样性,菌丝具有锁状联合,说明为双核菌丝,具备子实体形成条件;液体培养基最佳碳源为葡萄糖,最佳氮源为蛋白胨;液体发酵的最佳转速150 r/min,最佳接种量10%,最佳装液量100 mL和最佳发酵温度30 ℃,最佳培养基配方为葡萄糖40 g/L、酵母浸粉10 g/L、蛋白胨15 g/L、磷酸二氢钾1 g/L和无水硫酸镁1 g/L;原种发酵曲线0~50 h为迟缓期,50~130 h为对数生长期,130~150 h为稳定期,150 h开始进入衰亡期,发酵液pH与菌丝体干重变化呈负相关;灵芝菌株液体发酵最佳时间为120 h,不仅吃料速度快,而且满袋时间最短,不同发酵时间的种子液对菌丝吃料速度和固体培养基满袋时间存在着差异,但对出芝情况影响较小。
