萝卜VQ1基因的克隆与序列分析
2023-07-29霍燕琦李紫薇张文静徐铭婕刘同金
霍燕琦 李紫薇 张文静 徐铭婕 刘同金

摘要 利用RT-PCR技术克隆了萝卜(Raphanus sativus L.)VQ1基因CDS序列,并对其进行测序和生物信息学分析。结果表明,RsVQ1开放阅读框长861 bp,编码286个氨基酸残基,相对分子量为31.3 kD,理论等电点为6.49,脂肪指数为62.69,为不稳定的亲水性蛋白,无跨膜结构和信号肽。RsVQ1蛋白主要由无规则卷曲结构构成,预测其可定位于细胞核。系统发育分析表明该蛋白与十字花科作物VQ蛋白存在较高同源性。本研究为RsVQ1的表达和基因功能研究奠定了基础。
关键词 萝卜;VQ1基因;基因克隆;生物信息学
中图分类号 S631.1 文献标识码 A
文章编号 1007-7731(2023)10-0042-05
Cloning and sequence analysis of VQ1 gene in radish
HUO Yanqi LI Ziwei ZHANG Wenjing XU Mingjie LIU Tongjin*
(College of Horticulture,Jinling Institute of Technology,Nanjing Jiangsu 210000)
Abstract The full length coding sequence of VQ1 gene was cloned from radish (Raphanus sativus L.) by reverse transcription-PCR amplification and analyzed by bioinformatics. The results showed that the open reading frame (ORF) of RsVQ1 gene is 861 bp,encoding 286 amino acids with a molecular weight of 31.3 kD,isoelectric point of 6.49 and aliphatic index of 62.69. It was predicted to encode an unstable hydrophilic protein,and with no transmembrane structure or signal peptide. The protein structure of RsVQ1 is mainly composed of random coiled structures. Protein subcellular localization prediction results showed that it was probably localized in the nucleus. Phylogenetic analysis showed that RsVQ1 is closely related to Brassicaceae homologous proteins. Present study provides a basis for exploring the expression and function of RsVQ1 gene in the future.
Keywords radish; VQ1 gene; gene clone; bioinformatics
VQ蛋白是植物中广泛存在的一类转录辅助蛋白[1],因其含有高度保守的VQ基序(FxxhVQxhTG)而得名,其中x和h分别代表任意氨基酸和疏水性氨基酸[2]。基因结构分析发现,高等植物中多数VQ基因不含内含子,而苔藓基因组中包含的18个VQ基因均至少含有一个内含子[3]。
研究表明,VQ蛋白参与植物不同发育过程的调控,包括光形态的建成,种子、花、叶和下胚轴的发育及对生物和非生物胁迫的响应[3]。VQ家族蛋白可以通过其保守的V和Q残基与WRKY转录因子互作,进而调控下游一系列的生理生化过程[4]。盐胁迫特异性诱导AtVQ9上调表达,并与AtWRKY8互作而调控植物的耐盐性[5]。此外,ABA、高盐、高渗透压及低温或高温胁迫诱导与AtWRKY8互作的AtVQ10、AtVQ11和AtVQ23/SIB1编码基因显著上调表达,表明其可能参与植物对多种非生物逆境调控[6]。转录因子AtWRKY2和AtWRKY34与AtVQ20蛋白互作调控花粉萌发、发育及花粉管的伸长[7],AtVQ14可与VQ基序蛋白IKU1互作调节种子大小和胚乳发育[8],表明VQ蛋白参与植物发育过程的调控。VQ基因家族成员在对病原菌的防御过程中也发挥着重要作用[9]。丁香假单胞菌(Pseudomonas syringae)侵染诱导拟南芥AtVQ23/SIB1上调表达,其功能缺失突变会抑制SA和JA介导的防御反应[10]。AtVQ16/SIB2和AtVQ23/SIB1可增强AtWRKY33的DNA结合活性以增强植株对真菌病的防御能力[4],且过表达AtVQ23可增强植株对丁香假单胞菌的抗性[10]。AtVQ12、AtVQ22和AtVQ29负调控植物对灰霉菌(B. cinerea)的抗性[11],而VQ10与WRKY8互作增强拟南芥对灰霉病的基础防御[12]。
萝卜(Raphanus sativus L.)是一种重要的蔬菜作物,具有较高的食用与药用价值,在世界范围内被广泛栽培。其生长发育过程常遭受多种生物及非生物胁迫,极大影响了产量与品质,已成为萝卜种植生产过程中亟需解决的问题。然而,目前有关萝卜对生物及非生物胁迫的抗性机制研究较少,制约了其遗传改良进程。前人研究表明VQ基因家族成员广泛參与植物对生物和非生物胁迫的响应,但尚未见有关于萝卜VQ基因的报道。本研究克隆了萝卜VQ1基因,并进行测序和生物信息学分析,将为下一步RsVQ1的表达调控和功能研究奠定基础。
1 材料与方法
1.1 试验材料
试验材料为‘心里美萝卜高代自交系,种植于金陵科技学院园艺站,取成熟期肉质根置于液氮中速冻,-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 RNA提取及cDNA合成。使用多糖多酚植物RNA提取试剂盒(北京华越洋生物科技有限公司)进行总RNA的提取,经琼脂糖凝胶电泳检测合格后,使用FastKing cDNA第一链合成试剂盒(天根生化科技有限公司)将其反转录合成第一链cDNA。
1.2.2 引物设计与PCR扩增。根据已发表的萝卜基因组数据,设计并合成RsVQ1基因特异性引物VQ1-InF(CACCATGCAATCTTCAAGCGGCG)和VQ1-InR(CGAGGCGTGAAAGATGCGT),以cDNA为模板,使用KOD-Plus-Neo高保真酶(TOYOBO CO.,LTD)进行RsVQ1基因的PCR扩增。PCR反应体系为cDNA模板2 μL,10×PCR Buffer 5 μL,10 μmol/L Forward Primer 1.5 μL,10 μmol/L Reverse Primer 1.5 μL,2 mM dNTPs 5 μL,酶(1U) 1 μL,ddH2O补充至50 μL;PCR扩增程序使用两步法:94 ℃预变性2 min,98 ℃变性10 s,68 ℃延伸30 s,进行35个循环。
1.2.3 目的片段的回收、载体构建与测序。PCR扩增产物经1%琼脂糖凝胶电泳分离,使用大量琼脂糖凝胶DNA回收试剂盒(天根生化科技有限公司)对目的片段进行切胶回收,并将其连接到pENTER-TOPO为载体(Invitrogen),重组产物通过热激发转化至DH5α感受态细胞,涂布于含有50 mg/L卡那霉素的LB固体基中过夜培养,挑取单克隆进行摇菌和菌液PCR,筛选阳性克隆送上海生工进行Sanger测序。
1.2.4 生物信息学分析。利用ExPASy-ProtScale在线软件翻译碱基序列,并分析其分子式、分子量、理论等电点(PI)、不稳定系数、脂肪系数、亲疏水性;使用NovoPro在线工具预测其跨膜结构与信号肽序列;使用SPOMA在线工具预测其二级结构;使用Plant-mPLoc在线软件预测其亚细胞定位;采用NCBI中Conserved Domains 在线工具对RsVQ1蛋白保守结构域进行预测;使用NetPhos-3.1在线工具对RsVQ1蛋白磷酸位点进行预测;利用NCBI中Blast工具获取其他物种同源蛋白序列,运用MEGA软件进行系统发育进化树的构建(Neighbor-joining法,Bootstrap值设置为1 000)。
2 结果与分析
2.1 RNA提取及RsVQ1基因扩增
对‘心里美萝卜肉质根提取出的RNA进行电泳检测(图1),结果表明提取质量较好,条带清晰,可用于后续试验。以其反转录成的cDNA为模板,PCR扩增出了861 bp的目的条带(图2)。
2.2 RsVQ1蛋白的理化性质分析
将测序获得的RsVQ1碱基序列翻译成氨基酸并对其进行序列分析,结果表明:RsVQ1编码286个氨基酸,其中Asn(N)、Ser(S)和Leu(L)含量较高,分别为11.9%、14.3%和9.1%;Cys(C)与Trp(W)含量最低,均为0.3%。该蛋白分子式为C1345H2092N404O451S5,分子量大小为31.3 kD,理论等电点(PI)为6.49,不稳定系数为72.08,脂肪指数为62.69,总平均亲水性为-0.748,说明其为不稳定的亲水性蛋白。ProtScale预测表明RsVQ1亲水区含量高于疏水区,进一步说明其为亲水性蛋白。NovoPro预测结果表明,RsVQ1蛋白无跨膜结构、无信号肽,表明其为非分泌性蛋白。
2.3 RsVQ1蛋白空间结构预测及亚细胞定位
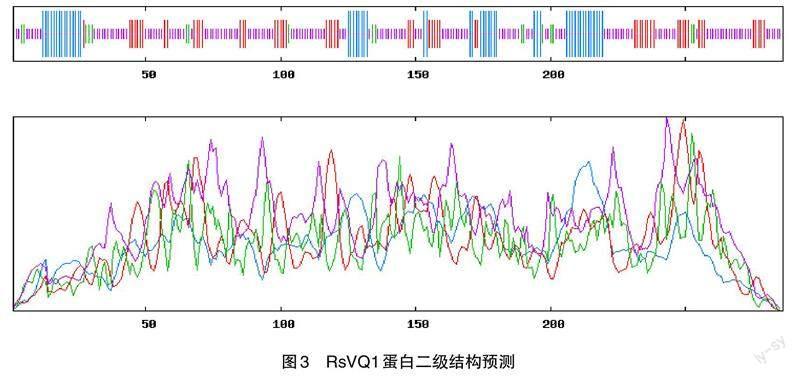
SPOMA预测表明RsVQ1蛋白二级结构中无规则卷曲、延伸链、α-螺旋和β-折叠所占比例分别为55.94%、20.28%、17.83%和5.94%(圖3)。Plant-mPLoc在线软件预测RsVQ1蛋白极可能定位于细胞核。
2.4 RsVQ1蛋白保守结构域及磷酸化位点预测
使用NCBI中Conserved Domains在线工具预测发现RsVQ1蛋白具有一个VQ保守结构域。NetPhos-3.1预测RsVQ1蛋白有44个磷酸化位点,其中丝氨酸、苏氨酸和酪氨酸磷酸化位点分别有31、10和3个(图4)。
2.5 RsVQ1蛋白的系统进化分析
为研究萝卜RsVQ1与其他植物蛋白的系统进化关系,利用MEGA软件构建了RsVQ1与14个不同物种的系统进化树(图5)。结果发现,RsVQ1与白芥(Sinapis alba)、甘蓝型油菜(Brassica napus)、甘蓝(Brassica oleracea )、白菜(Brassica rapa)和芝麻菜(Eruca vesicaria subsp. sativa)等十字花科植物的同源蛋白聚为一类,表明萝卜RsVQ1与十字花科植物同源蛋白的亲缘关系较近,而与醉蝶花(Tarenaya hassleriana)、苦菊(Cichorium endivia)、中华猕猴桃(Actinidia chinensis)和旋蒴苣苔(Dorcoceras hygrometricum)的亲缘关系相对较远。
3 讨论与结论
前人研究表明,VQ基因家族成员在调控植物生长发育和逆境响应过程中均发挥重要作用。籼稻(Oryza sativa subsp. Indica)多个OsMHVQs响应温度胁迫[13],甜瓜(Cucumis melo L.)中6个VQ家族基因响应白粉病菌侵染[14],盐胁迫诱导普通烟草(Nicotiana tabacum)NtVQ16和NtVQ52基因显著上调表达,NtVQ9、NtVQ46、NtVQ23和NtVQ26响应青枯菌的侵染,推测其可能参与烟草对青枯菌的免疫防御调控[15],小麦(Triticum aestivum)VQ家族部分成员响应高温与干旱胁迫[16]。此外,研究表明多种植物VQ1基因参与对生物和非生物胁迫的响应。茉莉酸、脱落酸和低温处理诱导香蕉(Musa paradisiaca)MaVQ1显著上调表达,高温与干旱抑制其表达水平[17];青杄(Picea wilsonii M.)VQ1基因参与温度、干旱、ABA、盐胁迫等多种非生物胁迫的响应[18];侯俊斌[19]发现棉花(Anemone vitifolia Buch)GhVQ1在根中具有较高的表达水平,且受植物抗病相关激素水杨酸与茉莉酸的影响,抑制其表达可降低棉花对枯萎病的敏感性。
目前萝卜VQ基因相关研究尚未见有报道,基于前人对VQ基因功能的研究,推测萝卜VQ基因可能参与调控植株的生长发育及生物与非生物胁迫的响应。本研究从‘心里美萝卜中克隆出RsVQ1基因,并对其进行生物信息学分析,RsVQ1蛋白为不稳定的亲水性非分泌性蛋白,无跨膜结构,含有VQ保守结构域,具有44个磷酸化位点。蛋白质二级结构主要为无规则卷曲结构,其次为延伸链结构,亚细胞定位预测表明该蛋白极可能存在于细胞核中。RsVQ1蛋白与白芥、芝麻菜等十字花科物种的同源性较高。本研究为进一步解析RsVQ1基因的功能和表达调控机制奠定了基础。
参考文献
[1] JIANG S Y,SEVUGAN M,RAMACHANDRAN S. Valine-glutamine (VQ)motif coding genes are ancient and non-plant-specific with comprehensive expression regulation by various biotic and abiotic stresses[J]. BMC Genomics,2018,19(1):1-14.
[2] MORIKAWA K,SHIINA T,MURAKAMI S,et al. Novel nuclear-encoded proteins interacting with a plastid sigma factor,Sig1,in Arabidopsis thaliana1[J]. FEBS Letters,2002,514(2-3):300-304.
[3] JING Y J,LIN R C. The VQ motif-containing protein family of plant-specific transcriptional regulators[J]. Plant Physiology,2015,169(1):371-378.
[4] LAI Z B,LI Y,WANG F,et al. Arabidopsis sigma factor binding proteins are activators of the WRKY33 transcription factor in plant defense[J]. The Plant Cell,2011,23(10):3824-3841.
[5] HU Y R,CHEN L G,WANG H P,et al. Arabidopsis transcription factor WRKY8 functions antagonistically with its interacting partner VQ9 to modulate salinity stress tolerance[J]. The Plant Journal:for Cell and Molecular Biology,2013,74(5):730-745.
[6] 韩笑,王后平,潘金晶,等. 拟南芥WRKY8转录因子相关基因VQ10和VQ11受多种非生物逆境胁迫诱导表达[J]. 植物分类与资源学报,2015,37(6):760-766.
[7] LEI R H,LI X L,MA Z B,et al. Arabidopsis WRKY2 and WRKY34 transcription factors interact with VQ20 protein to modulate pollen development and function[J]. The Plant Journal:for Cell and Molecular Biology,2017,91(6):962-976.
[8] WANG A H,GARCIA D,ZHANG H Y,et al. The VQ motif protein IKU1 regulates endosperm growth and seed size in Arabidopsis[J]. The Plant Journal:for Cell and Molecular Biology,2010,63(4):670-679.
[9] CAI H Y,ZHANG M,LIU Y H,et al. Genome-wide classification and evolutionary and functional analyses of the VQ family[J]. Tropical Plant Biology,2019,12(2):117-131.
[10] XIE Y D,LI W,GUO D,et al. The Arabidopsis gene SIGMA FACTOR-BINDING PROTEIN 1 plays a role in the salicylate-and jasmonate-mediated defence responses[J]. Plant,Cell & Environment,2010,33(5):828-839.
[11] WANG H P,HU Y R,PAN J J,et al. Arabidopsis VQ motif-containing proteins VQ12 and VQ29 negatively modulate basal defense against Botrytis cinerea[J]. Scientific Reports,2015,5:14185.
[12] CHEN J Q,WANG H P,LI Y,et al. Arabidopsis VQ10 interacts with WRKY8 to modulate basal defense against Botrytis cinerea[J]. Journal of Integrative Plant Biology,2018,60(10):956-969.
[13] 吳乐兵,向婧,刘珍,等. 籼稻明恢63中VQ基因家族鉴定及表达分析[J]. 基因组学与应用生物学,2021,40(S4):3663-3673.
[14] 孙建磊,董玉梅,王崇启,等. 甜瓜VQ家族基因鉴定及白粉病菌响应分析[J]. 核农学报,2020,34(11):2416-2424.
[15] 王东,李志远,周平,等. 普通烟草VQ家族基因的鉴定及表达[J/OL]. 分子植物育种,2021:1-10.(2021-09-14).https://kns.cnki.net/kcms/detail/46.1068.S.20210914.1419.006.html.
[16]李虎滢,魏春茹,孟钰玉,等. 小麦VQ家族全基因组鉴定与表达分析[J]. 分子生物育种,2020,18(2):358-366.
[17]刘嘉鹏,刘萍元,孙雪丽,等. 香蕉含VQ基序蛋白基因MaVQ1的克隆与表达[J]. 应用与环境生物学报,2021,27(4):994-1000.
[18] 胡安妮,张凌云. 青杄PwVQ1基因的克隆与表达[J]. 东北林业大学学报,2018,46(2):6-11.
[19] 侯俊斌. 棉花GhVQ1和GhVQ28基因的分离及抗枯萎病功能分析[D]. 泰安:山东农业大学,2021.
(责编:王 菁)
