基于抗氧化能力的牛血红蛋白的分步酶解工艺参数优化
2023-07-28李紫玉周光宏刘奇菡叶可萍
李紫玉,周光宏,刘奇菡,王 琳,王 珲,张 婷,叶可萍
•农产品加工工程•
基于抗氧化能力的牛血红蛋白的分步酶解工艺参数优化
李紫玉1,周光宏1,刘奇菡1,王 琳1,王 珲2,张 婷3,叶可萍1※
(1. 南京农业大学食品科技学院/国家肉品质量安全控制工程技术研究中心/江苏省肉类生产与加工质量安全控制协同创新中心,南京 210095;2. 新疆华凌农牧科技开发有限公司,乌鲁木齐 831400;3. 新疆农业科学院农产品贮藏加工研究所,乌鲁木齐 830091)
为探究牛血加工利用新技术,提高牛血蛋白资源利用率。该研究采用分步酶解法提取牛血红蛋白的抗氧化肽粗提物,从6种蛋白酶中筛选出最适蛋白酶组合,通过单因素试验优化温度、pH值、料液比、酶添加量和酶解时间,并通过响应面设计进一步优化酶添加量和酶解时间,得到牛血红蛋白抗氧化肽粗提物的最佳酶解工艺。结果表明:牛血红蛋白分步酶解的最佳工艺为:料液比40 g/L,一次酶解:风味蛋白酶添加量3 800 U/g、时间130 min、温度50 ℃、pH值7.5;二次酶解:碱性蛋白酶添加量2 900 U/g、时间60 min、温度40 ℃、pH值9.0。此工艺条件下的牛血红蛋白抗氧化肽粗提物的ABTS自由基清除能力为(333.62±6.29)µmol /g,具有优良的抗氧化活性,可作为食源性抗氧化肽的来源。该研究为牛血等副产物的综合加工利用提供了新思路,同时为食源性抗氧化肽的研发提供理论基础。
蛋白;抗氧化能力;响应面;分步酶解
0 引 言
中国是牛肉生产与消费大国,牛血约占活牛体质量的8%,年产量达50万t左右[1]。牛血中富含多种蛋白质和氨基酸,以及矿物质、维生素活性物质,具有很高的营养价值[2]。然而,牛血的生产研发过程中仍存在加工技术落后、产品附加值低等问题,目前牛血主要用于加工血粉等低值产品,甚至作为废弃物丢弃处理[3-4],造成了极大的资源浪费和环境污染。对中国牛血资源进行合理利用,变废为宝,既可以提高牛血利用价值,又能够缓解中国现存的蛋白资源短缺问题[5-6]。
上世纪以来,国内外对动物血液资源的开发利用研究逐渐加深。郑立红等[7]以猪血为原材料,亚硝酸钠为发色剂,制备半干固体亚硝酸钠血红蛋白,制备工艺简便、产品品质好,具有较高经济价值。SORAPUKDEE等[8]对猪、鸭等动物血液的功能特性进行分析,结果表明血液具有良好的发泡性和稳定性,是天然食品添加剂的潜在来源。此外,相比其他动物和植物源蛋白质,血液价格低廉、蛋白含量丰富,且具有潜在的抗氧化活性[9],是制备抗氧化肽的优质来源[10]。抗氧化肽作为生物活性肽中的一类,可以维持机体内自由基平衡,延缓氧化衰老[11]。但目前从动物血液中酶解制备抗氧化肽的研究以鸡、鸭等家禽血液为主,从牛血中分离抗氧化肽的研究较少。
酶解法是制备抗氧化肽最常用的方法,具有操作简便、条件温和、成本低等优点[12]。但研究表明单一酶解法存在水解不彻底、产物抗氧化活性低等问题[13]。近年来,酶解工艺逐渐向多酶复合酶解或分步酶解的方向发展,利用不同蛋白酶的酶解特性,提高产物水解度和酶解效率,进而提高产物抗氧化活性[14]。同时,分步酶解法不对蛋白酶水解条件做过多要求,减少对蛋白酶种类的限制。CUI等[15]采用碱性蛋白酶和风味蛋白酶分步水解乳蛋白浓缩物,得到的酶解产物抗氧化活性优于单酶水解;吴雷等[16]采用胃蛋白酶和碱性蛋白酶依次分步水解,得到的葡萄籽蛋白抗氧化肽,表现出良好的抗氧化能力。
因此,本研究对牛血进行分步酶解,筛选最适蛋白酶组合,并探究最优酶解工艺参数,为进一步分离纯化食源性抗氧化肽奠定基础,同时为牛血等屠宰副产物的高值化利用提供理论与技术支撑。
1 材料与方法
1.1 材料与仪器
从南京麒灵肉业有限公司采集3头新鲜黄牛血液(2022年1月);碱性蛋白酶(200 U/mg)、中性蛋白酶(14 U/mg)、木瓜蛋白酶(10 U/mg)、胰蛋白酶(250 U/mg)、胃蛋白酶(200 U/mg)、风味蛋白酶(20 U/mg),上海源叶生物科技有限公司;盐酸、氢氧化钠、氯化钠、硼酸(均为分析纯),国药集团化学试剂有限公司;T-AOC测试盒(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐,ABTS),南京建成生物工程研究所。
Avanti J-E落地式高速冷冻离心机,美国Beckman Coulter公司;HH系列数显恒温水浴锅,金坛市科析仪器有限公司;FE20台式pH计,瑞士Mettle Toledo公司;AUY120电子天平,日本SHIMADZU公司;Alpha2-4 LSC plus冷冻干燥机,德国Christ公司;Spark多功能酶标仪,Tecan Austria公司;Kjeltec8200 FOSS全自动凯氏定氮仪,上海瑞玢有限公司。
1.2 试验方法
1.2.1 样品预处理
收集新鲜血液并加入0.5%的柠檬酸钠溶液进行抗凝处理,4 ℃条件下运送至实验室,4 000 g离心15 min(4 ℃),收集下层红细胞,加入5倍体积生理盐水洗涤,离心去除上清,重复洗涤2次,所得牛血红细胞冻存至-20 ℃备用。
1.2.2 一次酶解条件优化
选取碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胃蛋白酶、胰蛋白酶、风味蛋白酶6种蛋白酶,按照图1流程水解牛血红蛋白,参照蛋白酶使用说明书选取酶解温度和pH值条件,参照文献研究结果选取料液比和酶添加量条件[17-18](具体条件见表1),收集水解0、20、40、60、90、120、180、240、300 min后的酶解产物,测定产物水解度和ABTS自由基清除能力,确定一次酶解的最适蛋白酶种类。
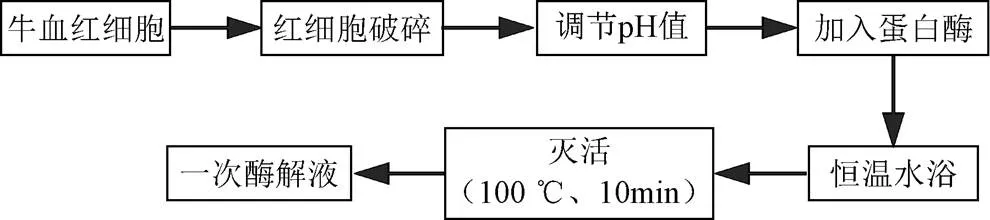
图1 牛血红蛋白一次水解流程图
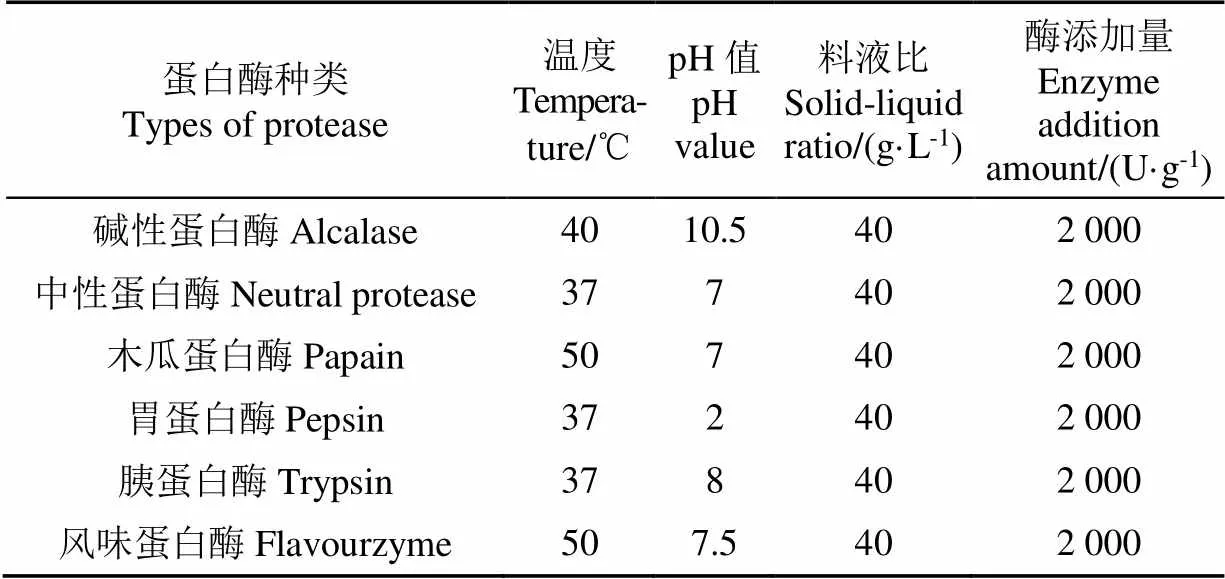
表1 6种蛋白酶的一次水解条件
1.2.3 二次酶解条件优化
选取剩余5种蛋白酶,按照图2流程水解一次酶解产物,参照蛋白酶使用说明书选取温度和pH值条件,参照文献研究结果选取酶添加量条件[18](具体条件见表2),收集水解0、30、60、90、120 min后的酶解产物,测定产物水解度和ABTS清除自由基能力,确定二次酶解的最适蛋白酶种类。

图2 牛血红蛋白二次水解流程图
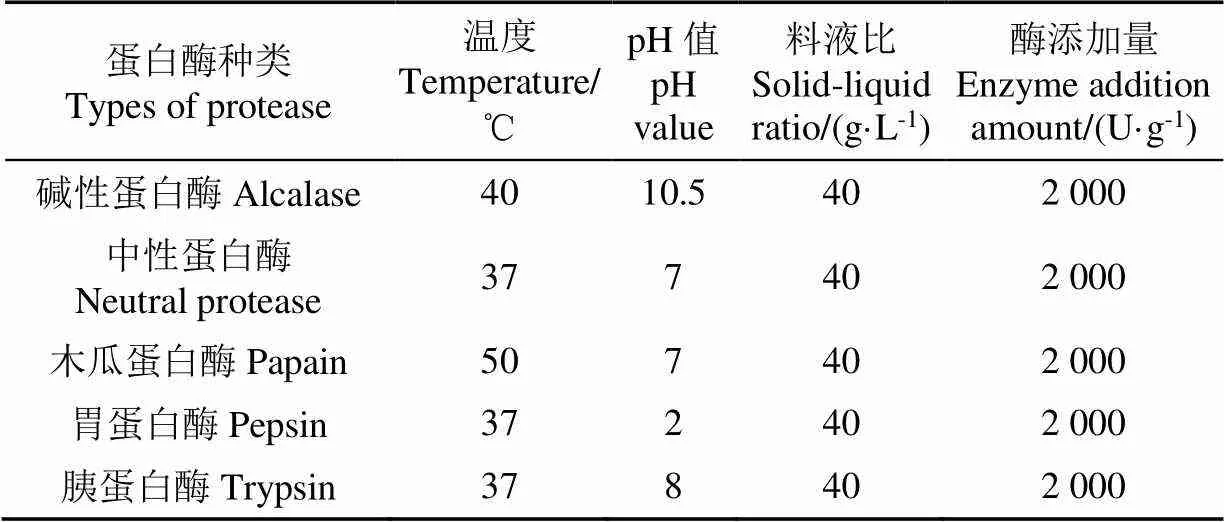
表2 5种蛋白酶的二次水解条件
1.2.4 响应面优化提取工艺
在单因素试验的基础之上,以ABTS自由基清除能力为响应值,选取一次酶添加量()、一次酶解时间()、二次酶添加量()、二次酶解时间()4个因素,进行Box-Behnken 试验设计(表3)。筛选得出牛血红蛋白抗氧化肽粗提物的最优酶解条件,并对其ABTS自由基清除能力进行验证。

表3 响应曲面法因素水平表
1.3 指标测定
1.3.1 ABTS自由基清除能力的测定
参照南京建成T-AOC测试盒(ABTS)说明书,计算样品的ABTS自由基清除能力。
1.3.2 水解度的测定
方法参照GB 5009.5-2016《食品中蛋白质的测定》,采用全自动凯氏定氮仪测定酶解液中的总氮含量。取2 mL牛血酶解液,加入1片消化石和5 mL硫酸进行消化(温度达到420 ℃后消化1 h)。待消化液冷却后置于全自动凯氏定氮仪,经过自动加液、蒸馏、滴定后,记录最终滴定数据。
采用甲醛滴定法测定酶解液中游离氨基的含量[19]。5倍体积稀释酶解液后,取1 mL稀释后样品加入20 mL蒸馏水中,开动磁力搅拌器并将电极轻放于溶液中,用0.01 mol/L的NaOH标准溶液滴定至pH值为8.2。加入5 mL已中和的甲醛溶液,继续用0.01 mol/L的NaOH溶液滴定至pH值为9.2,记录消耗的NaOH溶液体积为1。同时取蒸馏水代替酶解液做空白试验,记录消耗的NaOH溶液体积为2。计算酶解液中游离氨基的含量和水解度。游离氨基的含量计算公式如下:

式中为样品中游离氨基的浓度,μmol/mL;为NaOH标准液的浓度,mol/L;为酶解液的取用量,mL;5为酶解液稀释倍数。
水解度的计算公式为
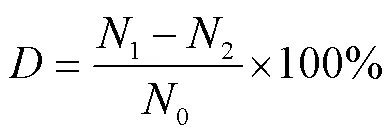
式中为样品水解度,%;1为甲醛法测定的酶解液中游离氨基的含量,µmol/mL;2为甲醛法测定的水解前的样品溶液中游离氨基的含量,µmol/mL;0为凯氏定氮法测定的水解前的样品溶液中的总氮含量,µmol/mL。
1.4 数据统计与分析
采用SAS 8.1软件进行单因素方差分析(One-Way ANOVA),采用Duncan’s multiple-range test 进行多重比较,显著性水平< 0.05 表示有显著差异。试验重复3次,试验结果表示为平均值±标准差。采用Design-Expert 8.0.6软件进行响应曲面设计。采用graphpad prism 8.0.2进行数据图绘制。
2 结果与分析
水解度是指蛋白质水解过程中肽键断裂数占蛋白质总肽键数的比例,是衡量蛋白质水解与肽段生成情况的重要参考指标[20]。ABTS自由基清除能力的测定原理是ABTS在氧化剂作用下生成绿色的ABTS+,而当抗氧化物存在时ABTS+生成受到抑制,通过测定反应物的吸光度即可计算得出样品的抗氧化能力[21]。本研究以水解度和ABTS自由基清除能力为参考指标,对牛血红蛋白的酶解效果及抗氧化能力进行综合评价。
2.1 一次酶解蛋白酶筛选
不同蛋白酶分别在其最适条件下对牛血红蛋白进行酶解反应,结果如表4所示,随着水解时间延长,6种蛋白酶的酶解产物水解度和ABTS自由基清除能力呈现逐渐上升趋势,至酶解20min起,风味蛋白酶组的抗氧化活性均显著高于其他组(< 0.05)。因此,后续试验选取风味蛋白酶对牛血红蛋白进行一次酶解。

表4 6种蛋白酶对牛血红蛋白一次酶解产物抗氧化效果的影响
注:不同小写字母表示相同时间下不同蛋白酶之间差异显著,不同大写字母表示相同蛋白酶不同时间之间差异显著(< 0.05)。
Note: Different lowercase letters indicate significant differences between different proteases at the same time, and different uppercase letters indicate significant differences between the same proteases at different times (< 0.05).
2.2 一次酶解单因素试验
温度、pH值、料液比、酶添加量以及时间等条件的变化,均会对牛血红蛋白酶解产物的水解度及抗氧化能力造成显著影响,通过单因素试验优化酶解条件,是提高酶解产物抗氧化能力的前提。一次酶解的单因素试验结果如图3所示,随着酶解温度升高,牛血红蛋白酶解产物的水解度及ABTS自由基清除能力呈现先升高后下降的趋势,在温度50 ℃时达到最大值,分别为37.16%±0.25%和(163.99±2.38)µmol/g(图3a)。如图3b所示,pH值对酶解产物抗氧化能力的影响如温度相似,也呈现由增到减的趋势。料液比对牛血红蛋白酶解产物的影响如图3c所示,随着料液比的增加,水解度及ABTS自由基清除能力呈先升高后降低,在料液比达到40 g/L时酶解产物抗氧化能力最强。酶添加量对酶解产物抗氧化活性的影响如图3d所示,随着酶添加量的升高,水解度及ABTS自由基清除能力呈先上升后趋于平缓的趋势,当酶添加量大于4 000 U/g后,牛血红蛋白酶解产物的ABTS自由基清除能力不再显著升高(> 0.05),故选择酶添加量4 000 U/g作为最优条件。此外,随着酶解时间延长,酶解产物抗氧化活性与酶添加量试验结果趋势一致,当酶解时间大于120 min时,ABTS自由基清除能力不再显著升高(> 0.05)(图 3e)。综合以上结果,确定牛血红蛋白一次酶解的最佳工艺条件为:温度50 ℃、pH值7.5、料液比40 g/L、酶添加量4 000 U/g、酶解时间120 min。
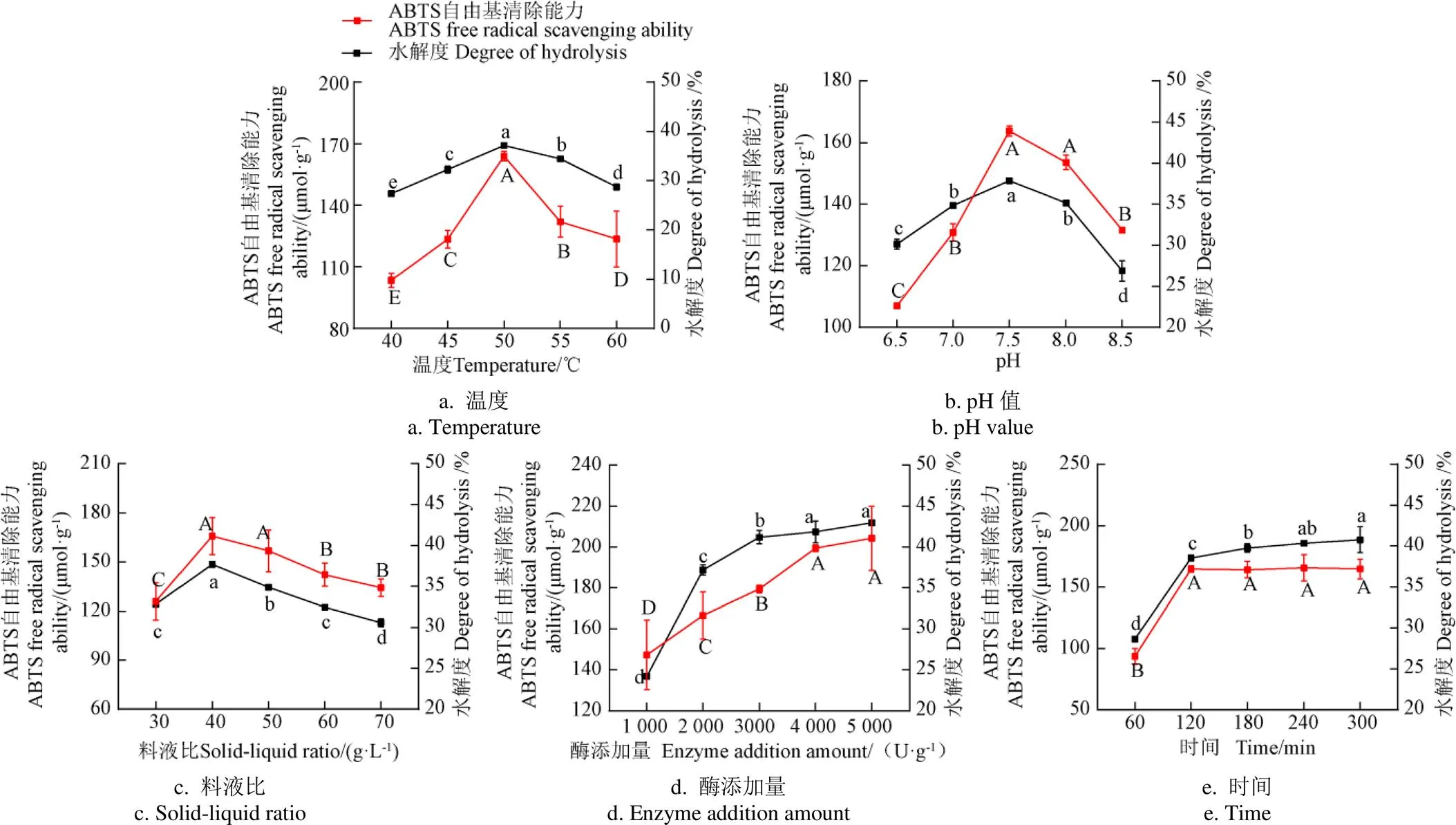
注:固定酶解条件为:温度50 ℃、pH值7.5、料液比40 g·L-1、酶添加量2 000 U·g-1、酶解时间120 min。探究温度(40、45、50、55、60 ℃)、pH值(6.5、7.0、7.5、8.0、8.5)、料液比(30、40、50、60、70 g·L-1)、酶添加量(1 000、2 000、3 000、4 000、5 000 U·g-1)和酶解时间(60、120、180、240、300 min)对一次酶解产物的ABTS自由基清除能力和水解度的影响。不同大写字母代表ABTS自由基清除能力差异显著,不同小写字母代表水解度差异显著(P < 0.05)。
2.3 二次酶解蛋白酶筛选
利用牛血红蛋白一次酶解产物,进一步通过二次酶解提高产物的抗氧化活性,试验结果如表5所示,二次酶解过程中,碱性蛋白酶处理组的水解度和ABTS自由基清除能力随着酶解时间的延长呈先升高后下降的趋势,在酶解时间为60 min时达到最高值,显著高于其他蛋白酶组(< 0.05),因此,选取碱性蛋白酶作为二次酶解的最佳蛋白酶。
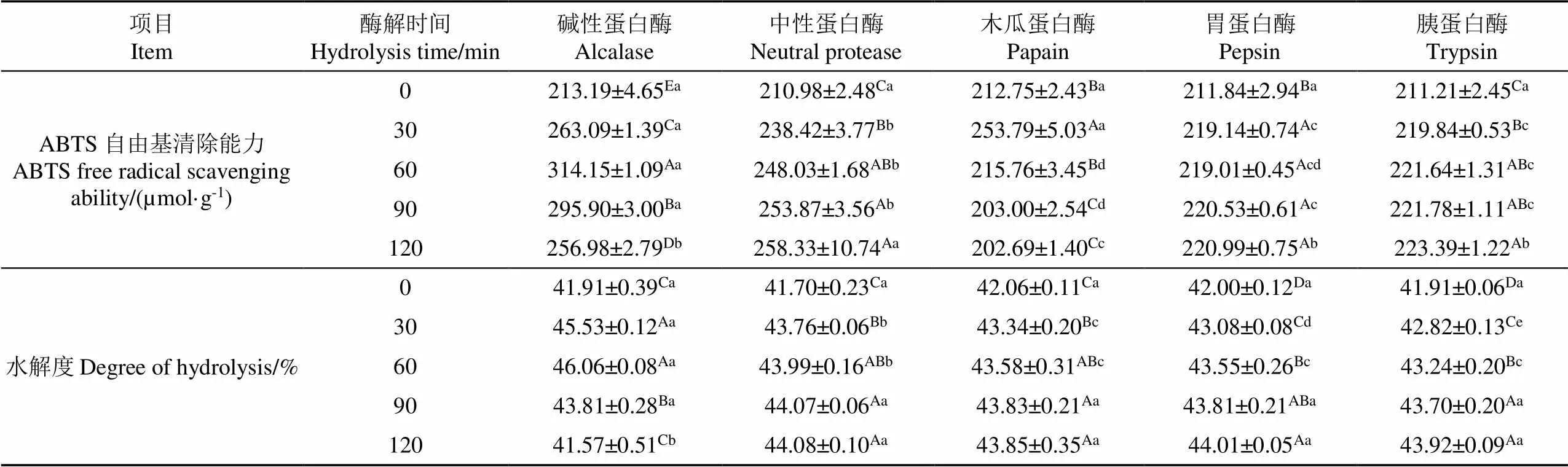
表5 5种蛋白酶对牛血红蛋白二次酶解产物抗氧化效果的影响
注:不同小写字母表示相同时间下不同蛋白酶之间差异显著,不同大写字母表示相同蛋白酶不同时间之间差异显著(< 0.05)。
Note: Different lowercase letters indicate significant differences between different proteases at the same time, and different uppercase letters indicate significant differences between the same proteases at different times (< 0.05).
2.4 二次酶解单因素试验
牛血红蛋白二次酶解的单因素试验结果如图4所示。随着酶解温度的升高,二次酶解产物的水解度及ABTS自由基清除能力呈先增后减的趋势,在温度40 ℃时达到最高值(图4a)。pH值对牛血红蛋白二次酶解产物的影响如图4b所示,随着pH值的增加水解度及ABTS自由基清除能力呈先升高后降低,在pH值为9.0时,酶解产物的抗氧化能力达到最高值,此后,酶解产物的抗氧化能力逐渐下降,在pH值为10.0时,其水解度达到最高值。这是由于酶解反应过程中pH值的变化会直接影响蛋白酶和底物的解离,进而影响酶解产物的肽段生成情况与抗氧化活性[22]。如图4c所示,酶添加量对酶解产物抗氧化活性的影响与pH相似,呈先增后减的趋势,酶添加量为3 000 U/g时,ABTS自由基清除能力达到最高值为(319.69±1.92)µmol/g。此外随着酶解时间的延长,产物的抗氧化能力先升高后降低,且在60 min时达到最高值(图4d)。综合以上结果,确定牛血红蛋白的二次酶解最佳工艺条件为:温度40 ℃、pH值9.0、酶添加量3 000 U/g、酶解时间60 min。
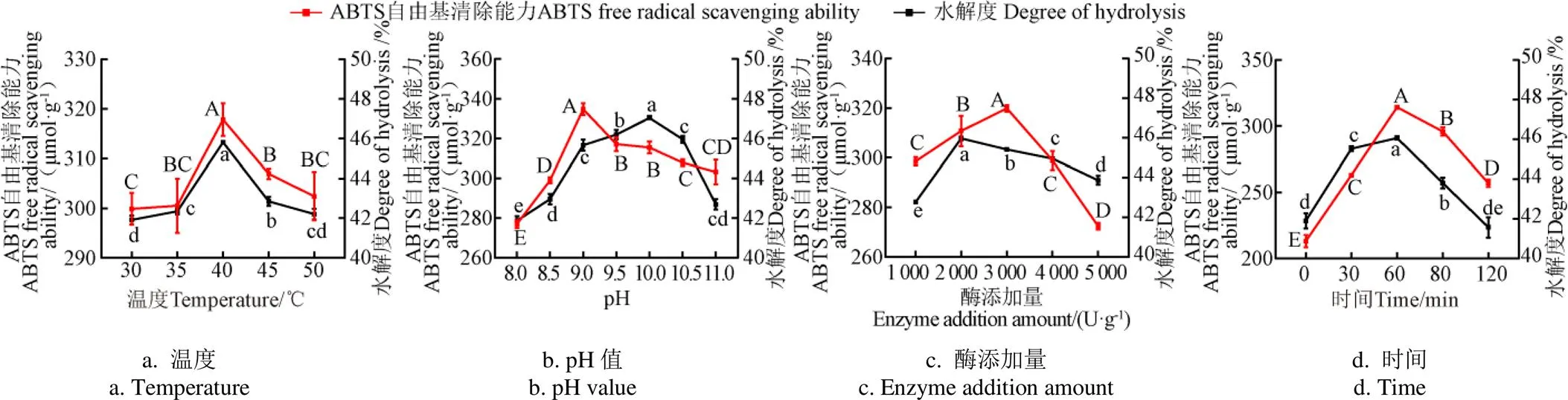
注:固定酶解条件为:40 ℃、pH值10.5、酶添加量2 000 U·g-1、时间60 min。探究温度(30、35、40、45、50 ℃)、pH值(8.0、8.5、9.0、9.5、10.0、10.5、11.0)、酶添加量(1 000、2 000、3 000、4 000、5 000 U·g-1)和酶解时间(0、30、60、90、120 min)对二次酶解产物的ABTS自由基清除能力和水解度的影响。不同大写字母代表ABTS自由基清除能力差异显著,不同小写字母代表水解度差异显著(P < 0.05)。
2.5 响应面优化提取试验
在单因素试验的基础之上,选取一次酶添加量()、一次酶解时间()、二次酶添加量()、二次酶解时间()四个因素为自变量,以ABTS自由基清除能力作为响应值,根据Box-Behnken试验设计的原理进行响应面优化试验,结果如表6、表7和图5所示。牛血红蛋白酶解产物的ABTS自由基清除能力回归模型方程为
=328.96-22.681+20.921-12.621+5.531-
2.9811-22.6311-17.4411+11.7811-
25.0311-22.6111-49.2612-46.4512-
26.5012-44.6712(3)
回归模型具有极显著性差异(< 0.000 1),失拟项=0.387 6 > 0.05(不显著),该模型较为可靠,可用于预测最优酶解条件。
经过响应面优化结果分析,得到分步酶解牛血红蛋白的最佳条件为:一次酶添加量3 780.57 U/g、一次酶解时间131.48 min、二次酶添加量2 860.22 U/g、二次酶解时间62.61 min,ABTS自由基清除能力的预测值为334.65 µmol/g。考虑到实际可操作性,将酶解条件优化为:一次酶添加量3 800 U/g、一次酶解时间130 min、二次酶添加量2 900 U/g、二次酶解时间60 min,并进行验证试验,测得产物ABTS自由基清除能力为(333.62±6.29)µmol/g,相对误差小于1%,说明得到的拟合优化条件可靠。
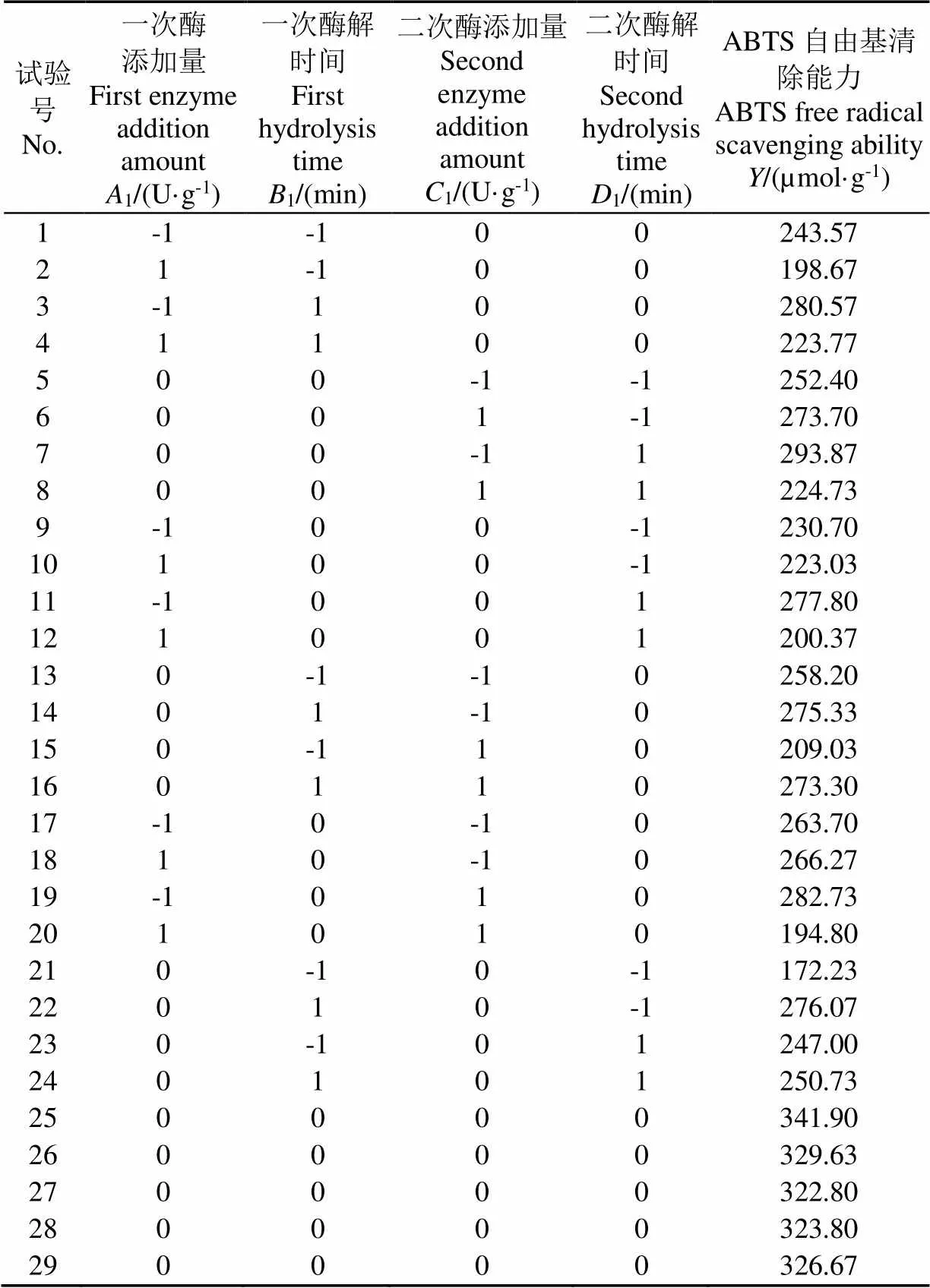
表6 Box-Behnken 试验设计方案及结果

表7 回归模型方差分析及回归方程系数显著性检验
注:*表示差异显著(< 0.05);**表示差异极显著(< 0.01)。
Note: * indicates significance at 0.05 level; ** indicates significance at 0.01 level.

图5 各因素交互作用的曲面图和等高线图
3 讨 论
随着畜牧业的迅猛发展,血液等屠宰加工副产物产量大幅增加,对其进行高值化加工利用,既可有效提高经济效益,减少资源浪费,又可防止环境污染,实现产业的可持续健康发展[23]。本研究通过分步酶解法制备牛血抗氧化肽粗提物,制备工艺简便且易于实现大规模生产,将其用于食品、制药等工业领域,既可实现牛血的高值化利用,又将极大程度上满足目前日益增长的对功能性产品的需求。
研究表明,动物血液中含有超氧化物歧化酶、过氧化氢酶等多种生物酶,抗氧化能力较强,因此可作为提取抗氧化肽的优质蛋白源[24]。王爽等[25]研究表明驴血经过木瓜蛋白酶酶解后得到的酶解产物,具有良好的DPPH自由基清除能力。ZHAN等[26]采用碱性蛋白酶水解猪血浆得到抗氧化肽粗提物,其对ABTS自由基的清除率达93.24%±0.86%。本研究中牛血酶解产物的ABTS自由基清除能力为(333.623±6.29)µmol/g,高于郑锦晓等[27]制备的金华火腿抗氧化肽(285.39±6.04)µmol/g,表现出较强的抗氧化能力。这是由于相比其他蛋白,在血液中多种活性物质的影响下,血液酶解产物具有更强的抗氧化能力[28]。
酶解法是改变蛋白质组成及结构、实现蛋白质的功能多元化、提高其利用价值的有效途径之一[29]。其中通过蛋白酶解工艺获得具有强抗氧化能力的酶解产物,成为近年来国内外广泛研究的重点。在本研究过程中,采用风味-碱性蛋白酶组合分步水解牛血,酶解产物的水解度及ABTS自由基清除能力最强。周亚迪等[30]采用风味-碱性蛋白酶水解制备得到的猪血浆酶解产物,表现出良好的抗氧化活性,与本研究研究结果一致。这是由于在蛋白酶作用下,蛋白质的空间结构发生改变,相互作用力减弱,肽键发生断裂,生成具有不同氨基酸组成及功能活性的肽链[31-32]。此外,肽段的抗氧化活性受到蛋白酶种类、分子量及氨基酸组成等多种因素的影响。本研究所采用的风味蛋白酶是一种由肽酶和真菌蛋白酶组成的复合体,同时具有内切和外切蛋白酶两种活性,可以作用于蛋白酶的多个酶切位点,提高产物水解度[33]。碱性蛋白酶是一种内切酶,其特异性作用位点广泛,可对酶解产物中的小分子蛋白进一步水解,提高产物的水解度及抗氧化能力[34]。在双酶相互作用下,牛血红蛋白释放出具有抗氧化活性的肽段,并暴露出更多的芳香族氨基酸和疏水氨基酸,使得产物抗氧化能力进一步提高[35]。
4 结 论
本研究确定牛红细胞分步酶解最佳组合为风味-碱性蛋白酶,并得到最佳工艺条件为:料液比40 g/L,一次酶解:风味蛋白酶添加量3 800 U/g、时间130 min、温度50 ℃、pH值7.5;二次酶解:碱性蛋白酶添加量2 900 U/g、时间60 min、温度40 ℃、pH值9.0。经验证,此研究工艺下制备的牛血红蛋白抗氧化肽粗提物对ABTS自由基的清除能力为(333.623±6.29)µmol/g,具有较强的抗氧化活性,可用于进一步分离纯化抗氧化肽。该研究为牛血等蛋白资源的开发利用和精深加工提供了技术参考,同时为开发食源性抗氧化肽奠定理论基础。
[1] 王文婷,侯成立,宋璇,等. 动物血浆蛋白水解物功能及应用研究进展[J]. 食品科学,2017,38(7):309-314. WANG Wenting, HOU Chengli, SONG Xuan, et al. Progress in functional properties and applications of animal plasma protein hydrolysates[J]. Food Science, 2017, 38(7): 309-314. (in Chinese with English abstract)
[2] 陈宇星,郑玉才,谈永萍,等. 牦牛血发酵的最佳菌种组合及最优发酵条件探究[J]. 中国饲料,2019(11):81-85. CHEN Yuxing, ZHENG Yucai, TAN Yongping, et al. Explore the optimum strain combination and fermentation conditions of yak blood fermentation[J]. China Feed, 2019(11): 81-85. (in Chinese with English abstract)
[3] 应晓彩,刘磊,裴志花,等. 动物血源抗菌肽的研究进展及应用[J]. 动物医学进展,2020,41(9):111-114. YING Xiaocai, LIU Lei, PEI Zhihua, et al. Progress and application of animal blood-derived antibcaterial peptides[J]. Progress in Veterinary Medicin, 2020, 41(9): 111-114. (in Chinese with English abstract)
[4] LEE S J, KIM Y S, HWANG J W, et al. Purification and characterization of a novel antioxidative peptide from duck skin by-products that protects liver against oxidative damage[J]. Food Research International, 2012, 49(1): 285-295.
[5] 张露娟. 畜禽血液在食品工业中的应用[J]. 农产品加工,2019,480(10):58-62. ZHANG Lujuan. The application of livestock and poultry blood in food industry[J]. Farm Products Processing, 2019, 480(10): 58-62. (in Chinese with English abstract)
[6] 闫文杰,李兴民. 动物血液主要功能成分制备及应用研究进展[J]. 食品研究与开发,2018,39(16):215-219. YAN Wenjie, LI Xingmin. Progress in preparation and application of main functional components from animal blood[J]. Food Research and Development, 2018, 39(16): 215-219. (in Chinese with English abstract)
[7] 郑立红,肖月娟,李凤英,等. 猪血亚硝基血红蛋白半干固体色素制备工艺[J]. 农业工程学报,2009,25(1):276-280. ZHENG Lihong, XIAO Yuejuan, LI Fengying, et al. Technology for preparation of semidry solid nitrosohemoglobin from pig blood[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2009, 25(1): 276-280. (in Chinese with English abstract)
[8] SORAPUKDEE S, NARUNATSOPANON S. Comparative Study on compositions and functional properties of porcine, chicken and duck blood[J]. Korean Journal for Food Science of Animal Resources, 2017, 37(2): 228-241.
[9] 郑召君,张日俊. 酶解鸡血球制备抗氧化肽的工艺优化和分析鉴定[J]. 食品科学,2018,39(22):71-79. ZHENG Zhaojun, ZHANG Rijun. Optimized preparation, characterization and identification of antioxidative peptide derived from chicken blood corpuscle proteins by enzymatic hydrolysis[J]. Food Science, 2018, 39(22): 71-79. (in Chinese with English abstract)
[10] LI G S, ZHAN J Q, HU L P, et al. Identification of a new antioxidant peptide from porcine plasma by in vitro digestion and its cytoprotective effect on H2O2induced HepG2 model[J]. Journal of Functional Foods, 2021, 86.
[11] 徐磊,王清爽,高珊,等. 菌酶协同处理提高脱脂薏米水提取液营养价值[J]. 农业工程学报,2020,36(12):303-309. XU Lei, WANG Qingshuang, GAO Shan, et al. Improving nutrition value of the defatted adlay water extract by using fermentation with enzyme[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(12): 303-309. (in Chinese with English abstract)
[12] 熊喆,赵钰,秦子波,等. 超声辅助酶解促进草鱼鳞胶原肽水解进程的内在机制解析[J]. 农业工程学报,2022,38(16):313-321. XIONG Zhe, ZHAO Yu, QIN Zibo, et al. Analysis of the internal mechanism for ultrasound-assisted enzymatic hydrolysis for promoting the hydrolysis of grass carp scale collagen peptide[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(16): 313-321. (in Chinese with English abstract)
[13] 马小刚,陆健康,阿丽耶·图尔荪,等. 杏仁蛋白肽功能活性及质量安全控制研究进展[J]. 食品安全质量检测学报,2022,13(3):710-718. MA Xiaogang, LU Jiankang, ALIYE Tuersun, et al. Research progress on functional activity and quality safety control of almond protein peptides[J]. Journal of Food Safety & Quality, 2022, 13(3): 710-718. (in Chinese with English abstract)
[14] 张宇昊,王强,周素梅,等. 分步酶解制备花生短肽的研究[J]. 农业工程学报,2008,128(5):275-279. ZHANG Yuhao, WANG Qiang, ZHOU Sumei, et al. Preparation of peanut functional oligopeptides by two-step-hydrolysis[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2008, 128(5): 275-279. (in Chinese with English abstract)
[15] CUI Q, SUN Y X, CHENG J J, et al. Effect of two-step enzymatic hydrolysis on the antioxidant properties and proteomics of hydrolysates of milk protein concentrate[J]. Food Chemistry, 2022, 366: 1-9.
[16] 吴雷,贡湘磊. 葡萄籽蛋白的提取及其酶解液抗氧化活性研究[J]. 美食研究,2021,38(2):93-98. WU Lei, GONG Xianglei. Optimization of extraction condition of grape seed protein by response surface methodology and antioxidant activities of enzymatic hydrolysates[J]. Journal of Researches on Dietetic Science and Culture, 2021, 38(2): 93-98. (in Chinese with English abstract)
[17] 刘皓涵,钟迪颖,张润光,等. 欧李多酚提取纯化及抗氧化性研究[J]. 农业工程学报,2020,36(22):324-332. LIU Haohan, ZHONG Diying, ZHANG Runguang, et al. Extraction and purification of polyphenols and determination of antioxidant activity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(22): 324-332. (in Chinese with English abstract)
[18] 田怀香,陈霜,陈小燕,等. 不同提取方式对萱草花中酚类物质及抗氧化活性的影响[J]. 农业工程学报,2021,37(20):303-312. TIAN Huaixiang, CHEN Shuang, CHEN Xiaoyan, et al. Effects of different extraction methods on phenolic compounds and antioxidant activity in Hemerocallis flower[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(20): 303-312. (in Chinese with English abstract)
[19] 徐兆刚. 河蚌抗氧化肽的制备及其特性研究[D]. 长春:吉林大学,2016. XU Zhaogang. Research on the Preparation and Properties of Antioxidant Peptides from Mussel[D]. Changchun: Jilin University, 2016. (in Chinese with English abstract)
[20] 杜梦珂. 富硒碱性茶蛋白ACE抑制肽的制备、分离纯化及结构鉴定[D]. 上海:上海师范大学,2018. DU Mengke. Study on the Preparation, Purification and Identification of ACE Inhibitory Activity Peptides from Se-enriched Tea Protein[D]. Shanghai: Shanghai Normal University, 2018. (in Chinese with English abstract)
[21] 李媛媛,陈玮鑫,曾珺,等. let-7d-5p介导姜黄素的抗氧化作用[J]. 中国食品学报,2021,21(6):19-25. LI Yuanyuan, Chen Weixin, Zeng Jun, et al. let-7d-5p mediated antioxidant activity of curcumin[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(6): 19-25. (in Chinese with English abstract)
[22] 颜阿娜,陈声漾,陈旭,等. 一种新型抗氧化五肽的纯化、鉴定与表征[J]. 食品科学,2019,40(10):43-49. YAN Ana, CHEN Shengyang, CHEN Xu, et al. Purification, Identification and Characterization of a Novel Antioxidant Pentapeptide[J]. Food Science, 2019, 40(10): 43-49. (in Chinese with English abstract)
[23] 潘风光,李洪山,刘静波,等. 超声预处理微波辅助酶解生产猪血活性肽工艺优化[J]. 农业工程学报,2011,27(增刊2):282-287. PAN Fengguang, LI Hongshan, LIU Jingbo, et al. Bioactive peptides produced from ultrasonic-pretreated swine blood by microwave-assisted hydrolyzation[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(Supp.2): 282-287. (in Chinese with English abstract)
[24] 刘冬,丁兆忠,吴忠良,等. 日粮中添加菌糠对奶牛产奶量、乳品质、血液生化指标及抗氧化功能的影响[J]. 饲料研究,2021,44(4):7-10. LIU Dong, DING Zhaozhong, WU Zhongliang, et al. Effect of adding bacterium residue in diets on milk production, milk quality, blood biochemical indexes and antioxidant function of dairy cows[J]. Feed Research, 2021, 44(4): 7-10. (in Chinese with English abstract)
[25] 王爽,刘雪松,江波涛. 驴血蛋白酶解制备抗氧化肽工艺优化[J]. 生物学杂志,2023,40(02):109-114. WANG Shuang, LIU Xuesong, JIANG Botao. Optimization of enzymatic hydrolysis on donkey blood to prepare antioxidant peptides[J]. Journal of Biology, 2023, 40(02): 109-114. (in Chinese with English abstract)
[26] ZHAN J Q, LI G S, DANG Y L, et al. Purification and identification of a novel hypotensive and antioxidant peptide from porcine plasma[J]. Journal of the Science of Food and Agriculture, 2022, 102(11): 4933-4941.
[27] 郑锦晓,邢路娟,周光宏,等. 三种中国传统干腌火腿中粗多肽的抗氧化与抑菌活性的比较[J]. 食品工业科技,2018,39(16):75-79,86. ZHENG Jinxiao, XING Lujuan, ZHOU Guanghong, et al. Antioxidant and antibacterial abilities of crude peptides extracted from the three chinese traditional Dry-Cured Hams[J]. Science and Technology of Food Industry, 2018, 39(16): 75-79, 86. (in Chinese with English abstract)
[28] 吴立国. 羊血浆蛋白肽抗氧化功能评价与应用[D]. 北京:中国农业科学院,2018. WU Liguo. Evaluation of Antioxidant Function and Application of Sheep Plasma Peptide[D]. Beijing: Chinese Academy of Agricultural Sciences, 2018. (in Chinese with English abstract)
[29] 王佳蓉,丁阳月,姜云庆,等. 酶法修饰对大豆分离蛋白凝胶性质影响的研究进展[J]. 食品科学,2021,42(15):329-336. WANG Jiarong, DING Yangyue, JIANG Yunqing, et al. Progress in understanding the effect of enzymatic modification on gel properties of soy protein isolate[J]. Food Science, 2021, 42(15): 329-336. (in Chinese with English abstract)
[30] 周亚迪,汪之颖,姚旻晶,等. 具有抗氧化活性的猪血浆蛋白酶解产物的制备及理化特性[J]. 中国农业大学学报,2014,19(2):150-155. ZHOU Yadi, WANG Zhiying, YAO Minjing, et al. Preparation and physiochemical properties of protein hydrolysates with an antioxidant activity from plasma protein[J]. Journal of China Agricultural University, 2014, 19(2): 150-155. (in Chinese with English abstract)
[31] 孙雪,赵晓燕,朱运平,等. 酶解大豆分离蛋白的功能性及应用研究进展[J]. 粮食与油脂,2021,34(9):14-17. SUN Xue, ZHAO Xiaoyan, ZHU Yunping, et al. Research progress on function and application of enzymatic hydrolysis of soy protein isolate[J]. Cereals & Oils, 2021, 34(9): 14-17. (in Chinese with English abstract)
[32] 郑环宇,赵晓明,张梦,等. 不同酶切方式引发大豆蛋白构象变化及功能特性评价[J]. 中国粮油学报,2022,37(6):103-111. ZHENG Huanyu, ZHAO Xiaoming, ZHANG Meng, et al. Evaluation on changes and functional properties of soy protein conformation due to different enzymolysis methods[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(6): 103-111. (in Chinese with English abstract)
[33] 包美丽,杨添植,张立钢,等. 双酶法制备马鹿茸降血糖肽工艺优化及其对-葡萄糖苷酶的抑制效果[J]. 食品科学,2017,38(6):88-95. BAO Meili, YANG Tianzhi, ZHANG Ligang, et al. Optimization of preparation of hypoglycemic peptides from red deer () antlers by two-step enzymatic hydrolysis and their-Glucosidase inhibitory activity[J]. Food Science, 2017, 38(6): 88-95. (in Chinese with English abstract)
[34] 张文敏,张健,周浩纯,等. 亚麻籽粕制备小分子抗氧化活性肽[J]. 食品科学,2020,41(8):36-44. ZHANG Wenmin, ZHANG Jian, ZHOU Haochun, et al. Preparation of small molecular antioxidant peptides from flaxseed meal[J]. Food Science, 2020, 41(8): 36-44.
[35] ZHI T X, LI X Y, SADIQ F A, et al. Novel antioxidant peptides from protein hydrolysates of scallop (Argopecten irradians) mantle using enzymatic and microbial methods: Preparation, purification, identification and characterization[J]. LWT, 2022, 164. (in Chinese with English abstract)
Optimization of the process parameters for the two-step-hydrolysis of bovine hemoglobin based on the antioxidant capacity
LI Ziyu1, ZHOU Guanghong1, LIU Qihan1, WANG Lin1, WANG Hui2, ZHANG Ting3, YE Keping1※
(1.,,,210095,; 2..,.,831400,; 3.,,830091,)
Bovine blood is one of the main by-products of bovine slaughtering and processing. The preparation and antioxidant activity of bovine blood peptides has been investigated systematically to promote their high-end value in industrial utilization. Taking the bovine hemoglobin (BH) as the raw material, this study aims to prepare the BH antioxidant peptide crude product using two-step hydrolysis. The reference indexes were taken as the hydrolysis degree and the ABTS·free radical scavenging ability. Six proteases were also employed for the hydrolysis to identify and select the optimal protease. Specifically, a systematic evaluation was made to investigate the effect of different solid-liquid ratios, enzyme concentration, reaction temperature, pH value, and reaction time on the initial hydrolysate, including antioxidant activity using ABTS·free radical scavenging. The remaining five proteases were used to further hydrolyze the first BH hydrolysate, where the optimal protease was selected for the single-factor test. Furthermore, the influencing parameters were assessed during enzymolysis on the antioxidant capacity of the bovine hemoglobin second hydrolysate. The results showed that: 1) The best effect was found in the first enzymatic hydrolysis of flavorzyme among the six proteases. The highest hydrolysis degree and the ABTS·scavenging ability were also observed in the first BH hydrolysate (<0.05); 2) The BH was hydrolyzed at pH value is 7.5 and 50 ℃ for 120 min, when the solid-liquid ratio and flavorzyme content were 40 g/L and 4 000 U/g, respectively, indicating the highest antioxidant capacity of the first hydrolysate; 3) The alcalase demonstrated the best second enzymatic hydrolysis effect; 4) The BH first hydrolysate was hydrolyzed (pH values are 9.0; 40 ℃; 60 min), when the concentration of alcalase was 3 000 U/g. While the hydrolysis degree (46.06%±0.08%) and ABTS free radical scavenging ability (314.15±1.09) µmol TE/g protein) of the second hydrolysate were significantly higher than other protease groups (<0.05). The single-factor test show that the enzyme concentration and reaction time were further optimized using the response surface method (RSM), with the ABTS free radical scavenging ability as the response value. Furthermore, the regression equation was obtained after RSM optimization, indicating the enzyme concentration and reaction time on the antioxidant capacity of the BH hydrolysate. The optimal parameters were achieved to prepare the BH antioxidant peptide crude product with the solid-liquid ratio of 40 g/L. The first enzymatic hydrolysis included: Amount of flavorzyme is 3 800 U/g, enzymatic hydrolysis time is 130 min, temperature is 50 ℃, and pH value is 7.5, while the second enzymatic hydrolysis process included: Amount of alcalase is 2 900 U/g, time is 60 min, temperature is 40℃, and pH value is 9.0. The ABTS free radical scavenging ability was achieved at (333.62±6.29) µmol TE/g protein, indicating excellent scavenging capacity and antioxidant activity. A systemic and effective procedure was obtained to extract the food-derived antioxidant peptides. The finding can provide new insight into the comprehensive processing and utilization of by-products, not limited to the bovine blood. A theoretical basis was also offered for the research and development of food-derived antioxidant peptides.
protein; antioxidant capacity; response surface; two-step-hydrolysis
2022-12-12
2023-04-08
新疆维吾尔自治区科技计划项目(2021A02003-4)
李紫玉,研究方向为肉品加工与质量控制。Email:2549305697@qq.com
叶可萍,博士,教授,研究方向为肉品加工与质量控制。Email:yekeping.arc@163.com
10.11975/j.issn.1002-6819.202212086
S21;TS251.93
A
1002-6819(2023)-08-0259-09
李紫玉,周光宏,刘奇菡,等. 基于抗氧化能力的牛血红蛋白的分步酶解工艺参数优化[J]. 农业工程学报,2023,39(8):259-267. doi:10.11975/j.issn.1002-6819.202212086 http://www.tcsae.org
LI Ziyu, ZHOU Guanghong, LIU Qihan, et al. Optimization of the process parameters for the two-step-hydrolysis of bovine hemoglobin based on the antioxidant capacity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2023, 39(8): 259-267. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.202212086 http://www.tcsae.org
