海藻糖及保存设备对猪全血冷藏品质的影响
2023-07-28万康陶乐仁沈钉
万康 陶乐仁 沈钉

摘 要:血液的长期保存有着重要的应用价值和理论意义。以猪全血为研究对象,将其保存于含不同浓度(0.05、0.25和0.50 mol ·L?1)海藻糖的血液保存液Ⅲ(CPDA)和不同保存设备中,并对猪全血的保存品质进行了评价。保存期间,每4天测量1次血液的 pH、红细胞总数(RBC)、平均红细胞血红蛋白含量(MCH)、红细胞比容(HCT)、平均红细胞体积(MCV)、白细胞总数(WBC)、游离血红蛋白(FHb)、溶血率。结果表明,0.05 mol ·L?1海藻糖延缓了红细胞、白细胞的凋亡速度以及红细胞的形变速度,降低了血液的溶血速度,使血液得到了更好的保存,海藻糖浓度过高反而会对血液的保存产生不利的影响。此外,与冰箱相比,恒温槽中的温度更为稳定,使得血液的保存效果明显提升。
关键词:猪全血;红细胞;海藻糖;保存设备
中图分类号: R446.11 文献标志码: A
Effect of trehalose and preservation equipment on storage quality of porcine whole blood
WAN Kang,TAO Leren ,SHEN Ding
(School of Health Science and Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Abstract:Long-term preservation of blood has important application value and theoretical significance. The influence of trehalose concentration (0.05, 0.25 and 0.5 mol ·L?1) in blood preservation solution III (CPDA) and preservation equipment on storage quality of porcine whole blood was evaluated. pH, total red blood cells(RBC), average red blood cell hemoglobin content (MCH), hematocrit (HCT), average red blood cell volume (MCV), total white blood cells (WBC), free hemoglobin (FHb) and hemolysis rate of porcine blood were determined every 4 days in its preservation process. Results show that at the trehalose concentration of 0.05 mol ·L?1, both the apoptosis rate of RBC and WBC and the deformation rate of RBC are delayed, and the hemolysis rate of blood reduces, which results in better preservation of blood. High concentration of trehalose has an adverse impact on the preservation of blood. In addition, compared with the refrigerator, the temperature in the thermostatic bath maintains more stably, which significantly improves thepreservation of blood.
Keywords:porcine whole blood; red blood cell; trehalose; preservation equipment
全血保存在过去是保存血制品的一种常见方式,近年来又重新引起了医学界的重视[1–2]。血液离体后保存于不同条件下,其血细胞的生化状况、形态等均会出现不同程度的变化,在衰老的过程中血细胞会出现不可逆的改变,从而导致血液保存失败。
海藻糖是一种人体细胞间优化沟通所需要的己糖脱氧糖,广泛存在于人体中,具有软化血管、调节血压的作用。此外,海藻糖还具有极高的稳定性,在各种恶劣环境下依然可以对生物膜、蛋白质等生物大分子发挥良好的保护作用[3]。研究[4–5]发现,海藻糖在冰冻过程中对细胞膜具有保护作用,可以取代水与磷脂极性基团结合来保持膜结构的完整性,同时还可以起到伴侣蛋白的作用,抑制变性蛋白质聚集,为蛋白质复性提供能量,进而有效延缓血液保存品质的变化。
人血因管控严格难以获得,猪血与人血在成分上大致相同,可以用来代替人血进行血液保存方面的研究,市面上也存在用人血保存液保存的实验用猪血。目前已有的研究表明,冷冻红细胞可以达到长期保存的效果,但是冷冻红细胞制作成本高且制作过程中添加的甘油对身体有害,需要在输注前经洗涤去除,操作过程复杂繁琐,因此该方法主要用于保存稀有血型。而现行的低溫保存方法会使血细胞损伤速度加快,导致溶血率快速增高,血液变质,从而易造成资源浪费。基于海藻糖对细胞的保护特性,以全血为实验对象,改变海藻糖浓度和保存设备,对全血的保存品质进行评估,以期建立一种方便、安全、有效的全血储存方法。
1 材料和方法
1.1 仪器与试剂
THD?2006型低温恒温槽购于宁波天恒仪器厂。 BCD?226WGAC 型变频冰箱购于无锡松下冷机有限公司。 UV?1200型紫外分光光度计购于上海美普达仪器有限公司。 SQP 型电子天平购于赛多利斯科学仪器(北京)有限公司。HH?2型数显恒温水浴锅购于上海梅香仪器有限公司。 TC?Spinplus?6型低速离心机购于上海珂淮仪器有限公司。330 Vet 型全自动动物血液细胞分析仪购于山东卓越生物技术股份有限公司。
二水合枸橼酸三钠、枸橼酸单水合物、磷酸二氢钠单水合物、葡萄糖单水合物、乙二醇、腺嘌呤均购于国药集团化学试剂有限公司,且均为分析纯。微量游离血红蛋白试剂盒购于南京建成生物工程研究所。Tr?100 ml 一次性使用塑料血袋购于山东威高集团医用高分子制品股份有限公司。猪全血采集于昆山市定点屠宰加工中心有限公司。
1.2 保存液和血液保存温度的确定
本实验中采用血液保存液Ⅲ(CPDA),将仅采用 CPDA 保存的血液作为对照组,将采用加入不同浓度(0.05、0.25和0.50 mol ·L?1)海藻糖的 CPDA 保存的血液作为实验组。目前常用全血储存温度为4℃。有研究表明,4℃下可明显减缓红细胞的溶血情况[6],因此本次实验中保存温度设定为4℃。
1.3 血液的采集
采血所需的工具多为塑料、树脂制品,因此对采血工具进行紫外灭菌。对血液保存液进行高温灭菌后将4种不同配方的血液保存液放置于4个无菌瓶中备用,并做好标记。
鉴于动物血液离体后会迅速凝固,操作时将注射器内壁先用血液保存液润湿,再进行静脉抽血。按照保存液、血液体积比14∶100将血液注入无菌瓶中,并将无菌瓶密封置于0~10℃的保温箱中带回。
1.4 样品的处理
将1个无菌瓶中的血液分装到14个血袋中,并做好标记。为了防止血细胞分布不均,每次装袋前将无菌瓶中的血液充分混匀。将其中7个血袋置于冰箱中,记为一组,另外7个血袋置于恒温槽中,记为一组。按照同样方法处理其他3个无菌瓶中的血液,共得到8组56个血袋。冰箱和恒温槽的温度均设定为4℃。
1.5 相关指标的测定
利用血细胞分析仪测量红细胞总数(RBC)、红细胞比容(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、白细胞 (WBC);利用 pH 计测量 pH;使用试剂盒测量游离血红蛋白(FHb);通过公式[7]计算溶血率。每4天测量1次各项指标,每次实验时取1个血袋,测量完毕血袋即报废。
2 结果讨论
经观察,整个保存期间所有血袋均未出现破损渗漏,采血管无裂纹、气泡、扭结,上清液呈微黄色且无杂质,血液颜色无异常,且各组血袋均未出现凝块。
使用 ADAM?4000?5000 Utility 分别对冰箱和恒温槽的温度进行30 min 连续监测,结果如图1所示,其中: t 为时间; T 为温度。从图中可以看出,恒温槽整体温度波动比冰箱的小。由于常规冰箱采用启停双位控制系统,每隔一段时间温度会有一次较大的波动,整体温度波动较大,而恒温槽采用的是电阻丝加热、压缩机制冷的方法,辅以比例积分微分(PID)微机自整定精确温度控制方式,将温度稳定在设定温度,恒温槽整体温度较稳定,温度波动均在0.3℃以内。
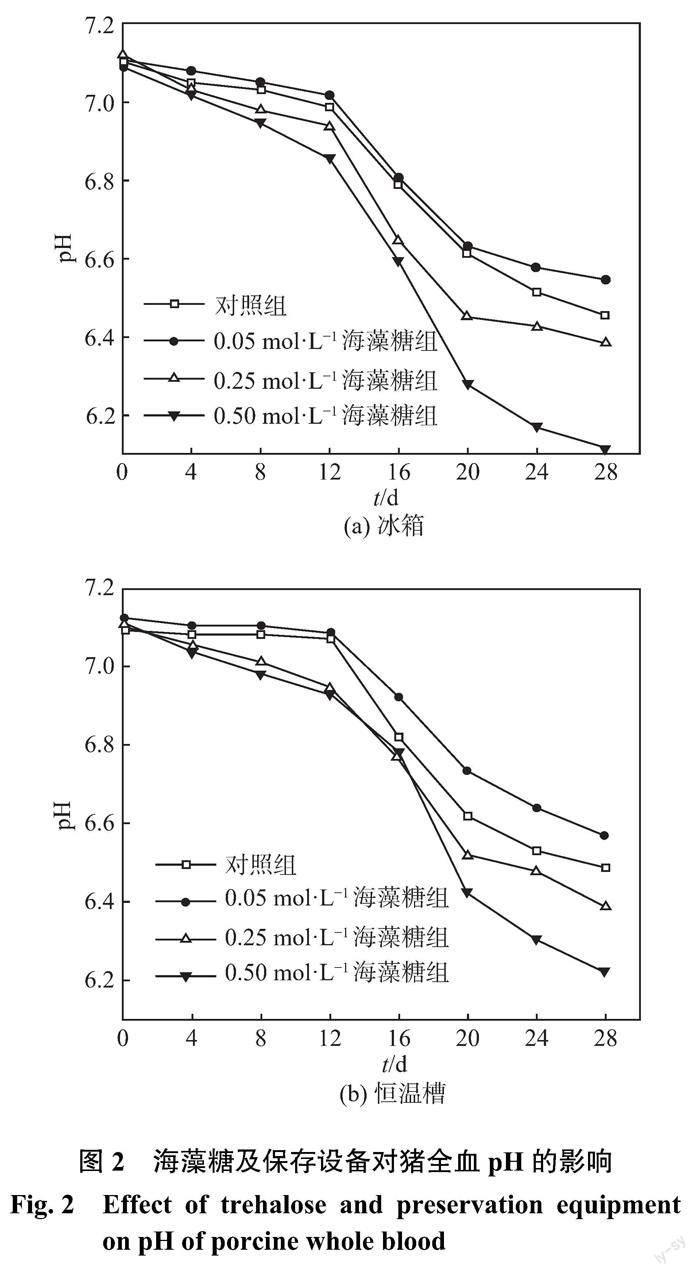
2.1 海藻糖及保存设备对猪全血 pH 的影响
当 pH 过低时,全血的细胞形态与细胞膜流变学特性均会受到一定影响,同时还会出现细胞聚集,从而加速 pH 的下降,对红细胞的携氧功能造成影响[8?9],因此 pH 可以作为评判血液保存效果的重要指标。图2为海藻糖及保存设备对猪全血 pH 的影响。从图中可见,各组血液的 pH 均呈下降趋势。这是由于血浆和外源性葡萄糖在保存过程中发生无氧酵解产生乳酸,乳酸堆积造成 pH 下降[10]。冰箱和恒温槽中0.50 mol ·L?1海藻糖组的 pH 均迅速下降,在保存末期其值低于6.3,且下降速度均慢于其他2种浓度海藻糖组和对照组。低浓度海藻糖降低了细胞膜的通透性,相对减少了红细胞与葡萄糖的接触,减缓了红细胞代谢速度,导致乳酸减少,pH 下降速度减慢,而高浓度海藻糖增加了细胞膜的通透性,保存液中的葡萄糖更容易渗透至细胞内,加速红细胞的代谢,因此 pH 下降得较快。与对照组相比,0.25、0.50 mol ·L?1海藻糖组的 pH 下降速度反而更快,这表明过量添加海藻糖不利于血液的保存。恒温槽中血液的 pH 下降速度比冰箱中的稍慢,尤其在保存末期,其下降速度更慢。
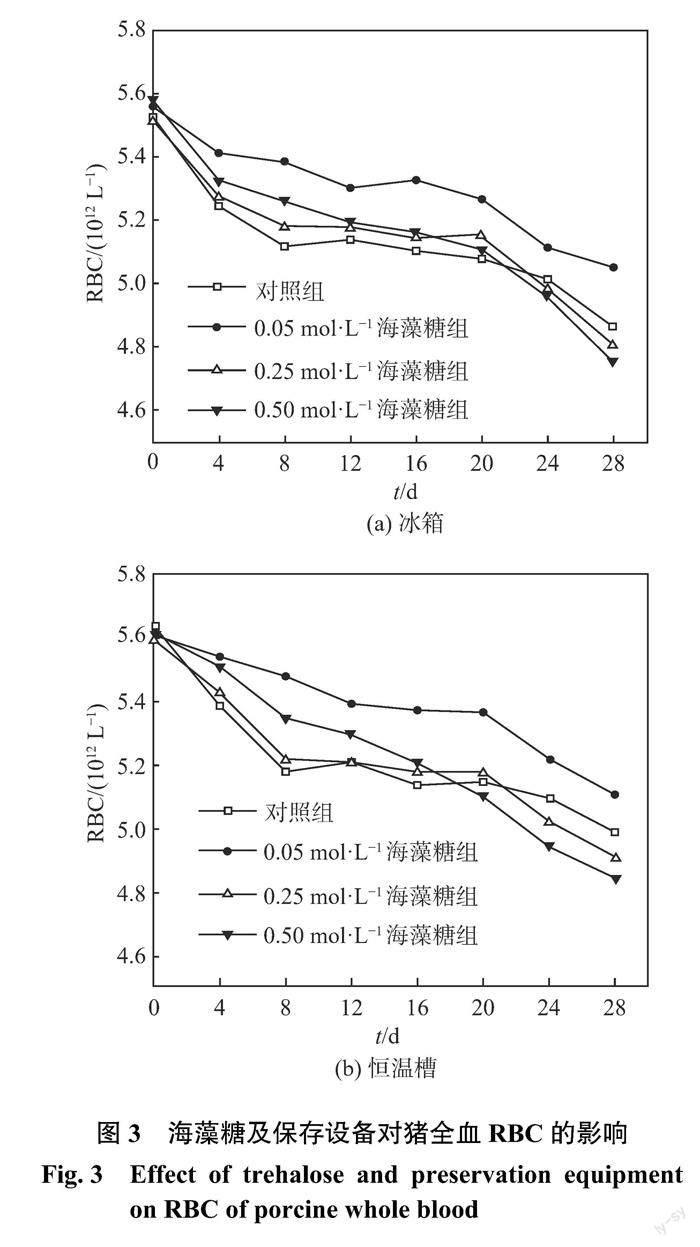
2.2 海藻糖及保存设备对猪全血 RBC 的影响
RBC 是指血液中数量最多的一种血细胞即红细胞总数。红细胞主要负责运送氧气,因此 RBC 可作为评判血液保存效果的重要指标。红细胞在保存过程中,随着时间的推移将发生一系列物理、生理改变,最终衰败、死亡,在此期间红细胞会出现双凹圆盘状消失、细胞膜破裂、内容物流出,从而造成溶血。图3为海藻糖及保存设备对猪全血 RBC 的影响。从图中可见,各组的 RBC 均呈缓慢下降趋势,这与邓梅英等[11]的研究结果一致。冰箱和恒温槽中0.05 mol ·L?1海藻糖组的 RBC 下降速度最慢,这表明该浓度海藻糖延缓了红细胞的衰亡进程。冰箱和恒温槽中0.50 mol ·L?1海藻糖组的 RBC 在前12天内下降速度比对照组和0.25 mol ·L?1海藻糖组的都慢,但是在整个保存期间该组的 RBC 持续快速下降,在第28天时 RBC 的损失率远高于其他组。保存末期,恒温槽中0.05 mol ·L?1海藻糖组的 RBC 高于冰箱中同浓度海藻组的。洛群等[12]研究了海藻糖浓度对红细胞的保存效果的影响,发现高浓度海藻糖可延长红细胞保存期近一倍,这与本次实验结果不同。這可能是因为洛群等只研究了短期内的保存效果(4~7 d),而本次实验时间为28 d,保存前期0.50 mol ·L?1海藻糖组对 RBC 保存效果的确优于对照组和0.25 mol ·L?1海藻糖组,但在保存末期0.50 mol ·L?1海藻糖组的 RBC 保存效果明显更差。
2.3 海藻糖及保存设备对猪全血 MCH 的影响
MCH 是指每个红细胞内所含血红蛋白的平均量。红细胞体积的变化以及胞内血红蛋白外漏均会导致 MCH 的检测结果发生变化。图4为海藻糖及保存设备对猪全血 MCH 的影响。从图中可见,直至保存末期,各组的 MCH 均未见明显的增加或减少,保存过程中的波动也均符合保存质量要求。不论是在冰箱中还是在恒温槽中,3组不同浓度海藻糖组与对照组之间均没有统计学意义(概率值r>0.05),冰箱中0.05、0.50 mol ·L?1 海藻糖组的 MCH 均值分别为21.09、20.76 pg,恒温槽中的分别为21.21、20.88 pg,可见恒温槽的保存效果略好于冰箱。但两种保存设备对 MCH 的保存效果差别不大,这说明红细胞中的血红蛋白并未发生明显的外漏,而血浆中增加的游离血红蛋白是因红细胞破裂所致。
2.4 海藻糖及保存设备对猪全血 MCV 的影响 MCV 是指单个红细胞的平均体积,可以反映红细胞的形变情况。图5为海藻糖及保存设备对猪全血 MCV 的影响。从图中可见,各组的 MCV 均呈上升趋势,与现有的研究结果一致[13]。成熟红细胞的主要功能是负责运输。为了方便运输,红细胞的细胞膜内只有水、血红蛋白,没有细胞核、细胞器,因此红细胞维持活动只能靠摄取葡萄糖。血液离体后血浆中的葡萄糖有限,如在保存液中过量添加葡萄糖又会导致胞外渗透压增加。在保存过程中红细胞代谢需要依靠持续消耗血浆中有限的葡萄糖来维持,葡萄糖酵解减少首先会导致胞外渗透压持续降低,在达到渗透平衡的过程中红细胞不断吸水导致膨胀变大。此外,葡萄糖的减少还会导致维持红细胞形态所必需的能量供应中断,并且还会伴有乳酸产生,乳酸堆积致使 pH 下降, pH 过低又进一步导致红细胞无法维持自身的正常形态[14],红细胞变形、体积增大,最后致使红细胞胀破,胞内的水和血红蛋白最终流向血浆。冰箱中0.05 mol ·L?1海藻糖组的 MCV 明显低于其他组,0.50 mol ·L?1海藻糖组的细胞形态维持得相对较好。恒温槽中0.50 mol ·L?1海藻糖组的 MCV 相较于其他组的上升更慢。计算保存末期各组红细胞的溶胀率,冰箱中对照组的为10.5%,0.05、0.25、0.50 mol ·L?1海藻糖组的分别为6.5%、9.8%、7.9%;恒温槽中对照组的为11.9%,0.05、0.25、0.50 mol ·L?1海藻糖组的分别为10.2%、11.1%、7.3%。冰箱中0.50 mol ·L?1海藻糖组的溶胀率高于恒温槽中相应浓度组的,其余3组的溶胀率也均低于恒温槽中相应浓度组的,其中0.05 mol ·L?1海藻糖组的溶胀率在8组中最小。
2.5 海藻糖及保存设备对猪全血 HCT 的影响
HCT 指单位容积内红细胞的占比,是由血细胞分析仪测量出的 RBC 和 MCV 相乘得到,它可以反映红细胞的积压及聚集程度。图6为海藻糖及保存设备对猪全血 HCT 的影响。从图中来看,冰箱和恒温槽中对照组和0.25 mol ·L?1海藻糖组的 HCT 在前8天均不同程度地下降。从数据来看,这是因为在前8天这两组的 RBC 下降速度较快,而 MCV 增加缓慢,两者乘积减少导致 HCT呈下降趋势;从微观来看,由于红细胞对保存环境的不适应造成前期相当一部分红细胞出现损伤,且红细胞前期聚集性不强,分布较为均匀,红细胞占比下降,因此 HCT 降低。第12~20天,对照组和0.25 mol ·L?1海藻糖组的 HCT 又不同程度地缓慢上升,这是因为它們的 RBC 在这段时间内变化趋于平稳,MCV 增大,红细胞堆积加剧[15],从而造成 HCT 上升。0.05 mol ·L?1 海藻糖组的 HCT 在整个保存期间相对于其他组更为平稳,这是因为0.05 mol ·L?1海藻糖组的 RBC 前期相对稳定,且 MCV 增幅较小。在保存末期 RBC 大幅下降导致对照组、0.05和0.25 mol ·L?1海藻组的 HCT 均明显下降。保存期间0.50 mol ·L?1海藻组的 RBC 持续快速下降,而其 MCV 相对平稳,造成该组的 HCT 在整个保存期间持续下降。在第28天时,冰箱和恒温槽中0.50 mol ·L?1海藻组的 HCT 均显著低于其余3组(r<0.05)。对冰箱和恒温槽中对照组,0.05、0.25 mol ·L?1海藻糖组的 HCT 依次进行方差分析,冰箱中各组的方差分别为0.52、0.44、0.56,恒温槽中各组的方差分别为0.43、0.39、0.48。总体来看,恒温槽中 HCT 的数据比冰箱中的更为稳定,8组中恒温槽中0.05 mol ·L?1海藻糖组的 HCT 最为稳定。
2.6 海藻糖及保存设备对猪全血 WBC 的影响
白细胞的主要功能是防卫作用,血液标本长时间放置会导致白细胞脆性增大,使白细胞受到破坏。图7为海藻糖及保存设备对猪全血 WBC 的影响。从图中可见,各组的 WBC 均持续下降。冰箱中0.05 mol ·L?1海藻糖组的 WBC 下降速度比其他3组的慢,其他3组的 WBC 差别不大,第20天时各组的 WBC 开始低于标准值的最低值1.1×1010L?1。恒温槽中0.05 mol ·L?1海藻糖组的 WBC 下降速度最慢,0.50 mol ·L?1海藻糖组的 WBC 在第20天开始低于标准值最低值。第24天时对照组的 WBC(1.05× 1010 L?1)和0.25 mol ·L?1海藻糖组的 WBC(1.04×1010 L?1)也均开始低于标准值最低值;第28天时 0.05 mol ·L?1海藻糖组的 WBC(1.04×1010 L?1)开始低于标准值的最低值。相同浓度海藻糖组中,恒温槽中各组 WBC 下降速度更慢,其中0.25 mol ·L?1海藻糖组的 WBC 下降速度显著低于冰箱中的4组(r<0.05)。
2.7 海藻糖及保存设备对猪全血 FHb 的影响
FHb 是评价血液保存效果的重要指标。随着时间延长,红细胞出现不同程度的破损,释放血红蛋白,导致 FHb 增加。图8为海藻糖及保存设备对猪全血 FHb 的影响。从图中可见,各组的 FHb 均呈上升趋势。保存前期各组的 FHb 均缓慢上升,第20天后各组的 FHb 上升速度均不同程度增加。前16天冰箱中4组的 FHb 差别较小,第16天后各组的 FHb 差别明显,其中0.05 mol ·L?1 海藻组的 FHb 上升速度开始小于其他3组,其值显著低于其他3组(r<0.05)。从第4天开始,恒温槽中0.25、0.50 mol ·L?1海藻糖组的 FHb 高于对照组,其中0.05 mol ·L?1海藻糖组的 FHb 在保存期间显著低于其他3组(r<0.05)。第28天时恒温槽中0.05 mol ·L?1海藻糖组的 FHb 开始低于冰箱中的4组,且其值与这4组的值之间均有显著性差异(r<0.05)。保存末期冰箱和恒温槽中0.25、0.50 mol ·L?1海藻糖组的 FHb 均迅速升高。高浓度海藻糖会造成细胞膜通透性增加,致使血红蛋白渗漏,这可能是高浓度海藻糖组的 FHb 高于对照组的原因。
2.8 海藻糖及保存设备对猪全血溶血率的影响
溶血率是评判血液保存效果最直接的指标,溶血率升高是红细胞破损的表现。图9为海藻糖及保存设备对猪全血溶血率的影响。从图中可见,各组的溶血率均持续升高,两种保存设备中0.05 mol ·L?1海藻糖组的溶血率均明显低于其他3组,而0.50 mol ·L?1海藻糖组的溶血率最高。前20天,各组溶血率缓慢上升,从第20天开始,各组的溶血率均明显上升,这与 FHb 的变化情况相同。前20天各组之间无显著性差异(r>0.05),保存末期冰箱中0.05 mol ·L?1海藻糖组的溶血率显著低于其他3组(r<0.05),而0.50 mol ·L?1 海藻糖组的溶血率显著高于其他3组(r<0.05)。恒温槽中各组的情况与冰箱中的相同。保存末期恒温槽中0.05 mol ·L?1海藻糖组的溶血率低于冰箱中相同浓度海藻糖组的,恒温槽中0.50 mol ·L?1海藻糖组的溶血率低于冰箱中相同浓度海藻糖组的,对照组和0.25 mol ·L?1海藻糖组的溶血率也均低于冰箱中的。
3 结 论
通过研究不同浓度海藻糖和不同保存设备对猪全血冷藏品质的影响发现,适量浓度(0.05 mol ·L?1)的海藻糖可以起到稳定细胞膜的作用,维持细胞自身形态,同时低浓度海藻糖可以增加细胞膜刚性,延长红细胞的保存时间,延缓红细胞损伤,适用于4℃下的血液保存;高浓度(0.50 mol ·L?1)海藻糖虽然减少了红细胞的溶胀,使红细胞更能维持自身的形态,然而红细胞一直处于高渗透压环境中会导致红细胞损伤增加,并且高浓度海藻糖使血液的 pH 下降速度过快,使红细胞的胞外环境更加恶劣,整体来看不适用于血液的长期保存。
海藻糖浓度相同时,短期内冰箱和恒温槽中保存的血液质量差别不大,但随着保存时间的延长,冰箱内长期不稳定的温度使细胞膜结构松散,血红蛋白外漏、MCH 降低、FHb 升高加快,红细胞内容物减少,同时也造成 MCV 上升速度有所减缓。此外,胞内血红蛋白的减少使得红细胞内部结构发生变化,在通过血细胞分析仪检测激光束时无法检测到其光散射次数和电脉冲信号的改变,导致检测结果中 RBC 减少,而恒温槽中温度的精准控制则可避免这些问题。
综上所述,在猪全血中加入适量浓度(0.05 mol ·L?1)海藻糖并保存在温度更加稳定的环境中可以有效提高全血的保存品质。
参考文献:
[1] NESSEN S C, EASTRIDGE B J, CRONK D, et al. Fresh whole blood use by forward surgical teams in Afghanistan is associated with improved survival compared to component therapy without platelets[J]. Transfusion, 2013, 53(S1):107S -113S.
[2] GURNEY J M, SPINELLA P C. Blood transfusion management in the severely bleeding military patient[J].Current Opinion in Anaesthesiology, 2018, 31(2):207-214.
[3] OPIELKA M, SOBOCKI B, MIERZEJEWSKA P, et al. The effect of trehalose on intracellular and extracellular nucleotide metabolism. A pilot study[J]. Nucleosides, Nucleotides & Nucleic Acids, 2020, 39(10?12):1400-1409.
[4]何迎粉, 何荣荣, 刘敦华, 等.海藻糖与酿酒酵母乙醇耐受性相关性的研究进展[J].中国酿造 , 2020, 39(11):1-4.
[5] MAHMUD S A, HIRASAWA T, SHIMIZU H, et al. SB-P2-High constitutive trehalose is required for resistance to multiple stresses in Saccharomyces cerevisiae[J]. Journal of Bioscience and Bioengineering, 2009, 108(S1):S169.
[6]赵永斌, 于长春, 李新華.工业生产中猪血溶血因素的研究[J].吉林师范大学学报(自然科学版), 2015, 36(4):138-141.
[7]王芳.红细胞制品储存期末溶血率的测定与分析[J].临床输血与检验, 2016, 18(1):26-27.
[8]魏蕾.保存时间对库存去白细胞悬浮红细胞血液指标变化的影响[J].中国医药指南, 2020, 18(22):15-17.
[9] YANG H, KIM W, BAE J, et al. Effects of irradiationand leukoreduction on down-regulation of CXCL-8 and storage lesion in stored canine whole blood[J]. Journal of Veterinary Science, 2019, 20(1):72-78.
[10]邓梅英.贮存期红细胞悬液质量变化及保存的研究概述[J].华夏医学, 2009, 22(4):783-785.
[11]邓梅英, 宁芳, 蒋利星.血液保存中血红蛋白、红细胞和红细胞压积参数变化[J].中国医药导报 , 2012, 9(18):110-111.
[12]骆群, 韩玮, 刘景汉.海藻糖在血液保存中的作用[J].临床输血与检验, 2006, 8(3):167-170.
[13]钱明, 郭兆旺, 汤艳平.血常规标本的保存时间对测定结果的影响[J].中国实用医药, 2011, 6(20):57-58.
[14]李宁, 曾光群, 刘昊天, 等.全血标本保存时间对血常规结果的影响[J].中国现代医生, 2015, 53(13):94-95, 99.
[15]钟锐, 刘华, 王红, 等.添加不同比例的 MAP 保存液对拉萨地区悬浮红细胞保存质量的影响[J].中国输血杂志, 2015, 28(7):780-783.
