超活化血小板裂解液和骨髓间充质干细胞联合应用对大鼠上颌快速扩弓后前腭缝骨改建影响的实验研究
2023-07-26李佳楠刘潇遥芦慧颖王培军
李佳楠 刘潇遥 刘 洋 芦慧颖 王培军 张 怡
上颌快速扩弓(rapid maxillary expansion,RME)快速打开腭中缝,增加上颌骨宽度,广泛应用于上颌牙弓狭窄、后牙对刃或反牙合、轻度牙列拥挤等错牙合畸形的矫治。RME 的扩弓效果值得肯定,但多数患者在治疗后常发生较为明显的复发,影响RME 的长期稳定性,甚至导致扩弓失败[1]。RME 后腭中缝内新骨形成不足是复发的主要原因之一,因此,如何促进RME 后腭中缝骨改建,增加骨缝内新骨形成成为了研究热点[2]。
超活化血小板裂解液(super-activated platelet lysate, sPL)是一种新型血小板浓缩物,富含高浓度的生物活性因子,可促进成骨细胞增殖和凋亡修复,加速骨组织再生[3]。sPL 可以注射的方式作用于局部,操作简单、创伤小,可调节实验性牙周炎大鼠炎症小体和细胞因子的表达,具有明显的缓解炎症的作用[4],可促进拔牙窝内新骨形成和软组织愈合[5],但尚未见其在口腔正畸领域的应用研究。骨髓间充质 干 细 胞(bone marrow mesenchymal stem cells,BMSCs)是成骨细胞的重要来源,能够有效促进骨折愈合和软骨损伤的修复,是骨再生研究领域的热点。
本研究通过扩弓装置快速扩张大鼠的前腭缝,评估sPL 和BMSCs 联合应用对大鼠RME 后前腭缝骨改建的影响,从而为正畸临床中提高RME 的长期稳定性,缩短保持时间,提供理论依据和实验基础。
资料和方法
1.主要实验材料和仪器
SD 大鼠骨髓间充质干细胞、大鼠骨髓间充质干细胞完全培养基、胎牛血清(广州赛业生物科技有限公司);胰蛋白酶(美国Gibco 公司);水合氯醛(美国Sigma 公司);酸蚀剂、粘接剂、光固化树脂(美国3M公司);多聚甲醛(广州硕谱生物科技有限公司);EDTA(北京索莱宝科技有限公司);苏木素染色液、伊红染色液(赛默瑞特科技有限公司);倒置相差显微镜、正置显微镜及彩色照相系统(日本Nikon 公司);全自动组织处理机、组织包埋机、组织切片机(美国Thermo Fisher Scientific 公司);小动物Micro-CT 机(瑞士Scanco Medical 公司);VG Studio Max 软件(德国Volume Graphics公司)。
2.动物分组及处理
选用16 只6 周龄Sprague-dawley(SD)雄性大鼠,平均体重200±10 g。动物来源于哈尔滨医科大学附属第一医院实验动物中心。本实验经哈尔滨医科大学附属第一医院动物实验伦理委员会审查批准。严格遵循《实验动物保护条例》,所有大鼠统一自由进食水,适应性喂养一周后分组实验,随机分为4 组:对照组(A 组);sPL 注射组(B 组);BMSCs 注射组(C 组);BMSCs+sPL 注射组(D 组),每组4只,正常饮食,分笼喂养,每2~3 天更换垫料,保持鼠笼内干燥卫生。
3.大鼠RME模型的建立
使用0.016 英寸不锈钢丝弯制大鼠上颌快速扩弓器,调整双侧扩张臂打开角度以提供100±5 g的扩弓力。大鼠经腹腔注射8%水合氯醛溶液(4 mL∕kg体重)麻醉后,将扩弓器加载于上颌切牙,使用结扎丝进行结扎固位后,再使用光固化复合树脂进行粘接固定,建立大鼠RME 模型(图1)。扩弓7 天后拆除扩弓装置,使用游标卡尺测量上颌中切牙间距离,在中切牙间放置相应长度的0.018×0.025 不锈钢方丝,并用光固化复合树脂固定,进入21 天的保持期(图2)。
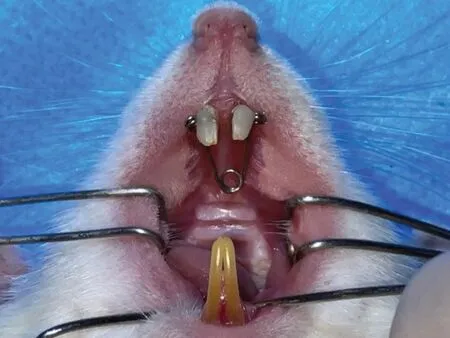
图1 大鼠RME装置的安放
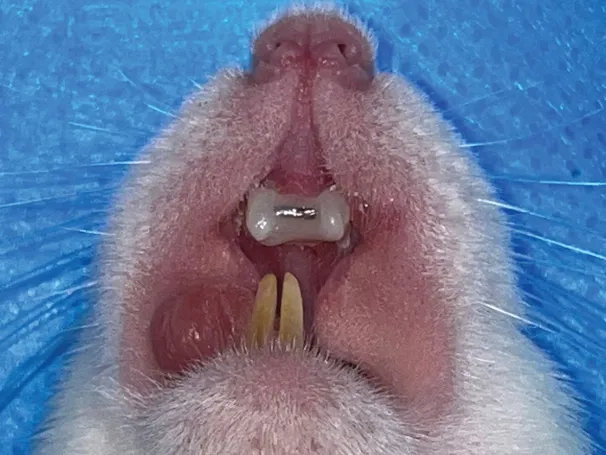
图2 大鼠RME后保持
4.sPL的制备
sPL 由天晴干细胞股份有限公司提供,具体制备方法参考先前的研究[4]:在麻醉下通过心脏穿刺从12只健康SD大鼠中采集血液80 mL,血液用3.8%的柠檬酸钠抗凝。抗凝血液样品在室温下1000 rpm离心10 分钟,去除下层红细胞;然后将剩余血液混合均匀,再在18~20℃、2300~3300 rpm 条件下离心15 分钟,将上层血浆转移至新的离心管中留存,将底层的血小板血浆颠倒混匀、计数,利用留存的上层血浆,将富血小板血浆中的血小板浓度调整至1×1012个∕L;为激活血小板并释放生长因子,将富血小板血浆与CaCl2和低分子量肝素钠在CO2培养箱中37℃孵育1~2小时,然后将混合物冻存于-80℃冰箱内1~2小时。最后,混合物在37℃下解冻5分钟,并在4℃下冷却1 小时,以允许纤维蛋白聚结。在4℃下离心后,过滤上清液,最终获得约20 mL sPL。
5.BMSCs的复苏、培养和传代
SD 大鼠骨髓间充质干细胞购于广州赛业生物科技有限公司。按照说明书进行细胞复苏、培养和传代,使用生长状态良好的第三代细胞进行后续实验。
6.生理盐水、sPL及BMSCs的注射
(1)注射方法
在异氟烷吸入麻醉下,将大鼠仰卧固定四肢,用碘伏消毒注射区域,于龈乳头腭侧2 mm 处进针,方向呈约30±5°锐角朝向口内,进针深度约2 mm。将100μL 的生理盐水、sPL 或BMSCs 细胞悬液注入大鼠前腭缝区域。
(2)动物分组及注射:①对照组(A 组):在保持期间,每只大鼠每隔一天注射100 μL 生理盐水,共注射11 次。②sPL 注射组(B 组):在保持期间,每只大鼠每隔一天注射sPL100 μL,共注射11 次。③BMSCs 注射组(C 组):在保持期的第1 天(即实验第8 天),每只大鼠注射100μL 细胞密度为1×107 个∕L的BMSCs+生理盐水悬液(含1×106个细胞);在随后的保持期间,每只大鼠每隔一天注射100 μL 生理盐水,共注射10 次。④BMSCs+sPL 注射组(D 组):在保持期的第1 天(即实验第8 天),每只大鼠注射100 μL细胞密度为1×107个∕L的BMSCs+sPL悬液(含1×106 个细胞);在随后的保持期间,每只大鼠每隔一天注射sPL100 μL,共注射10次。
7.大鼠处死及上颌标本的制备
保持21 天后,使用过量麻药处死所有大鼠,去除大鼠口内装置,测量大鼠上颌中切牙间距离,取出上颌骨样本,去除软组织,立即置于4%多聚甲醛中固定48小时,进行后续的影像学和组织学检查。
8.Micro-CT分析前腭缝成骨情况
样本置于Micro-CT 扫描管中,在高分辨率Micro-CT 扫描仪载物台上进行扫描,相关扫描参数为:电压90 kV,电流200 μA,分辨率15 μm。使用VG Studio Max 软件对图像进行三维重建和分析。研究分析的感兴趣区域(region of interest,ROI)位于大鼠上颌前腭孔近中4 mm 的前腭缝区域,厚度为0.6 mm,横向延伸至前腭缝两侧各0.75 mm 的范围(图3)。测量ROI 内前腭缝的三维整体宽度,将与ROI内前腭缝体积相等的球体直径定义为前腭缝的三维整体宽度,等效直径计算式为:Deq=。测量骨体积分数(BV∕TV)、骨小梁数目(Tb.N)、骨小梁厚度(Tb.Th)和骨小梁分离度(Tb.Sp)评价大鼠前腭缝成骨情况。

图3 Micro-CT感兴趣区域(ROI)
9.组织学染色
样本置于EDTA 脱钙液中室温脱钙1.5 个月,每三天换用新鲜脱钙液,期间使用针刺法判断脱钙的程度。对脱钙后的样本进行脱水、透明、浸蜡、包埋、切片处理,切片厚度5 μm。将样本脱蜡至水,自来水冲洗后染色。苏木素染液染色8~15 分钟,流水冲洗1~2 分钟,盐酸乙醇分化数秒,流水冲洗返蓝30~60 分钟,伊红染液染色2~5 分钟,然后流水冲洗、二甲苯透明、中性树胶封片。正置显微镜下观察染色结果并拍照。每张切片先于低倍镜下观察全部组织,选择前腭缝区域采集3 张400 倍图片,测量单位骨小梁周长成骨细胞数(osteoblast number∕unit trabecular perimeter, Ob.N∕Tb.Pm)和新生血管数量。
10.统计学分析
使用SPSS25.0 软件进行统计学处理,数据以“均数±标准差”的形式表示,进行单因素方差分析和最小差异显著法(LSD)检验,P<0.05 为具有统计学意义。
结 果
1.动物模型建立结果
实验期间,4 组大鼠均未出现装置脱落、体重明显下降、感染等意外情况,生长状态良好,全部纳入实验。
(1)大鼠的体重变化情况:由于对扩弓装置的不适应,4组大鼠在扩弓的第1、2天出现明显的体重下降,从第3 天起进食量增加,体重开始稳步增长,整个实验期间,4 组大鼠平均体重的差异无统计学意义(P>0.05,表1)。
表1 实验期间大鼠体重变化 g,±s
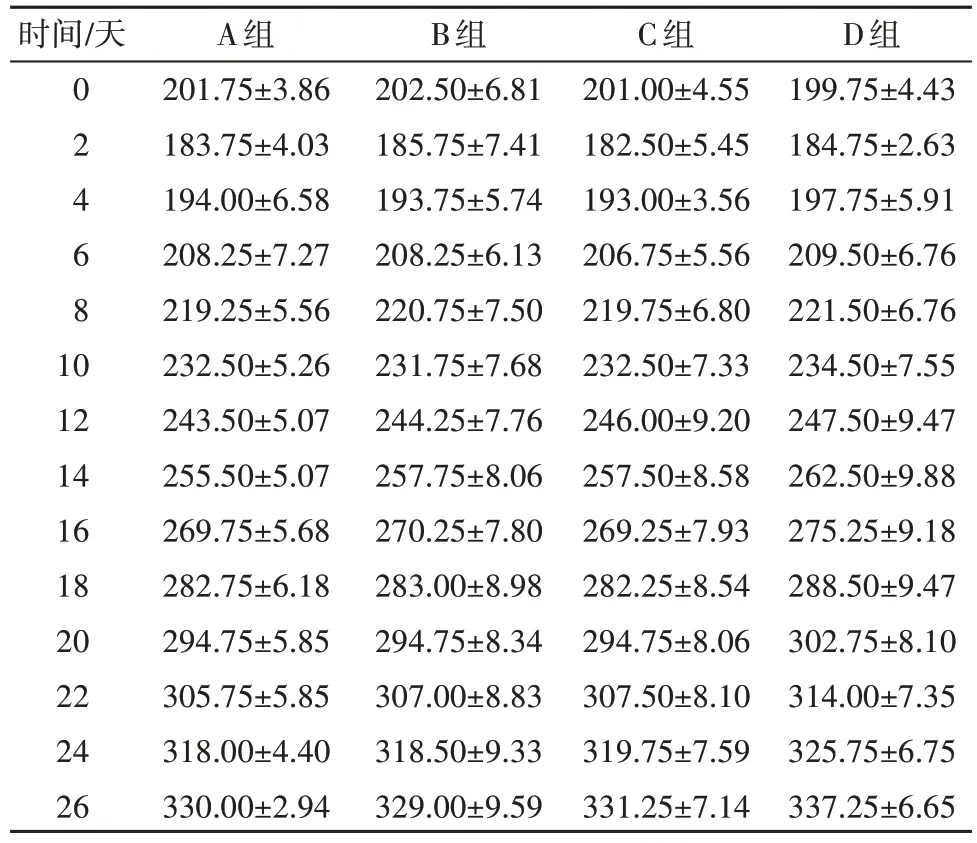
表1 实验期间大鼠体重变化 g,±s
A 组,对照组;B 组,sPL 注射组;C 组,BMSCs 注射组;D 组,BMSCs+sPL 注射组;P>0.05
时间∕天0 2 4 6 8 10 12 14 16 18 20 22 24 26 A组201.75±3.86 183.75±4.03 194.00±6.58 208.25±7.27 219.25±5.56 232.50±5.26 243.50±5.07 255.50±5.07 269.75±5.68 282.75±6.18 294.75±5.85 305.75±5.85 318.00±4.40 330.00±2.94 B组202.50±6.81 185.75±7.41 193.75±5.74 208.25±6.13 220.75±7.50 231.75±7.68 244.25±7.76 257.75±8.06 270.25±7.80 283.00±8.98 294.75±8.34 307.00±8.83 318.50±9.33 329.00±9.59 C组201.00±4.55 182.50±5.45 193.00±3.56 206.75±5.56 219.75±6.80 232.50±7.33 246.00±9.20 257.50±8.58 269.25±7.93 282.25±8.54 294.75±8.06 307.50±8.10 319.75±7.59 331.25±7.14 D组199.75±4.43 184.75±2.63 197.75±5.91 209.50±6.76 221.50±6.76 234.50±7.55 247.50±9.47 262.50±9.88 275.25±9.18 288.50±9.47 302.75±8.10 314.00±7.35 325.75±6.75 337.25±6.65
(2)扩弓7 天后大鼠上颌中切牙间宽度测量结果:在扩弓力作用下,大鼠上颌中切牙之间从紧密接触变为宽约2.2 mm 左右的间隙,且4 组大鼠中切牙间宽度无显著差异(P>0.05,表2),扩弓量基本一致,成功建立大鼠RME 模型。实验结束拆除保持装置时,保持钢丝无脱落、无形变、无移位,间隙无缩窄。
表2 扩弓7天后大鼠上颌中切牙间宽度变化 mm,±s
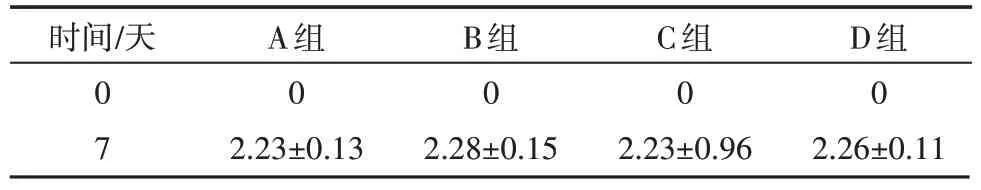
表2 扩弓7天后大鼠上颌中切牙间宽度变化 mm,±s
A 组,对照组;B 组,sPL 注射组;C 组,BMSCs 注射组;D 组,BMSCs+sPL 注射组;P>0.05
时间∕天0 7 A组0 2.23±0.13 B组0 2.28±0.15 C组0 2.23±0.96 D组0 2.26±0.11
2.Micro-CT三维重建与测量分析结果
(1)前腭缝宽度测量分析:与A 组相比,B、C、D组大鼠前腭缝宽度均缩窄,其中B 组和C 组的前腭缝宽度与A 组无显著性差异,D 组前腭缝宽度显著窄于A组(P<0.05,图4)。

图4 Micro-CT前腭缝宽度测量分析
(2)Micro-CT 三维重建和骨组织参数测量分析:从Micro-CT三维重建图中可见,D组前腭缝处骨表面修复效果最好。骨组织参数测量结果显示,B组和D 组BV∕TV 均显著高于A 组(P<0.05);C 组BV∕TV与A组相比,无统计学差异;与D组相比,C组BV∕TV 显著降低(P<0.05)。D 组Tb.N 测量值与A组相比显著增加(P<0.05),B 组和C 组Tb.N 测量值与A 组相比无统计学差异。4 组间的Tb.Th 测量值差异无显著性。A 组Tb.Sp 测量值显著高于B 组(P<0.05)和D组(P<0.01)(图5)。
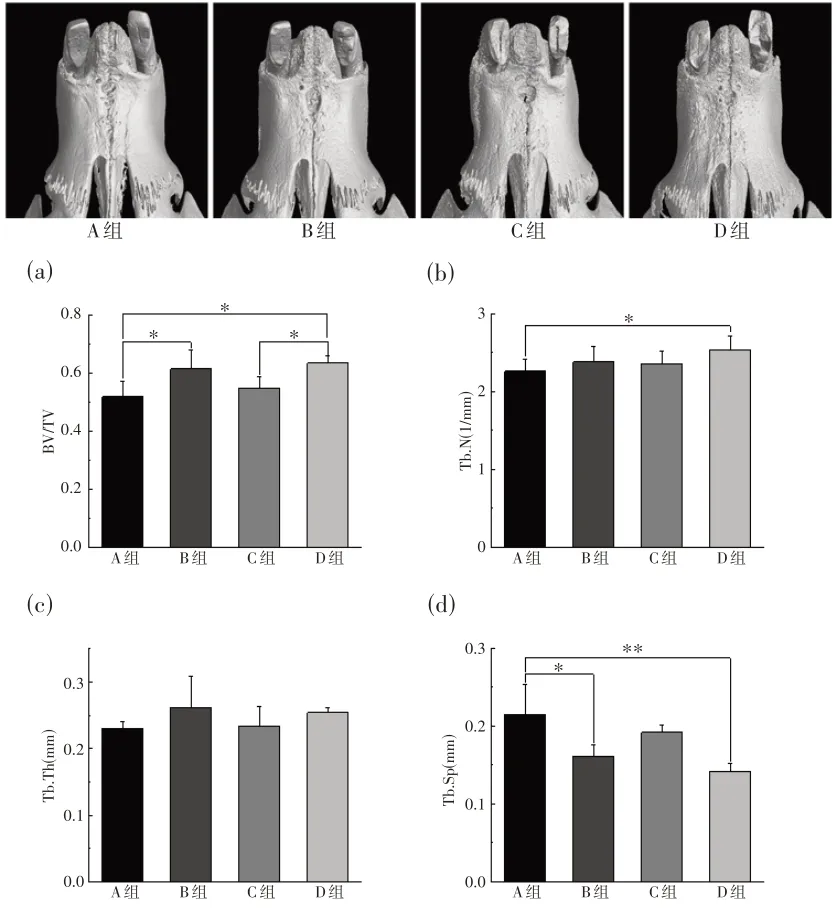
图5 Micro-CT三维重建及骨组织参数测量分析
3.大鼠前腭缝HE染色的组织学表现
镜下观察可见多呈立方形的成骨细胞呈带状或散在分布于前腭缝近骨边缘处,周围骨质部分区域呈现出齿状不齐的外观。前腭缝区可见大量的间质样细胞及红染的纤维组织,被拉长的纤维组织排列方向与扩弓力基本平行,亦见数量不等的新生血管(图6)。Ob.N∕Tb.Pm 测量结果显示,与A 组相比,B、C、D 组大鼠Ob.N∕Tb.Pm 均有增加,其中B、C 组与A组之间的差异无统计学意义(P>0.05),D 组大鼠Ob.N∕Tb.Pm 显著高于A 组和C 组大鼠(P<0.05,图7)。B 组大鼠新生血管数量显著高于A 组大鼠(P<0.05),D 组大鼠新生血管数量显著高于A 组大鼠(P<0.01)和C组大鼠(P<0.05)(图8)。

图6 4组大鼠前腭缝组织学观察

图7 4组大鼠单位骨小梁周长成骨细胞数

图8 4组大鼠新生血管数
讨 论
1.大鼠RME模型的建立
相关研究中,常采用前腭缝快速扩张和腭中缝快速扩张两种模型对RME 进行研究。腭中缝快速扩张即后牙扩弓法,虽然与临床中RME 更相似,但其存在一定的弊端。如在安放扩弓装置时易受口腔空间限制,使大鼠个体间扩弓力值不一致,且使用光固化树脂粘接于后牙的扩弓装置会影响大鼠的咬合,易造成大鼠进食困难、体重下降或装置脱落等问题,进而干扰实验结果。相比之下,前腭缝快速扩张有明显的优势:操作简单,不受限制;扩弓力大小一致,可重复性强;扩弓装置对机体影响较小,较为安全、有效。因此,本实验采用前腭缝快速扩张对RME 进行研究。文献报道中,常采用100~200 g 扩弓力进行前腭缝扩张研究[6,7],力值过大易导致牙周组织损伤和细胞增殖下降,力值过小则不足以扩开前腭缝。本实验参考张蕾等[8]的研究,使用直径0.016英寸的不锈钢丝弯制前腭缝扩弓装置,提供初始力值为100±5 g,扩弓7 天后大鼠两切牙平行分开约2.2 mm,组间无统计学差异(P>0.05),扩弓量较为一致。
2.BMSCs对前腭缝骨改建的影响
BMSCs 是存在于骨髓中的非造血干细胞,具有多种分化潜能,在微环境因素的刺激下,BMSCs能够分化为成骨细胞,参与注射部位的新骨形成。BMSCs 还可以通过分泌骨形态发生蛋白-2 或血管内皮细胞生长因子等生长因子来调节新骨的形成。作为一种理想的组织工程种子细胞,BMSCs 常与支架材料联合应用于颌骨缺损修复[9]、牙周组织再生[10]、颞下颌关节疾病治疗[11]等口腔医学研究中。RME 结束时,扩张的前腭缝中具有成骨潜能的细胞数量处于较低水平,本研究在此时进行BMSCs 单次局部注射,以期促进前腭缝处骨改建。但目前的研究结果显示,BMSCs 注射组大鼠Micro-CT 各项测量指标及Ob.N∕Tb.Pm 与对照组相比无统计学差异(P>0.05),仅在前腭缝内单次局部注射BMSCs不能显著促进骨再生,与Mohaghegh 等[12]和Ebadifar 等[13]的研究结果相似。与本研究结果相反,Ekizer 等[14]发现,注射BMSCs增加了RME后腭中缝处新骨的形成和血管化,认为将BMSCs 应用于腭中缝可能是提高RME 长期稳定性的有效方法。研究结果不同的原因可能是,Ekizer 等在扩弓后24 小时就进行BMSCs局部注射,促进了RME早期前腭缝内的新骨形成。
3.sPL对前腭缝骨改建的影响
sPL 是一种新型血小板浓缩物,富含对干细胞增殖、分化具有促进作用的高浓度生长因子,包括血小板衍生内皮细胞生长因子(platelet-derived endothelial cell growth factor,PD-ECGF)、血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、胰岛素样生长因子(insulin like growth factor,IGF)、表皮生长因子(epidermal growth factor,EGF)、成纤维细胞生长因子(fibroblast growth factor,FGF)、TGF-β、BMP-2、BMP-4、BMP-6、白细胞介素-1等[3]。
PD-ECGF 通过间充质干细胞和结缔组织细胞的趋化和有丝分裂启动伤口愈合,产生细胞粘附分子纤维连接蛋白,并通过促进血管内皮细胞增殖参与血管生成[15]。VEGF 与内皮细胞上表达的相关受体结合,诱导细胞反应,释放基质金属蛋白酶,消化周围的细胞外基质,允许血管内皮细胞迁移和增殖,促进新生内膜形成[16]。IGF 来源于骨细胞、内皮细胞和血小板,在骨成熟和骨重塑的后期发挥作用,其分泌可能受到BMP的刺激[17]。FGF刺激骨髓间充质干细胞向成骨通路的信号传递,特别是成骨细胞的形成[18]。TGF-β1 和TGF-β2 刺激成纤维细胞趋化,产生胶原蛋白和纤维连接蛋白,通过降低蛋白酶和增加蛋白酶抑制剂抑制胶原降解,参与破骨细胞凋亡和抑制,加速骨再生[19]。
在本研究中,使用专利方法(专利号:CN 111686305 A)制备了sPL,并使用生物因子培养技术诱导和激活sPL。与PRP 或血小板裂解液(platelet lysate,PL)相比,sPL 含有更高纯度的生物活性因子,且去除了白细胞、血小板片段和免疫球蛋白,降低了免疫原性,允许异体应用。与PRP 相似,sPL 在前12 小时内生长因子释放明显,约占总释放量的25%,24 小时后生长因子释放量约为初始释放量的一半。因此,在本研究中,需要在保持期间每隔1 天局部注射sPL,以保持局部sPL的持续有效释放。实验结束时,与对照组大鼠相比,sPL 注射组大鼠BV∕TV 显著增高(P<0.05),Tb.Sp 测量值显著降低(P<0.05),说明sPL 注射组大鼠前腭缝处骨合成代谢大于分解代谢,骨量增加,骨小梁排列更紧密。由于反复向前腭缝处注射sPL,外源性生长因子浓度保持在较高水平,持续促进RME后前腭缝处新骨形成。
4.BMSCs+sPL 对前腭缝骨改建的协同促进作用
本研究比较了sPL、BMSCs 单独注射和BMSCs+sPL 联合注射对大鼠RME 后前腭缝骨改建的影响。BMSCs+sPL 联合应用在促进前腭缝骨改建中具有协同作用,能够更有效地促进新骨形成。在本研究中,除了内源性生长因子参与前腭缝处成骨活动外,外源性sPL 中含有多种生长因子和细胞因子,为移植的BMSCs 增殖、分化提供良好的细胞外环境,促进BMSCs 分化为成骨细胞。sPL 还可以促进成骨细胞的激活,增加细胞周期调节因子的表达,加速进入细胞周期,增强成骨细胞增殖、分化和新骨形成。相关实验证实了上述分析,崔同等[3]将成骨细胞接种至含sPL的培养基进行培养后发现,sPL能明显促进成骨细胞的增殖和凋亡修复。Guo 等[5]的动物实验发现,sPL 治疗组大鼠成骨相关因子ALP、OCN、COL-1、Runx2、BMP-2、Osterix 的mRNA 相对表达量均高于对照组。sPL 联合BMSCs 移植有利于BMSCs的存活、增殖和分化,从而提高干细胞移植治疗的有效率。
综上所述,sPL 单独应用或BMSCs+sPL 联合应用均能促进大鼠上颌快速扩弓后前腭缝骨改建,促进骨质形成。为其在正畸临床中的应用提供了一定的实验基础。
