基于TGF-β/Smads通路分析上调miR-34b对前列腺癌模型大鼠的影响
2023-07-26田景昌田兵宗德斌李猛李勇胡明宇薛佐兴荆孝东
田景昌 田兵 宗德斌 李猛 李勇 胡明宇 薛佐兴 荆孝东
(大连大学附属新华医院泌尿外科,辽宁 大连 116021)
前列腺癌为男性常见恶性肿瘤,早期无明显症状,易被忽略〔1,2〕,主要临床表现为夜尿增多、尿频、尿痛、尿急等。前列腺癌与其他不同部位癌症有相同的治疗原则,要早期发现,早期诊断,早期治疗〔3,4〕。临床治疗主要以根治性放射及根治性手术治疗为主。近年来我国前列腺癌发病率居高不下,如何有效治疗仍是临床研究热点〔5〕。微小 RNA(miRNA) 在前列腺癌中具备一定的机制作用,miR-34b属于微小 RNA家族的一员,但现今研究中对于miR-34b在前列腺癌中的相关机制研究报道较为稀少〔6〕。基于上述背景,本文分析上调miR-34b对前列腺癌模型大鼠细胞外信号调节转化生长因子(TGF)-β/Smads信号通路的影响,以明确 miR-34b 是否经 TGF-α/Smads 信号通路影响并调控前列腺癌的发生及发展,具有一定的创新性。
1 材料与方法
1.1材料 选取40只SD健康雄性大鼠〔河北中旭检验检测技术有限公司,使用许可证号:SYXK(冀)2020-009〕,7~10周龄,平均(8.6±1.2)周龄;体质量216~240 g,平均(227.9±9.6)g。于(23.8±3.1)℃环境中喂养大鼠。本研究获医院伦理委员会批准。主要试剂:兔抗大鼠白细胞介素(IL)-1抗体(Selleck公司);小鼠抗大鼠血管内皮生长因子(VEGF)抗体(Invitrogen公司);兔抗大鼠肿瘤坏死因子(TNF)-α、基质金属蛋白酶(MMP)-3抗体(Hyclone公司);小鼠抗兔总胆固醇(TC)、三酰甘油(TG)抗体(Gibco公司);大鼠抗小鼠Toll样受体(TLR)4(BD公司);小鼠抗兔TGF-β/Smads抗体(Sigma公司)。
1.2建模及分组 随机挑选10只大鼠为正常组,不做任何处理。其余30只建立前列腺癌模型:大鼠禁食12 h后进行麻醉处理,开腹使大鼠前列腺暴露于术野,使用无菌棉对大鼠前列腺组织进行保护,向两侧前列腺侧叶注射小鼠前列腺癌细胞(RM-1)悬液10 μl,包膜鼓起且脱离腺体,注射成功,将无菌棉取出后关腹。大鼠麻醉苏醒后使用2 mg/kg的丝裂霉素磷酸盐缓冲液(PBS)腹腔注射,小鼠出现蜷缩、体温下降等濒死状态,经眼眶取血后脱颈处死,表示建模成功,建模过程中死亡3只,最终建模成功27只。将27只前列腺癌大鼠随机分为模型组、上调组、下调组各9只,上调组尾部静脉注射30 mg/kg激活胱天蛋白酶富集域家族成员(agoCARD)9,下调组尾部静脉注射30 mg/kg抑制ago-CARD9(antagoCARD9),正常组、模型组大鼠尾部静脉注射等量生理盐水,均连续给药干预7 d。
1.3苏木素-伊红(HE)染色 实验结束后,采集静脉血,离心,取上清,-20 ℃保存备用。立即处死大鼠,取大鼠前列腺组织,放于10%甲醛中固定,切片,脱蜡操作,HE染色,光学显微镜观察病理组织形态变化。
1.4双抗体夹心酶联免疫吸附试验(ELISA)测定VEGF、IL-1、TNF-α、ALP水平 将前列腺组织标本加入适量生理盐水捣碎,3 000 r/min离心10 min取上清液。分别设空白孔、标准孔、待测样品孔,将样品加入96孔酶标板中,每孔50 μl,随后将其样品加于至酶标板孔的底部位置,在进行加入的过程中对于孔壁尽量不要去触碰,摇匀,封板,置于37 ℃常温中进行孵育30 min。洗板3次,除去空白孔,其余的两孔内均分别加入50 μl的酶标试剂,37 ℃温育30 min。洗板3次,在3孔中按照先后顺序先加入50 μl的显色剂A,再加入50 μl的显色剂B,在37 ℃常温中进行温育30 min。每孔加入终止液50 μl,终止反应,此时蓝色立转黄色。以空白孔凋零,450 nm波长计算VEGF、IL-1、TNF-α、ALP水平。
1.5TC、TG、PSA、MMP-3水平检测 TC、TG水平采取罗氏c501全自动生化分析仪检测。采用罗氏公司的cobas e 602 全自动电化学发光免疫分析仪测定PSA、MMP-3水平。
1.6miR-34b表达检测 采用实时荧光定量PCR法测定。细胞转染成功,Trizol法提取细胞中总RNA,应用mRNA逆转录试剂盒行逆转录获得cDNA,GAPDH为内参,提取细胞总RNArimer5.0软件设计引物反应条件:16 ℃ 30 min、42 ℃ 30 min、85 ℃ 5 min,40个循环,2-△△Ct方法计算目的基因相对表达量。实验重复3次,取平均值。miR-34b上游引物:5′-TTTTTATTTGTTTTGTTTTGTGTTTGTTTTG-3′,下游:5′-CAACTACAACTCCCAAACA-ATCC-3′;内参基因U6:上游引物5′-GCTTCGGCAGCACATAT-ACTAAAAT-3′,下游:3′-CGCTTCACGAATTTGCGTGTCAT-5′。
1.7TGF-B/Smads通路蛋白相对表达量对比 采用Western印迹法对所有培养的细胞进行离心、蛋白提取,然后使用BCA做蛋白定量测定,将50 μg蛋白加入至2×十二烷基硫酸钠(SDS)凝胶缓冲液中,转膜、取膜、固定、做电泳1.5 h封闭处理,将1∶1 000比例的TBST稀释的TGF-B/Smads一抗,在4 ℃的环境中孵育过夜,TBST反复3次洗膜,将1∶10 000 TBST稀释的二抗加入,摇动孵育1 h,TBST反复3次洗膜,二氨基联苯胺(DAB)做显色处理,定量分析蛋白表达情况,以GAPDH蛋白为内参。
1.8统计学处理 采用SPSS19.0软件进行F检验、t检验。
2 结 果
2.1各组前列腺组织病理学观察 如图1所示,正常组前列腺组织细胞结构完好,无充血、水肿等病理变化,无炎性细胞浸润;模型组前列腺组织细胞排列无规则,且大量坏死,充血、水肿、炎性细胞浸润情况较明显;上调组前列腺组织细胞水肿、炎性浸润现象改善,病变缓解;下调组前列腺组织细胞坏死、充血、水肿、炎性细胞浸润等病理变化更为严重。
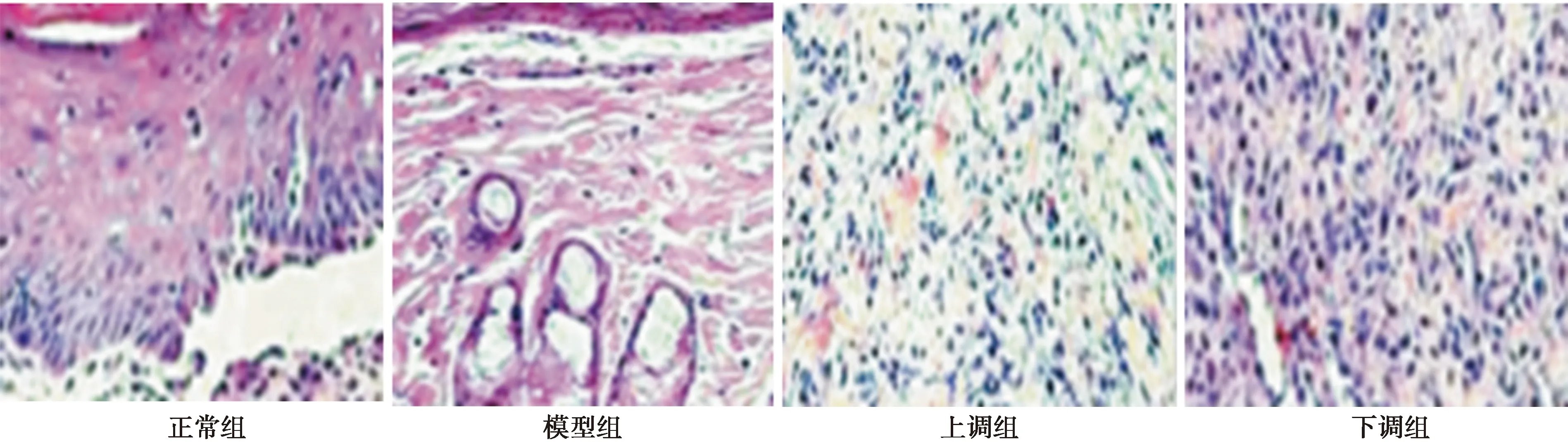
图1 各组前列腺组织(HE染色,×200)
2.2转染效率鉴定 如表1所示,与正常组相比,模型组、上调组、下调组miR-34b表达量降低,具有统计学差异(P<0.05);与模型组相比,上调组miR-34b表达量升高,下调组miR-34b表达量降低,具有统计学差异(P<0.05);与上调组相比,下调组miR-34b表达量降低,具有统计学差异(P<0.05),说明miR-10a转染成功。

表1 各组转染效率、骨转移相关指标、VEGF水平及免疫炎症因子水平对比
2.3各组血清PSA、VEGF、ALP水平对比 如表1所示,与正常组相比,模型组、上调组、下调组ALP水平降低,PSA、VEGF水平升高,具有统计学差异(P<0.05);与模型组相比,上调组PSA、VEGF水平下降,ALP水平升高,具有统计学差异(P<0.05);与上调组相比,下调组ALP水平降低,PSA、VEGF水平升高,具有统计学差异(P<0.05)。
2.4各组免疫炎症因子水平比较 如表1所示,与正常组相比,模型组、上调组、下调组IL-1、TNF-α、MMP-3水平升高,具有统计学差异(P<0.05);与模型组相比,上调组、下调组IL-1、TNF-α、MMP-3水平降低,具有统计学差异(P<0.05);与上调组相比,下调组IL-1、TNF-α、MMP-3水平升高,具有统计学差异(P<0.05)。
2.5各组血脂水平对比 如表2所示,与正常组相比,模型组、上调组、下调组TC、TG水平升高,具有统计学差异(P<0.05);与模型组相比,上调组、下调组TC、TG水平降低,具有统计学差异(P<0.05);与上调组相比,下调组TC、TG水平升高,具有统计学差异(P<0.05)。
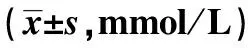
表2 各组血脂水平对比
2.6各组TGF-B/Smads通路蛋白表达对比 如表3、图2所示,与正常组相比,模型组、上调组、下调组TGF-β、Smads表达降低,具有统计学差异(P<0.05);与模型组相比,上调组、下调组TGF-β、Smads表达上升,具有统计学差异(P<0.05);与上调组相比,下调组TGF-β、Smads表达降低,具有统计学差异(P<0.05)。

表3 各组TGF-β/Smads通路蛋白表达对比

图2 4组TGF-B/Smads通路蛋白表达
3 讨 论
前列腺癌的发病病因目前尚未明确,晚期预后不佳〔7〕。研究显示,抑制癌细胞增殖,促进癌细胞凋亡是治疗前列腺癌研究热点〔8〕。随着临床对miRNA的进一步研究显示,miRNA在转录水平上具有抑制该靶基因mRNA的翻译或降解目标mRNA来调控蛋白质表达的作用〔9〕。miRNA是一种非编码RNA,广泛存在于多种生物中,在动物种系中具有保守序列,在血清、血浆中存在较稳定,因此miRNA可应用于诊断肿瘤的潜在血清标志物〔10〕。mRNA可结合靶序列对基因表达产生调节,miRNA在肿瘤的发生中类似于致癌基因和抑癌基因〔11,12〕。相关研究发现,miR-34的异常低表达可使miR-34b下游靶基因水平降低,导致肿瘤增殖,表明调控miR-34可有效抑制癌细胞生长、分化〔13〕。研究发现,miR-34在多种肿瘤(乳腺癌、非小细胞肺癌、肝细胞癌等)中表达均呈异常低表达,分析原因可能与基因启动子区甲基化改变相关〔14,15〕。本研究显示,miR-34b在前列腺癌组织中呈低表达水平,可能与DNA损伤的修复情况有关。报道显示,miR-34b参与列腺癌局部炎症反应,当炎症诱发列腺损伤后可经基因调控作用和介导促进炎症细胞因子表达参与炎症损伤,表现为表达异常升高〔16〕。本研究结果显示,上调miR-34b可有效抑制局部炎症反应,证实miR-34b对前列腺损伤具有良好保护作用。
研究显示前列腺癌大鼠TGF-β/Smads蛋白表达降低〔17〕。TGF-β作为功能细胞因子,在干细胞分化及T细胞调节和分化中发挥至关重要作用。研究发现,TGF-β作为一种有效的肿瘤抑制因子,对恶性肿瘤细胞的增殖、促进、凋亡具有良好的抑制作用,在众多生物学过程中具有重要作用〔18〕。分析其原因可能是其通过细胞突变来影响TGF-β信号通路,将细胞转化为恶性状态,产生基质修饰剂进而促进肿瘤的进展和转移〔19〕。TGF-β/Smad的信号转导是通过由膜结合的Ⅰ、Ⅱ型受体和Smad蛋白形成低聚体复合物参与转录反应的。而Smads家族蛋白在TGF-β信号传导过程中起到关键性作用,且不同的Smad介导不同的TGF-β家族成员的信号转导〔20,21〕。TGF-β作为配体形成的受体复合物,通过激活Smads进入核内,共同激活或抑制它们调节的靶基因的转录。本研究结果提示,上调miR-34b可能通过抑制TGF-β/Smads信号转导通路表达进而降低细胞增殖能力。
综上所述,上调miR-34b可有效抑制局部炎症反应蔓延,延缓前列腺癌骨转移进展,改善PSA、VEGF、MMP-9及血脂的水平,分析其机制可能是TGF-β/Smads通路蛋白表达受到调控。因此miR-34b可作为前列腺癌新的治疗靶点,可进一步进行深入研究。
