HIF-1α诱导m6A阅读蛋白YTHDF1表达对缺氧复氧诱导的小鼠心肌细胞自噬的影响
2023-07-26王磊郭继东韩艺辉王喜萍赵雪燕
王磊 郭继东 韩艺辉 王喜萍 赵雪燕
(1石河子市人民医院心血管内科,新疆 石河子 832000;2北京阜外医院冠心病一病区)
急性心肌梗死(AMI)是全球范围内心力衰竭和猝死的主要原因。在AMI中及时进行闭塞血管的血运重建是抢救缺血性心肌的常用方法,但当氧气重新输送至缺氧心肌时,就会发生心脏缺血/再灌注(I/R)损伤〔1〕。心脏I/R会引起心肌细胞功能障碍,导致心肌细胞死亡,可能会增加心肌梗死面积增加,加重患者的病情〔2〕。因此,解决或减轻局部缺血和再灌注损伤仍然是一个挑战。目前,在许多临床前研究中抑制I/R损伤的治疗主要集中在I/R损伤的发生和调节机制上〔3〕。氧化应激、线粒体功能障碍、炎症和细胞死亡引起的组织改变在I/R损伤的发展中具有重要作用。但是,I/R损伤的确切机制仍不完全清楚。
自噬是维持缺血性损伤过程中细胞正常代谢平衡和内环境稳态的必要条件,在缺血和再灌注过程中都非常重要〔4〕。缺氧诱导因子(HIF)-1α是AMI后心脏适应性变化过程中的主要调节因子之一,当细胞受到低氧刺激时,上调HIF-1α的表达,可通过诱导自噬发挥对心肌的保护作用〔5〕;且HIF-1α的表达水平与缺氧诱导的自噬程度显著相关〔6〕。但HIF-1α通过何种途径诱导自噬激活尚不十分明确。N6-甲基腺嘌呤(m6A)修饰是哺乳动物信使RNA的最常见修饰,研究发现在缺氧/复氧(H/R)处理的心肌细胞和I/R处理的小鼠心脏中,m6A修饰增加,参与H/R处理的心肌细胞自噬和凋亡〔7〕。YTH结构域家族蛋白(YTHDF)1作为RNA m6A甲基化重要的阅读器,是RNA m6A甲基化发挥主要功能的效应分子,也是HIF-1α转录因子的新型直接靶基因〔8〕,与心肌细胞的增殖和心脏再生有关〔9〕。而HIF-1α对H/R后心肌细胞自噬的影响是否与YTHDF1有关还未可知,本研究旨在探讨HIF-1α对H/R后心肌细胞自噬的作用机制。
1 材料和方法
1.1实验材料 小鼠心肌细胞(美国ATCC,YB-3031)购自上海钰博生物科技有限公司;胎牛血清、DMEM培养基、胰蛋白酶均购自美国Gbico公司;Lipofectamine3000转染试剂(L3037)购自Sigma-Aldrich;pcDNA3.1-HIF-1α和其阴性对照质粒(pcDNA3.1-NC)及RT-qPCR引物均由上海GenePharma合成;YTHDF1 siRNA和其阴性对照(siRNA-NC)购自Santa Cruz Biotechnology;CCK-8试剂盒(C0038)、Annexin V-FITC细胞凋亡检测试剂盒(C1062L)、RIPA裂解液(P0013B)、二喹啉甲酸(BCA)试剂盒(P0010)、自噬双标腺病毒Ad-mCherry-GFP-LC3B(mCherry-GFP-LC3B腺病毒,C3011-1ml)均购自碧云天生物科技公司;乳酸脱氢酶(LDH)试剂盒(二硝基苯肼比色法,A020-1-2)、肌酸激酶MB同工酶(CK-MB)测定试剂盒(免疫抑制法,E006-1-1)、肌钙蛋白(cTn)I测定试剂盒(胶乳增强免疫比浊法)(E019-1-1)均购自南京建成生物工程研究所;兔抗HIF-1α(ab179483)、YTHDF1(ab252346)、微管相关蛋白1轻链(LC)3(ab128025)、Beclin-1(ab207612)、β-actin(ab8227)、山羊抗兔IgG H&L(HRP,ab205718)购自英国abcam公司;兔抗自噬相关蛋白2同源物A(ATG2A,15011)、自噬相关蛋白(ATG)14(96752)购自美国Cell Signaling Technology公司。细胞培养箱(Thermo Fisher Scientific公司);ABI Prism® 7300型荧光定量PCR系统(美国应用生物系统公司);FV1000激光扫描共聚焦显微镜、IX73倒置荧光显微镜购自日本Olympus公司;BD FACSCanto Ⅱ流式细胞仪购自美国BD公司;蛋白转膜装置、ChemiDocXRS+化学发光凝胶成像仪购自美国Bio-Rad公司。
1.2实验方法
1.2.1细胞培养和分组处理 将小鼠心肌细胞接种于含10%胎牛血清、100 U/ml青霉素和100 mg/ml链霉素的DMEM培养基中,并在37 ℃、5% CO2的细胞培养箱中进行培养。每隔1 d更换1次培养基。在细胞达到对数生长期时开始实验。
为了模拟I/R损伤,对心肌细胞进行了H/R处理。取对数生长期的心肌细胞,胰蛋白酶消化后以6×106个/ml的浓度接种在96孔板中,待细胞融合约80%后,使用Lipofectamine3000将质粒转染至心肌细胞。细胞分为对照组(正常培养)、H/R组(行H/R处理:在37 ℃下于含1% O2、94% N2和5% CO2的缺氧培养基中培养24 h后,然后在含氧量正常的条件下培养6 h)、pcDNA3.1-NC组(pcDNA3.1-HIF-1α的阴性对照转染至心肌细胞48 h后进行H/R处理)、HIF-1α过表达组(pcDNA3.1-HIF-1α转染至心肌细胞48 h后进行H/R处理)、HIF-1α过表达+si-NC组(pcDNA3.1-HIF-1α和YTHDF1 siRNA阴性对照共转染至心肌细胞,48 h后进行H/R处理)、HIF-1α过表达+si-YTHDF1组(pcDNA3.1-HIF-1α和YTHDF1 siRNA共转染至心肌细胞,48 h后进行H/R处理)。
1.2.2实时荧光定量-聚合酶链反应(RT-qPCR)检测细胞中HIF-1α和YTHDF1 mRNA表达 使用TRIzol试剂提取细胞中总RNA,分光光度计测量总RNA的浓度,然后反转录为cDNA,进行RT-qPCR扩增。反应体系(20 μl):cDNA(200 ng/μl) 2 μl,SYBR® Premix Ex TaqTM(2×) 10 μl,上下游(引物序列:HIF-1α上游引物:5′-CCACAGGACAGTACAGGATG-3′、下游:5′-TCAAGTCGTGCTGAATAATAC-3′;YTHDF1上游引物:5′-GTGTATGAGGTGGTCAGCAT-3′、下游:5′-CTTGTTGAGGGAGTCACTGT-3′;β-actin上游引物:5′-TGTCCACCTTCCAGCAGATGT-3′、下游:5′-AGCTCAGTAACAGTCCGCCTAGA-3′;各0.4 μl,ddH2O 7.2 μl。循环条件:94 ℃ 10 min,然后再94 ℃持续10 s,60 ℃ 20 s和72 ℃ 1 min进行40个循环。用β-actin作为内参对照,采用2-ΔΔCt方法计算HIF-1α和YTHDF1 mRNA相对表达量。
1.2.3CCK-8法检测细胞活力 将心肌细胞以每孔2×103个细胞的密度接种在96孔板中,培养过夜,按照1.2.1中步骤进行分组及处理。复氧6 h后,向每孔中加入CCK-8溶液10 μl,于培养箱中继续孵育2 h,然后于450 nm波长处测定各孔吸光度(A),计算细胞活力。以培养基为空白孔调零,细胞活力=(实验组A值-空白孔A值)/(对照组A值-空白孔A值)×100%。
1.2.4流式细胞术检测细胞凋亡 心肌细胞按照1.2.1中进行分组与处理,复氧6 h后,用胰蛋白酶消化各组细胞,PBS洗涤后加500 μl 1×结合缓冲液重悬细胞并调整细胞浓度为1×106个/ml。取细胞悬浮液100 μl,然后分别加入Annexin Ⅴ-FITC和PI各5 μl,避光孵育15 min。再加入400 μl 1×结合缓冲液,用流式细胞仪检测各组心肌细胞凋亡率。
1.2.5试剂盒检测细胞上清液中CK-MB、LDH、cTnI水平 收集各组心肌细胞培养上清液,4 ℃、3 000 r/min离心10 min,分离上清,二硝基苯肼法测定上清液中LDH水平,免疫抑制法检测CK-MB水平,免疫比浊法检测cTnI水平。具体步骤参考试剂盒说明书操作进行。
1.2.6mCherry-GFP-LC3重组腺病毒转染的免疫荧光法检测心肌细胞自噬 将mCherry-GFP-LC3腺病毒以40 MOI(感染复数)于37 ℃在含有5% CO2的培养箱中转导于24孔板中培养的心肌细胞(1×105个/孔),持续24 h。转导后,将细胞与新鲜培养基在37 ℃下孵育12 h,按照1.2.1中步骤进行转染和H/R,并于激光共聚焦显微镜下随机选择3个区域,计数每个细胞的自噬体(mCherry+GFP黄色)和自噬溶酶体(mCherry红色)的数量。
1.2.7Western印迹检测心肌细胞HIF-1α、YTHDF1及自噬相关蛋白的表达 收集各组细胞,使用RIPA裂解液提取细胞中蛋白质。BCA法测定总蛋白浓度后,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量的蛋白质样品(40~60 μg),并转移到聚偏氟乙烯(PVDF)膜上。在室温下,用5%脱脂牛奶封闭2 h,然后在4 ℃下与一抗(HIF-1α、YTHDF1、LC3、ATG2A、ATG14、Beclin1、β-actin,稀释度1∶500)孵育过夜。随后与辣根过氧化物酶(HRP)耦联的二抗(稀释度1∶1 000)在室温下孵育1 h,并使用电化学发光(ECL)系统进行检测。以β-actin为内参蛋白,分析结果。
1.3统计学分析 所有实验重复至少3次,使用GraphPad Prism9.0软件进行Kolmogorov-Smirnov检验、t检验、方差分析、Bonferroni事后检验。
2 结 果
2.1各组心肌细胞HIF-1α和YTHDF1的表达 与对照组相比,H/R组心肌细胞中HIF-1α和YTHDF1mRNA和蛋白表达显著增加(P<0.05);与H/R组相比,HIF-1α过表达组、HIF-1α过表达+si-NC组、HIF-1α过表达+si-YTHDF组心肌细胞中HIF-1α和YTHDF1 mRNA和蛋白表达显著增加(P<0.05);与HIF-1α过表达组相比,HIF-1α过表达+si-YTHDF1组YTHDF1 mRNA和蛋白表达水平显著降低(P<0.05)。见图1、表1。
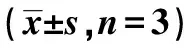
表1 各组HIF-1α、YTHDF1表达、细胞活力及细胞凋亡率
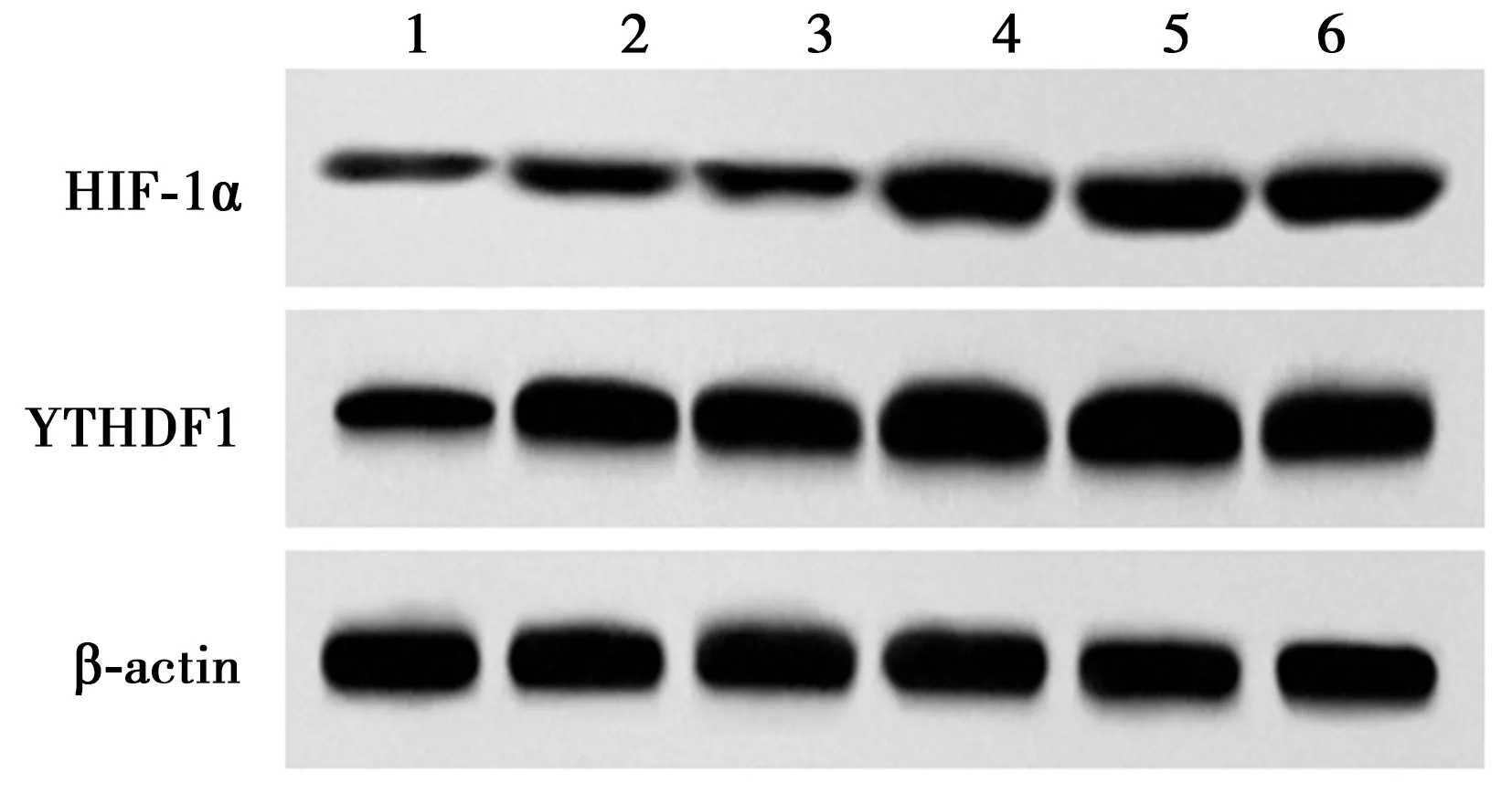
1~6:对照组,H/R组,pcDNA3.1-NC组,HIF-1α过表达组,HIF-1α过表达+si-NC组,HIF-1α过表达+si-YTHDF1组;图4同图1 Western印迹检验各组心肌细胞中HIF-1α和YTHDF1蛋白表达
2.2各组心肌细胞活力与细胞凋亡率 与对照组相比,H/R组心肌细胞活力显著降低,细胞凋亡率显著升高(P<0.05);与H/R组相比,HIF-1α过表达组、HIF-1α过表达+si-NC组、HIF-1α过表达+si-YTHDF组心肌细胞活力显著升高,细胞凋亡率显著降低(P<0.05);与HIF-1α过表达组相比,HIF-1α过表达+si-YTHDF1组细胞活力显著降低,细胞凋亡率显著升高(P<0.05)。见表1、图2。

图2 流式细胞术检测各组心肌细胞凋亡率
2.3各组LDH、CK-MB、cTnI水平 与对照组相比,H/R组LDH、cTnI、CK-MB水平显著升高(P<0.05);与H/R组相比,HIF-1α过表达组、HIF-1α过表达+si-NC组、HIF-1α过表达+si-YTHDF组心肌细胞LDH、cTnI、CK-MB水平显著降低(P<0.05);与HIF-1α过表达组相比,HIF-1α过表达+si-YTHDF1组细胞培养上清液中LDH、cTnI、CK-MB水平显著升高(P<0.05)。见表2。
表2 各组LDH、CK-MB、cTnI水平、自噬体和自噬溶酶体数量比较
2.4各组心肌细胞自噬情况 对照组心肌细胞表现出基础自噬,很少有自噬体和自噬溶酶体。与对照组相比,H/R组Ad-LC3-心肌细胞自噬体和自噬溶酶体数量显著增加(P<0.05);与H/R组相比,HIF-1α过表达组、HIF-1α过表达+si-NC组、HIF-1α过表达+si-YTHDF组Ad-LC3-心肌细胞自噬体和自噬溶酶体数量显著增加(P<0.05);与HIF-1α过表达组相比,HIF-1α过表达+si-YTHDF1组心肌细胞自噬体和自噬溶酶体数量显著降低(P<0.05)。见表2、图3。
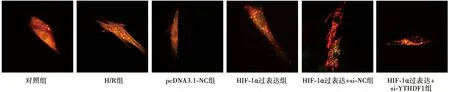
图3 各组心肌细胞表达(mCherry-GFP-LC3免疫荧光,×1 000)
2.5各组心肌细胞自噬相关蛋白的表达 与对照组相比,H/R组LC3Ⅱ/LC3Ⅰ比值、Beclin-1、ATG2A、ATG14表达显著增加(P<0.05);与H/R组相比,HIF-1α过表达组、HIF-1α过表达+si-NC组、HIF-1α过表达+si-YTHDF组LC3Ⅱ/LC3Ⅰ比值、Beclin-1、ATG2A、ATG14表达显著增加(P<0.05);与HIF-1α过表达组相比,HIF-1α过表达+si-YTHDF1组心肌细胞LC3Ⅱ/LC3Ⅰ比值、Beclin-1、ATG2A、ATG14表达显著降低(P<0.05)。见表3、图4。
表3 各组心肌细胞自噬相关蛋白表达
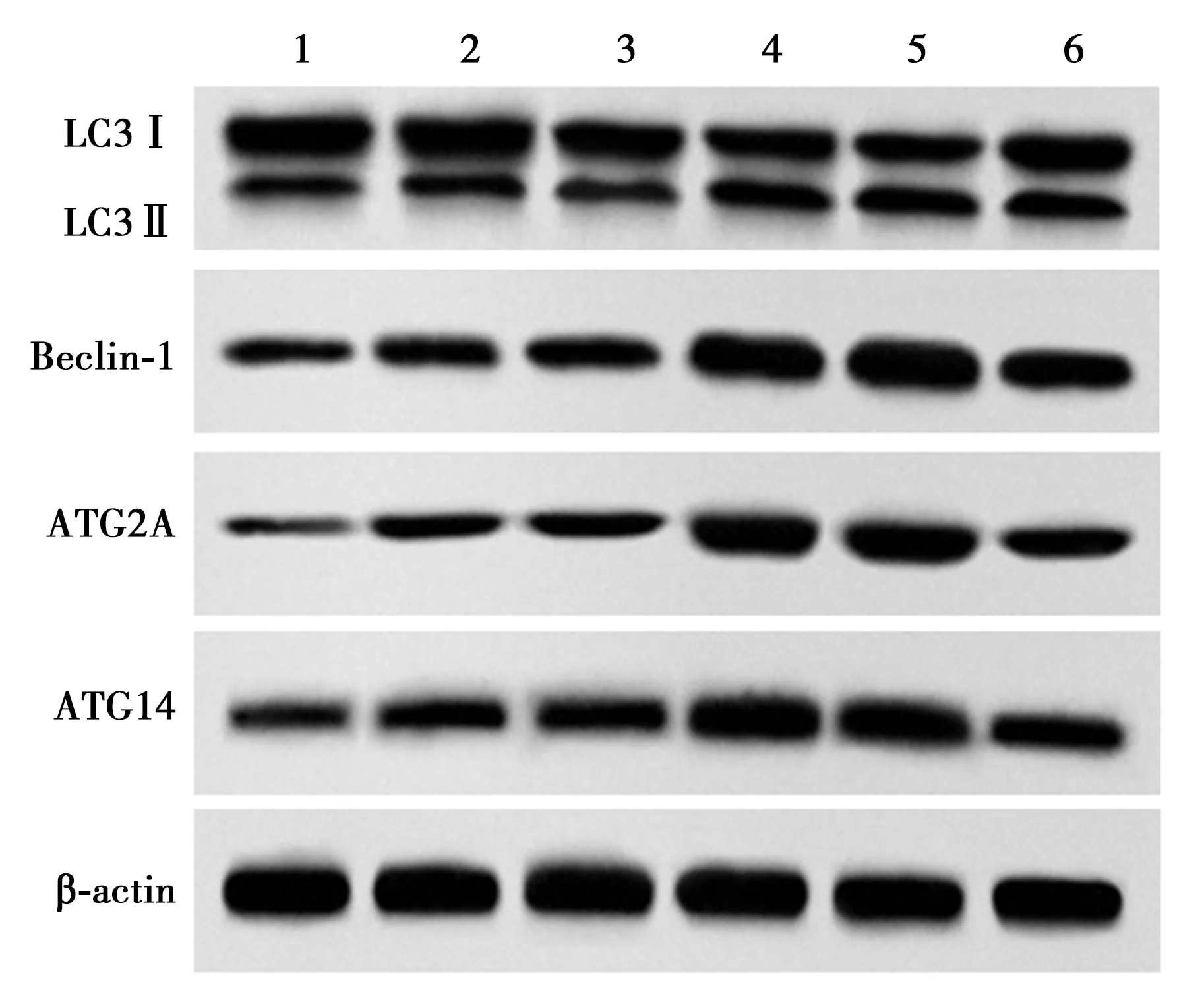
图4 Western印迹检测各组心肌细胞自噬相关蛋白的表达
3 讨 论
自噬在人体许多疾病的发生和发展中发挥着重要作用,包括AMI。AMI伴有多种病理特征,例如心肌细胞凋亡和心肌重塑。心肌细胞凋亡是AMI后心肌损伤的主要原因,缺氧是引起心肌细胞凋亡的重要因素。适度的心肌自噬可减少心肌细胞的凋亡并改善心肌细胞的存活〔10〕。
HIF-1α是低氧环境下细胞内一种重要的转录调控因子,负责诱导有助于适应缺氧的基因表达,如可调节一系列与糖酵解、葡萄糖代谢、线粒体功能、细胞存活、凋亡和抗氧化应激相关的基因表达〔11〕。正常生理条件下,细胞内不断合成的HIF-1α可通过泛素-蛋白酶途径降解;但是当细胞受到低氧刺激时,HIF-1α的降解受到抑制,在胞内大量聚集,导致HIF-1α易位到细胞核中并通过调控其靶基因的表达从而维持细胞的能量代谢。研究发现,在AMI和心肌细胞缺氧后,HIF-1α表达呈上升趋势〔12〕;HIF-1α的激活还刺激自噬,这是一种溶酶体介导的降解途径,可通过去除危险成分(尤其是不健康的线粒体和过氧化物酶体)来维持细胞的稳态〔13〕。在缺氧条件下,心肌细胞可诱导自噬,HIF-1α过表达可增强缺氧诱导的自噬,改善心肌细胞的凋亡,保护心肌免受I/R损伤〔14~16〕。H/R刺激抑制心肌细胞的细胞活力,培养液中LDH、cTnI和CK-MB的水平可反映H/R引起的心肌细胞损伤程度〔17,18〕。Ding等〔19〕研究显示,使用HIF-1α-siRNA可减少低氧诱导的心肌细胞自噬。这些数据表明,HIF-1α诱导了心肌细胞H/R损伤过程中自噬通量的上调。
研究发现,HIF-1α在缺氧条件下可激活YTHDF1转录,而YTHDF1是RNA m6A甲基化的阅读器,也是HIF-1α调控的下游靶基因,其表达水平与缺氧诱导的自噬显著相关〔8〕。Beclin-1是自噬的直接执行者,参与自噬泡的形成,其表达量越高说明细胞的自噬活性越强;LC3位于自噬泡的膜表面,其含量与自噬泡形成的数量呈正比,并通过将位于胞质中的LC3Ⅰ转化为结合自噬体的LC3Ⅱ,在自噬体形成中起关键作用〔20〕。因此,Beclin-1和LC3的表达量可以用来衡量细胞自噬的程度。自噬相关基因ATG2A和ATG14是YTHDF1的下游目标,也是细胞中自噬的关键调节蛋白,在缺氧诱导的肝细胞癌中,缺氧以HIF-1α依赖的方式上调了YTHDF1的表达,而且YTHDF1可在CDS上直接结合并识别ATG2A和ATG14的m6A甲基化,从而通过募集起始因子和促进核糖体负载来促进ATG2A和ATG14的翻译与缺氧诱导的自噬;敲除YTHDF1会降低正常氧和缺氧条件下肝癌细胞中LC3的表达〔8〕。Han等〔9〕研究发现,YTHDF1在新生儿心脏中的含量在出生后有所减少,ALKBH5过表达上调了YTHDF1 mRNA和蛋白表达,可促进心肌细胞增殖,有助于恢复受损心脏组织;敲除ALKBH5或使用YTHDF1 siRNA转染培养的心肌细胞,可降低YTHDF1表达,抑制心肌细胞增殖。本研究结果提示,HIF-1α对H/R诱导的心肌细胞自噬的促进作用可能与上调YTHDF1的表达有关。
