真空冷藏条件下罗非鱼内源蛋白酶对鱼片质构劣化的作用
2023-07-22范铭良郝淑贤李来好陈胜军岑剑伟吴燕燕魏涯相欢黄卉
范铭良 郝淑贤 李来好 陈胜军 岑剑伟 吴燕燕 魏涯 相欢 黄卉

摘要:【目的】探究冷藏期間造成罗非鱼鱼肉质构品质劣化的关键蛋白酶,为提升冷藏鱼肉品质提供理论依据。【方法】对罗非鱼鱼片进行真空包装,于4 ℃下冷藏,在0~6 d内对鱼肉进行质构、pH、肌原纤维小片化指数(MFI)、内源蛋白酶活性及在不同细胞器的分布和肌原纤维SDS-PAGE图谱测定,并通过皮尔逊相关分析确定冷藏期间造成鱼肉质构劣化的关键蛋白酶。【结果】冷藏过程中,罗非鱼鱼肉pH呈先降低后升高的变化趋势,最终pH为6.68;硬度和MFI分别呈下降和升高的趋势;组织蛋白酶B+L活性变化整体表现为升高趋势,第6 d时活性为初始值的1.27倍,在肌原纤维、肌浆蛋白和线粒体中活性呈先上升后下降的变化趋势,在溶酶体中活性呈下降趋势;组织蛋白酶B、D活性变化整体表现为先升高后降低,且均在第4 d达最大值,分别为初始值的1.20和1.48倍,肌原纤维、肌浆蛋白和线粒体中的组织蛋白酶B活性呈先升高后降低的变化趋势,溶酶体中的组织蛋白酶B活性呈下降趋势,肌原纤维和肌浆蛋白中的组织蛋白酶D活性呈升高趋势,溶酶体和线粒体中的组织蛋白酶D活性呈降低趋势;钙离子浓度呈升高趋势,钙激活蛋白酶活性呈先升高后降低的变化趋势;肌原纤维蛋白SDS-PAGE图谱中肌球蛋白重链、肌动蛋白和肌球蛋白轻链的条带逐渐减少和模糊;组织蛋白酶B、B+L活性与鱼肉硬度呈极显著负相关(P<0.01,下同),与鱼肉MFI呈极显著正相关;组织蛋白酶D和钙激活蛋白酶活性与鱼肉硬度和MFI无显著相关性(P>0.05)。【结论】组织蛋白酶B和组织蛋白酶L参与肌原纤维蛋白的降解和线粒体介导的细胞凋亡,可能是冷藏期间罗非鱼鱼肉质构劣化的2个关键靶点酶,可采取有效技术手段对其活性进行抑制,进而提升贮藏期间鱼肉质构品质。
关键词:内源蛋白酶;质构品质;鱼肉贮藏;肌原纤维蛋白;罗非鱼鱼片
中图分类号:S986.1 文献标志码:A 文章编号:2095-1191(2023)02-0555-09
Abstract:【Objective】 To investigate key proteases that caused deterioration of tilapia meat texture quality during refrigeration, and to provide a theoretical basis for refrigerated fish meat quality improvement. 【Method】Tilapia fillets were vacuum-packed and refrigerated at 4 ℃,and texture,pH,myofibril fragmentation index (MFI),endogenous protease activity, endogenous protease distribution in organelles and myofibril SDS-PAGE profiles were determined during 0-6 d. Key proteases that caused the deterioration of fish meat texture during refrigeration were identified through Pearson correlation analysis. 【Result】pH of tilapia fish meat decreased and then increased during refrigeration,with a final pH of 6.68; hardness decreased but MFI increased; cathepsin B+L activity increased overall as it was 1.27 times of its initial value on 6 d, and it first increased and then decreased in myofibril, myogen and mitochondria but it decreased in lysosome; cathepsin B activity and cathepsin D activity increased and then decreased, and they both reached the maximum on 4 d, which were 1.20 times and 1.48 times of their initial values, respectively. Cathepsin B activity in myofibril, myogen and mitochondria first increased and then decreased but it decreased in lysosome; cathepsin D activity increased in myofibril and myogen, but it decreased in lysosome and mitochondria; calcium ion concentration increased and calcium-activated protease activity first increased and then decreased; myofibrillar protein SDS-PAGE profile showed that bands of myosin heavy chain, actin, and myosin light chain became less and blurred; cathepsin B activity and cathepsin B+L activity had an extremely negative correlation with fish meat hardness(P<0.01,the same below), and they also had an extremely negative correlation with MFI of fish meat; cathepsin D activity and calcium-activated protease activity were not significantly correlated with fish meat hardness or MFI(P>0.05). 【Conclusion】Cathepsin B and cathepsin L participate in myofibrillar protein degradation and mitochondria-mediated apoptosis, and such situation may be attributed to the two key target enzymes for tilapia meat deterioration during refrigeration. Available techniques can be taken to inhibit their activity to improve fish meat texture quality during storage.
Key words: endogenous protease; texture quality; fish meat storage; myofibrillar protein; tilapia fillet
Foundation items:National Special Freshwater Fish Industry Technology System Project(CARS-46);Fundamental Research Funds for Chinese Academy of Fishery Sciences(2020TD69);Central Public-interest Scientific Institution Basal Research Fund of South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences(2021SD06)
0 引言
【研究意义】罗非鱼(Oreochromis niloticus)含有丰富的氨基酸,是一种高蛋白的经济鱼类(熊雅雯等,2022)。我国是罗非鱼生产大国,2020年罗非鱼养殖产量达165.54万t,占淡水鱼总产量的6.4%(农业农村部渔业渔政管理局等,2021),具有极好的发展前景。随着罗非鱼市场的扩大,消费者对鱼肉的品质要求更高,只需通过简单的触碰就能判断鱼肉的硬度,但鱼肉在运输和贮藏期间软化现象十分严重,影响罗非鱼消费市场。因此,明确罗非鱼在冷藏过程中鱼肉软化的潜在靶点,对于提高罗非鱼在贮藏储运期间质构品质具有重要意义。【前人研究进展】鱼肉的质地是消费者判断其新鲜的重要指标,鱼肉在贮藏期间质地品质劣化十分严重。Bao等(2020)发现青鱼(Mylopharyngodon piceus)在冷藏过程中随着肌钙蛋白、肌球蛋白和肌动蛋白的降解,肌纤维与肌原纤维出现缝隙,可能是鱼肉在贮藏过程中品质下降的一个原因。Tang等(2020)研究鳜鱼(Siniperca chuatsi)死后贮藏结构蛋白与肌肉品质的关系,发现结构蛋白被降解会影响肌原纤维的完整性,从而影响肌肉品质。Zhou等(2020)研究河豚鱼(Takifugu obscurus)肌肉品质与贮藏温度的关系,发现在0 ℃时鱼肉的肌原纤维完整性最好;肌原纤维的完整性越好,鱼肉的肌肉品质就越好。贮藏期间鱼肉质地劣化是迫切需要解决的问题,近年来,内源蛋白酶在鱼肉质地劣化中的作用受到关注,目前认为涉及到肌原纤维等蛋白降解主要是钙激活蛋白酶系统和组织蛋白酶系统进行的(Zhang and Xie,2020)。钙激活蛋白酶是钙依赖型的细胞内中性半胱氨酸蛋白酶,其活性与钙离子浓度相关(孙蕾蕾等,2014)。Chéret等(2007)研究内源蛋白酶与对舌齿鲈(Dicentrarchus labrax L.)鱼肉肌原纤维蛋白降解的关系,发现钙激活蛋白酶系统对海鲈鱼肌原纤维蛋白降解过程是次要作用。组织蛋白酶中能引起肌原纤维降解,导致鱼肉品质劣化的主要是组织蛋白酶B、D和L。Nielsen和Nielsen(2001)在鲱鱼(Clupea harengus)中发现组织蛋白酶D能降解肌球蛋白重链。Ladrat等(2003)在研究海鲈鱼蛋白水解中发现组织蛋白酶L能降解鱼肉中的肌球蛋白和肌动蛋白,且能与组织蛋白酶B同时降解肌球蛋白重链。Godiksen等(2009)在研究虹鳟鱼(Oncorhynchus mykiss)肌肉蛋白降解中发现组织蛋白酶B、D和L能对肌肉蛋白进行降解,且组织蛋白酶D对鱼肉硬度影响明显。Lomiwes等(2014)发现在低pH情况下,组织蛋白酶B活性越高,肌间线蛋白降解越快,肌间线蛋白降解会导致肌原纤维束解离。【本研究切入点】虽然已有一些对内源性蛋白酶和鱼肉软化的研究,但有关罗非鱼鲜见报道,不同的鱼类因品种和生长环境不同,鱼肉内源蛋白酶与肌肉蛋白也不相同,且负责质地软化的每种组织蛋白酶的相对作用有所不同(Godiksen et al.,2009;Wang et al.,2009;Ahmed et al.,2013)。此外,关于内源性蛋白酶及组织蛋白酶亚细胞再分布在罗非鱼冷藏储存期间鱼片质地变化中的作用,目前发表的信息有限。【拟解决的关键问题】以尼罗罗非鱼鱼片为试验材料,研究罗非鱼鱼肉真空包装在4 ℃条件下冷藏0~6 d内质构变化、钙离子浓度变化、钙激活蛋白酶活性变化、肌原纤维蛋白降解程度、组织蛋白酶活性变化及其亚细胞再分布,并确定在冷藏期间罗非鱼鱼肉软化的靶点,为提升冷藏期间罗非鱼鱼肉质构品质提供理论依据。
1 材料与方法
1. 1 试验材料
尼羅罗非鱼购自广州市华润万家超市,质量为800±50 g/条。Fura-2 AM、BeyoColorTM彩色预染蛋白、5×SDS-PAGE上样缓冲液和考马斯亮蓝染色液购自上海碧云天生物技术有限公司;Z-Arg-Arg-AMC、Z-Phe-Arg-AMC和N-Suc-Leu-Tyr-AMC购自美国Sigma公司;NuPAGETM Bis-Tris预制胶(12%)和NuPAGETM MOPS SDS电泳缓冲液(20×)购自英潍捷基(上海)贸易有限公司;苯甲基磺酰氟(PMSF)购自广州领驭生物科技有限公司。主要仪器设备:3K30型台式高速冷冻离心机(德国Sigma公司)、Sunrise-basic Tacan吸光酶标仪(瑞士TECAN公司)、Mini Gel Tank蛋白电泳槽(美国Invitrogen公司)、CT3质构仪(美国Brookfield公司)、Image Scanner III凝胶成像扫描仪(美国GE公司)和Cary Eclipse荧光分光光度计(美国VARIAN公司)。
1. 2 试验方法
1. 2. 1 罗非鱼样品处理 将8条鲜活的罗非鱼敲击致死,将背部新鲜白肉切成2 cm×2 cm×1 cm的块状,共46个样品,对样品真空包装并进行4 ℃冷藏。
1. 2. 2 鱼肉质构测定 参考黄卉等(2018)的方法稍作修改,取罗非鱼鱼片2条对角线上的6个点进行测定,设置测试速度为30 mm/min,下压缩距离0.3 cm,记录测定的硬度值。
1. 2. 3 鱼肉pH测定 参考GB 5009.237—2016《食品安全国家标准 食品pH值的测定》进行测定。
1. 2. 4 肌原纤维小片化指数(Myofibril fragmentation index,MFI)测定 参考张诗泉等(2022)的方法稍作修改,取2 g鱼肉与30 mL缓冲液(25 mmo/L磷酸盐缓冲液、100 mmol/L KCI、1 mmol/L EDTA、1 mmol/L MgCl2,pH 7.0)在冰水中均质30 s,间隔20 s后再均质30 s,用纱布过滤,将混合液离心15 min(4 ℃,10000×g),将沉淀再溶于缓冲液中,转速离心15 min(4 ℃,10000×g),将所得沉淀悬于缓冲液中,将样品蛋白浓度稀释为0.5 mg/mL,将540 nm处测得的吸光值乘以200即为MFI。
1. 2. 5 肌原纤维蛋白提取 参考李锐等(2020)的方法稍作修改,称取2 g罗非鱼碎肉,加入10 mL Tris-HCl缓冲溶液(10 mmol/L Tris-HCl、1mmol/L PMSF,pH 7.2),均质30 s,间隔20 s后再均质30 s,均质后离心15 min(4 ℃,10000×g),加入20 mL盐溶液(0.06 mol/L NaCl、10 mmol/L Tris-HCl、1 mmol/L PMSF,pH 7.2)溶解沉淀后均质1 min,温度保持在4 ℃左右,静置30 min后离心15 min(4 ℃,10000×g),上清液即为肌原纤维蛋白。
1. 2. 6 肌原纤维蛋白变性聚丙烯酰胺凝胶电泳 参考李锐等(2020)的方法稍作修改,上清液与上样缓冲液混合,体积比为3∶2,在沸水中放置3 min,得到电泳样品。电泳电压设为100 V,染色1 h,脱色1 h,染色剂为考马斯亮蓝R250,脱色液由10%醋酸、40%乙醇和50%水组成。
1. 2. 7 亚细胞结构分离 罗非鱼肌原纤维和溶酶体分级与提取参考Ge等(2015)的方法,取3 g鱼肉在15 mL缓冲液中(100 mmol/L蔗糖、100 mmol/L KCl、50 mmol/L Tris、10 mmol/L Na4P2O7、1 mmol/L Na2EDTA,pH 7.2)均质1 min,用纱布过滤后离心10 min(4 ℃,1100×g),将沉淀悬于缓冲液中即为肌原纤维部分,将剩余的上清液离心(4 ℃,3000×g)10 min,此时的沉淀为线粒体部分,将上清液继续离心30 min(4 ℃,16000×g),沉淀为溶酶体部分,上清液为肌浆。
1. 2. 8 钙离子浓度测定 参考Thompson等(2020)的方法稍有修改,取3 g绞碎的鱼肉与30 mL预冷缓冲液(118 mmol/L NaCl、4 mmol/L KCl、66 mmol/L MgCl2、330 mmol/L HEPES、5 mmol/L NaH2PO4、5 mmol/L葡萄糖)混合,混匀后离心15 min(4 ℃,5000×g),将上清液与1 μmol/L Fura-AM在室温下静置1 h,采用酶标仪测定混合液在发射波长510 nm、激发波长分别在340和380 nm的吸光值,340与380 nm处吸光值之比即为钙离子浓度。
1. 2. 9 钙激活蛋白酶和组织蛋白酶B、D、L的提取及活性測定 参考Xu等(2015)的方法,取10 g鱼肉加入20 mL 20 mmol/L Tris溶液(pH 7.5),均质30 s,间隔20 s后再均质30 s,在4 ℃下不时搅拌30 min,随后离心20 min(4 ℃,16000×g),上清液即为粗酶提取液。组织蛋白酶B和L特异性荧光底物分别为Z-Arg-Arg-AMC和Z-Phe-Arg-AMC,钙激活蛋白酶反应底物为N-Suc-Leu-Tyr-AMC,底物浓度均为20 μmol/L。取粗酶液0.5 mL,与0.25 mL反应缓冲液(组织蛋白酶B:352 mmol/L KH2PO4、48 mmol/L Na2HPO4、4 mmol/L Na2EDTA,pH 6.0,使用前配制成含8 mmol/L L-Cys的新鲜溶液;组织蛋白酶L:340 mmol/L NaAc、60 mmol/L HAc、4 mmol/L Na2EDTA,pH 5.5,使用前配制成含8 mmol/L DTT的新鲜溶液;钙激活蛋白酶:150 mmol/L Tris-HCl、7.5 mmol/L CaCl2,pH 6.0)混合,在37 ℃恒温箱中预热10 min,加入对应的反应底物,反应30 min后加入2.5 mL终止液(50 mmol/L Tris-HCl、1% SDS,pH 7.0)。采用荧光分光光度计测定7-氨基-4-甲基香豆素(AMC)的释放量。测定条件为激发波长340 nm、发射波长440 nm。酶活力单位定义为1 min内释放出1 μmol/L AMC所需的酶量。
组织蛋白酶D的提取与活性测定(李来好等,2015):称取15 g碎鱼肉,加入10倍体积的预冷丙酮,均质后用布氏漏斗过滤,滤液风干,得到丙酮粉,加入20 mL KCl溶液(2%),混匀后离心15 min(4 ℃,10000×g),所得上清液即为组织蛋白酶D粗酶液。取酶液与酸化的牛血红蛋白反应,参考Lowry法测定释放出的多肽,每个酶活力单位定义为1 min内释放1 μmol/L Tyr所需的酶量。
1. 3 统计分析
采用SPSS 23.0和Origin 8.5处理试验数据,并进行相关分析和差异显著性分析。
2 结果与分析
2. 1 罗非鱼鱼肉在冷藏期间pH、硬度和MFI的变化
鱼肉贮藏过程中pH变化能反映肌肉组织的生化变化,肌肉组织生理环境的改变会影响肌肉品质,因此pH是衡量鱼肉品质的重要指标。由表1可知,真空冷藏0~3 d,罗非鱼鱼肉pH显著降低(P<0.05,下同),在3~4 d pH略有升高,在5~6 d pH无显著变化(P>0.05,下同),最终pH为6.68。
鱼肉硬度是反映鱼肉质构品质的重要指标,也是消费者判断鱼肉新鲜度的一种方式。如表1所示,在真空冷藏条件下,罗非鱼鱼肉在0~5 d内硬度显著降低,在5~6 d硬度无显著变化,最终鱼肉硬度较初始值下降59.05%。
MFI能反映肌原纤维结构和肌原纤维蛋白的完整性。如表1所示,在冷藏期间,罗非鱼鱼肉MFI在0~6 d内显著增加,最终值为初始值的2.44倍。
2. 2 冷藏期间罗非鱼鱼肉中组织蛋白酶B、B+L和D的活性变化
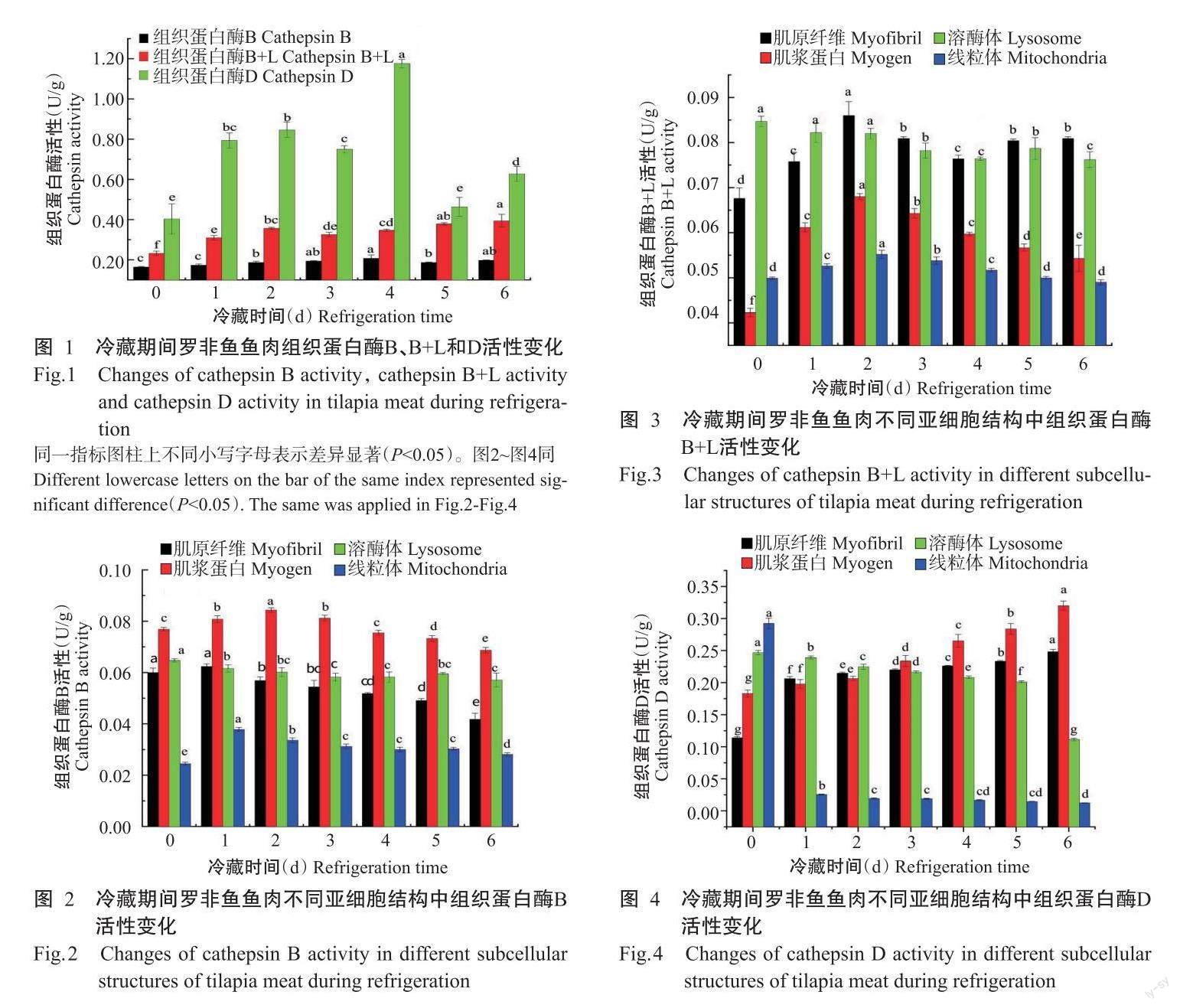
罗非鱼在贮藏过程中质地品质劣化主要由内源蛋白酶对肌原纤维的降解导致,为进一步明确鱼肉质地劣化的重要蛋白酶,对鱼肉贮藏过程中内源蛋白酶的活性进行考察。如图1所示,在整个冷藏期间,组织蛋白酶B+L活性变化整体为升高趋势,在第6 d时活性为初始值的1.27倍;组织蛋白酶B和D活性变化整体为先升高后降低,且均在第4 d达最大值,分别为初始值的1.20和1.48倍,第6 d时组织蛋白酶D活性为初始值的1.56倍。
2. 3 冷藏过程中罗非鱼鱼肉中组织蛋白酶B、B+L、D活性及分布变化
鱼体死后,肌肉细胞中的组织蛋白酶从溶酶体中释放后,会发挥其蛋白水解作用。如图2所示,冷藏期间鱼肉肌原纤维、肌浆蛋白和线粒体中的组织蛋白酶B活性整体变化为先升高后下降,分别在第1、2和1 d达最大值,此时活性分别为初始值的1.02、1.10和1.55倍,之后随贮藏时间延长活性下降,第6 d时,活性分别为初始值的70%、89%和1.15倍;在溶酶体中组织蛋白酶B活性呈下降趋势,第6 d活性降低11.75%。冷藏期间鱼肉肌原纤维、肌浆蛋白和线粒体中的组织蛋白酶B+L活性呈先升高后降低的变化趋势,且均在第2 d达最大值,活性分别为初始值的1.27、1.61和1.11倍,之后随着贮藏时间延长活性下降,第6 d时活性分别为初始值的1.20倍、1.28倍和98%;在溶酶体中组织蛋白酶B+L活性呈下降趋势,贮藏至第6 d时活性降低10.00%(图3)。由图4可知,冷藏期间鱼肉肌原纤维、肌浆蛋白和线粒体中的组织蛋白酶D活性变化与组织蛋白酶B、L不同,肌原纤维和肌浆蛋白中的组织蛋白酶D活性在冷藏期间呈持续上升趋势,第6 d时活性分别为初始值的2.18和1.75倍;而溶酶体和线粒体中的组织蛋白酶D活性在冷藏期间呈下降趋势,在第6 d时活性分别降低54.94%和95.79%。
2. 4 冷藏期间罗非鱼鱼肉肌浆中钙离子浓度和钙激活蛋白酶活性变化
由图5可知,在0~1 d罗非鱼鱼肉钙激活蛋白酶活性显著增加,提升43.00%,鱼肉肌浆中钙离子浓度在0~1 d内也显著增加(图6),但随着冷藏时间的延长钙激活蛋白酶活性降低,最终活性接近于初始值。而钙离子浓度在0~4 d内显著增加,在4~6 d内无显著变化,最终值为初始值的1.36倍。
2. 5 罗非鱼贮藏过程中肌原纤维蛋白SDS-PAGE作用
由图7可知,冷藏6 d的罗非鱼鱼肉肌原纤维蛋白相对分子质量为17~220 kD;其中,肌球蛋白重链(Myosinheavychain,MHC)(相对分子质量220 kD)、肌动蛋白(Actin)(相对分子质量45 kD)和肌球蛋白輕链(Myosinlightchain,MLC)(相对分子质量17~20 kD)条带相对清晰。在0~6 d内,随着贮藏时间的延长,MHC、肌动蛋白和MLC的条带逐渐减少和模糊,反映了在贮藏过程中罗非鱼鱼肉肌原纤维蛋白降解情况。
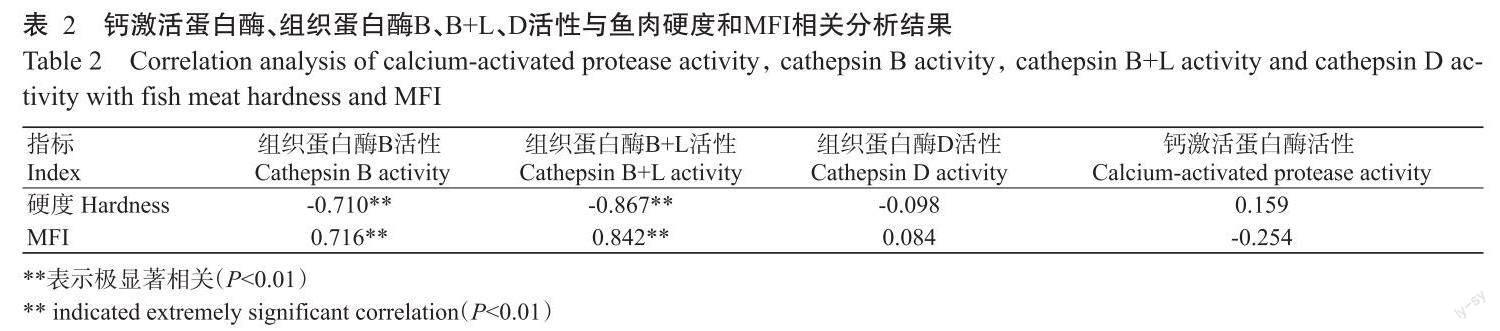
2. 6 鱼肉内源蛋白酶活性与鱼肉硬度和MFI的相关分析结果
对冷藏过程中罗非鱼鱼肉中的内源蛋白酶活性与鱼肉硬度和MFI进行皮尔逊相关分析,结果如表2所示,冷藏过程中罗非鱼鱼肉中组织蛋白酶B、B+L活性与鱼肉硬度呈极显著负相关(P<0.01,下同),与鱼肉MFI呈极显著正相关;组织蛋白酶D和钙激活蛋白酶活性与鱼肉硬度和MFI无显著相关性。
3 讨论
3. 1 冷藏过程中罗非鱼鱼肉理化指标的变化
鱼肉硬度和MFI作为反映鱼肉质量和组织特征的重要指标,由于鱼肉汁液流失、蛋白质降解和变性氧化等而导致鱼肉组织有不同程度的硬度变化,而MFI能反映肌原纤维的完整性。因此,硬度和MFI在鱼肉及其产品的科学研究和产品开发中具有重要意义。郝子娜等(2022)对4 ℃下的草鱼(Ctenopharyngodon idella)鱼肉在0~9 d内品质变化进行研究,发现随冷藏时间的延长鱼肉硬度不断下降。陈晓楠等(2022)发现冻藏的海鳗鱼(Muraenesox cinereus)鱼肉在0~120 d内MFI随贮藏时间的延长呈持续升高趋势。本研究中,随着贮藏时间的延长,罗非鱼鱼肉中的肌原纤维蛋白在内源蛋白酶的作用下被持续降解,造成鱼肉硬度的下降和MFI的升高。在鱼肉贮藏期间,活性蛋白酶引起的蛋白质三维结构分解是造成鱼肉质构劣化的主要原因,且在贮藏前期发挥的作用远高于微生物(Zhang and Xie,2020)。
pH是衡量鱼肉品质的重要指标之一。罗非鱼被宰杀后,由于厌氧呼吸过程中生成的乳酸和腺嘌呤核苷三磷酸(ATP)被降解生成磷酸,导致鱼肉pH下降,而后随着贮藏时间的延长蛋白质被降解,生成的碱性胺类物质导致鱼肉pH上升。官缘等(2022)研究发现海鲈鱼鱼肉在冷藏0~10 d内pH变化为先下降后升高,本研究在冷藏期间罗非鱼鱼肉pH变化也为先下降后升高,与官缘等(2022)的研究结果一致。
3. 2 冷藏过程中罗非鱼鱼肉组织蛋白酶B、B+L和D在不同细胞器的分布
有研究报道证实在鱼肉贮藏期间,组织蛋白酶B、D和L是造成鱼肉软化的主要原因(Godiksen et al.,2009)。组织蛋白酶主要存在于溶酶体中,与底物无法接触,因此在活鱼体内通常为无活性状态;而鱼死后的冷藏过程中,钙离子浓度增加和pH降低导致溶酶体破坏,使得组织蛋白酶释放,对鱼肉肌细胞中的蛋白质产生降解作用(魏世娜和秦启伟,2018)。对鱼肉中不同细胞器含有的组织蛋白酶B、D和B+L活性进行综合分析,旨在阐明组织蛋白酶B、D和L在罗非鱼鱼肉贮藏期间质量变化中的作用。罗非鱼鱼肉在冷藏期间由于pH降低和钙离子浓度增加导致溶酶体膜破裂,本研究中,在罗非鱼鱼肉冷藏期间溶酶体中的组织蛋白酶B、B+L和D活性均下降。Bahuaud等(2008)发现大西洋鲑鱼(Salmo salar L.)在-1.5和-25 ℃下溶酶体中组织蛋白酶B和B+L活性下降。Ge等(2015)发现草鱼鱼肉在微冻条件下贮藏期间溶酶体中的组织蛋白酶B、B+L和D活性均下降。鱼被宰杀后,肌肉中组织蛋白酶被溶酶体释放后发挥其降解蛋白质的作用,这些蛋白酶还通过水解Bid及抗凋亡蛋白来参与线粒体介导的细胞凋亡,间接影响肌肉蛋白质的降解(Guicciardi et al.,2004;?esen et al.,2012)。因此,线粒体中组织蛋白酶B、L活性的增加,表明组织蛋白酶B、L参与了细胞凋亡过程。本研究中,肌原纤维和肌浆蛋白中的组织蛋白酶B和B+L活性在0~1 d均为增加,而后随着冷藏时间的延长活性降低,说明在贮藏1 d后组织蛋白酶B和B+L可能已开始水解肌原纤维和肌浆中的某些蛋白,且水解速度大于酶释放至肌原纤维中的速度,与Ge等(2015)的研究结论相似。研究发现组织蛋白酶D不仅存在于溶酶体中,线粒体中也有一部分(Minarowska et al.,2009)。因此在罗非鱼鱼肉冷藏过程中,溶酶体和线粒体中的组织蛋白酶D活性持续下降,对应肌浆蛋白和肌原纤维中活性上升。
综上,组织蛋白酶B、B+L和D活性在不同细胞器中有显著变化,其参与了肌原纤维和肌浆中某些蛋白的降解及线粒体介导的细胞凋亡,揭示了组织蛋白酶B、D、L在罗非鱼鱼片品质劣化中的作用。
3. 3 冷藏过程中钙激活蛋白酶和钙离子浓度的关系
钙激活蛋白酶为中性半胱氨酸酶,钙蛋白酶能破坏Z线,其损坏会使肌原纤维分解断裂。钙激活蛋白酶在不同钙离子浓度下会表现不一样的特性,一般而言,细胞内钙离子浓度越高,钙激活蛋白酶的活性就越高(时海波等,2020)。鱼体死后内质网中的钙离子大量释放至肌浆中,能激活钙激活蛋白酶。本研究中,钙激活蛋白酶活性只在0~1 d内随钙离子浓度增加而升高,在1~6 d内钙激活蛋白酶活性降低,可能是由于其本身的自溶作用及钙蛋白酶抑素发挥作用(孙蕾蕾等,2014)。对本研究冷藏期间鱼肉肌浆中钙离子浓度与钙激活蛋白酶活性进行相关分析,结果显示二者无显著相关性(r=-0.275)。朱燕等(2007)研究钙离子对离体肌束中钙激活蛋白酶的影响,结果发现500 μmol/L以内的钙离子处理肌束可提高肌束中部分钙激活蛋白酶活性,当高于此浓度时,部分钙激活蛋白酶因发生自动降解而失活。总体而言,钙离子浓度的增加只能在冷藏初期激活钙激活蛋白酶,随着贮藏时间的延长钙激活蛋白酶活性降低。
3. 4 冷藏过程中罗非鱼鱼肉中的钙激活蛋白酶与组织蛋白酶B、B+L、D对鱼肉质构的影响
贮藏期间鱼肉质构品质的劣化与内源蛋白酶联系紧密,发现对此过程贡献较大的内源蛋白酶有利于为提升鱼肉品质提供理论基础。钙激活蛋白酶在贮藏初期对鱼肉质构劣化贡献很大,Ahmed等(2015)、Chang等(2016)研究指出在水产品和畜肉贮藏期间,钙激活蛋白酶在蛋白质水解过程中先对蛋白进行局部的特异性降解,再被溶酶体组织蛋白酶进一步降解。葛黎红(2017)通过体外模拟内源蛋白酶对肌原纤维蛋白进行降解,发现钙激活蛋白酶与组织蛋白酶B、L在降解肌原纤维蛋白过程中存在协同作用。
有研究表明贮藏过程中组织蛋白酶B、L对鱼肉质构劣化贡献较大(Ge et al.,2015)。此外,组织蛋白酶D被认为不是造成贮藏期内鱼肉质构品质劣化相关的主要蛋白酶之一(Wang et al.,2009;Ahmed et al.,2013)。Ladrat等(2003)证实了组织蛋白酶B、L在体外对肌球蛋白、α-肌动蛋白和原肌球蛋白的强烈降解作用,并指出这是贮藏期间鱼肉质构劣化的原因之一。Bahuaud等(2010a,2010b)发现拥挤应激条件下的大西洋鲑鱼,组织蛋白酶B、L活性基因表达的增加与鱼片质构劣化相关,表明鱼肉质构劣化与组织蛋白酶B、L活性之间存在潜在的关系。本研究结果表明,组织蛋白酶B、L活性与鱼肉硬度和MFI具有极显著相关性,说明在罗非鱼鱼肉整个贮藏期间组织蛋白酶B、L对鱼肉质构劣化过程发挥重要作用。
3. 5 冷藏过程中罗非鱼鱼肉肌原纤维蛋白SDS-PAGE的变化
肌原纤维蛋白被降解情况通过SDS-PAGE图谱蛋白条带的模糊、弱化和消失能直观体现。肌原纤维蛋白是由肌球蛋白、肌动蛋白和肌钙蛋白等组成的复合体,新鲜罗非鱼片肌原纤维蛋白条带主要为MHC、肌动蛋白和MLC。Jasra等(2001)发现野鲮鱼(Labeo rohita)在冷藏期间MLC发生明显的降解。Wang等(2009)对冷藏期间大西洋鳕鱼(Gadus morhua L.)品质进行研究,结果发现鱼肉在冷藏7和9 d后MHC出现不同程度的降解。沈妮等(2019)发现在0和4 ℃下冷藏的带鱼肌动蛋白条带随贮藏时间的延长而逐渐减少。本研究中,MHC、肌动蛋白和MLC条带随冷藏时间延长而减少,说明冷藏期间肌原纤维蛋白被降解程度较大,与前人研究结果(Jasra et al.,2001;Wang et al.,2009;沈妮等,2019)相似。MHC条带在第1、2 d发生明显的弱化,在对应的时间内鱼肉肌原纤维中的组织蛋白酶B、L活性达最大值。在3~6 d内MHC和肌动蛋白条带无明显变化,但此时肌原纤维中的组织蛋白酶D活性呈升高趋势,而组织蛋白酶B、L活性呈下降趋势,表明组织蛋白酶B、L较组织蛋白酶D在肌原纤维蛋白水解方面发挥更大的作用。可能原因是组织蛋白酶D能水解的肌原纤维蛋白种类较组织蛋白酶B、L少,也可能是冷藏過程中某一段时期的pH与组织蛋白酶D能直接降解完整的蛋白且其与最适pH相同,但这段时期内组织蛋白酶D的特异性底物不存在。
4 结论
冷藏期间罗非鱼鱼肉组织蛋白酶B、L在鱼肉质构劣化过程中发挥较大作用,参与肌原纤维蛋白的降解和线粒体介导的细胞凋亡;钙离子浓度的增加只能在冷藏初期激活钙激活蛋白酶,随着贮藏时间的延长钙激活蛋白酶活性降低。因此,组织蛋白酶B和组织蛋白酶L可能是冷藏期间罗非鱼鱼肉质构劣化的2个关键靶点酶,可采取有效技术手段对其活性进行抑制,进而提升贮藏期间鱼肉质构品质。
参考文献:
陈晓楠,蒋慧丽,吴琼静,涂传海,张宾. 2022. 稳定态二氧化氯结合真空包装对冻藏海鳗品质特性的影响[J]. 食品工业科技,43(7):255-261. [Chen X N,Jiang H L,Wu Q J,Tu C H,Zhang B. 2022. Effect of stable chlorine dio-xide combined with vacuum packaging on the quality of pike eel(Muraenesox cinereus) during frozen storage[J]. Science and Technology of Food Industry,43(7):255-261.] doi:10.13386/j.issn1002-0306.2021080333.
葛黎红. 2017. 内源蛋白酶在低温保鲜草鱼质构劣化中的作用与控制研究[D]. 无锡:江南大学. [Ge L H. 2017. Study on correlation of endogenous proteases with texture deterioration of grass carp (Ctenopharyngodon idella) during chilled storage and quality control[D]. Wuxi:Jiangnan University.]
官缘,蓝蔚青,孙雨晴,刘琳,周大鹏,谢晶. 2022. 超声—咖啡酸联合处理对海鲈鱼冷藏期间品质变化的影响[J]. 食品科学,43(9):207-214. [Guan Y,Lan W Q,Sun Y Q,Liu L,Zhou D P,Xie J. 2022. Effect of ultrasonic treatment combined with caffeic acid on the quality of sea bass(Lateolabrax japonicas) during refrigerated storage[J]. Food Science,43(9):207-214.] doi:10.7506/spkx 1002-6630-20210219-206.
郝子娜,冯硕,赵凯,陈思宇,吉美然,常宝贤. 2022. 茶多酚—海藻酸钠涂膜处理对草鱼储藏品质的影响[J]. 保鲜与加工,22(7):31-36. [Hao Z N,Feng S,Zhao K,Chen S Y,Ji M R,Chang B X. 2022. Effects of tea polyphenol-sodium alginate coating on grass carp quality during sto-rage[J]. Storage and Process,22(7):31-36.] doi:10. 3969/j.issn.1009-6221.2022.07.005.
黄卉,郑陆红,李来好,杨贤庆,魏涯,翟红蕾,吴燕燕,张鹰,郝淑贤. 2018. 不同预冷温度对鲈鱼冰藏期间质构和色差的影响[J]. 食品工业科技,39(24):302-308. [Huang H,Zheng L H,Li L H,Yang X Q,Wei Y,Zhai H L,Wu Y Y,Zhang Y,Hao S X. 2018. Effects of different precooling temperature on texture and color of Micropterus salmoides during ice storage[J]. Science and Technology of Food Industry,39(24):302-308.] doi:10.13386/j.issn 1002-0306.2018.24.051.
李来好,孙蕾蕾,黄卉,杨贤庆,郝淑贤,魏涯,马海霞. 2015. 冰藏奥尼罗非鱼片组织蛋白酶与品质变化的相关性分析[J]. 水产学报,39(4):589-597. [Li L H,Sun L L,Huang H,Yang X Q,Hao S X,Wei Y,Ma H X. 2015. Correlation analysis of cathepsins and quality variations of tilapia (Oreochromis niloticus [♂]×O. aureus ♀) fillets du-ring iced storage[J]. Journal of Fisheries of China,39(4):589-597.] doi:10.11964/jfc.20141109558.
李銳,孙祖莉,杨贤庆,李来好,魏涯,岑剑伟,相悦,赵永强. 2020. 加热方式对罗非鱼片质构特性和蛋白质理化特性的影响[J]. 大连海洋大学学报,35(4):577-583. [Li R,Sun Z L,Yang X Q,Li L H,Wei Y,Cen J W,Xiang Y,Zhao Y Q. 2020. Effects of heating methods on texture and protein physicochemical properties of Nile tilapia fillets[J]. Journal of Dalian Fisheries University,35(4):577-583.] doi:10.16535/j.cnki.dlhyxb.2020-040.
农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会. 2021. 中国渔业统计年鉴[M]. 北京:中国农业出版社:24-25. [Fishery and Fishery Administration of the Ministry of Agriculture and Rural Affairs,National Aquatic Technology Promotion Station,China Society of Fisheries. 2021. China fishery statistical yearbook[M]. Beijing:China Agricultural Press:24-25.]
沈妮,吴甜甜,李苑,江杨阳,陈士国,胡亚芹. 2019. 低温冷藏对带鱼肌肉蛋白的影响[J]. 渔业科学进展,40(6):196-202. [Shen N,Wu T T,Li Y,Jiang Y Y,Chen S G,Hu Y Q. 2019. Effect of chilling storage on the muscle protein of hairtail[J]. Progress in Fishery Sciences,40(6):196-202.] doi:10.19663/j.issn2095-9869.20180818002.
时海波,诸永志,方芮,张新笑,邹烨,王道营,徐为民. 2020. 宰后肉品嫩化技术及其作用机理研究进展[J]. 食品科学,41(23):311-321. [Shi H B,Zhu Y Z,Fang R,Zhang X X,Zou Y,Wang D Y,Xu W M. 2020. Recent progress in post-mortem meat tenderization techniques and their mechanisms of action[J]. Food Science,41(23):311-321.] doi:10.7506/spkx1002-6630-20191106-075.
孙蕾蕾,黄卉,李来好,杨贤庆,郝淑贤,岑剑伟,杨少玲,赵永强. 2014. 影响宰后鱼肉能量代谢和质构的酶及其活性测定方法研究进展[J]. 食品科学,35(11):348-355. [Sun L L,Huang H,Li L H,Yang X Q,Hao S X,Cen J W,Yang S L,Zhao Y Q. 2014. Enzymes associated with postmortem energy metabolism and texture of fish muscle and assays to detect them[J]. Food Science,35(11):348-355.] doi:10.7506/spkx1002-6630-201411067.
魏世娜,秦启伟. 2018. 鱼类溶菌酶和组织蛋白酶研究进展[J]. 广西科学,25(1):32-35. [Wei S N,Qin Q W. 2018. Advance on lysozyme and cathepsin of fish[J]. Guangxi Science,25(1):32-35.] doi:10.13656/j.cnki.gxkx.2018 0206.002.
熊雅雯,黄卉,李来好,杨贤庆,陈胜军,郝淑贤,吴燕燕,魏涯. 2022. 不同煮制条件对罗非鱼片品质的影响[J]. 食品科学,43(11):39-48. [Xiong Y W,Huang H,Li L H,Yang X Q,Chen S J,Hao S X,Wu Y Y,Wei Y. 2022. Effects of different boiling conditions on the quality of tilapia fillets[J]. Food Science,43(11):39-48.] doi:10. 7506/spkx1002-6630-20210610-133.
张诗泉,刘永峰,葛鑫禹,张朵朵,侯晨梓. 2022. 鸭肉宰后成熟过程中食用品质、营养品质及嫩度变化研究[J/OL]. 食品与发酵工业. [Zhang S Q,Liu Y F,Ge X Y,Zhang D D,Hou C Z. 2022. Study on the changes of edible quality,nutritional quality and tenderness during post-slaughter maturation of duck meat[J/OL]. Food and Fermentation Industries.] doi:10.13995/j.cnki.11-1802/ts.032891.
朱燕,徐幸莲,羅欣,周光宏. 2007. 钙离子对钙激活蛋白酶mRNA表达、活性及其对肌肉蛋白降解的影响[J]. 食品科学,28(5):25-28. [Zhu Y,Xu X L,Luo X,Zhou G H. 2007. Effects of calcium ion on calpains mRNA expression,activity and degradation of muscle protein[J]. Food Science,28(5):25-28.] doi:10.3321/j.issn:1002-6630. 2007.05.001.
Ahmed Z,Donkor O,Street W,VasiljevicT. 2013. Proteolytic activities in fillets of selected underutilized Australian fish species[J]. Food Chemistry,140(1-2):238-244. doi:10.1016/j.foodchem.2013.02.042.
Ahmed Z,Donkor O,Street WA,Vasiljevic T. 2015. Calpains-and cathepsins-induced myofibrillar changes in post-mortem fish:Impact on structural softening and release of bioactive peptides[J]. Trends in Food Science & Techno-logy,45(1):130-146. doi:10.1016/j.tifs.2015.04.002.
Bahuaud D,Gaarder M,Veiseth-Kent E,Thomassen M. 2010a. Fillet texture and protease activities in different families of farmed Atlantic salmon(Salmo salar L.)[J]. Aquaculture,310(1-2):213-220. doi:10.1016/j.aquaculture.2010.10.008.
Bahuaud D,M?rk?re T,Langsrud O,Sinnes K,Veiseth E,Ofstad R,Thomassen M S. 2008. Effects of -1.5 ℃ super-chi-lling on quality of Atlantic salmon(Salmo salar) pre-rigor fillets:Cathepsin activity,muscle histology,texture and liquid leakage[J]. Food Chemistry,111(2):329-339. doi:10.1016/j.foodchem.2008.03.075.
Bahuaud D,M?rk?re T,?stbye T K,Veiseth-Kent E,Thomassen M S,Ofstad R. 2010b. Muscle structure responses and lysosomal cathepsins B and L in farmed Atlantic salmon (Salmo salar L.) pre- and post-rigor fillets exposed to short and long-term crowding stress[J]. Food Chemistry,118(3):602-615. doi:10.1016/j.foodchem. 2009.05.028.
Bao Y L,Wang K Y,Yang H X,Regenstein J M,Ertbjerg P,Zhou P. 2020. Protein degradation of black carp (Mylopharyngodon piceus) muscle during cold storage[J]. Food Chemistry,308:125576.doi:10.1016/j.foodchem. 2019.125576.
[ǒ] [C]esen M H,Pegan K,Spes A,Turk B. 2012. Lysosomal pathways to cell death and their therapeutic applications[J]. Experimental Cell Research,318(11):1245-1251. doi:10. 1016/j.yexcr.2012.03.005.
Chang Y S,Hsu D H,Stromer M H,Chou R G R. 2016. Postmortem calpain changes in ostrich skeletal muscle[J]. Meat Science,117(2):117-121. doi:10.1016/j.meatsci. 2016.03.004.
Chéret R,Delbarre-LadratC,de Lamballerie-Anton M,Verrez-Bagnis V. 2007. Calpain and cathepsin activities in post mortem fish and meat muscles[J]. Food Chemistry,101(4):1474-1479. doi:10.1016/j.foodchem.2006.
Ge L H,Xu Y S,Xia W S. 2015. The function of endogenous cathepsin in quality deterioration of grass carp (Ctenopharyngodon idella) fillets stored in chilling conditions[J]. International Journal of Food Science & Technology,50(3):797-803. doi:10.1111/ijfs.12713.
Godiksen H,Morzel M,Hyldig G,Jessen F. 2009. Contribution of cathepsins B,L and D to muscle protein profiles correlated with texture in rainbow trout (Oncorhynchus mykiss)[J]. Food Chemistry,113(4):889-896. doi:10.1016/j.foodchem.2008.08.012.
Guicciardi M E,Leist M,Gores G J. 2004. Lysosomes in cell death[J]. Oncogene,23(16):2881-2890. doi:10.1038/sj.onc.1207512.
Jasra S K,Jasra P K,Talesara C L. 2001. Myofibrillar protein degradation of carp(Labeo rohita (Hamilton)) muscle after post-mortem unfrozen and frozen storage[J]. Journal of the Science of Food and Agriculture,81(5):519-524. doi:10.1002/jsfa.841.
Ladrat C,Verrez-Bagnis V,No?l J,Fleurence J. 2003. In vitro proteolysis of myofibrillar and sarcoplasmic proteins of white muscle of sea bass (Dicentrarchus labrax L.):Effects of cathepsins B,D and L[J]. Food Chemistry,81(4):517-525. doi:10.1016/S0308-8146(02)00481-8.
Lomiwes D,Farouk M M,Wu G,Young O A. 2014. The deve-lopment of meat tenderness is likely to be compartmenta-lised by ultimate pH[J]. Meat Science,96(1):646-651. doi:10.1016/j.meatsci.2013.08.022.
Minarowska A,Karwowska A,Gacko M. 2009. Quantitative determination and localization of cathepsin D and its inhibitors[J]. Folia Histochemica et Cytobiologica,47(2):153-177. doi:10.2478/v10042-009-0073-4.
Nielsen L B,Nielsen H H. 2001. Purification and characterization of cathepsin D from herring muscle(Clupea harengus)[J]. Comparative biochemistry and Physiology B:Biochemistry & Molecular Biology,128(2):351-363. doi:10.1016/S1096-4959(00)00332-8.
Tang M,Dai H J,Ma L,Yu Y,Liu T W,Feng X,Hu W J,Li Y,Zhang Y H. 2020. Degradation of structural proteins and their relationship with the quality of Mandarin fish(Siniperca chuatsi) during post-mortem storage and cooking[J]. International Journal of Food Science and Technology,55(4):1617-1628. doi:10.1111/ijfs.14421.
Thompson M,Kliewer A,Maass D,Becker L,White D J,Brya-nt D,Arteaga G,Horton J,Giroir B P. 2000. Increased cardiomyocyte intracellular calcium during endotoxin-induced cardiac dysfunction in guinea pigs[J]. Pediatric Research,47(5):669-676. doi:10.1203/00006450-20000 5000-00019.
Wang P A,Martinez I,Olsen R L. 2009. Myosin heavy chain degradation during post mortem storage of Atlantic cod (Gadus morhua L.)[J]. Food Chemistry,115(4):1228-1233. doi:10.1016/j.foodchem.2009.01.031.
Xu Y S,Ge L H,Jiang X Q,Xia W S,Jiang Q X. 2015. Inhibitory effect of aqueous extract of Allium species on endogenous cathepsin activities and textural deterioration of ice-stored grass carp fillets[J]. Food and Bioprocess Technology,8(10):2171-2175. doi:10.1111/ijfs.13047.
Zhang X C,Xie J. 2020. The differential effects of endogenous cathepsin and microorganisms on changes in the texture and flavor substances of grouper (Epinephelus coioides) fillets[J]. RSC Advances,10(18):10764-10775. doi:10.1039/D0RA01028F.
Zhou R,Zheng Y R,Liu Y,Ma M. 2020. Texture and quality assessment of ready-to-eat farmed obscure puffer fish(Takifugu obscurus) fillet by evaluating bacterial and myofibrillar degradation and biochemical changes during refrigerated storage[J]. Journal of Aquatic Food Product Technology,29(7):604-615. doi:10.1080/10498850.2020. 1781318.
(責任编辑 罗 丽)
