中药多酚类成分抗肿瘤表观遗传机制的研究进展
2023-07-21龚普阳
王 琴,杨 斌,顾 健,龚普阳
中药多酚类成分抗肿瘤表观遗传机制的研究进展
王 琴,杨 斌,顾 健,龚普阳*
西南民族大学药学院 四川 成都 610041
表观遗传调控紊乱导致的基因表达异常是肿瘤的发生的重要特征之一。近年来,中药活性成分调控肿瘤表观遗传机制研究成为热点。多酚是多种抗肿瘤中药的主要物质基础。姜黄素、表没食子儿茶素没食子酸酯、白藜芦醇、槲皮素和原花青素等可通过多种表观遗传机制调控肿瘤抑制基因或癌基因的表达,发挥抗肿瘤作用。通过对代表性中药多酚类成分调节DNA甲基化、组蛋白修饰和非编码RNA等表观遗传方面发挥抗肿瘤的作用进行综述,为中药对肿瘤的干预治疗提供理论依据和研究策略。
表观遗传;多酚;肿瘤;DNA甲基化;组蛋白修饰;姜黄素;表没食子儿茶素没食子酸酯;白藜芦醇;槲皮素;原花青素
恶性肿瘤是严重威胁人类健康的重大疾病。肿瘤的发生发展是多基因多途径参与的复杂生物学进程,主要涉及经典和表观遗传学等调控方式。其中,表观遗传调控凭借其动态及可逆的特点成为当前肿瘤防治的研究热点,且干预表观遗传调控也为抗肿瘤药物研发提供了新方向和新策略[1]。表观遗传学主要研究在细胞核DNA序列不改变的情况下,基因功能的可逆、可遗传的改变,包括DNA甲基化、组蛋白修饰、染色体重塑和非编码RNA(non-coding RNA,ncRNA)调控等。表观遗传修饰异常,会造成细胞产生基因表达的多样性,在复杂的生物进程中影响胚胎发育、干细胞分化、衰老,甚至导致肿瘤的发生。目前已陆续开发出多种基于表观遗传调控机制的抑制肿瘤生长的广谱性小分子药物,如阿扎胞苷、地西他滨、伏立诺他和罗米地辛等已通过美国食品和药物管理局(Food and Drug Administration,FDA)认证[2]。然而,现有的调控表观遗传修饰的药物对肿瘤的抑制效果有限,且存在不可忽视的不良反应。因此,开发新的具有调控肿瘤表观遗传修饰的活性天然产物具有重要的临床意义。
中药针对肿瘤的治疗具有特殊优势及显著疗效,单味中药及复方可对肿瘤的多个靶点和通路发挥调控作用。由于中药有效成分具有多样性、复杂性,因此其抗肿瘤机制也非常复杂。多酚类化合物作为广泛存在于多种中药中的天然代谢产物,其种类繁多,具有良好的抗氧化、抗炎、抗纤维化和抗肿瘤等多重生物药理活性,同时低毒性、无蓄积是潜在的可用于食品和药品的极具开发价值的活性成分[3-4]。随着对中药药理研究的不断深入,多酚类成分包括姜黄素、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)、白藜芦醇、槲皮素、原花青素等显示出不同的抗肿瘤机制,如调节细胞信号转导通路、刺激细胞自噬及抑制肿瘤血管生成等[5]。其中,多酚基于表观遗传机制调控肿瘤抑制基因或癌基因的表达,进而发挥抗肿瘤疗效的作用引起广泛关注[6]。本文从中药多酚类有效成分对DNA甲基化、组蛋白修饰和ncRNA调控等肿瘤表观遗传修饰的作用及机制进行综述,为中药对肿瘤的干预治疗提供理论依据和研究策略。
1 肿瘤的表观遗传修饰
肿瘤发生的病因不仅仅局限于基因突变或染色体畸变等遗传变异,也涉及基于非核苷酸序列改变的表观遗传修饰异常[7-8]。表观遗传学是研究基因表达的科学,主要指在DNA序列不发生改变的情况下,基因表达可逆、可遗传的改变,包括DNA甲基化、组蛋白修饰和ncRNA调控等。异常的表观遗传修饰可以通过改变核小体间或核小体内部的非共价作用,进而影响染色质结构,调控基因的表达与功能,诱发肿瘤的形成[9]。因此,表观遗传修饰可为肿瘤患者的早期检测、风险评估和预后提供重要的潜在分子标志物[10]。
1.1 DNA甲基化
1948年,在牛胸腺组织中首次发现DNA的甲基化修饰,这是最早发现的表观遗传修饰方式[11]。在哺乳动物中,DNA甲基化主要指在甲基转移酶(DNA methyltransferase,DNMT)的催化下,以s-腺苷甲硫氨酸作为甲基供体,DNA中胞嘧啶-磷酸-鸟嘌呤(cytosinephosphate-guanine,CpG)2个核苷酸中的胞嘧啶的C-5选择性地添加甲基,形成5-甲基胞嘧啶(5-methylcytosine,5mC)的过程[12]。随着基因测序技术的不断发展,检测发现70%的CpG位于基因启动子区域,当基因启动子区域的CpG岛发生5mC修饰时,可招募序列特异性甲基化结合蛋白(methyl-CpG-bindingprotein,MeCP)与甲基化的CpG岛结合,通过级联控制调控基因的表达[13-14]。此外,6-甲基腺嘌呤(N6-methyladenine,6mA)、7-甲基鸟嘌呤(7-methylguanine,7mG)在调控基因表达方面也具有特殊的作用[15-16]。
与正常细胞相比,肿瘤细胞中某些DNA修复基因和抑癌基因出现转录调控区域甲基化水平升高的现象,最终导致修复基因和抑癌基因在细胞内表达失活,促进肿瘤发生[17-18]。如肿瘤抑制因子Ras相关结构域家族成员1A(Ras association domain family 1A,)转录调控区域的高甲基化导致其在乳腺癌和卵巢癌中表达失活[19]。同时,在肿瘤的发展过程中往往也伴随着抑癌基因启动子区域的甲基化程度逐渐上调,研究显示在正常肝组织、邻近非肝癌组织、肝结节非典型增生及肝癌组织4个阶段中抑癌基因呈现逐渐递增的甲基化水平[20]。此外,抑癌基因的异常甲基化往往也与、DNA甲基双加氧酶等表观遗传修饰酶的基因表达情况密切相关。的异常表达在肝癌的转移、侵袭、发生和发展中具有促进作用[21]。异柠檬酸脱氢酶(isocitrate dehydrogenase,)突变与成人胶质瘤G-CIMP表型亦密切相关[22]。目前已陆续开发出多种针对DNA甲基化修饰酶的广谱性小分子药物,其中阿扎胞苷和地西他滨已被FDA批准用于多发性骨髓瘤及急性粒细胞白血病的治疗[2,23]。
1.2 组蛋白修饰
组蛋白修饰是表观遗传的重要组成部分,核小体核心组蛋白的-末端常发生翻译后修饰,包括乙酰化、甲基化、磷酸化、糖基化和ADP核糖基化等,其中组蛋白的乙酰化修饰在调节基因转录中起着重要作用[24]。组蛋白乙酰化是由组蛋白乙酰转移酶(histoneacetyltransferase,HATs)和组蛋白去乙酰酶(histone deacetylase,HDACs)2个酶家族调节的动态过程[25]。HATs可催化乙酰基转移至核心组蛋白氨基末端特定赖氨酸残基上修饰调控转录激活。HDACs则移去组蛋白赖氨酸残基上的乙酰基,抑制转录[26]。此外,组蛋白甲基化修饰主要由蛋白质精氨酸甲基转移酶(protein arginase methyltransferase,PRMT)、组蛋白赖氨酸甲基转移酶(histone lysine methyl-transferases,HKMT)和基因增强子同源物2(enhancer of Zeste homolog 2,EZH2)进行催化[27]。
组蛋白的修饰在肿瘤的发生、发展中起着重要的调控作用。组蛋白乙酰转移酶P300可通过调控Wnt/β-连环蛋白通路影响结肠癌细胞凋亡[28]。在视网膜母细胞瘤中,组蛋白H3第9位赖氨酸残基(histone H3 lysine 9,H3K9)的异常乙酰化使得视网膜母细胞瘤蛋白质结合的锌指蛋1(retinoblastoma protein-interacting zinc finger gene1,)基因沉默,促进肿瘤的发展[29]。此外,作为不同的表观遗传修饰方式,组蛋白乙酰化与DNA甲基化之间也存在重要的交互作用,如MeCP与甲基化的CpG结合后可与SIN3转录调控蛋白家族成员A结合,并进一步与异二聚体Mad/Max形成复合物,募集HDACs[30]。目前,已有多种组蛋白去乙酰酶抑制剂进入抗肿瘤药物临床I期和II期试验[31-32]。伏立诺他、贝利司他、罗米地辛和帕比司他已被FDA批准用于多种肿瘤的治疗[2]。
1.3 ncRNA调控
ncRNA是指不编码蛋白质的RNA。人类基因组中,约98%的基因不具备编码为蛋白质的能力,其均从DNA转录为非编码RNA执行功能。ncRNA包括4类:长链ncRNA(long ncRNA,lncRNA)、微小RNA(microRNA,miRNA)、环状RNA(circular RNA,circRNA)及小干扰RNA等。大量研究表明,ncRNA作为关键调节因子可通过调控氧化应激、炎症和细胞凋亡等机制对肿瘤的发生、发展及治疗具有重要作用[33-34]。
miRNA是长度为18~22个核苷酸的非编码单链RNA分子,可通过与mRNA的结合抑制mRNA的翻译或促进mRNA降解,进而在转录水平调控基因的表达。约有30%的人类蛋白质基因组由miRNA调控其表达[35]。lncRNA也可以参与miRNA的调节。一方面,通过与miRNA竞争结合mRNA非翻译区UTR,充当竞争性内源RNA;另一方面,lncRNA可以充当miRNA的前体,通过直接生成miRNA而发挥调控作用[36]。Calin等[37]首次在慢性淋巴白血病中发现,和基因表达缺失可促进肿瘤的发生。随后,研究发现与正常组织相比,结肠癌患者组织中和表达下调,和表达升高,并且粪便中的异常表达可作为结肠癌筛查的重要指标[38]。同时,miRNA在调控肿瘤血管生成方面也具有重要作用。可通过调控磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)/缺氧诱导因子-1/血管内皮生长因子信号通路抑制肿瘤血管的生成[39]。Xu等[40]发现在胃癌组织中lncRNA H19呈现高表达,并且与DNA甲基化的调控相互作用,进而调控胃癌的发生。此外,作为环状ncRNA的代表,circRNA在细胞中分布广泛,已成为新型肿瘤生物标志物和治疗靶标。circRNA可与RNA聚合酶II相互作用并与典型剪接竞争,或直接与RNA结合蛋白相互作用调节基因转录。研究表明circ-SMARCA5可通过海绵化和促进抑癌基因组织金属蛋白酶抑制因子3的表达,进而抑制肝癌细胞的增殖和侵袭[41]。
与经典遗传理论相比,表观遗传学为肿瘤的精准医疗开辟了全新的方向。自2004年FDA批准第1个表观遗传调控小分子药物阿扎胞苷以来,表观遗传学药物迈出了从理论到应用的一步。随后十多年,FDA批准了多个表观遗传药物,开启了肿瘤治疗的新篇章,见表1。然而,除了针对少数的实体瘤、T细胞淋巴瘤、复发/难治性滤泡性淋巴瘤等有较好的疗效以外,这些表观遗传药物在晚期肿瘤中的疗效有限,并且其作用靶点广泛,脱靶效应可引起骨髓抑制和中枢神经毒性,对病人有着不可忽视的不良反应[42-43]。开发新的具有调控肿瘤表观遗传修饰的活性天然产物具有重要的临床意义。
表1 FDA批准用于肿瘤治疗的表观遗传调控药物
Table 1 Epigenetic regulatory agents approved by FDA for tumor therapy
药物抑制剂种类临床应用 阿扎胞苷、地西他滨DNMT急性髓细胞白血病、慢性粒单核细胞白血病、骨髓增生异常综合征 伏立诺他、罗米地辛、贝利司他、帕比司他等HDAC皮肤T细胞淋巴瘤、外周T细胞淋巴瘤、多发性骨髓瘤 恩西地平IDH2急性髓细胞白血病 艾伏尼布IDH1急性髓细胞白血病 他泽司他EZH2上皮样肉瘤和复发/难治性滤泡性淋巴瘤
2 中药多酚类化合物基于表观遗传调控发挥抗肿瘤作用
多酚为多羟基类化合物的总称,是多种中药重要的活性次生代谢物。根据多酚所含苯环的数量及结构元素单元可将多酚分为酚酸类、类黄酮、二苯乙烯类和木脂素类[44]。多酚化合物种类繁多,因其良好的抗氧化、抗炎、抗纤维化和抗肿瘤等多重药理活性而受到广泛关注[45]。以往的研究表明,多酚的生物学作用主要体现在其能够有效抑制活性氧产生,将电子转移至自由基,同时可以激活抗氧化酶,改善氧化应激和炎症[46-47]。近年来研究发现,中药多酚类化合物可以基于表观遗传修饰的调控进一步抑制多种肿瘤细胞生长(图1)。多种中药多酚类成分可通过改变DNA甲基化、组蛋白修饰和ncRNA调控等导致基因的激活或沉默,从而调控肿瘤抑制基因和癌基因的表达(表2)。通过对中药多酚类成分调控肿瘤表观遗传机制的进一步研究,为源于中药的抗肿瘤新药的研制与开发提供更好的理论依据和数据支撑。
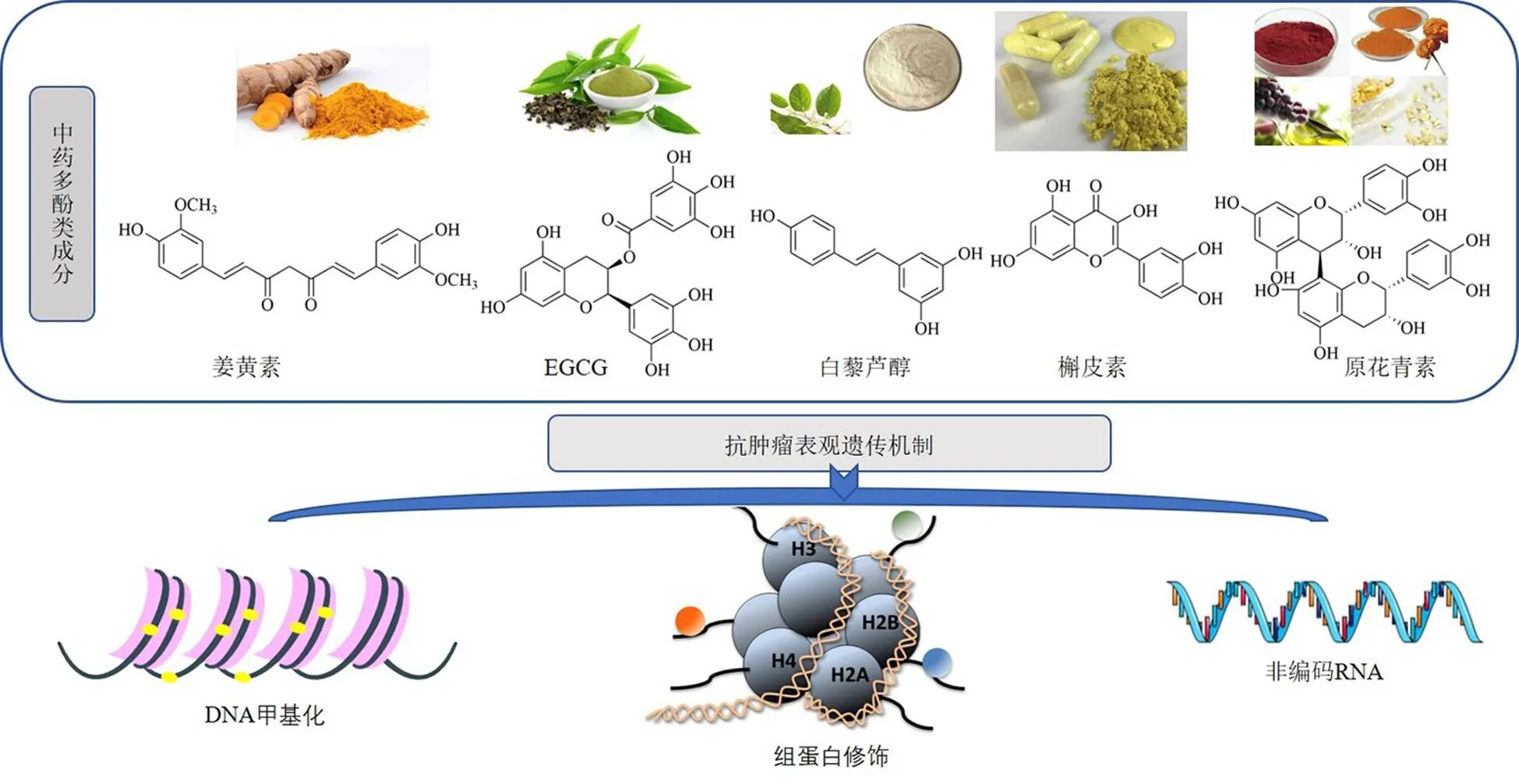
图1 中药多酚类化合物基于表观遗传调控发挥抗肿瘤作用
表2 多酚类化合物抗肿瘤表观遗传机制研究
Table 2 Polyphenols on antitumor epigenetic mechanism
多酚类化合物分子机制目标位点 姜黄素DNA甲基化RASSF1A、NEP、RECK、p16、MGMT 组蛋白修饰EZH2、H3K4、H3K9、H3K27、LSD1、JARID、JMJD2 ncRNAlncRNA UCA1、miR-21 EGCGDNA甲基化p16、RaBβ、MGMT、MLH1、CDH1、DAPK1 ncRNAmiR-98-5p、lncRNA LINC00511、miR-30b、miR-16、miR-629等 白藜芦醇DNA甲基化DNMT1、DNMT3a、DNMT3b、PTEN 组蛋白修饰HDAC2、MTA1-NuRD、p53 ncRNAArgonaute-2、miR-16、miR-141、miR-143、miR-200c、miR-155-5p 槲皮素DNA甲基化DNMT、NRF2、P16INK4A ncRNAmiR-125a、miR-155、miR-195、miR-27a、miR-605、miR-491、miR-503等 原花青素DNA甲基化DNMT1、DNMT3a、DNMT3b、E-cadherin、Maspin、BRCA1、Bax、Bcl-2 组蛋白修饰HDAC、RASSF1A、P16INK4A、Cip1/p21 ncRNAmiR-1281
2.1 姜黄素
姜黄素是从姜科植物根茎中提取的最具代表性的有效成分,主要来源于莪术、石菖蒲和姜黄,目前在食品工业中得到了广泛的开发和应用。近年来,随着对姜黄素研究的深入,其强大的抗炎、抗氧化和抗肿瘤的生物活性引起了研究者的广泛兴趣[48]。
研究发现,姜黄素是一种有效的DNMT抑制剂,在DNA甲基化调控方面发挥作用。在人乳腺癌MCF-7细胞中,姜黄素20 μmol/L可有效地抑制核因子-κB(nuclear factor-κB,NF-κB)/特异性蛋白1复合体与启动子区域的结合,显著下调的表达[49]。此外,在小鼠神经母细胞瘤N2a细胞中,姜黄素5 μmol/L可通过下调脑啡肽酶(neprilysin,)基因启动子区域甲基化水平,上调表达,进一步抑制Akt/NF-κB信号通路活性,并下调炎症相关因子环氧合酶-2和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,抑制炎症的进程[50]。在人鼻咽癌CNE-1细胞中,姜黄素20 nmol/L可降低细胞内甲基化程度,上调半胱氨酸丰富蛋白Kazal基元(reversion inducing cysteine rich protein with Kazal motifs,)基因表达,从而抑制基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)表达,发挥抑制肿瘤细胞浸润转移的作用[51]。姜黄素40~60 μmol/L还可通过下调人胃癌SGC-7901细胞中抑癌基因和O6-甲基鸟嘌呤-DNA-甲基转移酶(O6- methylguanine-DNA methyhransferase,)基因启动子区域甲基化程度,抑制胃癌细胞的增殖[52]。除了对DNA甲基化的调控作用,姜黄素在介导组蛋白的翻译后修饰方面也具有重大的潜力。针对组蛋白乙酰化修饰方面,姜黄素可调节HATs和HDACs 2个酶家族的动态平衡抑制肿瘤的进程[53]。此外,姜黄素也可以参与调控组蛋白甲基化修饰,影响HKMT和去甲基化酶的活性[54]。在人乳腺癌MDA-MB-231细胞中,姜黄素40 μmol/L可通过沉默组蛋白甲基转移酶基因的表达,进一步抑制肿瘤细胞的增殖、迁移和侵袭[55-56]。姜黄素0.6 μmol/L还可以参与调控ncRNA的表达,如通过抑制人肺癌A549细胞中lncRNA的表达,间接下调哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和Wnt信号通路中的相关蛋白的表达,进一步诱导肺癌细胞的凋亡[57]。Chen等[58]研究发现,在多种肿瘤细胞中高表达,姜黄素可调控激活蛋白-1抑制的转录,进一步调控下游PI3K/Akt/mTOR信号通路发挥抑癌作用。对DNA甲基化、组蛋白修饰和ncRNA的调控是表观遗传修饰的重要方式,姜黄素通过上述几种调控方式对肿瘤的发生与发展起到重要调节作用。因此,对姜黄素进行深入研究,有助于为抗肿瘤新药的开发提供宝贵的理论基础。
2.2 EGCG
EGCG是绿茶、白果和余甘子中的重要活性成分。EGCG可通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、阻滞肿瘤细胞周期和抑制血管生成等多种机制发挥抗肿瘤活性[59]。
在调控表观遗传修饰方面,在人食管癌KYSE510细胞中,EGCG 5~50 mmol/L可通过抑制的表达,下调抑癌基因视黄酸受体β(retinoic acid receptor β,)、错配修复蛋白1(mut L homolog l,)启动子区域甲基化水平,进而恢复抑癌基因的表达,实现抑癌作用[60]。在人宫颈癌HeLa细胞中发现EGCG 25 μmol/L可以与表观遗传修饰基因和直接结合并抑制其活性,恢复抑癌基因、上皮性钙黏蛋白(e-cadherin,)和死亡相关蛋白激酶1(death associated protein kinase1,)的表达[61]。此外,在调控ncRNA方面,使用EGCG处理人肺癌H460、H1299和A549细胞后,可以上调lncRNA核富集转录体1(nuclear enriched abundant transcript 1,NEAT1)的水平,抑制,恢复铜转运蛋白1(copper transport protein 1,CTR1)表达,最终增强顺铂对肺癌细胞的杀伤敏感性[62]。在非小细胞肺癌细胞中也检测到EGCG可通过其促氧化特性调节的表达[63]。在人胃癌AGS和SGC7901细胞中,EGCG 100 μmol/L可显著下调lncRNA的表达,并进一步调控LINC00511/miR-29b/KDM2A信号通路抑制胃癌细胞生长[64]。值得注意的是,不同浓度EGCG干预肿瘤细胞时调控的miRNA种类不同。如在处理人肝癌HepG2细胞中,低浓度的EGCG抑制、、表达,而高浓度的EGCG则参与调控、、的表达[65-66]。作为天然的中药多酚成分,EGCG具有高效、不良反应少和抗肿瘤范围广的特点。因此,近年来EGCG在各种癌症中的治疗被深入研究。证实了EGCG单独使用或与其他表观遗传调控化合物联用均有较好的抑制肿瘤生长的作用。
2.3 白藜芦醇
白藜芦醇在虎杖地下根和根茎中含量很高,同时其广泛存在于何首乌和藜芦等植物中,是植物受到病原侵害时产生的一种抗毒素[67]。在虎杖根茎中,白藜芦醇主要以虎杖苷的形式存在,通过糖苷酶的作用可使虎杖苷水解为白藜芦醇,此为目前获得白藜芦醇最主要的方式。
白藜芦醇可抑制胃癌细胞中多种表观遗传调控酶类HDAC2、DNMT1、DNMT3a、DNMT3b的表达,使肿瘤细胞周期阻滞于G1期,诱导细胞的凋亡[68]。在人前列腺癌LNCaP和DU145细胞中,白藜芦醇50~100 μmol/L可以抑制转移相关蛋白(metastasis associated protein 1,MTA1)的表达,降低MTA1-核小体重塑去乙酰化复合物(nucleosome remodeling and histone deacetylation,NuRD)的稳定性,进而上调抑癌基因的组蛋白乙酰化水平,诱导肿瘤细胞凋亡[69]。此外,研究显示白藜芦醇具有显著的抗肿瘤增殖作用。在SGC7901细胞中,白藜芦醇200 μmol/L处理细胞后可通过调控的表达抑制胃癌细胞增殖、侵袭和转移,促进细胞凋亡[70]。将白藜芦醇处理的LNCaP细胞进行miRNA微阵列技术检测,结果发现细胞中23个miRNA显著下调,28个miRNA显著上调,与肿瘤细胞的增殖和凋亡密切相关[71]。白藜芦醇50 μmol/L还可通过提高的表达活性,增加肿瘤相关miRNA,包括、、和的表达,从而抑制乳腺癌干细胞分化[72]。在联合用药方面,白藜芦醇10 μmol/L联合维生素D3可以显著降低第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome 10,)启动子区域的甲基化程度并诱导的表达,并且在雌激素受体阳性的MCF-7细胞中联合用药可抑制的表达并恢复的抑癌功能,但对MDA-MB-231细胞没有显著的影响[73]。白藜芦醇发挥肿瘤抑制作用时往往并非依赖调控单基因的表达,而是通过联合多种表观遗传学机制调控多基因的表达。综上,在未来的研究中,可以从整体角度出发,结合生物信息分析手段深入探讨白藜芦醇的抑癌机制。
2.4 槲皮素
槲皮素是一种天然黄酮类多酚,广泛存在于各种蔬菜和水果中,也是柴胡、槐花等中药的有效化学成分。槲皮素具有抗炎、抗氧化、免疫抑制、清除氧自由基及抗肿瘤等多种生物作用[74]。
将ICR小鼠暴露于含槲皮素的硫酸镍中,槲皮素可显著降低镍诱导的小鼠肝脏中总和核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)的DNA甲基化水平,同时降低促炎因子肿瘤坏死因子-α、白细胞介素-1β和iNOS表达,最终抑制镍诱导的肝损伤及肿瘤的发展[75]。在人结肠癌HT29细胞中,抑癌基因由于启动子区域的高甲基化导致其表达失活,槲皮素20 μmol/L处理肿瘤细胞后可以下调的甲基化水平,恢复其表达,最终抑制肿瘤细胞的增殖[76]。此外研究发现,槲皮素处理肿瘤细胞后,可同时调节多个肿瘤相关miRNA的表达。包括与肿瘤细胞增殖相关的、、,与肿瘤细胞凋亡相关的、、,与肿瘤细胞迁移和侵袭相关的、、[77-79]。Nwaeburu等[80]使用槲皮素50 μmol/L处理人胰腺癌AsPC1和PANC1细胞时,发现槲皮素可以通过上调,进而抑制Notch信号通路影响肿瘤干细胞的自我更新。近年来,槲皮素通过表观遗传调控抑制肿瘤细胞生长的作用被广泛研究。然而,槲皮素的水溶性和稳定性限制了其临床应用。因此,在未来的研究中,应结合现代制剂学技术提高其成药性,为其进一步的深入开发提供有力支撑。
2.5 原花青素
原花青素属于缩合鞣质,由多个儿茶素、表儿茶素分子聚合而成,广泛存在自然界多种中药植物中,主要分布于果皮、种子和叶等部位[81]。原花青素具有强抗氧化、抗衰老、抗菌和消除自由基的作用,并且在多种肿瘤中表现出良好的抗癌活性[82]。
葡萄籽原花青素(grape seed proanthocyanidins,GSPs)已在体内外模型中被证明具有抗皮肤癌作用。在人皮肤癌A431和SCC13细胞中,GSPs 5~20 μg/mL处理细胞后,可显著降低和的mRNA和蛋白水平,同时上调组蛋白H3和H4不同位点赖氨酸残基的乙酰化,从而内源性激活抑癌基因、和的重新表达[83]。在MDA-MB-231细胞中,原花青素同样发挥有效的抗肿瘤作用。体外实验表明,原花青素B2(6.88±0.65)μmol/L可有效减弱DNMT活性,进而增强靶基因、和的表达[84]。在人骨肉瘤HOS细胞中发现原花青素可通过调控miR-1281/肽基脯氨酰异构酶F(peptidylprolyl isomerase F,PPIF)通路,下调表达,抑制骨肉瘤细胞的生长和迁移[85]。此外,原花青素在联合用药方面也展示出巨大潜力,GSPs 20 μg/mL和白藜芦醇10 μmol/L联合处理MDA-MB-231和MCF-7细胞后,可以显著降低细胞中DNMTs和HDACs的活性,进而下调B淋巴细胞瘤2(B-cell lymphoma 2,Bcl-2)表达及上调Bcl-2相关X蛋白表达,最终协同诱导乳腺癌细胞的凋亡[86]。近年来,原花青素已成为国内外研究的热点。在不同的植物中,原花青素的含量差异较大,其中研究最广泛的为GSPs,主要应用于化妆品和保健品中。通过对原花青素抗肿瘤表观遗传机制的研究,一方面可以拓宽原花青素的应用领域,另一方面为抗肿瘤药物的开发提供新的思路。
3 结语与展望
肿瘤的表观遗传调控机制研究为中药抗肿瘤活性物质及分子机制发现提供了新方向和新视角。多种来源于中药的多酚类成分被证明具有明确的抗肿瘤作用,且兼具低毒低蓄积的天然优势。多酚的生物活性与其特殊的化学结构相关,功能结构包括苯环、酚羟基、邻苯二酚等。因而,多酚易传递电子,对羟基自由基、超氧阴离子自由基均具有很强的清除活性。此外,基于其特殊的功能结构,多酚还具有广谱的抑菌活性,即抑制病毒复制、调控宿主相关抗病毒蛋白表达的功能。近年来,系列研究证实姜黄素、EGCG、白藜芦醇等多酚类成分可通过调控DNA甲基化、组蛋白修饰及ncRNA等方式发挥抗肿瘤作用。这些研究为中药通过表观遗传调控防治肿瘤的机制研究提供了有效策略和方法学参考。然而,仍存在一定的不足之处:(1)已有的此类研究多以单一的多酚成分为研究对象。中药通常以同类型多成分叠加发挥药效作用,故可从单体所在的中药多酚组分开展整合机制研究,探索构-效关系,进一步探究不同结构多酚类成分抗肿瘤的共性机制,有望发现具有协同作用的组合药物。(2)研究多从单一肿瘤类型开展多酚物质的表观遗传调控机制研究。未来可以多种肿瘤细胞和组织为载体,探索在不同病种间的共性干预机制。(3)多酚类化合物的水溶性差及稳定性缺乏等也限制了其临床应用,应结合现代制剂学技术提高其成药性,为其进一步的深入开发和临床转化应用提供有力支撑。
利益冲突 所有作者均声明不存在利益冲突
[1] Cavalli G, Heard E. Advances in epigenetics link genetics to the environment and disease [J]., 2019, 571(7766): 489-499.
[2] Verza F A, Das U, Fachin A L,. Roles of histone deacetylases and inhibitors in anticancer therapy [J]., 2020, 12(6): 1664.
[3] Shah D, Gandhi M, Kumar A,. Current insights into epigenetics, noncoding RNA interactome and clinical pharmacokinetics of dietary polyphenols in cancer chemoprevention [J]., 2023, 63(12): 1755-1791.
[4] Maleki Dana P, Sadoughi F, Asemi Z,. The role of polyphenols in overcoming cancer drug resistance: A comprehensive review [J]., 2022, 27(1): 1.
[5] Cione E, La Torre C, Cannataro R,. Quercetin, epigallocatechin gallate, curcumin, and resveratrol: From dietary sources to human microRNA modulation [J]., 2019, 25(1): 63.
[6] Rajendran P, Abdelsalam S A, Renu K,. Polyphenols as potent epigenetics agents for cancer [J]., 2022, 23(19): 11712.
[7] Dawson M A, Kouzarides T. Cancer epigenetics: From mechanism to therapy [J]., 2012, 150(1): 12-27.
[8] Dawson M A. The cancer epigenome: Concepts, challenges, and therapeutic opportunities [J]., 2017, 355(6330): 1147-1152.
[9] Feinberg A P, Koldobskiy M A, Göndör A. Epigenetic modulators, modifiers and mediators in cancer aetiology and progression [J]., 2016, 17(5): 284-299.
[10] Jung G, Hernández-Illán E, Moreira L,. Epigenetics of colorectal cancer: Biomarker and therapeutic potential [J]., 2020, 17(2): 111-130.
[11] Hampton T. New markers may help predict prostate cancer relapse risk [J]., 2006, 295(19): 2234.
[12] Wu H, Zhang Y. Reversing DNA methylation: Mechanisms, genomics, and biological functions [J]., 2014, 156(1/2): 45-68.
[13] Jones P A. Functions of DNA methylation: Islands, start sites, gene bodies and beyond [J]., 2012, 13(7): 484-492.
[14] Shen H, Laird P W. Interplay between the cancer genome and epigenome [J]., 2013, 153(1): 38-55.
[15] Boulias K, Greer E L. Means, mechanisms and consequences of adenine methylation in DNA [J]., 2022, 23(7): 411-428.
[16] Huang Y L, Kawai G, Hasegawa A,. Impact of 5’-end nucleotide modifications of HIV-1 genomic RNA on reverse transcription [J]., 2019, 516(4): 1145-1151.
[17] Baylin S B, Jones P A. A decade of exploring the cancer epigenome-Biological and translational implications [J]., 2011, 11(10): 726-734.
[18] Dor Y, Cedar H. Principles of DNA methylation and their implications for biology and medicine [J]., 2018, 392(10149): 777-786.
[19] Sahm F, Schrimpf D, Stichel D,. DNA methylation-based classification and grading system for meningioma: A multicentre, retrospective analysis [J]., 2017, 18(5): 682-694.
[20] Ye W R, Siwko S, Tsai R Y L. Sex and race-related DNA methylation changes in hepatocellular carcinoma [J]., 2021, 22(8): 3820.
[21] Han T S, Ban H S, Hur K,. The epigenetic regulation of HCC metastasis [J]., 2018, 19(12): 3978.
[22] Victor R R, Malta Tathiane M, Tomohiro S,. Metabolic reprogramming associated with aggressiveness occurs in the G-CIMP-high molecular subtypes of IDH1mut lower grade gliomas [J]., 2020, 22(4): 480-492.
[23] Dhillon S. Decitabine/cedazuridine: First approval [J]., 2020, 80(13): 1373-1378.
[24] Martire S, Banaszynski L A. The roles of histone variants in fine-tuning chromatin organization and function [J]., 2020, 21(9): 522-541.
[25] Kouzarides T. Chromatin modifications and their function [J]., 2007, 128(4): 693-705.
[26] Pirola C J, Sookoian S. Epigenetics factors in nonalcoholic fatty liver disease [J]., 2022, 16(6): 521-536.
[27] Singh T, Kaur P, Singh P,. Differential molecular mechanistic behavior of HDACs in cancer progression [J]., 2022, 39(11): 171.
[28] Lazarova D L, Wong T, Chiaro C,. p300 influences butyrate-mediated Wnt hyperactivation in colorectal cancer cells [J]., 2013, 4(6): 491-501.
[29] Zhang C J, Li H, Wang Y,. Epigenetic inactivation of the tumor suppressor genein hepatocellular carcinoma involves both DNA methylation and histone modifications [J]., 2010, 53(5): 889-895.
[30] Nan X, Ng H H, Johnson C A,. Transcriptional repression by the methyl-CpG-binding protein MeCP2 involves a histone deacetylase complex [J]., 1998, 393(6683): 386-389.
[31] Galli M, Salmoiraghi S, Golay J,. A phase II multiple dose clinical trial of histone deacetylase inhibitor ITF2357 in patients with relapsed or progressive multiple myeloma [J]., 2010, 89(2): 185-190.
[32] Duvic M, Talpur R, Ni X A,. Phase 2 trial of oral vorinostat (suberoylanilide hydroxamic acid, SAHA) for refractory cutaneous T-cell lymphoma (CTCL) [J]., 2007, 109(1): 31-39.
[33] Anastasiadou E, Jacob L S, Slack F J. Non-coding RNA networks in cancer [J]., 2018, 18(1): 5-18.
[34] 王楠楠, 李超宇, 薛沁冰, 等. 基于非编码RNA的中药有效成分抗肿瘤作用机制研究进展 [J]. 中草药, 2023, 54(11): 3725-3733.
[35] Musavi Shenas S M H, Mansoori B, Mohammadi A,. SiRNA-mediated silencing ofinduces apoptosis and alters micro RNA expression in human urinary bladder cancer cell line [J]., 2017, 45(5): 969-974.
[36] Weng M J, Wu D, Yang C,. Noncoding RNAs in the development, diagnosis, and prognosis of colorectal cancer [J]., 2017, 181: 108-120.
[37] Calin G A, Dumitru C D, Shimizu M,. Frequent deletions and down-regulation of micro-RNA genesandat 13q14 in chronic lymphocytic leukemia [J]., 2002, 99(24): 15524-15529.
[38] Heublein S, Albertsmeier M, Pfeifer D,. Association of differential miRNA expression with hepatic. peritoneal metastatic spread in colorectal cancer [J]., 2018, 18(1): 1-10.
[39] Qian X, Yu J, Yin Y,.inhibits tumor growth and angiogenesis and sensitizes chemosensitivity to oxaliplatin in colorectal cancers [J]., 2013, 12(9): 1385-1394.
[40] Xu H Y, Zhang Y, Qi L,. NFIX circular RNA promotes glioma progression by regulatingvia Notch signaling pathway [J]., 2018, 11: 225.
[41] Yu J, Xu Q G, Wang Z G,. Circular RNA cSMARCA5 inhibits growth and metastasis in hepatocellular carcinoma [J]., 2018, 68(6): 1214-1227.
[42] Dai E Y, Zhu Z, Wahed S,. Epigenetic modulation of antitumor immunity for improved cancer immunotherapy [J]., 2021, 20(1): 171.
[43] Singh M, Kumar V, Sehrawat N,. Current paradigms in epigenetic anticancer therapeutics and future challenges [J]., 2022, 83: 422-440.
[44] Wang Q, Yang B, Wang N,. Tumor immunomodulatory effects of polyphenols [J]., 2022, 13: 1041138.
[45] 吕芳, 苏幼红, 张富春, 等. 植物活性成分对表观遗传调节的研究概况 [J]. 中草药, 2008, 39(10): 1580-1583.
[46] Yahfoufi N, Alsadi N, Jambi M,. The immunomodulatory and anti-inflammatory role of polyphenols [J]., 2018, 10(11): 1618.
[47] Musial C, Kuban-Jankowska A, Gorska-Ponikowska M. Beneficial properties of green tea catechins [J]., 2020, 21(5): 1744.
[48] 刘婷, 高飞云, 张转红, 等. 姜黄素抗结肠癌作用机制的研究进展 [J]. 中草药, 2022, 53(24): 7933-7940.
[49] Du L P, Xie Z L, Wu L C,. Reactivation of RASSF1A in breast cancer cells by curcumin [J]., 2012, 64(8): 1228-1235.
[50] Deng Y S, Lu X, Wang L,. Curcumin inhibits the Akt/NF-κB signaling via CpG demethylation of the promoter and restoration of NEP in the N2a cell line [J]., 2014, 16(4): 649-657.
[51] Jia W, Deng F M, Fu W,. Curcumin suppresses Wilms’ tumor metastasis by inhibitingmethylation [J]., 2019, 111: 1204-1212.
[52] 陈馨, 肖乐, 吴小雪, 等. 姜黄素对胃癌细胞抑癌基因甲基化的抑制作用 [J]. 华中科技大学学报: 医学版, 2015(6): 674-677.
[53] Hassan F U, Rehman M S U, Khan M S,. Curcumin as an alternative epigenetic modulator: Mechanism of action and potential effects [J]., 2019, 10: 514.
[54] Sawesi S, Malkaram S A, Abd Elmageed Z Y,. Modulation of the activity of histone lysine methyltransferases and demethylases by curcumin analog in leukaemia cells [J]., 2022, 26(22): 5624-5633.
[55] Shahabipour F, Caraglia M, Majeed M,. Naturally occurring anti-cancer agents targeting EZH2 [J]., 2017, 400: 325-335.
[56] Zhou X L, Jiao D C, Dou M M,. Curcumin inhibits the growth of triple-negative breast cancer cells by silencing EZH2 and restoring DLC1 expression [J]., 2020, 24(18): 10648-10662.
[57] Wang W H, Chen J, Zhang B R,. Curcumin inhibits proliferation and enhances apoptosis in A549 cells by downregulating lncRNA UCA1 [J]., 2018, 73(7): 402-407.
[58] Chen J Z, Xu T F, Chen C. The critical roles ofin anti-cancer effects of curcumin [J]., 2015, 3(21): 330.
[59] 李晓阳, 吴志平, 王梦馨, 等. 表没食子儿茶素没食子酸酯抗癌分子机制及其应用的研究进展[J]. 中草药, 2019, 50(13): 3217-3229.
[60] Fang M Z, Wang Y M, Ai N,. Tea polyphenol (–)-epigallocatechin-3-gallate inhibits DNA methyltransferase and reactivates methylation-silenced genes in cancer cell lines [J]., 2003, 63(22): 7563-7570.
[61] Ali Khan M, Hussain A, Sundaram M K,. (–)-Epigallocatechin-3-gallate reverses the expression of various tumor-suppressor genes by inhibiting DNA methyltransferases and histone deacetylases in human cervical cancer cells [J]., 2015, 33(4): 1976-1984.
[62] Jiang P, Wu X Y, Wang X M,. NEAT1 upregulates EGCG-induced CTR1 to enhance cisplatin sensitivity in lung cancer cells [J]., 2016, 7(28): 43337-43351.
[63] Chen A C, Jiang P, Zeb F,. EGCG regulates CTR1 expression through its pro-oxidative property in non-small-cell lung cancer cells [J]., 2020, 235(11): 7970-7981.
[64] Zhao Y L, Chen X B, Jiang J,. Epigallocatechin gallate reverses gastric cancer by regulating the long noncoding RNA LINC00511/miR-29b/KDM2A axis [J]., 2020, 1866(10): 165856.
[65] Tsang W P, Kwok T T. Epigallocatechin gallate up-regulation ofand induction of apoptosis in human cancer cells [J]., 2010, 21(2): 140-146.
[66] Adami G R, Tangney C C, Tang J L,. Effects of green tea on miRNA and microbiome of oral epithelium [J]., 2018, 8: 5873.
[67] Malaguarnera L. Influence of resveratrol on the immune response [J]., 2019, 11(5): 946.
[68] Calcagno D Q, Wisnieski F, da Silva Mota E R,. Role of histone acetylation in gastric cancer: Implications of dietetic compounds and clinical perspectives [J]., 2019, 11(3): 349-362.
[69] Kai L, Samuel S K, Levenson A S. Resveratrol enhances p53 acetylation and apoptosis in prostate cancer by inhibiting MTA1/NuRD complex [J]., 2010, 126(7): 1538-1548.
[70] Su N N, Li L L, Zhou E L,. Resveratrol downregulatesto block the malignant behavior of gastric cancer cells [J]., 2022, 2022: 1-10.
[71] Leite K R M, Sousa-Canavez J M, Reis S T,. Change in expression of,, andfrom high grade localized prostate cancer to metastasis [J]., 2011, 29(3): 265-269.
[72] Hagiwara K, Kosaka N, Yoshioka Y,. Stilbene derivatives promote Ago2-dependent tumour-suppressive microRNA activity [J]., 2012, 2: 314.
[73] Stefanska B, Salamé P, Bednarek A,. Comparative effects of retinoic acid, vitamin D and resveratrol alone and in combination with adenosine analogues on methylation and expression of phosphatase and tensin homologue tumour suppressor gene in breast cancer cells [J]., 2012, 107(6): 781-790.
[74] 杨扬, 郭举. 具有抗肿瘤活性的槲皮素衍生物研究进展 [J]. 中草药, 2018, 49(6): 1468-1475.
[75] Liu C M, Ma J Q, Xie W R,. Quercetin protects mouse liver against nickel-induced DNA methylation and inflammation associated with the Nrf2/HO-1 and p38/STAT1/NF-κB pathway [J]., 2015, 82: 19-26.
[76] Russo M, Spagnuolo C, Moccia S,. Biochemical and cellular characterization of new radio-resistant cell lines reveals a role of natural flavonoids to bypass senescence [J]., 2021, 23(1): 301.
[77] Noratto G D, Kim Y, Talcott S T,. Flavonol-rich fractions of yaupon holly leaves (, Aquifoliaceae) induceand have anti-inflammatory and chemopreventive effects in intestinal myofribroblast CCD-18Co cells [J]., 2011, 82(4): 557-569.
[78] Lam T K, Shao S, Zhao Y D,. Influence of quercetin-rich food intake on microRNA expression in lung cancer tissues [J]., 2012, 21(12): 2176-2184.
[79] Wang D, Sun-Waterhouse D, Li F,. microRNAs as molecular targets of quercetin and its derivatives underlying their biological effects: A preclinical strategy [J]., 2019, 59(14): 2189-2201.
[80] Nwaeburu C C, Abukiwan A, Zhao Z F,. Quercetin-inducedregulates the mode of self-renewing divisions in pancreatic cancer [J]., 2017, 16(1): 1-10.
[81] Zeng Y X, Wang S, Wei L,. Proanthocyanidins: Components, pharmacokinetics and biomedical properties [J]., 2020, 48(4): 813-869.
[82] Rauf A, Imran M, Abu-Izneid T,. Proanthocyanidins: A comprehensive review [J]., 2019, 116: 108999.
[83] Vaid M, Prasad R, Singh T,. Grape seed proanthocyanidins reactivate silenced tumor suppressor genes in human skin cancer cells by targeting epigenetic regulators [J]., 2012, 263(1): 122-130.
[84] Shilpi A, Parbin S, Sengupta D,. Mechanisms of DNA methyltransferase-inhibitor interactions: Procyanidin B2 shows new promise for therapeutic intervention of cancer [J]., 2015, 233: 122-138.
[85] Jia J, Xia J J, Liu W F,. Cinnamtannin B-1 inhibits the progression of osteosarcoma by regulating the miR-1281/PPIF axis [J]., 2023, 46(1): 67-73.
[86] Gao Y F, Tollefsbol T. Combinational proanthocyanidins and resveratrol synergistically inhibit human breast cancer cells and impact epigenetic-mediating machinery [J]., 2018, 19(8): 2204.
Research progress on antitumor epigenetic mechanism of polyphenols from traditional Chinese medicine
WANG Qin, YANG Bin, GU Jian, GONG Pu-yang
College of Pharmacy, Southwest Minzu University, Chengdu 610041, China
Abnormal gene expression caused by epigenetic regulation is one of the important characteristics of tumor occurrence. In recent years, the research on the epigenetic mechanism of the active components of traditional Chinese medicine has become a hot topic. Polyphenols are the main basal components of many antitumor Chinese medicine. Curcumin, epigallocatechin gallate, resveratrol, quercetin and proanthocyanidins can regulate the expression of tumor suppressor genes or oncogenes through various epigenetic mechanisms, thus play an antitumor role. This paper discusses the antitumor effects of representative Chinese medicine polyphenols on epigenetic regulation of DNA methylation, histone modification, and non-coding RNA, to provide theoretical basis and research strategy for the treatment of traditional Chinese medicine on tumor.
epigenetic; polyphenol; tumor; DNA methylation; histone modification; curcumin; epigallocatechin gallate; resveratrol; quercetin; proanthocyanidins
R285
A
0253 - 2670(2023)14 - 4722 - 10
10.7501/j.issn.0253-2670.2023.14.032
2023-02-05
四川省自然科学基金资助项目(2022NSFSC1735);中央高校基本科研业务费专项基金项目青年成长项目(ZYN2022094)
王 琴(1992—),博士,讲师,从事中药抗肿瘤作用机制研究。E-mail: jiajiawangqin@163.com
龚普阳(1990—),博士,副教授,从事中药及民族药药效物质基础研究。E-mail: gongpuyang1990@163.com
[责任编辑 赵慧亮]
