高山桑黄挥发油超临界CO2萃取工艺优化及其生物活性研究
2023-07-21陈勇杏吴博宇申开泽于富强
鲁 斌,陈勇杏,吴博宇,王 赟,申开泽,于富强,华 燕*
高山桑黄挥发油超临界CO2萃取工艺优化及其生物活性研究
鲁 斌1, 2,陈勇杏1,吴博宇1,王 赟3,申开泽1,于富强2*,华 燕1*
1. 西南林业大学林学院,西南山地森林资源保育与利用教育部重点实验室,云南 昆明 650224 2. 中国科学院昆明植物研究所,中国西南野生生物种质资源库,云南省真菌多样性与绿色发展重点实验室,云南 昆明 650201 3. 西南林业大学生命科学学院,云南 昆明 650224
优化高山桑黄挥发油的提取工艺,对其化学成分进行分析,并评价其生物活性。采用单因素试验和响应面法(RSM)优化超临界CO2萃取高山桑黄挥发油的工艺条件;使用GC-MS、MTS和微量稀释方法鉴定挥发油的化学成分,并评估其体外抗炎、抗肿瘤和抗菌活性。超临界CO2萃取高山桑黄挥发油的最佳工艺条件为萃取温度47 ℃、萃取压力31 MPa、萃取时间1.5 h,在此条件下挥发油提取得率为(0.326±0.005)%。高山桑黄挥发油主要化学成分为四氯藜芦醚、1,2,4,5-四氯-3,6-二甲氧基苯、1,2,3,4-四氯-5-甲氧基-6-硝基苯、亚油酸乙酯、二十五烷。挥发油表现出显著的体外抗炎和抗肿瘤作用,但其抑菌活性不显著。成功优化了高山桑黄挥发油的提取工艺,在最适条件下获得了较高的得率;结合体外模型与生物活性评价,可为高山桑黄的药物开发和资源利用提供价值参考。
高山桑黄;挥发油;响应面法;提取工艺;生物活性
广义桑黄是锈革孔菌科(Hymenochaetaceae)下桑黄孔菌属Sheng H. Wu, L. W. Zhou & Y. C. Dai、木层孔菌属和纤孔菌属属下多个物种的统称[1],狭义桑黄是指(Sheng H. Wu, T. Hatt. & Y. C. Dai) Sheng H. Wu, L. W. Zhou & Y. C. Dai[2-3],通常情况下桑黄指桑黄孔菌属下的物种。桑黄又名桑耳、桑臣、桑黄菇、猢狲眼、桑上寄生、树鸡等,在中国已有两千多年的药用记载历史,被誉为“森林黄金”[4];其药用功效最早见于《神农本草经》《本草纲目》和《药性论》,常用于治疗血崩、血淋、脱肛泄血、带下、闭经、脾虚泄泻、症瘕积聚、癖饮等疾病[5]。
目前,已从桑黄中分离得到多种类型的化合物,包括甾体类、萜类、黄酮类、多糖类、多酚类、生物碱类、脂肪酸类、香豆素类等多种有效成分[6-10]。多年来,国内外学者对桑黄的药理作用进行了深入的研究,明确桑黄具有广泛的药理作用,主要表现在抗肿瘤、免疫调节、肝脏保护和抗肝纤维化、自由基清除和抗脂质过氧化、抑菌、消炎、降血糖等活性方面[11-20];因其显著的抗肿瘤效果,被认为是目前生物抗癌领域中药理活性最高的药用真菌[21-22]。近年来,中药挥发油成分及其生物活性受到广泛关注,然而大型药用真菌在此方面的相关研究却较少,仅在灵芝(Curtis) P. Karst.、银耳Berk.、香栓菌(L.) Fr.等部分真菌开展了挥发油的化学成分以及抗菌、抗氧化、细胞毒活性等药理活性方面的研究工作[23-26]。
挥发油作为一种挥发性的芳香物质被广泛应用,常用的提取方法主要有水蒸气蒸馏法、有机溶剂萃取法、压榨法、超声波辅助萃取、分子蒸馏法、超临界流体萃取法和亚临界流体萃取等[27]。超临界CO2流体萃取技术是利用CO2在高压下处于超临界状态而萃取分离各种有机物的一种先进技术,近年来广泛应用于挥发油物质的分离应用方面以及医药、食品、化妆品等领域[28]。超临界流体萃取法相比于其他方法具有提取率高和保护有效成分等明显优势[29-30],且采用CO2为萃取溶剂,具有无毒无污染、廉价及来源丰富等特点[31],适用于天然药物的萃取分离。本实验以桑黄孔菌属中的高山桑黄(Y. C. Dai & X. M. Tian) L. W. Zhou & Y. C. Dai(在真菌分类学研究上,经桑黄孔菌属系统发育分析,确定高山桑黄隶属于桑黄孔菌属中的一种)子实体为原料,采用Box-Behnken设计-响应面法(Box Behnken design- response surface methodology,BBD-RSM)对其挥发油进行提取工艺优化、化学成分分析及相关生物活性探讨,以期为桑黄资源的进一步开发利用提供数据参考和理论基础。
1 仪器与材料
1.1 仪器设备
Speed SFE型超临界萃取仪,美国ASI公司;7890B-5977B型气相色谱-质谱联用仪,美国Agilent公司;Sartorius BAS2245型万分之一电子天平,德国赛多利斯公司;SPX-100B-Z型生化培养箱,上海博远实业有限公司医疗设备厂;YB-200型高速多功能粉碎机,上海力箭机械有限公司;美国Thermo Scientific Multiskan FC多功能酶标仪,赛默飞世尔(上海)仪器有限公司。
1.2 材料
高山桑黄(Y. C. Dai & X. M. Tian) L. W. Zhou & Y. C. Dai子实体购于昆明市官渡区福盛堂中药材经营部,由中国科学院昆明植物研究所刘建伟鉴定,ITS序列上传至GenBank数据库(ITS OP881498和LSU OP881500),样品保存于西南林业大学林学院非木质资源培育与利用教研室。经自然晾干、粉碎过60目筛备用。
人类肿瘤细胞系:白血病HL-60细胞、肺癌A549细胞、肝癌SMMC-7721细胞、乳腺癌MDA-MB-231细胞、结肠癌SW480细胞,均购自美国ATCC细胞库。菌种:大肠埃希氏菌(ATCC25922)、金黄色葡萄球菌金黄亚种subsp.(ATCC29213)、肠沙门氏菌肠亚种subsp.(ATCC14028)、铜绿假单胞菌(ATCC27853),购自中国普通微生物菌种保藏管理中心。
1.3 试剂
小鼠单核巨噬细胞RAW264.7,中国科学院上海细胞库;DMEM培养基和胎牛血清,BI公司;Griess Reagent、脂多糖(lipopolysaccharide,LPS)及对照药物-NMMA[总一氧化氮合成酶(nitric oxide synthase,NOS)抑制剂,即G- monomethyl--arginine, monoacetate salt,也称ω- Me--Arg,或NG-Me--Arg, AcOH,是NOS广普性抑制剂]、二甲基亚砜(dimethyl sulfoxide,DMSO),美国Sigma公司;头孢他啶,上海源叶生物科技有限公司;青霉素G钠,Biosharp公司;MH肉汤、LB肉汤,广东环凯微生物科技有限公司;琼脂粉,Scientific Research Special公司;正己烷,分析纯,广东光华科技股份有限公司;二氯甲烷,分析纯,天津市致远化学试剂有限公司;无水硫酸钠,分析纯,天津市风船化学试剂科技有限公司。
2 方法与结果
2.1 高山桑黄挥发油超临界CO2萃取工艺
将粉碎的高山桑黄干燥粉末过60目药筛后装入萃取釜,通入CO2,设定萃取釜温度,当温度达到设定值后开始增压至设定压力,计时静态萃取,然后调节CO2流量进行连续动态萃取,用装有溶剂的样品瓶收集得到有特殊香味的黄色油状物。称定质量后通过公式计算挥发油得率。
挥发油得率=萃取挥发油量/原料质量
2.2 单因素试验优化高山桑黄挥发油的提取条件
通常情况下,萃取所用压力、温度和时间等因素会影响挥发油的得率,因此,在本试验中选择萃取温度、萃取压力、萃取时间为单因素试验条件。
2.2.1 萃取温度对高山桑黄挥发油提取的影响 固定称取30 g样品干燥粉末(已过60目筛)装入超临界CO2萃取仪萃取釜内,在萃取压力为30 MPa,静态萃取0.5 h后,在CO2流量10 L/h条件下连续动态萃取1.5 h,用二氯甲烷富集得到有特殊香味的黄色油状物并使用无水硫酸钠干燥处理,考察不同萃取温度(35、40、45、50、55 ℃)对挥发油得率的影响。在萃取压力为30 MPa,静态萃取0.5 h后,设定CO2流量10 L/h,连续动态萃取1.5 h的条件下,不同萃取温度提取挥发油的得率见表1。结果表明,在45 ℃下萃取挥发油的得率最大,且挥发油得率在一定温度条件下随温度的升高而增加,因为在超临界萃取中,升高温度有助于分子间的相互作用,增加分子扩散系数,提高萃取效率;但温度升高到一定程度得率反而出现下降趋势,这可能是由于温度过高时,分子间密度降低不利于传质作用,不利于组分的溶出导致挥发油得率降低[29]。
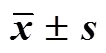
表1 萃取温度对高山桑黄挥发油得率的影响(, n = 3)
2.2.2 萃取压力对高山桑黄挥发油提取的影响 固定称取30 g样品干燥粉末(过60目筛)装入超临界CO2萃取仪萃取釜内,在萃取温度45 ℃,静态萃取0.5 h后在CO2流量10 L/h条件下连续动态萃取1.5 h,用二氯甲烷富集得到有特殊香味的黄色油状物并使用无水硫酸钠干燥处理,考察不同萃取压力(20、25、30、35、40 MPa)对挥发油得率的影响。在萃取温度40 ℃,静态萃取0.5 h后在CO2流量10 L/h条件下连续动态萃取1.5 h,不同萃取压力对挥发油得率的影响见表2。可见,在一定范围内随着萃取压力的增大挥发油的得率有明显增大,当超过最适压力后,萃取效率变低。在超临界CO2萃取过程中,当温度一定时,压力越大,超临界流体的密度越大,溶解能力也越大;但压力超过一定变化量时,传质效率降低,溶解度也受影响,易产生沟流现象使样品物料结块,不利于组分的溶出,从而导致挥发油得率降低[28]。
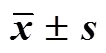
表2 萃取压力对高山桑黄挥发油得率的影响(, n = 3)
2.2.3 萃取时间对高山桑黄挥发油提取的影响 固定称取30 g样品干燥粉末(过60目筛)装入超临界CO2萃取仪萃取釜内,在萃取压力为30 MPa,静态萃取0.5 h后在CO2流量10 L/h条件下连续动态萃取,用二氯甲烷富集得到有特殊香味的黄色油状物并使用无水硫酸钠干燥处理,考察不同萃取时间(0.5、1.0、1.5、2.0、2.5 h)对挥发油得率的影响。在萃取压力为25 MPa下,静态萃取0.5 h后设定CO2流量为10 L/h连续动态萃取,萃取温度40 ℃,获得不同萃取时间下挥发油的得率见表3。随着时间的增加,使物料与CO2得到充分接触,挥发油的萃取效率也随之增加,当达到1.5 h时,萃取过程达到最后的萃取阶段,物料中的大部分精油几乎完全被萃取出,获得最大得率;再往后延长萃取时间,得率出现降低的现象,这说明延长时间对萃取效率几乎无影响,反而导致一些极易挥发的物质随CO2气流扩散到环境中,使挥发油萃取得率降低,同时也增加了时间成本和CO2的消耗量[32]。
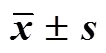
表3 萃取时间对高山桑黄挥发油得率的影响(, n = 3)
2.3 BBD-RSM优化挥发油的提取工艺
2.3.1 BBD-RSM结果分析 在单因素试验的基础上,根据Design Expert 13软件中的BBD-RSM试验设计原理,以萃取温度(1)、萃取压力(2)、萃取时间(3)为影响因素,以高山桑黄挥发油的得率()为响应值,进行3因素3水平组合设计优化并确定超临界CO2萃取法提取挥发油的最佳工艺条件。BBD-RSM试验设计因素水平及结果见表4。
通过响应面软件对表4中的数据进行多元二次回归分析,得到挥发油萃取得率的回归方程为=0.331 2+0.009 81+0.008 62-0.003 43+0.008 512+0.005 013+0.001 723-0.019 512-0.020 222-0.019 232。
表4 BBD-RSM试验设计及结果
Table 4 Response surface experiment design and results
试验号X1/℃X2/MPaX3/hY/% 150 (+1)30 (0)2.0 (+1)0.303±0.004 250 (+1)25 (−1)1.5 (0)0.284±0.001 340 (−1)35 (+1)1.5 (0)0.282±0.002 445 (0)30 (0)1.5 (0)0.332±0.004 545 (0)35 (+1)2.0 (+1)0.296±0.004 645 (0)35 (+1)1.0 (−1)0.301±0.003 745 (0)30 (0)1.5 (0)0.335±0.001 850 (+1)30 (0)1.0 (−1)0.298±0.002 945 (0)25 (−1)1.0 (−1)0.291±0.001 1040 (−1)25 (−1)1.5 (0)0.278±0.001 1140 (−1)30 (0)2.0 (+1)0.277±0.003 1245 (0)30 (0)1.5 (0)0.330±0.004 1345 (0)30 (0)1.5 (0)0.328±0.002 1445 (0)30 (0)1.5 (0)0.331±0.003 1545 (0)25 (−1)2.0 (+1)0.279±0.002 1650 (+1)35 (+1)1.5 (0)0.322±0.002 1740 (−1)30 (0)1.0 (−1)0.292±0.003
2.3.2 响应面回归方程方差分析与试验验证 根据表5方差分析可知,模型中值<0.01且失拟项不显著=0.163 5>0.05,说明模型拟合良好且显著,方法可靠二次模型选择合适。模型中2=0.988 4,2adj=0.973 5,表明回归方程适合对本实验中挥发油得率的分析和预测。其中单因素1、2之间对挥发油得率的影响有极显著差异(<0.01),而单因素3对挥发油得率的影响差异显著(<0.05),在萃取温度与萃取压力交互项(12)中对挥发油得率的相互作用影响有极显著差异(<0.01),萃取温度与萃取时间交互项(13)对挥发油得率的相互作用影响具有显著性(<0.05)。在各单因素水平范围内,根据值判断出各因素间对结果的影响程度大小为1(萃取温度)>2(萃取压力)>3(萃取时间)。
表5 响应面回归方差分析
Table 5 Response surface statistical results of regression variance analysis
方差来源平方和自由度均方F值P值显著性方差来源平方和自由度均方F值P值显著性 模型7.30×10−398.11×10−466.34<0.000 1极显著X121.60×10−311.60×10−3130.67<0.000 1极显著 X18.00×10−418.00×10−462.23<0.000 1极显著X221.70×10−311.70×10−3140.93<0.000 1极显著 X26.00×10−416.00×10−448.702.00×10−4极显著X321.60×10−311.60×10−3127.33<0.000 1极显著 X31.00×10−411.00×10−47.460.029 3显著残差1.00×10−471.43×10−5 X1X23.00×10−413.00×10−423.651.80×10−3极显著失拟项1.00×10−433.33×10−52.920.163 5 X1X31.00×10−411.00×10−48.180.024 3显著误差2.68×10−546.70×10−6 X2X31.22×10−511.22×10−51.000.350 1 合计7.40×10−316
综上所述,由响应面回归方差分析及二元回归方程绘制各因素之间交互影响的等高线图和相互作用的曲面图,如图1所示。通过响应面模型拟合方程分析得到优化后的最佳工艺参数条件为萃取温度46.53 ℃,萃取压力31.37 MPa,萃取时间1.48 h,挥发油得率的预测值为0.334%。结合实际情况进行参数调整后得到最优工艺条件为萃取温度47 ℃,萃取压力31 MPa,萃取时间1.5 h。在此工艺参数下,试验平行3次进行验证,挥发油得率分别为0.322%、0.326%、0.331%,计算高山桑黄挥发油的最终平均提取得率为(0.326±0.005)%,与模型理论值基本一致,说明此实验模型可以很好反映出各相互作用因素与挥发油得率之间的影响关系,对工艺条件优化具有指导作用。
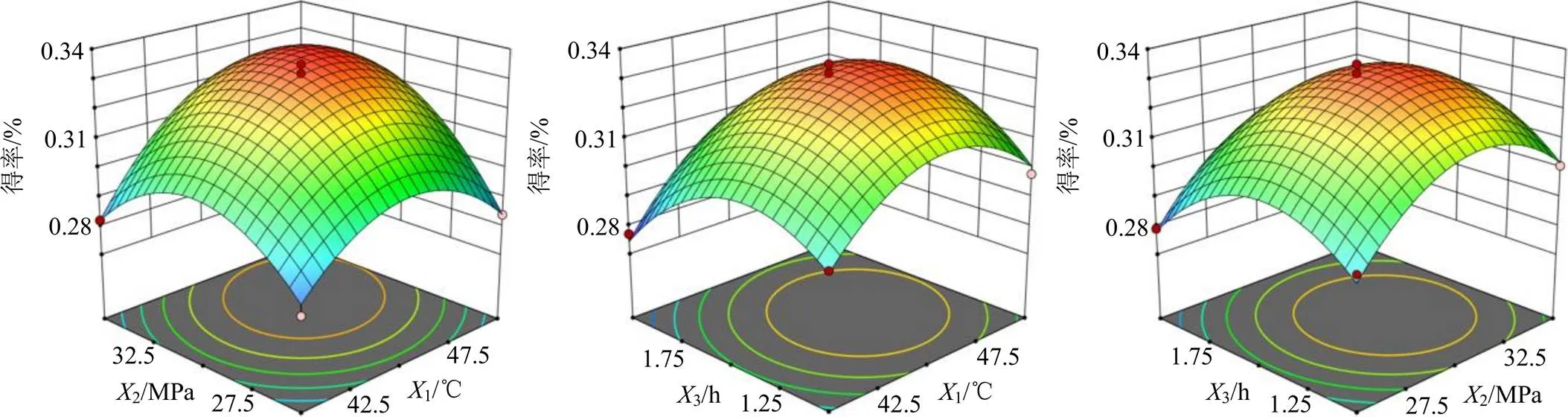
图1 各因素间的交互作用对高山桑黄挥发油得率的影响
2.4 高山桑黄挥发油GC-MS分析
将萃取得到的挥发油溶于正己烷进行无水硫酸钠干燥处理后,过0.45 μm膜,备用。
GC条件:HP-5 MS毛细管色谱柱(30 m×0.25 mm×0.25 μm);载气为高纯氦气;恒定流量1.0 mL/min;采用程序升温,初始温度50 ℃,保持1 min,以速率10 ℃/min升至160 ℃,保持5 min,以3 ℃/min的速率升至200 ℃,保持5 min;再以10 ℃/min的速率升至250 ℃,保持2 min。进样口温度250 ℃;进样量1 μL;分流比25∶1。
MS条件:EI离子源;电子能量70 eV;离子源温度230 ℃;接口温度250 ℃;四级杆温度150 ℃;溶剂延迟4 min;全扫描质量范围/30~550。
通过检索NIST 14.L化学工作站标准质谱图库鉴定分析总离子流图内各峰的质谱图结果(图2),采用峰面积归一化法确定组分的相对含量。
对采用CO2超临界萃取法提取得到的挥发油进行分析,通过色谱图解卷积方式进行谱库检索鉴定其化学成分及相对含量,结果见表6。根据结果显示,使用CO2超临界萃取法得到的挥发油化学成分较多,共鉴定了37种化合物,这些组分包括酮类、醛类、酯类、烷烃类、烯烃类以及其他类等,其中相对质量分数较高的主要化学成分为四氯藜芦醚(19.97%)、1,2,3,4-四氯-5-甲氧基-6-硝基苯(14.24%)、二十五烷(9.97%)、亚油酸乙酯(8.38%)、1,2,4,5-四氯-3,6-二甲氧基苯(6.76%)、2(3)-呋喃酮二氢-5,5-二甲基-4-(3-氧代丁基)(5.98%)、十二烷(4.78%)、2,4-癸二烯醛(3.92%)、花侧柏烯(2.67%)、十三烷(2.57%)、(+)-γ-古芸烯(2.29%)、α-布藜烯(2.28%)、十七烷(2.08%)、十六烷(1.67%)、马苄烯酮(1.42%)、5-羟基-2,4-二叔丁基苯基戊酸酯(1.21%)。
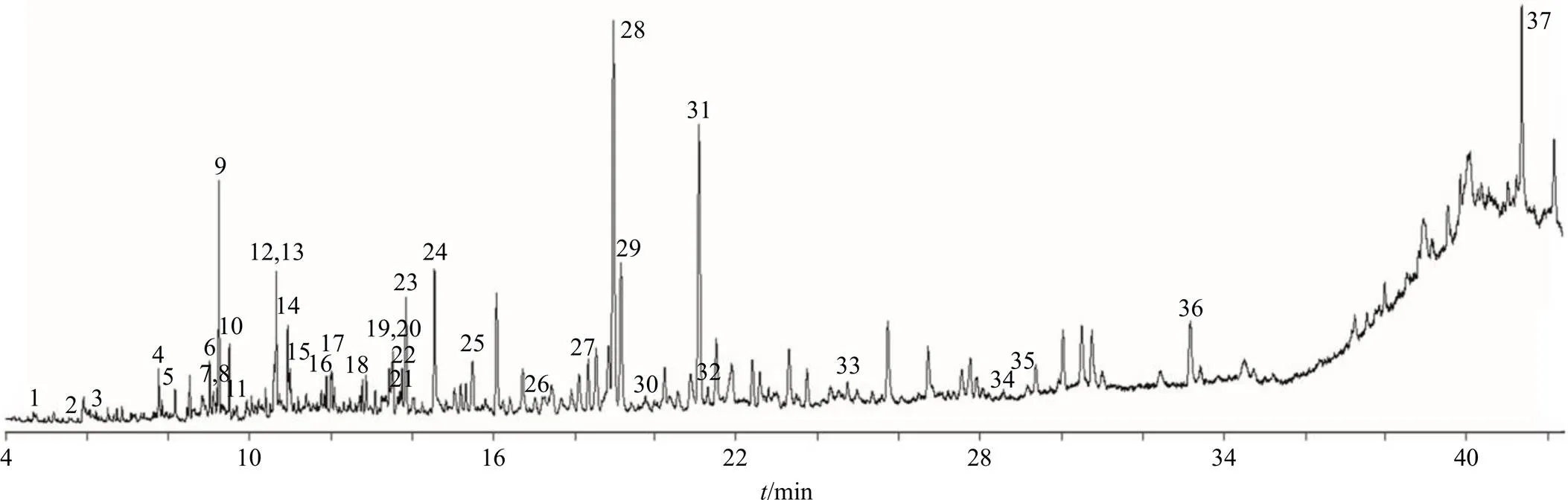
图2 高山桑黄挥发油GC-MS分析总离子流图
表6 高山桑黄挥发油成分分析
Table 6 Components analysis of volatile oil from S. alpinus
峰号化合物名称分子式CAS号相对含量/% 11,3-二氯-2-丙醇(1,3-dichloro-2-propanol)C3H6Cl2O96-23-10.44 23-羟基-2-丁酮(acetoin)C4H8O2513-86-00.05 33,3-二甲基已烷(3,3-dimethyl-hexane)C8H18563-16-60.11 4十一烷(undecane)C11H241120-21-40.92 5壬醛(nonanal)C9H18O124-19-60.36 6(−)-4-萜品醇[(R)-4-methyl-1-(1-methylethyl)-3-cyclohexen-1-ol]C10H18O20126-76-50.93 72-(4-甲基苯基)丙-2-醇(α,α,4-trimethyl-benzenemethanol)C10H14O1197-01-90.42 8(S)-(+)-5-甲基-1-己醇[(S)-(+)-5-methyl-1-heptanol]C8H18O57803-73-30.13 9十二烷(dodecane)C12H26112-40-34.78 10马苄烯酮(4,6,6-trimethyl-bicyclo[3.1.1]hept-3-en-2-one)C10H14O80-57-91.42 111-庚烯-3-酮(1-hepten-3-one)C7H12O2918-13-00.12 122,4-癸二烯醛[(E,Z)-2,4-decadienal]C10H16O25152-83-43.92 13十三烷(tridecane)C13H28629-50-52.57 144,5-二甲基壬烷(4,5-dimethyl-nonane)C11H2417302-23-70.26 15鲸蜡烯(cetene)C16H32629-73-20.60 162,7-二甲基十一烷(2,7-dimethyl-undecane)C13H2817301-24-50.54 17香叶基丙酮[(E)-6,10-dimethyl-5,9-undecadien-2-one]C13H22O3796-70-10.92 183,5-二甲基十一烷(3,5-dimethyl-undecane)C13H2817312-81-10.72 196-乙基-2-甲基癸烷(6-ethyl-2-methyl-decane)C13H2862108-21-80.66 20α-布藜烯{[1S-(1α,7α,8aβ)]-1,2,3,5,6,7,8,8a-octahydro-1,4-dimethyl-7-(1-methylethenyl)-azulene}C15H243691-11-02.28 21(+)-γ-古芸烯{[1R-(1α,3aβ,4α,7β)]-1,2,3,3a,4,5,6,7-octahydro-1,4-dimethyl-7-(1-methylethenyl)-azulene}C15H2422567-17-52.29 225-羟基-2,4-二叔丁基苯基戊酸酯(5-hydroxy-pentanoic acid, 2,4-di-t-butylphenylesters)C19H30O3166273-38-71.21 23花侧柏烯[(R)-1-methyl-4-(1,2,2-trimethylcyclopentyl)-benzene]C15H2216982-00-62.67 242(3H)-呋喃酮二氢-5,5-二甲基-4-(3-氧代丁基)[dihydro-5,5-dimethyl-4-(3-oxobutyl)-2(3H)-furanone]C10H16O34436-81-15.98 25十六烷(hexadecane)C16H34544-76-31.67 26(1-乙基丙基)环己烷[(1-ethylpropyl)-cyclohexane]C11H2226321-98-20.63 27十七烷(heptadecane)C17H36629-78-72.08 28四氯藜芦醚(1,2,3,4-tetrachloro-5,6-dimethoxy-benzene)C8H6Cl4O2944-61-619.97 291,2,4,5-四氯-3,6-二甲氧基苯(1,2,4,5-tetrachloro-3,6-dimethoxy-benzene)C8H6Cl4O2944-78-56.76 30四氢糠醇丙酸酯(n-butyric acid tetrahydrofurfuryl ester)C8H14O3637-65-00.31 311,2,3,4-四氯-5-甲氧基-6-硝基苯(1,2,3,4-tetrachloro-5-methoxy-6-nitro-benzene)C7H3Cl4NO369576-80-314.24 32大根香叶烷[1,7-dimethyl-4-(1-methylethyl)cyclodecane]C15H30645-10-30.73 333,3-二甲基已烷(3,3-dimethyl-hexane)C8H18563-16-60.75 341,3-苯二酚单苯甲酸酯(1,3-benzenediol,monobenzoate)C13H10O3136-36-70.15 35丙烯醛(2-propenal)C3H4O107-02-80.07 36亚油酸乙酯(linoleic acid ethyl ester)C20H36O2544-35-48.38 37二十五烷(pentacosane)C25H52629-99-29.97
2.5 生物活性
2.5.1 挥发油对RAW264.7细胞NO释放水平的影响 将RAW264.7细胞接种至96孔板,用1 μg/mL LPS进行诱导刺激,同时加入待测样品(终质量浓度50 μg/mL)处理初筛,确定初筛结果活性良好后再以终质量浓度为50 µg/mL进行2倍系列质量浓度稀释复筛,设置对照(不含药物)组和阳性对照(-NMMA)组。细胞过夜培养后,吸取培养基通过Griess法检测NO生成,在570 nm处测定吸光度()值。在剩余培养基中加入MTS进行细胞存活率检测,排除样品对细胞的毒性影响。
NO生成抑制率=(对照组570-样品或阳性对照组570)/对照组570
取对数生长期的RAW 264.7细胞,采用Griess法测定细胞培养上清液中NO的浓度,并计算待测样品抑制RAW264.7细胞释放NO的半数抑制浓度(half inhibitory concentration,IC50)。通过待测样品的活性初筛结果,进一步设置系列质量浓度梯度,以待测样品终质量浓度为50 μg/mL按照2倍稀释关系进行活性复筛并最终计算IC50。根据表7结果显示,以阳性对照药物-NMMA作为参考,挥发油能够很好地抑制LPS诱导RAW264.7细胞释放NO,具有较高的抑制活性,说明该挥发油提取物在炎症治疗方面具有一定疗效。
2.5.2 挥发油的细胞毒活性评价 使用MTS法测定挥发油的细胞毒活性。接种细胞:用含10%胎牛血清的培养液(DMEM或者RMPI 1640)配成单个细胞悬液,以每孔3000~15 000个细胞接种到96孔板,每孔体积100 μL,细胞提前12~24 h接种培养。加入待测样品溶液:供试样品用DMSO溶解,以100 µg/mL质量浓度进行初筛,在初筛结果有活性前提下以100、20、4、0.8、0.16 µg/mL质量浓度复筛,每孔终体积200 μL,每种处理均设3个复孔。显色:在37 ℃条件下培养48 h后,贴壁细胞弃孔内培养液,每孔加MTS溶液20 μL和培养液100 μL;设3个空白复孔(MTS溶液20 μL和培养液100 μL的混合液),继续孵育2~4 h,使反应充分进行后测定值。比色:选择492 nm波长,多功能酶标仪读取各孔值,记录结果。
表7 高山桑黄挥发油对LPS诱导RAW 264.7巨噬细胞释放NO的影响(, n = 3)
细胞抑制率=(对照-样品)/(对照-空白)
对照为含有MTS溶液、培养液、细胞的值,样品为含有MTS溶液、培养液、细胞和药物(挥发油/顺铂/紫杉醇)的值,空白为含有MTS溶液、培养液的值
每次实验均设顺铂(DDP)和紫杉醇(Taxol)2个阳性化合物,以质量浓度为横坐标,细胞存活率为纵坐标绘制细胞生长曲线,应用两点法(Reed and Muench法)计算化合物的IC50值。
lgIC50=高于或等于50%细胞存活率的稀释度的对数+距离比例×稀释系数的对数
距离比例=(高于或等于50%细胞存活率的百分数-50%)/(高于或等于50%细胞存活率的百分数-低于50%细胞存活率的百分数)
根据MTS原理方法考察挥发油对5株肿瘤细胞(白血病HL-60、肺癌A549、肝癌SMMC-7721、乳腺癌MDA-MB-231、结肠癌SW480)的抑制活性,在挥发油样品质量浓度为100 µg/mL时初筛对体外肿瘤细胞生长有抑制活性,进一步设置系列质量浓度复筛的测定结果见表8,表明挥发油对5株体外肿瘤细胞生长均有较高的抑制活性。
2.5.3 挥发油抑菌活性的测定 将待测样品用DMSO溶解并加入96孔培养板,以128 μg/mL质量浓度进行初筛,向各孔加入菌液(5×105cfu/mL);在37 ℃条件下培养24 h,使用酶标仪测定625 nm波长下的值。实验同时设置培养基空白对照、细菌对照以及头孢他啶、青霉素G钠阳性药物对照。
本实验选取大肠埃希菌、金黄色葡萄球菌金黄亚种、肠沙门氏菌肠亚种、铜绿假单胞菌4株细菌进行挥发油的体外抗细菌活性筛选。其抑制作用筛选结果见表9,结果显示,当质量浓度为128 μg/mL时,挥发油对4株细菌均无明显抑制作用。
3 结论
炎症是许多疾病发生的必经过程,不仅诱导肿瘤的发生,而且促进肿瘤的转移扩散,肿瘤是目前威胁人类健康的重大疾病,也是全球主要的公共健康问题[33]。当机体受到感染刺激时体内巨噬细胞会产生大量的炎症因子[34],其中NO是一种十分重要的炎症因子,在炎症发生过程中,具有调节内皮细胞、平滑肌细胞,参与组织炎症的重要作用[33]。抗炎活性研究中测试方法较多,表征抗炎作用的主要方法之一是通过药物或药材对LPS诱导炎症评价其抑制效果。
表8 高山桑黄挥发油对5种癌细胞的IC50
Table 8 IC50 of S. alpinus volatile oil on five types of cancer cells
组别IC50/(μg∙mL−1) HL-60A549SMMC-7721MDA-MB-231SW480 挥发油30.22±2.2726.60±1.7719.90±1.8440.25±0.9344.55±0.81 顺铂13.32±0.1915.87±0.266.59±0.1815.77±0.4524.26±1.11 紫杉醇<0.008<0.0080.12±0.01<0.008<0.008
表9 高山桑黄挥发油抑菌结果
Table 9 Antibacterial results of volatile oil of S. alpinus
分组质量浓度/(μg∙mL−1)抑制率/% 大肠埃希菌金黄色葡萄球菌肠沙门氏菌铜绿假单胞菌 青霉素G钠5 97.72±0.00 10 99.19±0.11 头孢他啶2100.16±0.08 99.43±0.16 挥发油12810.38±2.98−63.10±0.36−10.67±1.5415.93±0.79
近年来,国内外学者发现不少天然药物不仅来源广泛,还具有毒副作用小的优点,深受青睐。MTS法是一种简便、快速测定抗癌药物敏感性的方法,常用于抗癌活性药物研究的筛选工作中[35]。超临界流体CO2萃取技术近年来发展迅猛,广泛应用在萃取中药材有效成分研究领域。此萃取技术效率高、速度快,溶剂无毒无害,活性成分不易破坏,相对水蒸气蒸馏法来说优势明显,对中药有效成分提取的卫生及品质符合国家要求,也更有利于中药现代化产业的发展及人类对环境的保护。
本研究利用超临界流体CO2萃取技术,对高山桑黄挥发油的萃取工艺进行优化,在此基础上通过GC-MS分析测定其挥发油的主要成分和含量,并评价了其对炎症因子NO释放的影响以及体外细胞毒活性。在单因素试验基础上,通过响应面法优化设计,发现超临界流体CO2的萃取温度和压力等因素对挥发油的得率有极显著影响(<0.01),而萃取时间对挥发油得率影响显著(<0.05)。最终经模型优化获得超临界流体CO2萃取挥发油的最佳工艺条件为萃取温度47 ℃,萃取压力31 MPa,萃取时间1.5 h,以此参数条件进行试验验证,实际测得挥发油的平均得率为(0.326±0.005)%,与二元回归模型分析所得的挥发油提取得率预测值基本一致,说明此模型可靠。
利用GC-MS对提取得到的高山桑黄挥发油进行成分分析,共鉴定出37种化合物,其中相对质量分数较高的化学成分主要包括四氯藜芦醚(19.97%)、1,2,3,4-四氯-5-甲氧基-6-硝基苯(14.24%)、二十五烷(9.97%)、亚油酸乙酯(8.38%)、1,2,4,5-四氯-3,6-二甲氧基苯(6.76%)、2(3)-呋喃酮二氢-5,5-二甲基-4-(3-氧代丁基)(5.98%)、十二烷(4.78%)、2,4-癸二烯醛(3.92%)、花侧柏烯(2.67%)、十三烷(2.57%)、(+)-γ-古芸烯(2.29%)、α-布藜烯(2.28%)、十七烷(2.08%)、十六烷(1.67%)、马苄烯酮(1.42%)、5-羟基-2,4-二叔丁基苯基戊酸酯(1.21%)等。在实验开展初期查阅大量资料对比发现,水蒸气蒸馏法,温度过高容易造成物质结构破坏,产生更多的裂解产物;但超临界流体CO2萃取法与其相比,可以有效避免对成分的破坏,更好保护活性成分的结构和功能,且萃取溶剂CO2具有无毒、廉价等特点,因此选择超临界流体CO2萃取法作为本项研究工作的技术方法。
本实验采用MTS法,对超临界流体CO2萃取法得到的高山桑黄挥发油提取物进行体外抗炎和抗肿瘤活性评价,均表现出显著的抑制效果。然而,当挥发油提取物质量浓度为128 µg/mL时进行体外抗菌活性初筛,发现其对大肠埃希菌、金黄色葡萄球菌、肠沙门氏菌、铜绿假单胞菌均无明显的抑制作用。
综上,结合本实验分析测试的物质基础,在实际应用中,由于该技术提取的化学成分除挥发油外,还可能含有大量的脂溶性成分,推测其体外抗炎和抗肿瘤活性显著的原因是挥发油成分以及其他脂溶性成分之间存在协同作用,从而发挥出更好的抑制活性。同时,挥发油的体外抗菌活性也与其特定的化学组成和含量有关[36-39],根据实验初筛结果不显著推测原因可能是与提取物成分种类之间的拮抗作用致使抑菌活性降低或不明显有关,还有可能是因为细菌的细胞壁阻止了抗菌活性成分的进入。本研究为高山桑黄挥发油超临界CO2萃取工艺优化及其生物活性的研究,提供了初步的理论依据,其机制仍有待进一步的研究考证,可为其资源开发利用提供指导。
志谢:何新华教授、张凤明博士对文章修改提出建议,西南林业大学林学院林产品分析检测中心提供实验平台、中国科学院昆明植物研究所活性筛选平台对活性测试提供帮助。
利益冲突 所有作者均声明不存在利益冲突
[1] 吴声华, 戴玉成. 药用真菌桑黄的种类解析 [J]. 菌物学报, 2020, 39(5): 781-794.
[2] Wu S H, Dai Y C, Hattori T,. Species clarification for the medicinally valuable ‘sanghuang’ mushroom [J]., 2012, 53(1): 135-149.
[3] Zhou L W, Vlasák J, Decock C,. Global diversity and taxonomy of thecomplex (Hymenochaetales, Basidiomycota):gen. nov.,andgen. et spp. nov., and 17 new combinations [J], 2016, 77(1): 335-347.
[4] 吕英华, 王建芳, 李玉平, 等. 药用真菌桑黄的研究进展 [J]. 蚕业科学, 2009, 35(1): 204-210.
[5] 孙培龙, 徐双阳, 杨开, 等. 珍稀药用真菌桑黄的国内外研究进展 [J]. 微生物学通报, 2006, 33(2): 119-123.
[6] 莫顺燕, 杨永春, 石建功. 桑黄化学成分研究 [J]. 中国中药杂志, 2003, 28(4): 339-341.
[7] Kang H S, Choi J H, Cho W K,. A sphingolipid and tyrosinase inhibitors from the fruiting body of[J]., 2004, 27(7): 742-750.
[8] Lee Y S, Kang Y H, Jung J Y,. Inhibitory constituents of aldose reductase in the fruiting body of[J]., 2008, 31(4): 765-768.
[9] Wu X L, Lin S, Zhu C G,.- and heptanor- sterols and tremulane sesquiterpenes from cultures of[J]., 2010, 73(7): 1294- 1300.
[10] Yin R H, Zhao Z Z, Chen H P,. Tremulane sesquiterpenes from cultures of the fungusand their vascular-relaxing activities [J]., 2014, 10: 300-303.
[11] Kim G Y, Park H S, Nam B H,. Purification and characterization of acidic proteo-heteroglycan from the fruiting body of(Berk. & M. A. Curtis) Teng [J]., 2003, 89(1): 81-87.
[12] Kim B C, Choi J W, Hong H Y,. Heme oxygenase-1 mediates the anti-inflammatory effect of mushroomin LPS-stimulated RAW264.7 macrophages [J]., 2006, 106(3): 364-371.
[13] Lee Y S, Kim Y H, Shin E K,. Anti-angiogenic activity of methanol extract ofand its fractions [J]., 2010, 131(1): 56-62.
[14] Huang H Y, Chieh S Y, Tso T K,. Orally administered mycelial culture ofexhibits antitumor effects in hepatoma cell-bearing mice [J]., 2011, 133(2): 460-466.
[15] 昝立峰, 包海鹰, 李丹花. “桑黄”类真菌中多酚物质及其生物活性研究进展 [J]. 天然产物研究与开发, 2016, 28(1): 147-155.
[16] 朱琳, 崔宝凯. 药用真菌桑黄的研究进展 [J]. 菌物研究, 2016, 14(4): 201-209.
[17] Shan L, Liu Z N, Ci L L,. Research progress on the anti-hepatic fibrosis action and mechanism of natural products [J]., 2019, 75: 105765.
[18] Wu M D, Cheng M J, Chen Y L,. Secondary metabolites from the fermented whole broth of fungal strain[J]., 2019, 55(1): 36-40.
[19] Wang X T, Sun T T, Sun J,. Molecular cloning, characterisation, and heterologous expression of farnesyl diphosphate synthase from[J]., 2020, 62(2): 132-141.
[20] 石河, 梅景晨, 李荣雪, 等. 桑黄多糖的提取分离及药理作用研究进展 [J]. 药物评价研究, 2023, 46(6): 1360-1368.
[21] Ikekawa T, Nakanishi M, Uehara N,. Antitumor action of some Basidiomycetes, especially[J]., 1968, 59(2): 155-157.
[22] 曾鹏, 黄世荣, 刘明明, 等. 应用响应面法优化超声波辅助热水提取桑黄多糖的工艺条件 [J]. 蚕业科学, 2015, 41(5): 928-933.
[23] Al-Fatimi M, Wurster M, Lindequist U. Chemical composition, antimicrobial and antioxidant activities of the volatile oil ofBres [J]., 2016, 3(2): 10.
[24] Ohiri R C, Bassey E E. Gas chromatography-mass spectrometry analysis of constituent oil from Lingzhi or Reishi medicinal mushroom,(Agaricomycetes), from[J]., 2016, 18(4): 365-369.
[25] Liu W, Tang Q T, Wei Y T,. Chemical compounds and antioxidant activity of volatile oil from the white jelly mushroom,(Tremellomycetes) [J]., 2019, 21(3): 207-214.
[26] Ma L, Han Y, Bao H Y,. GC-MS analysis and cytotoxicity detection of volatile oil from the fragrant bracket mushroom,(Agaricomycetes) [J]., 2020, 22(4): 397-406.
[27] 张苏慧, 廖良坤, 魏晓奕, 等. 超临界CO2萃取斜叶黄檀精油工艺优化及精油成分分析 [J]. 热带作物学报, 2018, 39(4): 791-796.
[28] 王靖, 刘东波, 张志旭. 苦瓜挥发油超临界二氧化碳萃取工艺优化及其抗炎活性研究 [J]. 食品工业科技, 2019, 40(4): 153-158.
[29] 丁仡, 李源栋, 刘秀明, 等. 超临界CO2萃取印蒿精油工艺优化及成分分析 [J]. 食品研究与开发, 2019, 40(24): 167-172.
[30] 王立英, 王艳珍, 吴丽艳, 等. 响应面法优化超临界CO2萃取决明子挥发油工艺及其抑菌活性研究 [J]. 药物分析杂志, 2016, 36(4): 594-601.
[31] 张晓月, 杨晓芳, 肖培云, 等. 超临界CO2萃取不同产地云南松松针挥发油及其GC-MS分析 [J]. 中国实验方剂学杂志, 2020, 26(11): 161-169.
[32] 苗笑雨, 谷大海, 王桂瑛, 等. 响应曲面法优化超临界CO2萃取虎掌菌精油工艺及其挥发性化合物成分分析 [J]. 现代食品科技, 2018, 34(5): 148-157.
[33] 杨超, 闫庆梓, 唐洁, 等. 蒲公英挥发油成分分析及其抗炎抗肿瘤活性研究 [J]. 中华中医药杂志, 2018, 33(7): 3106-3111.
[34] Gao Y, Chen X, Fang L,. Rhein exerts pro- and anti-inflammatory actions by targeting IKKβ inhibition in LPS-activated macrophages [J]., 2014, 72: 104-112.
[35] 张海霞, 方芸, 葛卫红, 等. 四氮唑盐法肿瘤药敏试验及应用 [J]. 中国医院药学杂志, 2005, 25(7): 663-664.
[36] Almadiy A A, Nenaah G E, Al Assiuty B A,. Chemical composition and antibacterial activity of essential oils and major fractions of fourspecies and their nanoemulsions against foodborne bacteria [J]., 2016, 69: 529-537.
[37] Vallverdú-Queralt A, Regueiro J, Martínez-Huélamo M,. A comprehensive study on the phenolic profile of widely used culinary herbs and spices: Rosemary, thyme, oregano, cinnamon, cumin and bay [J]., 2014, 154: 299-307.
[38] 程嘉莉, 马江, 肖爱华, 等. 不同干燥方式对红花玉兰花蕾挥发油成分及抗氧化、抗菌活性的影响 [J]. 食品科学, 2020, 41(19): 132-139.
[39] 田丹丹, 李艳, 梅晓宏. 牛油果中植物甾醇的鉴定及抗氧化、抑菌活性 [J]. 食品科学, 2019, 40(3): 30-35.
Optimization of supercritical CO2extraction process and biological activities ofvolatile oil
LU Bin1, 2, CHEN Yong-xing1, WU Bo-yu1, WANG Yun3, SHEN Kai-ze1, YU Fu-qiang2, HUA Yan1
1. Key Laboratory for Forest Resources Conservation and Utilization in the Southwest Mountains of China, College of Forestry, Southwest Forestry University, Ministry of Education, Kunming 650224, China 2. The Germplasm Bank of Wild Species, Yunnan Key Laboratory for Fungal Diversity and Green Development, Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China 3. College of Life Science, Southwest Forestry University, Kunming 650224, China
To optimize the extraction of volatile oil from Gaoshan Sanghuang (), analyze its constituents, and evaluate their biological activities.According to the result of the single factor experiment, the supercritical CO2extraction conditions of volatile oil fromwere optimized by the single factor test and response surface method (RSM). The chemical constituents, biological activities of anti-inflammatory, antitumor, and antibacterial of volatile oil were evaluated by GC-MS, MTS, and microdilution methods.The optimal conditions for extracting volatile oil were found to be 47 ℃ and 31 MPa pressure for 1.5 h. The yield obtained was (0.326 ± 0.005)%. The volatile oil ofcontains 1,2,3,4-tetrachloro-5,6-dimethoxy-benzene, 1,2,3,4-tetrachloro-5-methoxy-6-nitro-benzene, linoleic acid ethyl ester, and pentacosane. The volatile oil exhibited significant activitiesanti-inflammatory and antitumor properties. However, it showed no significant antibacterial activity.The study successfully optimized the extraction of volatile oil from, resulting in a significantly high yield under the tested conditions. The integration ofmodels and biological activities evaluation provides valuable insights for pharmaceutical development and resource utilization from.
(Y. C. Dai & X. M. Tian) L. W. Zhou & Y. C. Dai; volatile oil; response surface method; extraction process; biological activities
R283.6
A
0253 - 2670(2023)14 - 4520 - 10
10.7501/j.issn.0253-2670.2023.14.012
2023-02-09
云南省教育厅科学研究基金项目(2022Y584);云南重大科技专项计划项目(202202AE090001);国家现代农业产业技术体系(CARS-21-05B);西南林业大学科技创新基金项目(KY21029)
鲁 斌(1994—),男,硕士研究生,从事天然药物化学研究。E-mail: 1300255072@qq.com
于富强(1976—),男,正高级工程师,研究方向为大型真菌种质资源收集保藏与开发利用。E-mail: fqyu@mail.kib.ac.cn
华 燕(1968—),女,教授,博士生导师,从事天然药物化学研究。E-mail: huayan1216@163.com
[责任编辑 郑礼胜]
