TFF3 和HER2 在食管胃交界部腺癌中的表达及临床意义
2023-07-20张小辉王海伟田云霄杨建华袁艳龙邯郸市中心医院病理科河北邯郸056001
张小辉,王海伟,田云霄,杨建华,孙 颖,袁艳龙(邯郸市中心医院病理科,河北 邯郸 056001)
近年来,食管胃交界部腺癌(adenocarcinoma of esophagogastric junction,AEG)的发病率迅速增加,严重威胁人们的生命健康[1]。AEG 进展迅速,发现时多为晚期,肿瘤的异质性较大,治疗方法包括传统的手术、化疗、放疗及新型的免疫治疗,目前AEG 患者的5 年生存率仍不高,仅20%左右[2]。故亟需寻找新的AEG 预后生物标志物及治疗靶点。三叶因子家族成员三叶因子3(trefoil factor-3,TFF3)是一种小分子多肽,主要由消化道黏膜中的杯状细胞分泌,在多种恶性肿瘤中高表达。TFF3 对消化道黏膜损伤有修复和保护作用,并参与多种恶性肿瘤的发生、发展及转移[3]。人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)是一种酪氨酸激酶受体,通过形成二聚体激活下游MAPK信号通路和PI3K/Akt信号通路,二者共同作用于肿瘤细胞,从而促进肿瘤的生存、增殖、侵袭、转移、血管生成及抗肿瘤细胞凋亡等[4]。因此,TFF3 及HER2 有望成为AEG 免疫治疗的靶点或预测预后的标志物。本研究通过检测TFF3 及HER2 在AEG 组织中的表达并分析其与预后的关系,探讨二者在AEG发生发展中的作用,以期为AEG的治疗提供理论依据。
1 材料与方法
1.1 标本来源
收集邯郸市中心医院2016 年1 月至2017 年3 月未经放疗及化疗的AEG 患者的手术标本。纳入标准:所有标本均经2名副高级职称以上病理医师鉴定为腺癌;有完整的临床资料和随访记录。排除标准:合并小细胞癌、鳞状细胞癌及其他类型肿瘤;肿瘤多发。符合标准的病例共140 例,其中女24 例,男116 例;年龄52~82岁,中位年龄66岁;肿瘤最大径0.8~11.0 cm;Laurén 分型:肠型36 例,混合型73 例,弥漫型31 例;T 分期:T1~T2 期9 例,T3~T4 期131 例;淋巴结转移101例,未转移39例;TNM分期:Ⅰ~Ⅱ期41例,Ⅲ~Ⅳ期99 例。 本研究经我院医学伦理委员会批准(202102-002)。
1.2 实验方法
所有标本均经10%福尔马林固定24 h,石蜡包埋、4 μm 切片,以PBS 代替一抗为阴性空白对照,正常结肠黏膜作为阳性对照。行HE染色和免疫组化Elivison两步法染色检测TFF3和HER2表达,若HER2检测结果不确定,进一步行免疫荧光原位杂交。分析AEG组织中TFF3、HER2 表达与患者年龄、性别、肿瘤最大径、Laurén 分型、T 分期、淋巴结转移及TNM 分期等临床病理特征的关系。
1.3 结果判断
1.3.1 TFF3免疫组化检测结果判断 对免疫组化结果进行半定量分析,测量染色强度和程度。每个样本选取5个视野,对每个视野中的阳性细胞进行计数。细胞染色强度:无染色计0 分,黄色计1 分,棕黄色计2 分,棕色计3 分。肿瘤细胞数<25%、25%~<50%、50%~<75%、≥75%,阳性细胞数评分分别计1 分、2 分、3 分、4 分。两者评分相乘,得分0~4 分为阴性,5~12分为阳性。
1.3.2 HER2 免疫组化检测结果判读 HER2 阳性定位于细胞膜,无反应或<10%肿瘤细胞膜染色为0;≥10%肿瘤细胞微弱或隐约可见膜染色或仅有部分细胞膜染色为1+;≥10%肿瘤细胞有弱到中等的基底侧膜、侧膜或完全性膜染色为2+;≥10%肿瘤细胞基底侧膜、侧膜或完全性膜强阳染色为3+。0、1+为阴性,3+为阳性,2+为不确定,进一步行免疫荧光原位杂交检测[5]。
1.4 统计学分析
应用SPSS 23.0 统计学软件进行数据分析,计数资料以率(%)表示,采用χ2检验;Kaplan-Meier生存曲线分析TFF3 及HER2 对预后的影响;Cox回归分析影响AEG 患者预后的危险因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 AEG 组织中TFF3、HER2 表达及与临床病理特征的关系
在140 例AEG 标本中,TFF3 阳性表达72 例(51.43%),HER2 阳性表达21 例(15.00%),见图1。AEG 中TFF3 的阳性表达与Laurén 分型及淋巴结转移有关(P<0.05),与患者性别、年龄、肿瘤最大径、T分期及TNM 分期无关(P>0.05),见表1。AEG 中HER2 的阳性表达与肿瘤Laurén 分型有关(P<0.05),肠型腺癌中阳性表达率最高(33.33%),弥漫型最低(3.23%)。HER2 表达与患者性别、年龄、肿瘤最大径、T 分期、淋巴结转移及TNM分期无关(P<0.05),见表1。
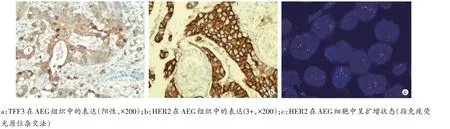
图1 TFF3、HER2在AEG组织中的表达
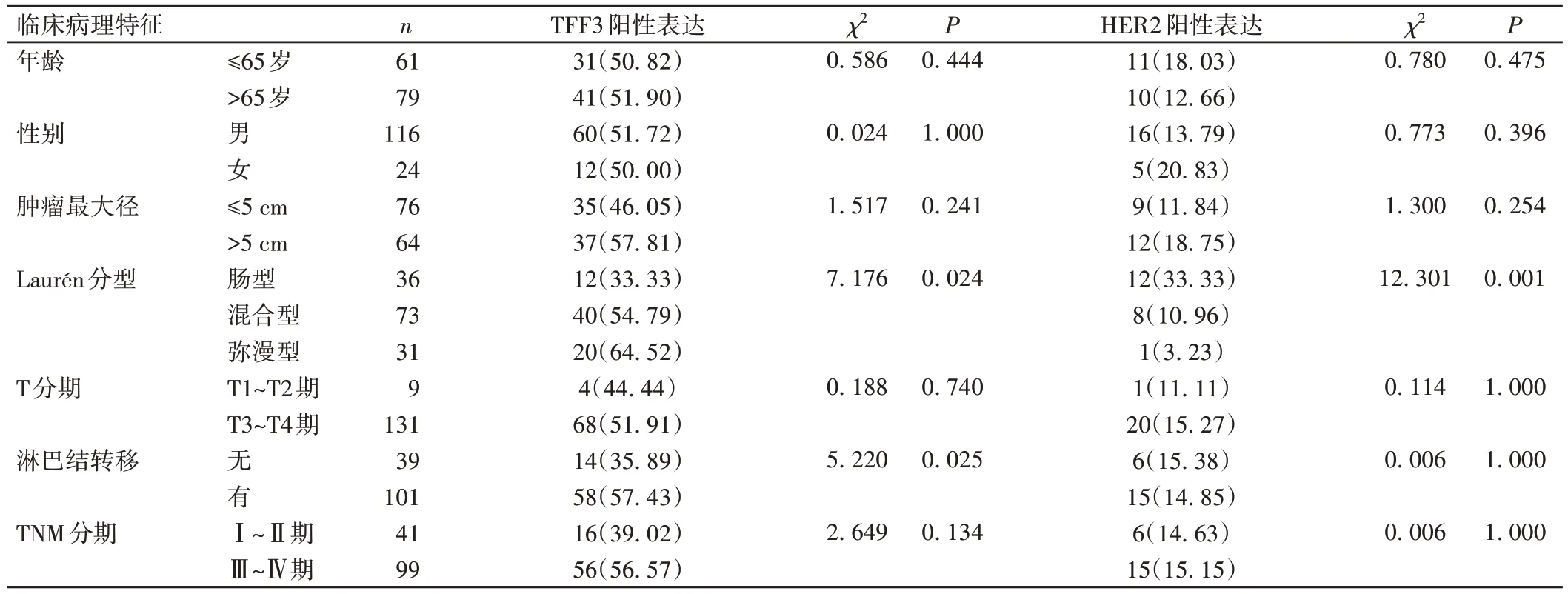
表1 AEG组织中TFF3及HER2的表达与临床病理特征的关系[例(%)]
2.2 AEG组织中HER2与TFF3表达的关系
在140 例AEG 标本组织中,72 例TFF3 阳性,21 例HER 阳性;6 例HER2 与TFF3 同时阳性,53 例同时阴性。HER2 阳性标本中TFF3 阳性率为28.57%,HER2阴性标本中TFF3 阳性率为55.46%,二者TFF3 阳性表达率比较差异有统计学意义(χ2=5.167,P=0.023),提示TFF3的表达与HER2表达相关。
2.3 AEG组织中HER2的表达与预后的关系
AEG 患者的中位总生存期为35.5 个月,5 年生存率为34.3%。HER2 阴性及阳性表达患者的5 年生存率分别为(32.8±4.3)%、(42.9±10.8)%;TFF3 阴性及阳性表达患者的5 年生存率分别为(42.6±6.0)%、(26.4±5.2)%,Kaplan-Meier生存曲线分析显示,TFF3的表达会影响患者生存率。TFF3 阳性患者与阴性患者生存率有统计学差异(P=0.012),见图2。
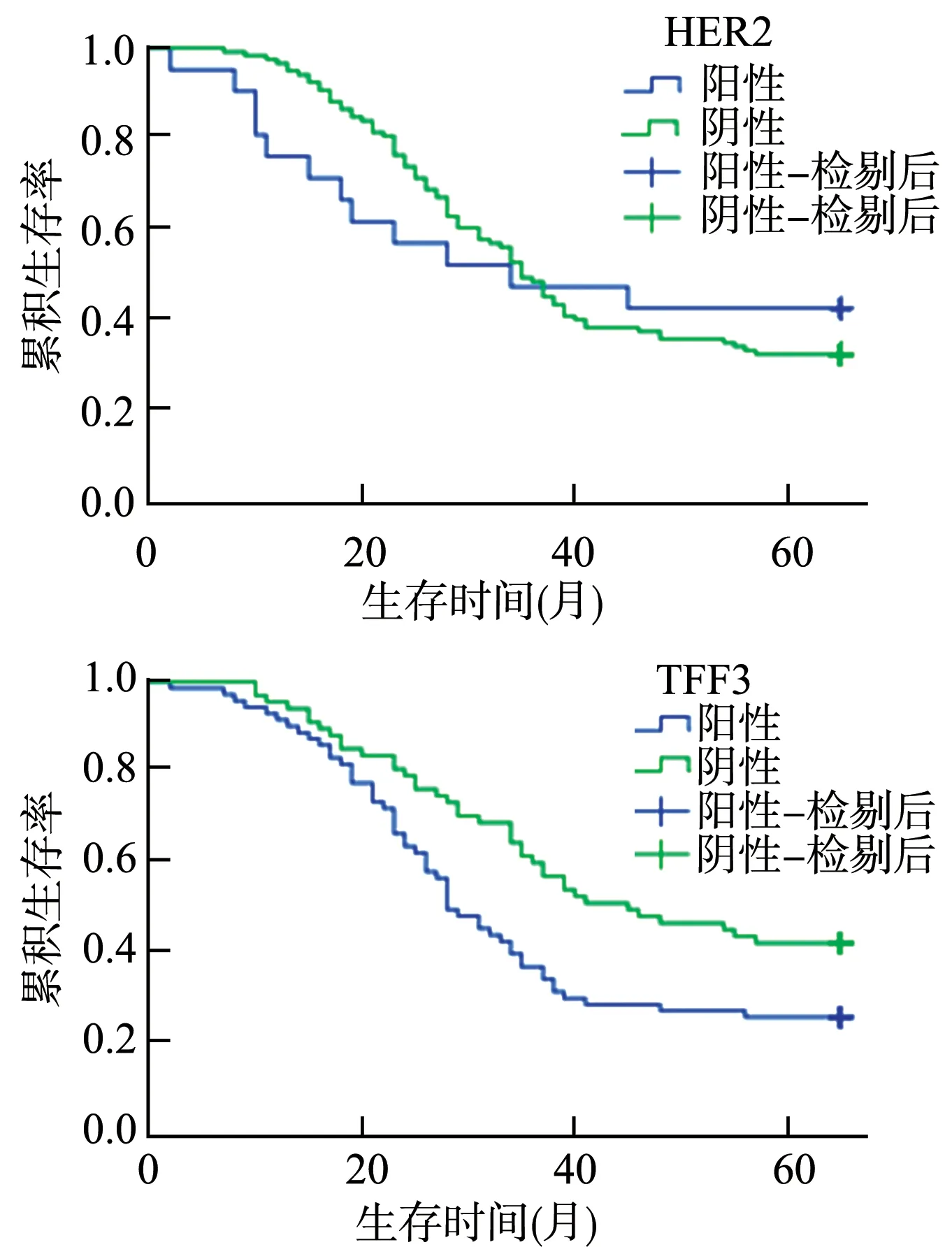
图2 HER2、TFF3表达与总生存率的关系
2.4 影响AEG患者预后的单因素及多因素分析
采用Cox回归模型对AEG患者预后进行单因素和多因素分析。单因素分析发现,入组患者的预后与肿瘤最大径、T 分期、淋巴结转移、TNM 分期及肿瘤TFF3的表达相关(P<0.05);将以上5 项具有统计学意义的指标纳入Cox多因素分析,结果显示,淋巴结转移、TNM 分期较晚及TFF3阳性表达为影响AEG 患者预后的独立危险因素(P<0.05),见表2、3。
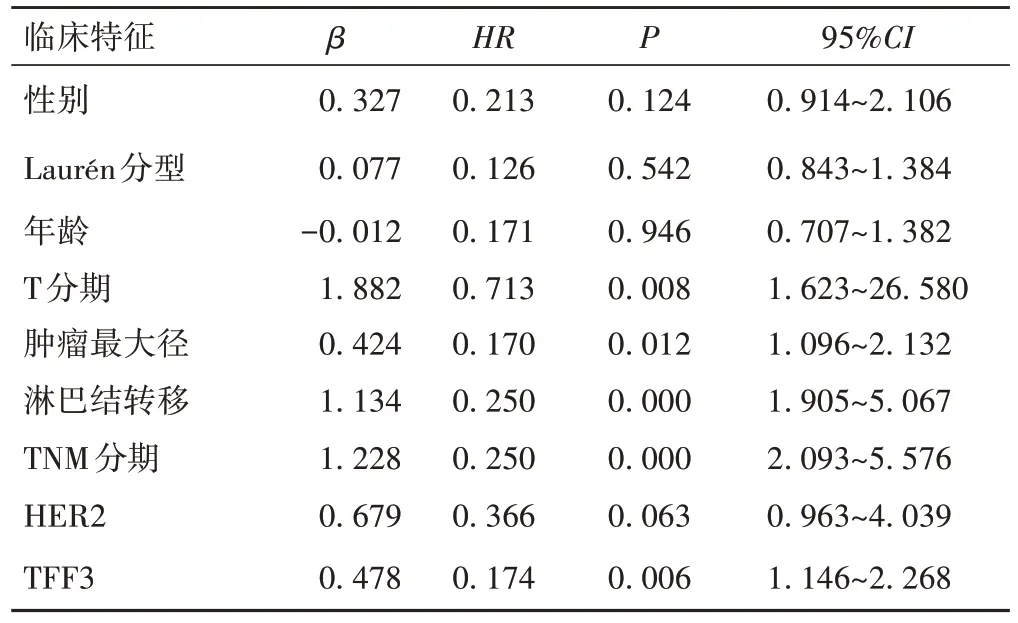
表2 影响AEG患者预后的单因素
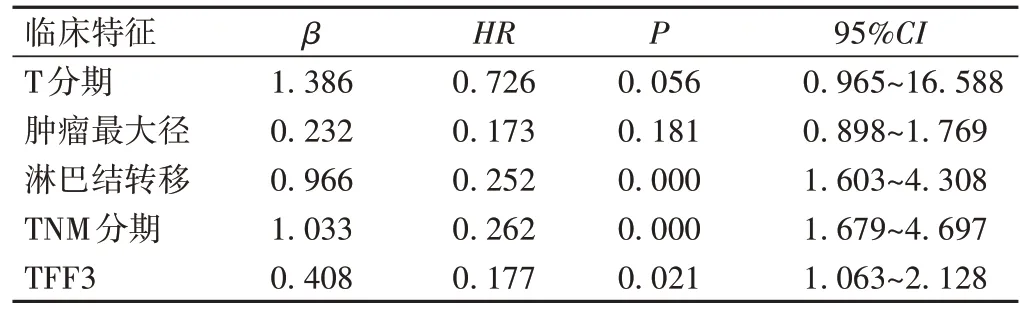
表3 影响AEG患者预后的多因素分析
3 讨论
AEG 为肿瘤中心位于食管胃交界部上下5 cm 以内的腺癌,并跨越/接触食管胃交界部,在生物学行为和预后方面,AEG 有别于真正意义上的食管癌和胃癌,是一种独特的临床病理类型[6],男性多于女性。肿瘤中心位于食管胃交界部以下2 cm(含2 cm)内的AEG 遵循食管癌分期标准;肿瘤中心位于食管胃交界部以下2 cm 以远的AEG 应遵循胃癌分期标准[7]。目前,手术切除仍是AEG 的主要治疗手段[2],随着医疗技术的提高,AEG 的近期预后有了一定提升,但远期效果仍不理想,因此亟需寻找新的治疗方案,以提升AEG的整体预后。
TFF3是三叶因子家族的成员之一,家族其他成员还有TFF1 和TFF2,均主要由黏液分泌上皮细胞表达,TFF3主要由小肠及结肠的杯状细胞分泌,在正常胃黏膜中几乎不表达[8],当消化系统黏膜受到机械性/化学性刺激、损伤(如幽门螺杆菌感染、胃食管反流等)时,消化道黏膜上皮细胞迅速分泌TFF3 以应对刺激及损伤[9]。TFF3 除了参与损伤的修复和保护机制外,在多种恶性肿瘤的发生、发展过程中也具有非常重要的作用,目前认为TFF3 通过促进肿瘤的侵袭和转移从而导致肿瘤的进展[10]。食管胃交界部在正常黏膜-癌旁组织-高分化腺癌-低分化腺癌中,TFF3的阳性表达率逐步升高[11]。Rivat 等[12]研究发现,TFF3 和VEGF 能够激活STAT3 信号通路,促进肿瘤细胞的增殖、分化及凋亡,通过RNA 干扰等方式阻断STAT3 信号途径后,能够抑制TFF3 和VEGF 诱导的肿瘤细胞侵袭以及裸鼠移植瘤的生长,提示TFF3通过STAT3信号通路促进肿瘤进展。顾建春[13]纳入92 例胃癌患者进行研究,结果显示,TFF3 阳性表达率为42.7%,TFF3 阳性多见于肿瘤浸润深、TNM 分期晚的胃癌患者,并且TFF3 阴性的胃癌患者的生存期明显长于TFF3 阳性患者,其5 年总体生存率分别为(42.6±6.0)%、(26.4±5.2)%,提示TFF3表达与胃癌患者的预后密切相关,且为胃癌患者生存期的独立预测因素[12]。本研究发现,AEG 组织TFF3 的阳性表达率为51.43%,与以往研究结果相似[12],并且TFF3 阳性表达与肿瘤Laurén 分型、淋巴结转移有关,说明在AEG 中TFF3 的表达与肿瘤的进展密切相关;Kaplan-Meier生存曲线分析显示,TFF3表达会影响AEG 患者的生存率,TFF3 阳性患者生存率低于TFF3阴性患者。
HER2 是EGFR 家族的第2 号成员,是一种跨膜酪氨酸激酶受体,由胞外区、跨膜区和胞内区三个部分组成。胞外区为配体结合区,胞内区具有内源性酪氨酸激酶活性,HER2 不能与任何已知的配体相结合,其通过与自身或EGFR 家族的其他成员形成二聚体,然后连接相应的配体,使胞内区的酪氨酸残基发生自身磷酸化,从而激活下游信号通路,包括PI3K/AKT/mTOR 和Ras/Raf/MAPK 等途径,参与细胞的增殖、凋亡、黏附、迁移和分化[14],并在乳腺癌、肺癌、胃癌、结肠癌及鼻咽癌等癌组织中高表达,与恶性肿瘤的发生发展密切相关[15]。以往研究表明,HER2 在AEG 的阳性表达率高于远端胃腺癌[16]。本研究140 例AEG 标本中,HER2 阳性表达率为15.00%,与以往研究相似[17];同时在肠型AEG 中表达率最高(33.33%),与相关研究结果一致[18],但由于HER 过表达使肿瘤更易出现浸润、化疗药物不敏感,导致预后较差[15,19]。本研究结果显示,HER2 阳性与淋巴结转移及肿瘤TNM 分期无明显相关性,这与雷瑞雪等[16]的研究结果不一致,有待进一步探讨。
本研究结果显示,HER2 多表达于Laurén 分型为肠型的AEG,而TFF3 多表达于Laurén 分型为弥漫型的AEG,且二者表达呈负相关。顾建春[13]的研究显示,同时表达HER2、TFF3 的患者预后较其他患者差,而TFF3和HER2同时阴性者预后相对较好,TFF3阳性为影响预后的危险因素。针对HER2 阳性的AEG,目前可以采用曲妥珠单抗、拉帕替尼等抗HER2 药物靶向治疗[19]。本研究中,51.43%的AEG 患者存在TFF3 过表达,HER2 阴性患者的TFF3 阳性表达率高于HER2阳性患者,对于HER2 阴性,无法应用抗HER2 药物靶向治疗的患者,TFF3 是否能成为AEG 治疗的靶点,还需进一步研究。
综上,TFF3 的阳性表达与AEG 患者的Laurén 分型和淋巴结转移情况有关,TFF3阳性患者的生存率低于阴性患者;HER2 的阳性表达与患者的Laurén 分型有关,与患者的生存率无关;TFF3 与HER2 表达呈负相关。检测TFF3 及HER2 有助于判断患者的预后,并有望在治疗方面提供帮助。
