豇豆枯萎病生防细菌的筛选鉴定及抗病机理初探
2023-07-20谢海鹏林樱桃吴小燕林俊旭林明智麦贤俊陈子跃谢文孔祥义
谢海鹏 林樱桃 吴小燕 林俊旭 林明智 麦贤俊 陈子跃 谢文 孔祥义
关键词:尖孢镰刀菌嗜导管专化型;贝莱斯芽孢杆菌;拮抗机制;促生能力
中图分类号:S436.43 文献标识码:A
豇豆[Vigna unguiculata (L.) Walp.]是一年生豆科作物,主要分布在世界干旱、半干旱的热带地区。豇豆起源和驯化于非洲,现已在全世界100多个国家种植[1]。世界上主要的豇豆生产区是撒哈拉以南的非洲,其中,非洲的尼日利亚、尼日尔和布基纳法索的豇豆产量排名世界前三,中国豇豆产量位列世界第16 位[2]。在我国,除高寒地区外各地均有栽培[3]。尤其在海南三亚地区,豇豆种植面积已达5340 hm2,出岛产量达15 万t,已经成为海南冬季瓜菜南种北运的主要蔬菜之一[4]。
豇豆枯萎病是由尖孢镰刀菌嗜导管专化型(Fusarium oxysporum f.sp. tracheiphilum)引起的维管束病害,它通过伤口或直接穿透根部,然后在木质部定植。被侵染的豇豆植株表现为基部茎肿胀、叶片褪绿、变黄、落叶、枯萎、维管变色和死亡。几乎在所有豇豆种植区均有豇豆枯萎病的发生。在澳大利亚西北部、巴西东北部、非洲的尼日利亚、美国东南部和加利福尼亚州的中央谷地均报道过豇豆枯萎病的发生[5]。我国主要在广东、福建、广西、海南、江西等地为害较多,目前已遍布所有豇豆产区, 产量损失可高达70%[6]。近年来,由于海南三亚市豇豆多年连作,土壤条件恶化,三亚市豇豆枯萎病大面积流行,发生严重地块可减产70%~80%,严重影响豇豆生产[7]。
目前豇豆枯萎病的防治手段有选育抗病品种、轮作、土壤消毒、控制线虫、化学防治和生物防治等[8]。国内使用最多的防治手段是化学防治,但是由于豇豆长期使用化学农药,近年来国内豇豆农药残留超标等问题频繁发生[9-10]。利用微生物防治土传病害是近年来的热点。微生物不仅可以生活在土壤中与病原菌形成长期对抗,降低病害发生,而且能减少农药的使用量,预防农药残留的风险发生[11]。目前,用于防治植物病害的微生物主要有真菌、细菌和病毒等,而细菌因其数量和种类众多,广泛分布于植物根际和地面上部,具有对植物生长环境适应性强、繁殖速度快和易培养等特点成为最主要的生防资源之一[12]。现已成功应用于植物病害防治的生防细菌主要有芽孢杆菌属( Baccillus )、假单胞菌属(Pseudomonas)、土壤杆菌属(Agrobacterium)、沙雷氏菌属(Serratia)、巴氏杆菌属(Pasteuria)以及肠杆菌属(Enterobacteri)等[13]。
近年来,越来越多的学者开展了筛选拮抗细菌防治植物枯萎病的研究并取得成果。李娜等[14]从黄瓜枯萎病根际土筛选生防细菌,获得1 株对黄瓜枯萎病菌有较强抑制作用的假单胞属菌株33-1。周东兴等[15]利用梯度稀释涂板法和平板对峙生长法从蚯蚓粪中筛选到1 株对番茄枯萎病有良好生防作用的细菌,并通过盆栽试验测定该菌株对番茄枯萎病的防治效果达59.25%。此外,郑丽等[16]从8 个不同生境木薯中分离到298 株细菌,通过测定其产酶、次生代谢物和拮抗活性优选11 个菌株进行日光温室大棚盆栽防效测定,其中,HWY-3-1 对木薯枯萎病防效为100%,其余10 株防效均在60%以上。而国内外有关豇豆枯萎病生防资源的报道较少,从豇豆-水稻轮作土壤中筛选生防细菌是挖掘豇豆枯萎病生防资源的主要途径之一。
本研究通过分离纯化豇豆-水稻轮作土壤细菌,采用对峙法评价其生防潜力,对其中拮抗效果最好的菌株SD13 通过形态学及分子手段进行鉴定,初步探究该生防菌的抑菌以及促生机制,最后通过盆栽实验评估不同浓度的生防菌SD13对豇豆枯萎病的防治效果。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试豇豆枯萎病病原菌由海南省三亚市热带农业科学研究院提供。供试豇豆种子南豇1 号。土壤样品采自海南省三亚市崖州区的热水宫路常年发病地块,采集豇豆-水稻轮作土壤15 份。盆栽自然土采自海南省三亚市热带农业科学研究院崖州基地种子资源圃。
1.1.2 供试培养基 蛋白质检测培养基[17]:脱脂奶粉3.0 g、琼脂4 g、去离子水200 mL、pH 为7.0~7.2,108 ℃高压蒸气灭菌15 min。
几丁质酶检测培养基[18]:胶体状几丁质1%(w/V)、磷酸二氢铵1 g、氯化钾0.2 g、硫酸镁0.2 g、琼脂20 g,无菌水定容至1000 mL,pH 为7。制备胶状几丁质:20 g 甲壳素溶于350 mL 浓盐酸,4 ℃放置24 h,玻璃棉过滤,滤液加入2 L冰无水乙醇–20 ℃ 过夜后, 10 000 r/min 离心20 min,沉淀用流动自来水不断冲洗,直至pH 呈中性,–20 ℃密封保存。
β-1,3-葡聚糖酶检测培养基[19]:β-1,3-葡聚糖2 g、硝酸钠2 g、磷酸氢二钾1 g、氯化钾0.5 g、硫酸镁0.5 g、硫酸亚铁0.01 g、刚果红0.05 g、琼脂20 g,无菌水定容至1000 mL,pH 为7.2。
纤维素酶检测培养基[18]:羧甲基纤维素钠10 g、蛋白胨10 g、酵母粉10 g、氯化钠5 g、磷酸二氢钾1 g、琼脂20 g,无菌水定容至1000 mL,pH 为7.0。
无氮培养基[20]:蔗糖10 g、氯化钠0.12 g、硫酸氢二钾0.5 g、碳酸钙1 g、硫酸镁0.2 g、琼脂20 g,无菌水定容至1000 mL,pH 为7.2。
钾长石培养基[21]:硫酸铵1.0 g、七水硫酸镁0.5 g、氯化钠0.1 g,硫酸氢二钠2.0 g,蔗糖10 g,酵母粉0.5 g,钾长石粉10.0 g,无菌水定容至1000 mL,pH 為7.2。
无机磷培养基[21]:硫酸铵0.5 g、七水硫酸镁0.5 g、氯化钠0.2 g、磷酸钙10.0 g、碳酸钙0.5 g、葡萄糖2.0 g、硫酸锰0.02 g、硫酸亚铁0.02 g、琼脂20 g,无菌水定容至1000 mL,pH 为7.2。
有机磷培养基[21]:硫酸铵0.5 g、碳酸钙0. 5g、七水硫酸镁0.5 g、氯化钠0.2 g、卵磷脂0.2 g、葡萄糖2.0 g、硫酸锰0.02 g、硫酸亚铁0.02 g、琼脂20 g,无菌水定容至1000 mL,pH 为7.2。
嗜铁素检测培养基:北京酷来博科技有限公司改良的CAS 琼脂检测培养基。
1.2 方法
1.2.1 土壤细菌分离 采集未患枯萎病的豇豆-水稻轮作土壤,采用稀释涂板法[22]分离土壤细菌。从15 份土壤中各称取10 g 土壤样品,10 g土壤样品与90 mL 无菌水混合,振荡30 min,静止15 min,将上清液依次稀释为10–3、10–4、10–5和10–6,然后各取100 μL 上清液涂布于LB 培养基平板上,于28 ℃恒温培养1~2 d,挑取不同形态的细菌菌落划线纯化,于–20 ℃冰箱保存。
1.2.2 拮抗菌的初筛与复筛 以豇豆枯萎病病原菌作为对照菌株,采用平板对峙法[23]对
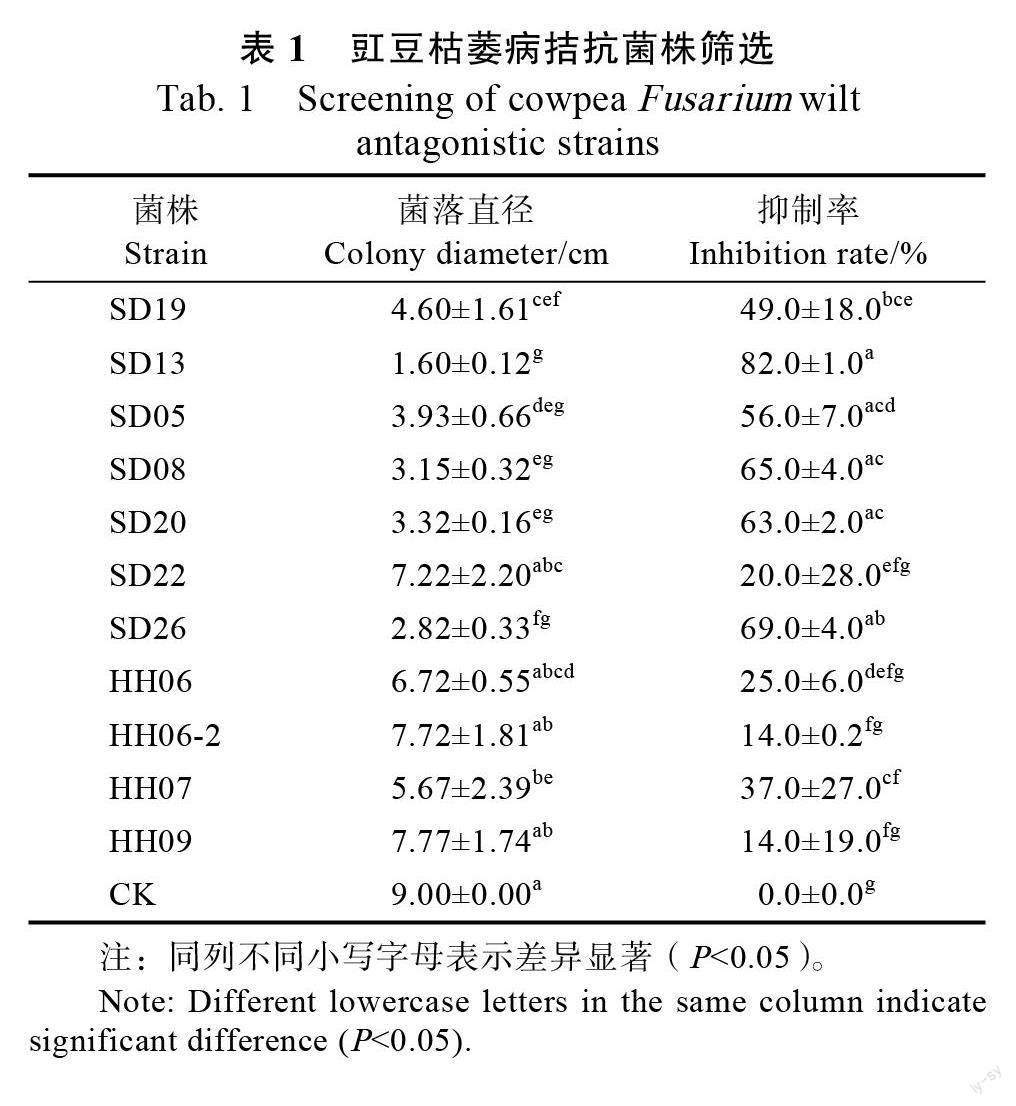
1.2.1 中保存的菌株进行初筛,在PDA 固体培养基平板中央接种0.5 cm 豇豆枯萎病菌菌饼,每个培养基平板用十字对称选取4 个距离中央2.5 cm 的点,在4 个点用牙签点接分离纯化保存的同一菌株,对具有拮抗效果的菌株用同样的方法进行复筛并保存。采用十字交叉法测量菌落直径。抑制率=(对照组菌落直径-处理组菌落直径)/对照组菌落直径×100%。
1.2.3 生防菌SD13 的鉴定 (1)菌体形态观察。将拮抗菌株SD13 在LB 培养基上划线培养,于30 ℃恒温培养24 h 后观察菌落形态,革兰染色后显微镜观察菌体形态特征。
(2)分子鉴定。通过北京诺博莱德科技有限公司细菌DNA 提取试剂盒提取拮抗菌株SD13 的DNA, 采用16S rDNA 细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对拮抗菌株SD13 进行PCR 扩增。50 μL 反应体系:DNA 模板1 μL、引物1492R 和27F 各1 μL、Taq 酶25 μL、ddH2O 22 μL。反应条件:94 ℃预变性5 min,94 ℃变性30 min,54 ℃退火30 s,72 ℃延伸1 min,35 个循环,最后72 ℃总延伸10 min。PCR 扩增产物采用1%琼脂糖凝胶电泳检测后送至生工生物工程(上海)股份有限公司测序,将测序结果通过Ezbicloud 数据库进行同源序列比对分析,选取同源性较高的菌株通过MEGA 6.06 软件使用邻接法构建系统发育树。
1.2.4 制备109CFU/mL SD13 菌悬液 将LB 平板中的SD13 单菌落接种至LB 液体培养基中,29 ℃、180 r/min 条件下培养24 h 得到菌悬液,以1%接种量接种至LB 培养基中,于29 ℃、180 r/min 条件下发酵24 h 后,将菌悬液稀释成OD600=2.3,得到109CFU/mL SD13 菌悬液(菌悬液的OD600 为2.3 稀释涂板法后,计算其菌落个数为1×109~2.5×109CFU/mL,3 次重复)。本研究中制备109CFU/mL SD13 菌悬液均用此方法。
1.2.5 拮抗菌株SD13 对豇豆枯萎病病原菌菌丝与孢子的抑制效果 参考林福呈等[24]的液体共培养测定方法,稍加改进,将病原菌接种于PDA液体培养基中,于28 ℃、200 r/min 条件下培养7 d,再用无菌水稀释培养物,使培养物的孢子数量为108 CFU/mL,培养物中的菌丝无需过滤。然后取10 mL 培养物接种到100 mL PDA 液体培养基中,使孢子总数为109CFU/mL,再接1 mL 109CFU/mL SD13 菌悬液,使SD13 菌量与病原菌孢子数量一致,置于28 ℃恒温箱培养,3 次重复。以10 mL 病原菌培养物+1 mL LB 作为对照。间隔12 h 观察一次拮抗菌对孢子和菌丝抑制作用,并拍照记录。
1.2.6 生防菌SD13 菌体和发酵滤液对豇豆枯萎病病原菌孢子的抑制能力 制备病原菌孢子悬浮液:将病原菌接种于PDA液体培养基中,在28 ℃,200 r/min 条件下培养7 d,并用8 层无菌纱布过滤菌丝。用血球计数板计算孢子数量,并将孢子数量用无菌水稀释至5×107CFU/mL。
制备SD13 菌体悬浮液:将制备的109CFU/mLSD13 菌悬液(含发酵液)以10 000 r/min 离心15 min,将菌体与发酵液分开,再用等体积的无菌水重悬浮菌体,获得浓度为109CFU/mL 的菌体悬浮液,备用。
制备发酵滤液:将离心得到的发酵液通过0.22 μm 无菌微孔滤膜过滤2 次,备用。
摇匀菌体悬浮液与病原菌孢子悬浮液,使菌体与孢子在液体中分布均匀,取1 mL 109CFU/mL菌体悬浮液和1 mL 5×107CFU/mL 病原菌孢子悬浮液于5 mL 无菌试管中,以1 mL 无菌水加等量的病原菌孢子悬浮液作为对照。再取1 mL 无菌发酵液和1 mL 5×107CFU/mL 病原菌孢子懸浮液于另一个5 mL 无菌离心管中,以1 mL LB 液体培养基加等量病原菌孢子悬浮液作为对照。重复3 次,28 ℃恒温箱培养。分别于0、12、24、48 h用血球计数板观察处理组与对照组的完整孢子数量。
1.2.7 生防菌SD13 抑菌胞外酶活性测定 蛋白酶、几丁质酶、β-1,3-葡聚糖酶活性测定[17-19]:菌株在LB 固体培养基划线培养24 h,再用灭菌接种针挑取单菌落分别点接于蛋白酶、几丁质酶、β-1,3-葡聚糖酶检测培养基平板上,28 ℃恒温培养3~7 d,观察周围有无透明圈产生并测量菌落直径(d)和透明圈直径(D)。根据培养基上是否产生透明圈判断有无酶活性,酶活性大小与HC值(D/d)呈正相关。
纤维素酶活性测定[18]:菌株在LB 固体培养基划线培养24 h,再用灭菌接种针挑取菌落点接于纤维素酶活性检测培养基平板上,28 ℃恒温培养3 d,用1 mg/mL 剛果红溶液将整个培养皿完全浸没染色,染液停留30 min,倒掉染液,用1 mol/L NaCl 溶液洗涤。观察测量方法同上。
1.2.8 生防菌SD13的促生能力相关功能检测固氮能力测定:参考王明欢等[20]的方法,根据菌株是否能在无氮培养基上生长判断有无固氮能力。
溶磷、解钾能力的测定[21]:菌株在LB 平板培养基上活化24 h,再用灭菌接种针挑取菌落分别点接于有机磷培养基、无机磷培养基和钾长石培养基上,28 ℃恒温培养3~7 d,观察测量方法同1.2.7。
产嗜铁体能力测定:菌株在LB 固体培养基划线培养24 h,再用灭菌接种针将单菌落点接于嗜铁素检测培养基平板上,观察7~14 d。铬天青(CAS)和溴化十六烷基三甲铵(HDTMA)与铁离子混合后可以形成一种复合物,呈亮蓝色。当铁离子被试验菌株分泌嗜铁素夺走时,菌株周围形成橘黄色的透明圈。因此,可根据平板上菌落周围是否形成橘黄色的透明圈和根据透明圈大小判断产嗜铁素的强弱。
IAA 定性测定:参考万兵兵等[25]的方法,产IAA 能力可根据白瓷板上溶液颜色是否变红,如果颜色变色就表示菌株能够产生IAA。
1.2.9 生防菌SD13 广谱抑菌能力测定 测定拮抗菌株SD13 对6 种生产上重要病害病原菌[青瓜枯萎病菌(Fusarium oxysporum)、辣椒枯萎病菌(F. oxysporum)、甜瓜枯萎病菌(F. oxysporum)、苦瓜枯萎病菌( F. solani )、豇豆叶斑病菌( Alternaria alternata )、烟草疫霉病菌(Phytophthora nicotianae)]的抑制率。
拮抗菌株SD13 的菌饼制备:在LB 固体培养基平板中加入200 μL 109 CFU/mL SD13 菌悬液,均匀涂布,于30 ℃恒温培养24 h,制成菌株平板,用打孔器取0.5 cm 的拮抗菌株菌饼,备用。
采用平板对峙法在PDA 固体培养基平板中央接种0.5 cm 病原菌菌饼,用十字对称选取4 个距离中央2.5 cm 的点,放置0.5 cm 的SD13 菌饼,以只接病原菌菌饼作为对照,于28 ℃恒温培养7 d 后采用十字交叉法测量菌落直径,计算抑制率,公式同1.2.2。
1.2.10 SD13 盆栽防效及促生实验 豇豆种子处理:将豇豆种子用3%次氯酸钠消毒10 min,然后用蒸馏水反复清洗3~5 遍,晾干后置于含有椰糠育苗盘中,在温室大棚培育2 周后,原叶完全展开,取长势优良且一致的幼苗用于实验。土壤处理:自然土经晒干,过筛与营养土2∶1 质量比混合,备用。
生防菌SD13 无发酵液菌体悬浮液制备:将制备的109CFU/mL SD13 菌悬液8000 r/min 离心,收集菌体,再用200 mL 无菌水重悬菌体,获得浓度为109CFU/mL 的无发酵液菌体悬浮液,用无菌水配置浓度为108、106、104CFU/mL 无发酵液菌体悬浮液,备用。
豇豆枯萎病病原菌孢子悬浮液制备:将在PDA平板上生长3 d 的菌落接种至200 mL 的PDA液体培养基中,在28 ℃、180 r/min 条件下培养5 d后用无菌8 层纱布过滤,获得孢子悬浮液,再用无菌水稀释至106 CFU/mL,备用。
盆栽防效实验中生防菌共设置4 个浓度:109、108、106、104CFU/mL。取1 kg 土装至盆铂中,10 个处理:(1)病原菌处理+生防菌104CFU/mL(F+104S)、(2)病原菌处理+生防菌106CFU/mL(F+106S)、(3)病原菌处理+生防菌108CFU/mL(F+108S)、(4)病原菌处理+生防菌109 CFU/mL(F+109S)、(5)病原菌对照(F)、(6)生防菌104CFU/mL(104S)、(7)生防菌106CFU/mL(106S)、(8)生防菌108CFU/mL(108S)、(9)生防菌109CFU/mL(109S)、(10)清水对照(CK)。
其中,病原菌处理:取100 mL 豇豆枯萎病病原菌孢子悬浮液与200 mL 无菌水混合后拌土,充分搅拌混匀,土壤含菌量为105 CFU/g。其他处理则用等体积的清水混拌。将豇豆植株的根尖处切除0.3 cm 进行伤根移植。移植后,每周对F 和CK 处理用55 mL 清水处理,其他处理取5 mL 生防菌与50 mL 清水混合灌根。每个处理3 个重复,每个重复2 株苗,3 个平行实验,观察并记录发病情况,计算发病率、病情指数、防治效果。豇豆苗期的病情分级标准参照文献[1],豇豆苗后期到抽蔓期的病情分级标准参照文献[5]。测量其株高、根长、地上鲜重、地下鲜重、地上干重、地下鲜重,评价其促生作用。发病率=发病株数/总株数×100%;病情指数=Σ(各级病株数×该病级值)/(总株数×最高级值)×100;防治效果=(CK 病情指数-处理病情指数)/CK 病情指数×100%。
2 结果与分析
2.1 土壤细菌的分离纯化
从海南省三亚市崖州区常年发病严重的5 块地块采集土壤样本15 份,从中分离到93 株菌,其中63 株细菌,30 株放线菌。
2.2 拮抗菌的初筛与复筛
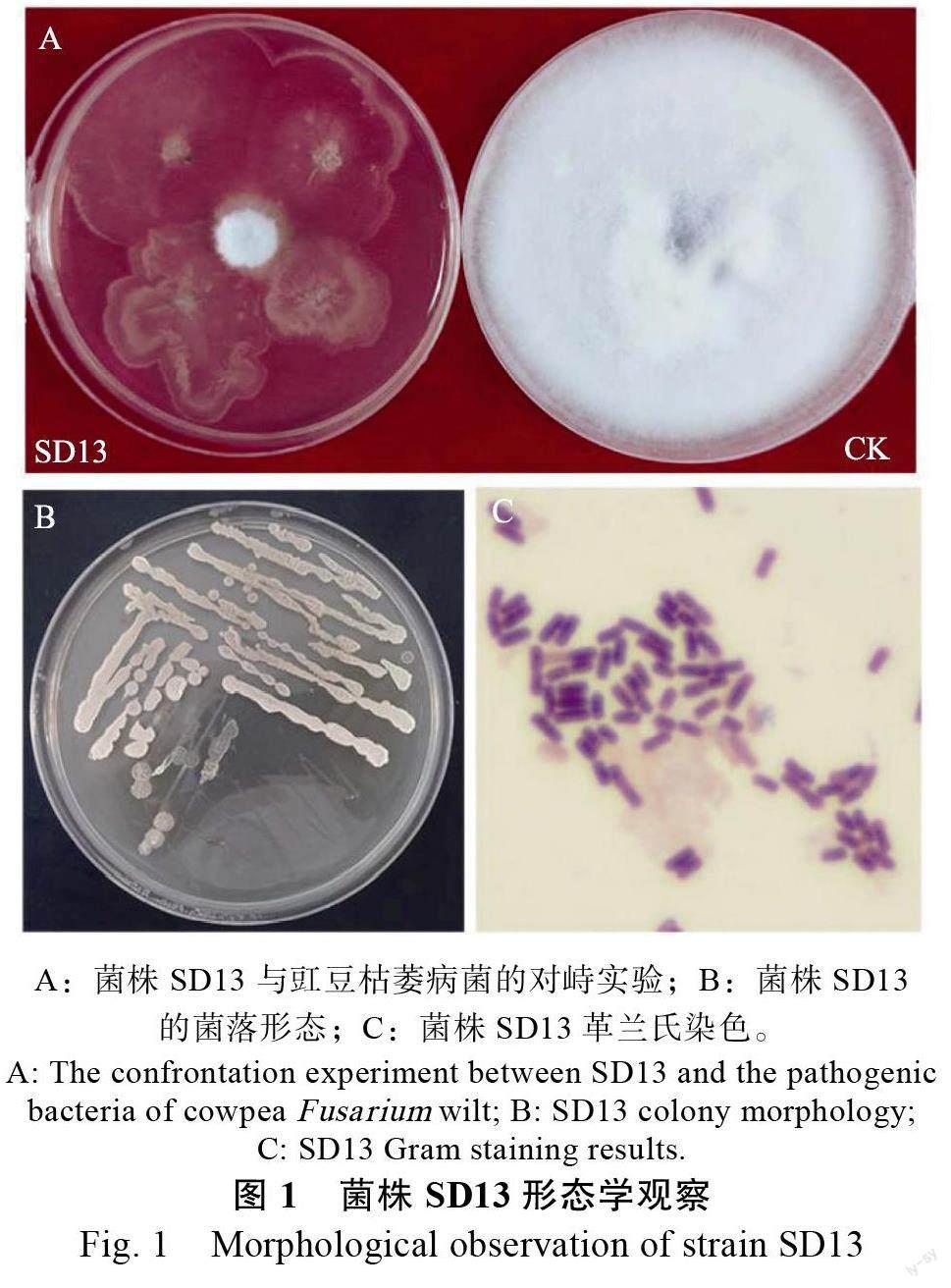
用平板对峙法对分离纯化的菌株进行初筛和复筛,筛选得到11 株对豇豆枯萎病有较好抑制作用的菌株(表1),其中菌株SD13 抑制率为82.0%,抑制效果最好(图1A)。
2.3 生防菌SD13的鉴定
2.3.1 形态学鉴定 拮抗菌SD13 在LB培养基培养24 h 后,呈浅乳白色、近圆形、表面粗糙边缘不规则(图1A~图1B)。经革兰氏染色,将SD13鉴定为革兰氏阳性菌(图1C)。
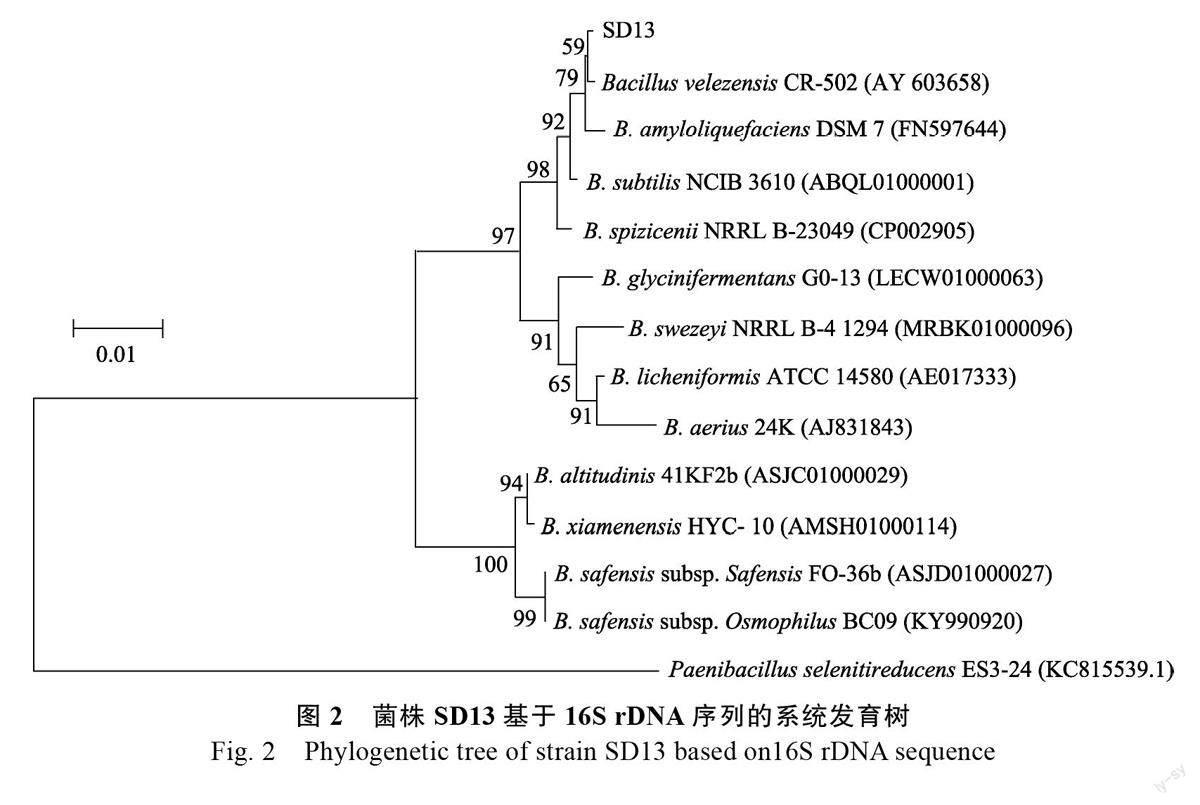
2.3.2 分子鉴定 测序结果显示,拮抗菌株SD13的16S rDNA 序列长度为1452 bp,在Ezbicloud数据库同源序列对比结果中,菌株SD13 的16SrDNA 序列与贝莱斯芽孢杆菌(Bacillus velezensis)CR-502(登录号:AY603658)相似性为99.5%(图2),从Ezbicloud 数据库中挑选12 株具有代表性的序列相似菌株以及1 株外源菌株Paenibacillusselenitireducens ES3-24(登录号:KC815539.1)与SD13 构建系统发育树,发现菌株SD13 与B.velezensis CR-502 单独聚为一支。结合形态学,将菌株SD13 鉴定B. velezensis。
2.4 生防菌SD13 对豇豆枯萎病病原菌菌丝和孢子的抑制效果
液体共培养实验结果表明,菌株SD13 对尖孢镰刀菌菌丝、孢子均有很强的溶菌作用。图3为病原菌菌丝的溶解过程。图3A 为只添加病原菌的对照处理,病原菌菌丝正常,24 h 后观察到添加SD13 的处理部分病原菌菌丝发生膨大、畸形、基质外泄(图3B),120 h 菌丝全部被溶解,仅剩少量无内容物菌丝(图3C)。图4 为孢子的溶解状态。
2.5 生防菌SD13 菌体与发酵滤液对豇豆枯萎病病原菌孢子的抑制能力
研究结果表明,在菌体处理0~12 h,豇豆枯萎病病原菌孢子数量下降64.5%,48 h 时比0 h下降86.6%。发酵滤液处理0~12 h,豇豆枯萎病病原菌孢子数量下降34.4%,48 h 相对0 h 下降27.2%(表2)。说明生防菌SD13 菌体与发酵滤液均能溶解豇豆枯萎病病原菌孢子,但SD13 菌体的溶解能力比SD13 发酵滤液更强。
2.6 生防菌SD13的抑菌胞外酶活性检测
检测结果表明(图5),生防菌SD13 具有产蛋白酶、纤维素酶、β-1,3-葡聚糖酶的能力,β-1,3-葡聚糖酶的HC 值是蛋白酶、纤维素酶的4~6 倍(表3),说明SD13 分泌β-1,3-葡聚糖酶活性更高。
2.7 SD13促生因子检测
检测结果显示(图5,表3),SD13 在嗜铁素与解无机磷检测培养基上产生透明圈,可以在无氮培养基上生长,说明SD13 具有产嗜铁素、解无机磷、固氮能力。
2.8 生防菌SD13的广谱抑菌活性测定
平板对峙实验结果表明,菌株SD13 对6 种病原菌的抑制率在66.7~82.3%之间(表4,图6)。说明菌株SD13 具有广谱抑菌活性,且抑菌能力较强。
2.9 不同浓度生防菌SD13的促生及防治效果
盆栽实验结果表明(表5,图7),SD13 的各浓度处理对豇豆植株均具有较强的促生能力,能加快植株生长,表现为植株增高,叶片增大(图7A)。由表5 可知,108S 处理的促生能力最好,与其他处理具有较强显著差异。109S 处理的促生效果较差,处理植株在幼苗期间生长缓慢,植株矮小,茎根细小,植株进入抽蔓期后恢复促生生长,35 d 后植株各生长指标相对CK 较高。
在实验观察期间,F 处理的病情指数随时间逐渐升高,施用生防菌4 个处理的病情指数增长缓慢,并且在28~35 d 停止增长(图7B),说明多次施用生防菌SD13 可以持续有效控制豇豆枯萎病病情的发展。14 d 后,F 处理的豇豆植株开始发病,原生叶片开始变黄、掉落,基茎肿胀,植株发育不良,发病率为80%。F+104S、F+106S、F+108S 与F+109S 处理的豇豆植株发病率分别为40%、30%、80%、80%。35 d 后,F 处理的发病率达到100%,施用生防菌的4 個处理发病率均无增长。如图7C 所示,F+106S 防治效果为62.0%,具有显著差异,是最佳防治浓度。
综合防治效果与促生能力认为,生防菌SD13的最佳施用浓度为106 CFU/mL,其防治效果最好,而促生效果仅次于108 CFU/mL。
3 讨论
国内豇豆枯萎病的防治主要依赖化学防治,微生物防治的相关报道较少,尤其是生防细菌,国内外报道甚少。本研究通过从土壤中筛选11 株拮抗细菌,对抑制率最强的拮抗菌株SD13 进行形态学鉴定与分子鉴定,该菌株鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。贝莱斯芽孢杆菌SD13 对豇豆枯萎病菌尖孢镰刀菌的菌丝、孢子具有很强的溶解作用,同时可以产纤维素酶、蛋白酶、β-1,3-葡聚糖酶3 种抑菌胞外酶,并具有产嗜铁素、固氮、解无机磷3 种促生功能,抑菌广谱。经盆栽实验证明贝莱斯芽孢杆菌SD13 对豇豆枯萎病具有良好的防治效果,并对豇豆植株具有较强的促生能力。贝莱斯芽孢杆菌SD13 是一株有潜力的生防细菌,有望成为防治豇豆枯萎病的重要生防资源。
贝莱斯芽孢杆菌(B. velezensis)属于芽孢杆菌属(Bacillus)的一个新种,因具有广谱抑菌活性和促进植物生长等特点而被广泛研究[26-27]。已有研究表明,贝莱斯芽孢杆菌对小青菜、香蕉、番茄等有促生长作用,能抑制植物病原稻瘟病菌、黄瓜枯萎病菌、辣椒疫霉菌、橡胶炭疽菌、香蕉枯萎病菌等病菌的生长[28-31]。
糖蛋白和葡聚糖是尖孢镰刀菌细胞壁的主要成分,也是大部分真菌细胞壁的主要成分[32]。据报道,贝莱斯芽孢杆菌可以通过分泌的蛋白酶、几丁质酶、葡聚糖酶等胞外水解酶抑制病原菌[33],贝莱斯芽孢杆菌HYEB5-6 通过分泌蛋白酶和葡聚糖酶破坏炭疽菌菌丝细胞壁,抑制分生孢子的萌发、胚芽管的生长和附着胞的形成[34],尤其是β-1,3-葡聚糖酶,广泛存在于高等植物中,可以降解真菌细胞壁,对植物防御致病真菌起到重要作用[35]。本研究中SD13 对尖孢镰刀菌的菌丝、孢子溶解主要是由蛋白酶、β-1,3-葡聚糖酶破坏其细胞壁导致的。
氮、磷、钾是植物生长的必需元素,能够促进植物健康发育,提高作物产量。作物缺氮、磷会导致作物生长缓慢。研究表明,接种固氮菌株巨芽孢杆菌(B. megaterium)N3 能够促进二月兰生长,同时土壤的理化性质与生物学性质均得到显著改善[36]。解磷細菌贝莱斯芽孢杆菌(B. velezensis)CBMB205 的19 个磷酸酶基因均参与使土壤中难以利用的磷转化为植物易吸收的磷[37]。在本研究中,SD13 能够解无机磷、固氮,对豇豆具有较强的促生能力。此外,SD13 具有较强的产嗜铁素能力,嗜铁素(siderophore)也叫高铁载体,能特异地螯合含铁离子的化合物使SD13 在低铁环境中与病原菌竞争铁元素,抑制病原菌的发展,也能将难溶的铁转化为易溶的铁供植物吸收,促进植物生长[38-41]。
经盆栽实验表明,不同浓度SD13 均具有防治豇豆枯萎病和促进豇豆植株生长的作用,并不是浓度越高效果越好,106CFU/mL 为最佳防治浓度,而108CFU/mL 是最佳促生浓度,浓度为109 CFU/mL 时,豇豆幼苗生长受到抑制,但这种抑制是短暂的,豇豆植株会在抽蔓期恢复促生生长。研究显示,多次施用生防菌SD13 可以持续有效控制豇豆枯萎病病情发展,因此,在施用SD13 防治枯萎病时建议少量多次。研究发现SD13 具有溶菌作用,在防治病害时,溶菌作用与促生共同起作用,在接种SD13 后,SD13 产生的蛋白酶、蛋白酶溶解致病菌细胞壁,减少病原菌数量。同时,SD13 具有促生作用,提高植株的品质,加强抗病能力,在二者作用下,从而控制病害的发展,达到防治效果。
