胆盐诱导急性胰腺炎大鼠模型中TNF-α、IL-6、相关AMS 水平变化的研究
2023-07-19刘亚男王哲常鸿杰胡立华
刘亚男,王哲,常鸿杰,胡立华
黑龙江省医院香坊消化内二科,黑龙江哈尔滨 150036
急性重症胰腺炎是伴有全身及局部并发症的机械胰腺炎,属于急性胰腺炎的特殊类型,是一种病情险恶、并发症多、病死率较高的急腹症,占整个急性胰腺炎的10%~20%[1]。随着近年来对重症急性胰腺炎的病理机制认知的逐渐加深,研究指出,重症急性胰腺炎患者机体内出现炎性因子风暴,其胰腺外组织器官和胰腺细胞内的活动与免疫功能密切相关,炎性因子指标变化可引发重症急性胰腺炎炎性介质变化、胰腺微循环改变,进而促使病情加重,其主要的炎性介质损伤因子包括肿瘤坏死因子-α、白介素6[2]。本研究纳入黑龙江省医院实验中心2021 年1 月—2022 年7 月的成年大鼠(Wistar)50 只,分析胆盐诱导急性胰腺炎大鼠模型中相关AMS、IL-6、TNF-α 指标变化,现报道如下。
1 资料与方法
1.1 一般资料
纳入本实验中心成年大鼠(Wistar)50 只,其中雌性24 只,雄性26 只;体质量239~280 g,平均(265.7±6.2)g,根据随机双盲法分组,分为胆盐诱导急性胰腺炎组(n=26)、假手术组(n=24)。胆盐诱导急性胰腺炎组雌性12 只,雄性14 只;体质量239~280 g,平均(264.3±6.0)g。假手术组雌性12 只,雄性12 只;体质量239~280 g,平均(265.6±6.3)g。本研究经本院医学伦理委员会审批通过(伦理审批号:S2022-066-02)。
1.2 材料
美国Sigma 公司生产的牛黄胆酸钠,美国Genzyine 公司生产的抗人单克隆抗体,TNF-α、IL-6 试剂盒,检测TNF-α、IL-6最小值分别为40、12 ng/L;上海沪东仪器厂生产的微量输液泵,天津南开大学电子仪器厂生产的LDF-III型激光多普勒血流计。
1.3 方法
全部研究对象操作前12 h 禁食,饮水自由,予以6 mg/kg 20%乌拉坦肌肉注射麻醉,后予以颈静脉插管,另一侧连接上海沪东仪器厂生产的微量输液泵,胆盐诱导急性胰腺炎组将5%牛黄胆酸钠注射至胰管内,用药剂量为0.1 g/100 g 计算,用药速度为0.2 mL/min,假手术组予以开腹,予以十二指肠、胰腺轻揉,两组均监测12 h。予以LDF-Ⅲ型激光多普勒血流仪在大鼠的体尾交界、胰头处选择相对固定、辨别度较高的部位,组织轻触探头即可,分析两组实验动物在开始0.5、1、1.5 、2、2.5、3 h 的胰腺血流量,基数为初始数据,计算各检测值的百分数;在操作前、操作后2、4、6、12 h 经颈静脉采集1 mL 血液,10 min 离心,速度为4 000 r/min,分离血清,置于-72°C 保存,予以双抗体夹心酶联免疫吸附试验检测血清中TNF-α、IL-6 指标变化;在操作前、操作后12 h 采集血清,监测其脂肪酶、淀粉酶含量;操作后12 h 将大鼠处死,10%福尔马林固定胰腺组织,包埋石蜡,苏木染色,光镜监测下予以病理检查,由病理科医师评估其病理变化。
1.4 评定标准
胰腺病理学检查评分:中性粒细胞浸润(4 分)、坏死(3 分)、出血(2 分)、水肿(1 分)、正常(0 分)[3]。
1.5 观察指标
观察两组实验开始0.5、1、1.5、2、2.5、3 h 的胰头部微循环血流量、胰体尾部微循环血量、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)、血清淀粉酶、血清脂肪酶、胰腺病理学检查评分。
1.6 统计方法
应用SPSS 21.0 统计学软件分析数据,计量资料用(±s)表示,组间差异比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组大鼠胰头部微循环血流量比较
胆盐诱导急性胰腺炎组实验动物在开始0.5、1、1.5、2、2.5、3 h 的胰头部微循环血流量低于假手术组,差异有统计学意义(P<0.05)。见表1。
表1 两组大鼠胰头部微循环血流量比较[(±s),mL]

表1 两组大鼠胰头部微循环血流量比较[(±s),mL]
组别胆盐诱导急性胰腺组(n=26)假手术组(n=24)t 值P 值0.5 h 86.3±3.5 106.4±7.5 12.299<0.001 1 h 81.3±3.4 109.7±5.6 21.869<0.001 1.5 h 76.4±2.8 116.2±5.2 34.061<0.001 2 h 61.3±2.4 109.7±4.6 47.170<0.001 2.5 h 56.4±2.1 106.2±3.2 65.549<0.001 3 h 39.3±1.7 100.7±2.6 99.583<0.001
2.2 两组大鼠胰体尾部微循环血流量比较
胆盐诱导急性胰腺炎组实验动物在开始0.5、1、1.5、2、2.5、3 h 的胰体尾部微循环血流量低于假手术组,差异有统计学意义(P<0.05)。见表2。
表2 两组大鼠胰体尾部微循环血流量比较[(±s),mL]
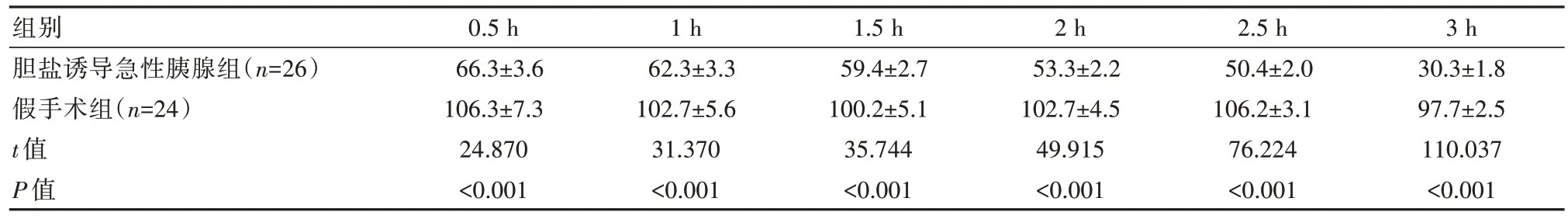
表2 两组大鼠胰体尾部微循环血流量比较[(±s),mL]
组别胆盐诱导急性胰腺组(n=26)假手术组(n=24)t 值P 值0.5 h 66.3±3.6 106.3±7.3 24.870<0.001 1 h 62.3±3.3 102.7±5.6 31.370<0.001 1.5 h 59.4±2.7 100.2±5.1 35.744<0.001 2 h 53.3±2.2 102.7±4.5 49.915<0.001 2.5 h 50.4±2.0 106.2±3.1 76.224<0.001 3 h 30.3±1.8 97.7±2.5 110.037<0.001
2.3 两组大鼠实验前后的肿瘤坏死因子-α 指标比较
胆盐诱导急性胰腺炎组大鼠在术后2、4、6、12 h肿瘤坏死因子-α 指标高于假手术组,差异有统计学意义(P<0.05)。见表3。
表3 两组大鼠实验前后的肿瘤坏死因子-α 指标比较[(±s),pg/mL]

表3 两组大鼠实验前后的肿瘤坏死因子-α 指标比较[(±s),pg/mL]
组别胆盐诱导急性胰腺组(n=26)假手术组(n=24)t 值P 值术前60.3±7.6 59.2±7.3 0.521 0.605术后2 h 209.3±20.3 114.7±15.6 18.362<0.001术后4 h 278.4±19.7 116.2±15.1 32.472<0.001术后6 h 306.3±18.2 122.7±15.5 38.243<0.001术后12 h 281.5±17.4 116.4±12.6 38.148<0.001
2.4 两组大鼠实验前后的白介素-6 指标比较
胆盐诱导急性胰腺炎组大鼠在术后2、4、6、12 h的白介素-6 指标高于假手术组,差异有统计学意义(P<0.05)。见表4。
表4 两组大鼠实验前后的白介素-6 指标比较[(±s),pg/mL]

表4 两组大鼠实验前后的白介素-6 指标比较[(±s),pg/mL]
组别胆盐诱导急性胰腺组(n=26)假手术组(n=24)t 值P 值术前96.3±7.6 96.2±7.3 0.047 0.962术后2 h 273.3±60.3 104.7±32.6 12.150<0.001术后4 h 459.4±89.7 116.2±35.1 17.535<0.001术后6 h 403.3±70.2 162.7±45.5 14.248<0.001术后12 h 361.5±30.4 98.4±22.6 34.494<0.001
2.5 两组大鼠实验前后的血清脂肪酶、血清淀粉酶指标比较
与实验前相比,实验后两组的脂肪酶、血清淀粉酶均增高,且胆盐诱导急性胰腺炎组高于假手术组,差异有统计学意义(P<0.05)。见表5。
表5 两组大鼠实验前后的血清脂肪酶、血清淀粉酶指标比较[(±s),U/L]
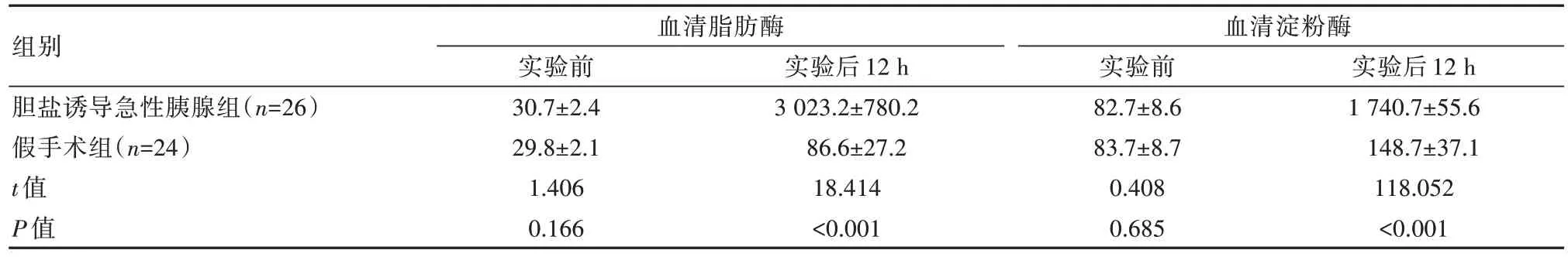
表5 两组大鼠实验前后的血清脂肪酶、血清淀粉酶指标比较[(±s),U/L]
组别胆盐诱导急性胰腺组(n=26)假手术组(n=24)t 值P 值血清脂肪酶实验前30.7±2.4 29.8±2.1 1.406 0.166实验后12 h 3 023.2±780.2 86.6±27.2 18.414<0.001血清淀粉酶实验前82.7±8.6 83.7±8.7 0.408 0.685实验后12 h 1 740.7±55.6 148.7±37.1 118.052<0.001
2.6 两组大鼠胰腺病理组织学评分比较
胆盐诱导急性胰腺炎组胰腺病理学中性粒细胞浸润、坏死、出血、水肿评分高于假手术组,差异有统计学意义(P<0.05)。见表6。
表6 两组大鼠胰腺病理组织学评分比较[(±s),分]

表6 两组大鼠胰腺病理组织学评分比较[(±s),分]
组别胆盐诱导急性胰腺组(n=26)假手术组(n=24)t 值P 值中性粒细胞浸润3.2±0.7 1.6±0.3 8.289<0.001坏死2.7±0.2 1.3±0.7 5.690<0.001出血1.2±0.3 0.9±0.2 4.124<0.001水肿0.7±0.3 0.3±0.1 6.217<0.001
假手术组胰腺病理示:腺泡、间质水肿,炎性细胞浸润,少量散在出血坏死灶,见图1;胆盐诱导急性胰腺炎胰腺病理示:镜下可见胰腺组织高度充血水肿,呈紫黑色、深红色,胰腺组织结构被破坏,出现大量炎性细胞浸润,大片出血坏死灶,见图2。

图2 胆盐诱导急性胰腺炎胰腺病理
3 讨论
近年随着大量深入研究,人们对重症急性胰腺炎的病理机制有了更全面、更深入的了解。重症急性胰腺炎发病的中心环节包括激活异位胰蛋白酶原、WBC 依赖性炎性因子反应变化、胰腺的微循环受限[4-6]。目前,有研究指出,重症急性胰腺炎除了具有以上局部病变外,属于一种侵袭胰腺远隔系统、脏腑组织、邻近组织的全身性、急性、系统性炎性反应病变[7-8]。重症急性胰腺炎其临床特征为肾功能、呼吸功能不同程度的高动力循环,引发各脏腑组织器官功能衰竭。重症急性胰腺炎的最初的受损反应为细胞分子网的炎性病变,机体启动了各种炎性介质及细胞因子,进而引发炎性因子级联反应、全身性病变,引发炎性因子反应风暴,导致病情迅速进展。而在重症急性胰腺炎的病程中,肿瘤坏死因子-α、白介素-6 可在生物学效应、调节受体、诱生等不同层面相互影响,在发挥作用时与其他炎性介质形成级联反应,属于立体的复杂结构[9-10]。
白介素-6 属于急性反应期的关键性炎性介质,属于巨噬/单核细胞,可在肿瘤坏死因子-α、白介素1、内毒素等各种细胞作用下生成。对重症急性胰腺炎的病情进展评估敏感指标之一为白介素-6;白介素-6 可在各种靶细胞内发挥作用,通过对炎性成熟细胞成分肝功能予以调节,进而促使炎性因子进展,促使炎性因子在炎性细胞的激化效应下引发多脏衰[10-11]。白介素-6 的具体病理机制包括:①和肿瘤坏死因子-α 发挥协同效应,可在微血管系统广泛存在,促使血管内皮细胞的表型诱导为炎症型,促使外源性凝血系统被激活,促进组织因子的急骤增高表达,过度激化血管内皮细胞,引发组织受损、形成微循环血栓[12-13];②促使中性粒细胞凋亡周期延长,确保中性粒细胞生成氧自由基;③生成抗体、促进分化B 细胞、对白介素1 产生协同作用,对肝细胞的毒性、炎性因子反应发达,促进催化急性反应肝细胞合成蛋白,引发细胞组织受损[14-15]。重症急性胰腺炎的TNF-α 的作用机制为:①在重症急性胰腺炎早期最早增高的炎性介质为TNF-α,是导致白介素相关因子、自身表达基因,造成级联反应的始发因子,可导致炎性介质释放具有失控性;②可促使膜磷脂酶A1 激活,导致代谢花生四烯酸失衡,出现血小板活化因子,促使微循环障碍严重受限;对血管内皮细胞进行刺激,生成氧自由基、一氧化氮等介质[16-17];③对炎性因子细胞激活,促使粘附分子增高,在血管内皮中粘附白细胞,促使血管的通透性增高;对组织纤溶酶原激活物进行灭活,进而对纤溶反应进行抑制,促使组织因子表达急骤增高,血栓调理素降低表达,对凝血系统激活,形成毛细血管微血栓。
本研究观察胆盐诱导急性胰腺炎大鼠模型中相关淀粉酶中白细胞介素-6、肿瘤坏死因子-α 指标变化,结果显示:胆盐诱导急性胰腺炎组实验动物在开始0.5、1、1.5、2、2.5、3 h 的胰头部微循环血流量和假手术组相比较低(P<0.05);胆盐诱导急性胰腺炎组实验动物在开始0.5、1、1.5、2、2.5、3 h的胰体尾部微循环血流量和假手术组相比较低(P<0.05);说明胆盐诱导急性胰腺炎大鼠可出现胰头、胰体尾部微循环血流下降,形成微循环血栓;胆盐诱导急性胰腺炎组大鼠在术后2、4、6、12 h肿瘤坏死因子-α 指标与假手术组相比较高(P<0.05);胆盐诱导急性胰腺炎组大鼠在术后2、4、6、12 h 中白介素-6 指标与假手术组较高(P<0.05);说明胆盐诱导急性胰腺炎大鼠的炎性因子IL-6、TNF-α 急骤增高,引发机体的级联炎性反应;胆盐诱导急性胰腺炎组实验后的血清脂肪酶、血清淀粉酶指标分别为(3 023.2±780.2)、(1 740.7±55.6)U/L与假手术组(86.6±27.2)、(148.7±37.1)U/L 相比较高(P<0.05),与张顺等[18]的研究结果大体一致,张顺等研究中急性重症胰腺炎大鼠的SAP 组实验前血清淀粉酶(81.5±9.6)、血清脂肪酶(29.5±2.6)U/L;而实验12 h 后SAP 组的血清淀粉酶为(1 739.2±57.9)、血清脂肪酶为(3 041.9±779.2)U/L(P<0.05)。本研究说明胆盐诱导急性胰腺炎的血清脂肪酶、淀粉酶大幅度增高;胆盐诱导急性胰腺炎组与假手术组相比,胰腺病理学中性粒细胞浸润、坏死、出血、水肿评分较高(P<0.05),说明胆盐诱导急性胰腺炎病理学中性粒细胞浸润、坏死、出血、水肿等变化。
综上所述,急性重症胰腺炎患者胰腺区域血流量大幅度降低,产生微循环障碍,加重病情的炎性因子指标为肿瘤坏死因子-α、白介素-6 指标。
