DMDD 与索拉非尼联合应用协同抑制肝癌细胞恶性生物学行为的实验研究
2023-07-19农莹丹范氏泰和何勇飞梁天仪卢春苗唐立博杨子叶韩创业罗小玲
农莹丹,范氏泰和,韩 箫,何勇飞,梁天仪,卢春苗,唐立博,杨子叶,韩创业,6,罗小玲,5
(1.广西医科大学附属肿瘤医院实验研究部,广西 南宁 530021;2.广西区域性高发肿瘤早期防治研究教育部重点实验室,广西 南宁 530021;3.广西国际壮医医院壮瑶药研发中心,广西 南宁市 530201;4.广西医科大学第一附属医院肝胆外科,广西 南宁 530021;5.广西医科大学基础医学院,广西 南宁 530021;6.广西消化道肿瘤加速康复外科(ERAS)基础研究重点实验室,广西 南宁 530021)
原发性肝癌是我国第四大常见肿瘤,其死亡率高居所有恶性肿瘤中的第二位,75%~85%以上的原发性肝癌病理类型为肝细胞癌(hepatocellular carcinoma,HCC)(以下简称肝癌)[1]。根治性切除术是肝癌患者获得长期生存的首选治疗方法,但由于肝癌早期缺乏明显症状,70%的患者在就诊时已为中晚期,无法获得根治性切除[2,3]。对于多发肿瘤、已经发生血管侵犯、远处转移或肿瘤体积过大而残肝体积不足的中晚期肝癌患者,分子靶向药物治疗是主要的治疗方式[4]。索拉非尼是美国FDA批准作为肝癌系统性治疗的一线用药,是最早用于肝癌系统抗肿瘤治疗的小分子多靶点药物,至今仍然是肝癌诊疗指南推荐的一线药物[1]。临床研究表明,索拉非尼能有效延长晚期肝癌患者的总体生存时间,改善患者的生存质量[5]。然而,临床发现部分患者一开始即对索拉非尼不敏感,称为原发性耐药;部分患者在使用过程中逐渐对索拉非尼降低敏感性,称为继发性耐药[6],耐药性限制了索拉非尼的治疗效果。因此,肝癌治疗过程中增强索拉非尼敏感性和逆转索拉非尼耐药的研究一直是肝癌治疗领域的研究重点和热点。
中西医结合治疗已成为我国肝癌治疗的模式之一,大量研究表明中药可经多途径控制肿瘤进展,可诱导细胞凋亡、抑制细胞增殖、抗肿瘤血管生成,在提高机体免疫力方面也有较好作用[7-9];中药与索拉非尼联合应用对肝癌治疗有协同增效作用[10,11]。近年来,本课题组开展了中药活性成分治疗肝癌及增强索拉非尼治疗敏感性及逆转耐药方面的研究,我们从中药材杨桃根中分离得到中药单体——DMDD(2-十二烷基-6-甲氧基-2,5-二烯-1,4-环己二酮),初步实验证明DMDD 为有效的抗肝细胞癌药物[12]。因此,本研究旨在进一步探讨DMDD与索拉尼联合应用对肝癌细胞恶性生物学行为的影响,二者是否具有协同增效作用,为提高索拉非尼治疗肝癌的疗效提供参考。
1 材料与方法
1.1 材料
人肝癌细胞株Huh7 购自中国科学院上海细胞库;索拉非尼购自美国MCE 公司;中药单体DMDD由课题组成员广西国际壮医医院壮瑶药研发中心范氏泰和博士提取,DMDD 已于2021 年申请发明专利,发明专利名称:杨桃根及其提取物在制备治疗和/或预防肝癌药物中的应用;申请号:202011305629.9[12];DMEM 培养液、胎牛血清购于美国Gibco 公司;CCK-8 细胞增殖-毒性检测试剂盒购于中国白鲨公司;Transwell 细胞培养板、基质胶购于美国Corning 公司;细胞周期检测试剂盒购于中国碧云天生物技术公司;兔源 PHGDH 抗体、抗兔IgG 二抗和鼠源微管蛋白tubulin、抗鼠IgG 二抗购于武汉三鹰生物技术有限公司;PHGDH 基因引物、tubulin 基因引物购于擎科生物公司;CO2细胞培养箱为美国Thermo Scientific Varioskan 公司产品。
1.2 方法
1.2.1 CCK-8 法检测Huh7 细胞活力 取对数生长期Huh7 细胞接种于96 孔板中,密度为5×103个,待细胞贴壁后更换100 μL 含有不同药物的培养基。DMDD 组以0、2、4、6、8、10 μmol/L 的浓度梯度干预,索拉非尼组以0、1、2、3、4、5 μmol/L 的浓度梯度干预,联合应用组以上述相应浓度的DMDD 和索拉非尼两两配伍,以等量不含药物和细胞的培养基作为空白对照组,干预48 h 后检测450 nm 处吸光度值(OD),计算细胞存活率和细胞增殖抑制率。细胞存活率=[(实验组OD 值-空白组OD 值)/(对照组OD 值-空白组OD 值)]×100%。细胞增殖抑制率=[(对照组OD 值-实验组OD 值)/(对照组OD 值-空白组OD 值)]。采用金氏公式[13]Q=Ea+b/(Ea+Eb-EaEb)评价药物联合应用效果,公式中的Ea和Eb为单药的抑制率,Ea+b为两药联合的抑制率,Q<0.85 提示两药联合效果为拮抗,Q 值为0.85~1.15 提示两药联合效果为相加,Q 值>1.15 表示两药联合效果为增效。
1.2.2 平板克隆检测Huh7 细胞集落形成能力 根据CCK-8 结果确定药物浓度,设Huh7 细胞空白对照组、DMDD 5 μmol/L 组、索拉非尼2 μmol/L 组、联合应用组(DMDD 5 μmol/L+索拉非尼2 μmol/L)。各组药物干预48 h 后,收集细胞接种于6 孔板中,接种密度为每孔500 个细胞。在培养箱中培养,每3~4 d 换液一次,14 d 后取出培养板,移除培养液,多聚甲醛固定15 min,结晶紫染色30 min。清洗及干燥后在显微镜下计数,以≥10 个细胞的细胞团为细胞集落进行计数。
1.2.3 划痕实验检测Huh7 细胞迁移能力 Huh7 细胞接种于6 孔板,待细胞生长密度达90%~100%,用100 μL 移液枪头沿无菌钢尺边缘划直线,PBS 洗2 次。用2%血清培养基配制各组浓度药物进行干预,各药物分组及用量与1.2.2 中相同,倒置显微镜下取直线附近区域进行拍照并记录位置。0、24、48、72 h 于倒置显微镜下寻找标记位置拍照。利用Image J 处理图片并计算划痕愈合率。划痕愈合率%=(划痕面积0 h-划痕面积72 h)/划痕面积0 h×100%。
1.2.4 Transwell 实验检测Huh7 细胞迁移和侵袭能力 细胞迁移实验中,各药物分组及用量与1.2.2 中相同。取不同药物干预的Huh7 细胞种植于上室,密度为每孔1×105个,下室加入完全培养基,24 h 后取出小室,多聚甲醛固定及结晶紫染色各30 min,清洗结晶紫并用棉签小心清除上室细胞,待小室干燥后在倒置显微镜下选择3 个视野拍照,计数迁移细胞。
细胞侵袭实验中,各药物分组及用量与1.2.2 中相同,上室加入100 μL/孔Matrigel 胶,置于37 ℃细胞培养箱中孵育1 h 胶化,取不同药物干预的Huh7细胞种植于上室,密度为每孔1×105个,下室加入完全培养基,24 h 后取出小室,多聚甲醛固定及结晶紫染色各30 min,清洗结晶紫并用棉签小心清除上室细胞,待小室干燥后在倒置显微镜下选择3 个视野拍照,计数侵袭细胞。
1.2.5 流式细胞术检测Huh7 细胞周期分布 取对数生长期细胞接种于6 孔板,过夜贴壁后加药,各药物分组及用量与1.2.2 中相同。孵育48 h 后收集细胞,PBS 洗2 次,用预冷的70%乙醇固定过夜。次日离心洗涤后,加入含有RNase A 和PI 的染色液,37 ℃避光染色30 min。流式细胞仪检测细胞周期分布,用FlowJo 软件分析数据。
1.2.6 RT-qPCR 检测Huh7 细胞PHGDH mRNA表达水平 取对数生长期细胞接种于6 孔板,过夜贴壁后加药,各药物分组及用量与1.2.2 中相同。孵育48 h 后,收集细胞,使用Omega RNA 试剂盒提取总RNA,并用TaKaRa 逆转录试剂盒,将RNA 逆转录为cDNA。引物序列如下:PHGDH 上游引物:5'-ATGAACTTCTTCCGCTCCCATTT-3',下游引物:3'-TCGGTGAAATGCTGTGGTTTAAA-5'。tubulin上游引物:5' - CTTGGGTCTGTAACAAAGCATTC - 3',下游引物:5'- AAGTTAAAACGTCACAAAGGTGCT - 3'。利用SYBR Green 染料检测细胞目的基因的表达,以tubulin作为内参,采用相对定量公式:2-ΔΔCt计算细胞目的基因的相对表达量。
1.2.7 Western blot 检测Huh7 细胞PHGDH 蛋白表达水平 不同药物干预的Huh7 细胞用裂解液冰上裂解30 min,收集裂解后的细胞悬液,14 000×g离心15 min,收集上清,测蛋白浓度,将等量总蛋白从SDS-聚丙烯酰胺凝胶转移到PVDF 膜上,脱脂奶粉封闭1 h,一抗溶液4 ℃孵育12~16 h,洗膜3 次,二抗室温孵育2 h,ECL 显影液充分浸泡20 s 后扫膜,图片用ImageJ 软件处理并进行灰度值分析。
1.3 统计学处理
采用GraphPad Prism 8 软件进行数据分析及图形绘制。计量资料以均数±标准差(±s)表示,单因素方差分析用于多组比较,并以Tukey's 检验进行多重比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同药物对Huh7 细胞增殖能力的影响
CCK-8 实验结果显示,与对照组比较,Huh7 细胞存活率随DMDD、索拉非尼、DMDD 和索拉非尼联合应用的浓度增加而降低,联合应用组细胞存活率显著降低,呈浓度依赖关系,结果见图1。经金氏公式计算,2、4、8 μmol/L DMDD 分别联合1、2、4 μmol/L 索拉非尼具有协同作用(Q>1.15),6、10 μmol/L DMDD 分别联合3、5 μmol/L 索拉非尼具有相加作用(0.85<Q<1.15),结果见表1。

表1 以金氏公式Q 值评价不同浓度DMDD 与索拉非尼联合应用的作用效果Tab 1 Evaluation of the combined effect of different concentrations of DMDD and sorafenib by Q value of Kim's formula

图1 不同药物对Huh7 细胞活力的影响Fig 1 Effects of different drugs on the viability of Huh7 cells
2.2 不同药物对Huh7 细胞集落形成能力的影响
平板克隆实验结果显示,干预48 h 后,对照组、DMDD 组、索拉非尼组及联合应用组的细胞集落个数分别为99.00±6.56、47.67±8.02、71.33±5.51、28.33±6.03。与对照组比较,3 组的Huh7 细胞集落个数均下降,差异均有统计学意义(P<0.000 1,P<0.01,P<0.000 1);与DMDD 组、索拉非尼组比较,联合应用组细胞集落个数显著下降(P<0.05,P<0.001)。结果见图2。

图2 不同药物对Huh7 细胞集落形成的影响Fig 2 Effects of different drugs on clony formation of Huh7 cells
2.3 不同药物对Huh7 细胞迁移能力的影响
划痕实验结果显示,干预48 h 后,对照组、DMDD 组、索拉非尼组及联合应用组的划痕愈合率分别为(40.43±5.10)%、(31.38±1.56)%、(22.04±1.51)%、(15.02±2.76)%。与对照组比较,3 组的Huh7 细胞划痕愈合率均下降,差异均有统计学意义(P<0.05,P<0.001,P<0.000 1);与DMDD组比较,联合应用组划痕愈合率显著下降(P<0.001);联合应用组与索拉非尼组的划痕愈合率比较,差异无统计学意义(P>0.05)。结果见图3。
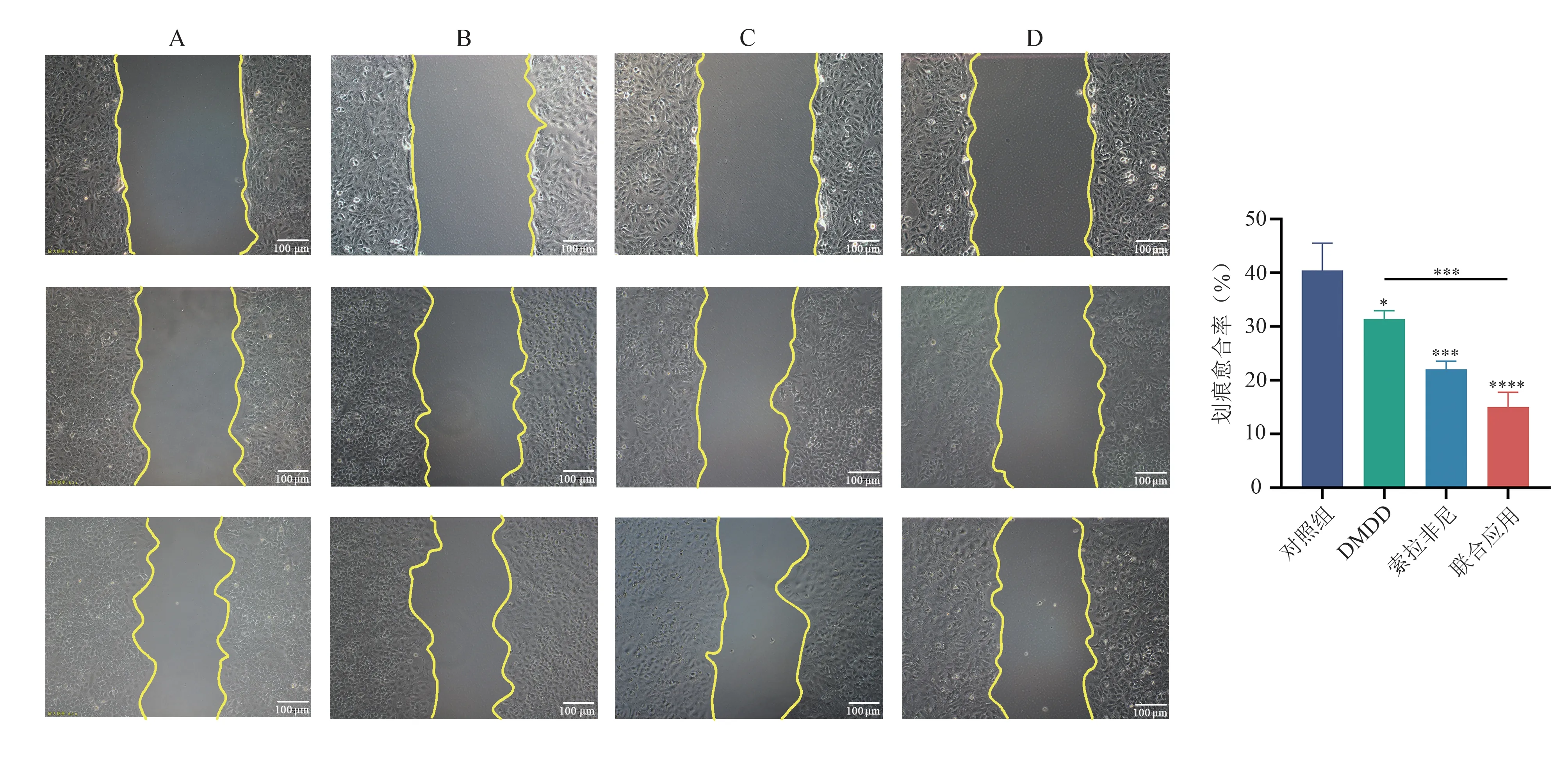
图3 不同药物对Huh7 细胞迁移能力的影响(×100)Fig 3 Effects of different drugs on the migration ability of Huh7 cells(×100)
2.4 不同药物对Huh7 细胞迁移和侵袭能力的影响
Transwell 迁移实验结果显示,干预48 h 后,对照组、DMDD 组、索拉非尼组及联合应用组的迁移细胞数分别为 346.70±17.50、247.70±14.57、233.30±10.50、97.00±13.75。与对照组比较,3 组的迁移细胞数均下降,差异均有统计学意义(P<0.001,P<0.0001,P<0.000 1)。与DMDD 组、索拉非尼组比较,联合应用组迁移细胞数显著下降,差异均有统计学意义(均P<0.000 1)。结果见图4。

图4 不同药物对Huh7 细胞迁移能力的影响(×100)Fig 4 Effects of different drugs on the migration ability of Huh7 cells(×100)
Transwell 侵袭实验结果显示,干预48 h 后,Huh7 细胞对照组、DMDD 组、索拉非尼组及联合应用组的侵袭细胞数分别为443.00±17.06、177.00±19.67、186.00±16.70、54.67±7.371。与对照组比较,3 组的侵袭细胞数均下降,差异均有统计学意义(均P<0.000 1)。与DMDD 组、索拉非尼组比较,联合应用组侵袭细胞数显著下降,差异均有统计学意义(均P<0.000 1)。见图5。
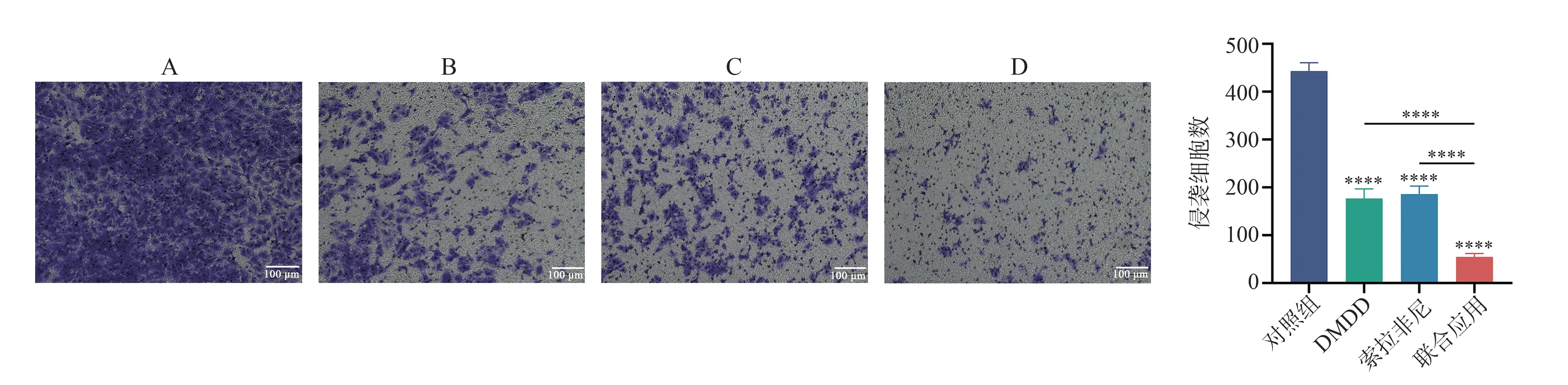
图5 不同药物对Huh7 细胞侵袭能力的影响(×100)Fig 5 Effects of different drugs on the invasive ability of Huh7 cells(×100)
2.5 不同药物对Huh7 细胞周期的影响
流式细胞术检测细胞周期实验结果显示,各组药物干预48 h 后,对照组、DMDD 组、索拉非尼组及联合应用组G2/M 期细胞比例分别为(10.63±0.32)% 、(35.77±1.22)% 、(30.03±2.22)% 、(38.97±0.60)%。与对照组比较,3 组G2/M 期细胞比例均显著上升,差异均有统计学意义(均P<0.000 1)。与索拉非尼组比较,联合应用组G2/M 期细胞比例上升(P<0.001),联合应用组与DMDD 组比较,差异无统计学意义(P>0.05)。见图6。
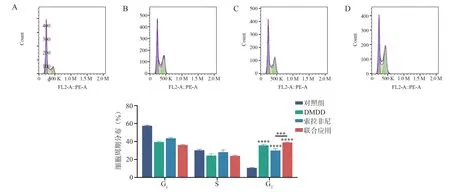
图6 不同药物对Huh7 细胞周期的影响Fig 6 Effects of different drugs on Huh7 cell cycle
2.6 不同药物对Huh7 细胞PHGDH mRNA 转录水平和蛋白表达水平的影响
RT-qPCR 实验结果显示,干预48 h 后,与对照组比较,DMDD 组、索拉非尼组、联合应用组PHGDH mRNA 转录水平均下降,差异均有统计学意义(均P<0.000 1);与DMDD 组、索拉非尼组比较,联合应用组Huh7 细胞PHGDH mRNA 转录水平均下降,差异有统计学意义(P<0.05,P<0.01)。Western blot 实验结果显示,与对照组比较,3 组Huh7 细胞PHGDH 蛋白表达水平均下降,差异有均统计学意义(P<0.01,P<0.000 1,P<0.000 1),与DMDD组、索拉非尼组比较,联合应用组PHGDH 蛋白表达水平显著下降(P<0.000 1,P<0.001)。结果见图7。

图7 不同药物对Huh7 细胞PHGDH mRNA 转录水平和蛋白表达水平的影响Fig 7 Effects of different drugs on PHGDHmRNA transcription and protein expression in Huh7 cells
3 讨论
索拉非尼作为晚期肝癌治疗的一线靶向药物,可有效延长患者生存期、提高生存质量,但耐药和毒副作用限制了索拉非尼的治疗效果[14]。因此,目前有较多增强索拉非尼敏感性或逆转索拉非尼耐药方面的研究[15,16],其中有研究显示中药与索拉非尼联合应用可提高索拉非尼的敏感性,在肝癌治疗中具有良好的应用前景[17]。本课题组也开展了中药活性成分治疗肝癌及增强索拉非尼治疗肝癌敏感性及逆转耐药方面的研究,从中药材杨桃根中分离提取活性成分DMDD,研究表明DMDD 为有效的抗肝细胞癌药物并申请了发明专利[12]。此外,Wang 等[18]研究发现,DMDD 可调控细胞周期进程抑制肺癌细胞生长。Zhou 等[19]研究发现,DMDD可通过调节MAPK 信号通路抑制乳腺癌癌细胞的增殖和转移。本研究则进一步探讨DMDD 与索拉尼联合应用是否具有协同增效作用及对肝癌细胞恶性生物学行为的影响,为DMDD 提高索拉非尼肝癌治疗效果提供实验依据。结果表明,DMDD 和索拉非尼单独及联合应用对肝癌Huh7 细胞的增殖均有抑制作用,且联合应用对肝癌细胞的抑制作用大于单独用药。经金氏公式分析,DMDD 与索拉非尼联合应用表现为协同作用或相加作用,其中,低剂量DMDD 与低剂量索拉非尼联用对肝癌细胞的协同抑制作用更显著,说明DMDD 可促进肝癌细胞对索拉非尼敏感。克隆形成实验结果显示,DMDD 和索拉非尼单独应用均可减少肝癌细胞集落形成个数,而联合应用可显著降低细胞集落形成个数,对Huh7 细胞的抑制作用更强。划痕实验、Transwell实验结果表明,DMDD、索拉非尼单独应用均可抑制Huh7 细胞的迁移和侵袭能力,联合应用抑制作用更显著。细胞周期实验结果显示,DMDD、索拉非尼单独应用和联合应用均可导致Huh7 细胞发生G2/M 期周期阻滞。G2期是细胞从S 期到M 期之间的时间段,细胞在此期间进行细胞器复制和准备有丝分裂所必需的物质[20]。G2/M 检查点阻断是许多细胞毒药物杀伤肿瘤细胞的一种有效途径[21]。实验中发现DMDD 与索拉非尼联合应用组对Huh7 细胞的G2/M 期阻滞作用显著高于索拉非尼单独应用组,但与DMDD 单独应用组相比,无统计学意义,说明DMDD 单独应用即具有较强的G2/M 期细胞周期阻滞能力,与索拉非尼联合应用有协同增效作用。
丝氨酸合成途径将葡萄糖酵解产物3-磷酸甘油酸经三步酶催化反应转化为丝氨酸,中间代谢产物参与细胞内一碳代谢、抗氧化能等生物过程,在癌细胞中,丝氨酸代谢的异常活化被认为是肿瘤生长和发展的重要机制之一[22]。在机制上探讨,我们发现DMDD、索拉非尼单独使用和联合应用均可下调Huh7 细胞PHGDH 表达水平,联合应用组PHGDH 表达下调更明显。PHGDH 是丝氨酸合成通路中的第一个限速酶,在结肠癌、尤文氏肉瘤和乳腺癌中,均检测到PHGDH 表达水平上调,且PHGDH表达水平这些肿瘤的增殖、侵袭和迁移能力呈正相关[23]。Montrose 等[24]研究发现,限制丝氨酸活化可逆转结肠癌5-氟尿嘧啶耐药,提高5-氟尿嘧啶的治疗效果。这些研究表明,抑制丝氨酸合成途径的过度活化是抑制癌细胞恶性生物学行为、提高药物治疗效果及克服肿瘤细胞耐药的有效途径。
综上所述,DMDD 与索拉非尼联合应用对Huh7 细胞的增殖、迁移、侵袭能力的抑制作用均显著优于DMDD 和索拉非尼单独应用,其机制可能与DMDD 和索拉非尼协同下调丝氨酸合成通路相关。本研究为提高索拉非尼治疗肝癌的疗效、降低其使用剂量以减轻毒副作用和延缓耐药提供了实验依据。
作者贡献度说明:
农莹丹:进行实验设计、实验操作、数据分析、撰写论文;范氏泰和:DMDD 单体提取及其作用功能研究;韩箫、何勇飞、梁天仪:实验技术指导;卢春苗:参与细胞培养;唐立博:参与Transwell 实验;杨子叶:参与RT-PCR 实验;韩创业:研究方案设计、实验技术和操作指导;罗小玲:项目负责人,课题设计、实验指导、研究经费支出、文稿修改。
所有作者声明不存在利益冲突关系。
