建立大鼠慢性非细菌性前列炎模型两种方法的比较研究
2023-07-19唐益文周艳艳陈豪特张泽家高庆和刘剑刚
唐益文,王 雄,周艳艳,陈豪特,张泽家,王 忠,高庆和,刘剑刚,高 瞻
(1.北京中医药大学研究生院,北京 100029;2.中国中医科学院西苑医院泌尿外科,北京 100091;3.中国中医科学院西苑医院男科,北京 100091;4.中国中医科学院心血管病研究所,北京 100091)
慢性非细菌性前列腺炎(chronic nonbacterial prostatitis,CNP)为泌尿外科常见疾病,占所有前列腺炎的90%以上[1,2],因前列腺特殊的解剖及生理特点,致使临床表现多样、症状反复难愈,是前列腺炎中最常见、最复杂的一类临床综合征[3]。目前研究发现病原体感染、尿液反流、神经内分泌因素、氧化应激等都与前列腺炎发病相关,其中免疫因素在CNP 发生发展中起到重要作用[4,5]。免疫因素CNP动物模型的建立,是进行CNP 病因病机及药物研究的重要基础,目前,前列腺免疫因素动物模型包括去势结合雌激素诱导型、自身免疫反应诱导型、自发型CNP 模型[6],其中常用方法为前两种,但尚缺乏系统的从手法、病理组织、免疫炎症指标和激素水平比较两种模型的报道,本研究拟采用此两种方法建立CNP 模型,比较两种模型特征、病理及各项指标,探讨制备CNP 动物模型的最优选择,为今后药物防治CNP 的实验研究提供较好的动物模型。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 健康SPF 级,雄性,Wistar 大鼠34 只,体质量(200±20)g,由斯贝福(北京)生物技术有限公司[SYXK(京)2019-0030]提供,饲养于中国中医科学院西苑医院屏障级实验动物室[SYXK(京)2018-0018]。饲养环境:屏障系统内饲养,温度22℃~26℃,湿度控制在40%~70%,由12 h 光照/黑暗循环,自由饮食。饲料由北京科澳协力饲料有限公司[京饲证(2014)06054]提供。饮水:灭菌水,装入饮水瓶供实验动物自由饮用。
1.1.2 试剂 0.9%生理盐水(山东辰欣药业股份有限公司,批号:1211040591);10%水合氯醛(国际集团化学有限公司,批号:20050805);苯甲酸雌二醇(Solarbio 公司,批号:WXBD0151V);弗氏完全佐剂(CFA)(Sigma 公司,批号:C104202);BCA 测蛋白浓度试剂盒(上海碧云天生物技术公司,批号:P0010);IgA、IgG、IgM 试剂盒(北京华英生物技术研究所,批号:20220416BH);白细胞介素-1β(IL-1β)、白细胞介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)、高敏-C 反应蛋白(hs-CRP)试剂盒(北京欣博盛生物科技有限公司,批号:20220428X);T 试剂盒(上海罗氏诊断产品有限公司,批号:48879601)。
1.1.3 仪器 3-18K 型低温离心机(美国SiGma 公司);T18 型分散机(德国IKA 公司);DNP9082 型电热恒温平培养箱(上海精宏实验设备有限公司);MultiSkan3 型酶标仪(美国Thermo 公司);EG1150型病理包埋机(德国Leica 公司);7160 型全自动生化仪(日本HITACHI 公司);DR-200BS 型全自动酶标分析仪(无锡华卫德朗仪器有限公司)。
1.2 实验方法
1.2.1 模型构建和分组 适应性饲养大鼠7 d 后,按随机对照表分为5 组,假手术组6 只、去势结合雌激素诱导CNP 模型组(去势激素组)8 只、自身免疫性前列腺炎(experimental autoimmune prostatitis,EAP)组3 组,分别为EAP 蛋白高剂量组(高EAP组)8 只、EAP 蛋白中剂量组(中EAP 组)6 只、EAP蛋白低剂量组(低EAP 组)6 只。
去势结合雌激素诱导CNP 造模,大鼠采用10%水合氯醛腹腔麻醉(0.2 mL/kg 体质量),仰卧位固定四肢及头颈,充分暴露会阴区视野,会阴区备皮并消毒铺巾,眼科剪剪开阴囊正中皮肤,逐层分离两侧睾丸至鞘膜,钝性分离睾丸和附睾,丝线结扎睾丸根部,剪断精索,移走睾丸,仔细观察结扎断端,确认无活动性出血。伤口消毒,逐层缝合,再次消毒伤口,放回鼠笼。术后连续3 d 背部4 点肌内注射青霉素(剂量25 万 U/kg,每只注射0.1 mL),以防感染。术后第2 天开始,每天对大鼠进行背部皮下注射苯甲酸雌二醇,剂量为0.25 mg/kg·d-1,连续注射30 d。第31 天可制备大鼠慢性前列腺炎模型,该模型可维持不少于30 d[7]。假手术组手术步骤同前,区别仅在于钝性分离睾丸和附睾步骤即止,伤口予以缝合放回鼠笼,每日注射药物为芝麻油。
EAP 造模,取下预备大鼠前列腺组织放入生理盐水中,修掉脂肪、膀胱及多余组织,清洗2~3 次,剪碎搅匀前列腺组织,加入含0.5%Triton-100 的生理盐水溶液,冰浴匀浆,12 000 r/min,4℃离心30 min。离心后吸去上层的脂肪组织,上清液吸入冷冻管进行液氮冷冻,并保存于-20 ℃条件下备用。临用前用BCA 测定蛋白浓度,根据测得的蛋白浓度,用0.01 mmol/L 的PBS 将蛋白提纯液分别稀释成40、20、10 mg/mL 高中低3 种浓度,吸取前列腺蛋白提纯液高、中、低3 种浓度0.5 mL 分别与完全弗氏佐剂0.5 mL 等比混悬,共1 mL。在造模的第0天、15 天、30 天将1 mL 高、中、低三种浓度混悬液分别对应不同组别进行背部4 点皮下注射,腹腔同时注射百白破疫苗0.5 mL,造模时间为45 d。第46 天可制备大鼠EAP 模型,本模型的维持时间不少于30 d[7]。
1.2.2 标本采集 各组大鼠按相应组别造模时间结束之后,称重,再次麻醉,腹主动脉取血,静置1 h后,3 000 r/min,离心10 min,分离血清备用,-80 ℃保存。取出大鼠前列腺组织,剥离被膜及脂肪组织,生理盐水清洗2~3 次,滤纸吸干,电子天平称重,计算各组大鼠前列腺指数,即前列腺湿重/体质量,取材结束后采用二氧化碳安死术处理。实验过程中严格遵循2011 年修订版《实验动物管理条例》及相关规定,动物实验经过中国中医科学院西苑医院医学伦理委员会批准(伦理批件号:2022XLC043-2)。
1.3 模型评价
1.3.1 一般情况 记录大鼠一般体征状况变化,造模期间每周对各组大鼠予以称重记录,并每日观察进食量、饮水量,观察大鼠毛发情况及一般活动情况。
1.3.2 前列腺组织病理学评价 将各组大鼠前列腺组织选取一部分保存于10%福尔马林溶液固定72 h,室温下水洗、脱水、透明、浸蜡、包埋、烤片处理后,HE 染色后封片,光镜下观察前列腺局部病理变化。其余部分备用留取做匀浆用于前列腺组织指标测定。
1.3.3 前列腺组织炎症病理评分 对前列腺组织从炎性细胞、成纤维细胞、腺腔大小、分泌物四个指标进行评价。炎性细胞:0 分:无炎性细胞浸润,2分:炎性细胞轻度浸润,4 分:炎性细胞中度浸润,6分:炎性细胞重度浸润。成纤维细胞:0 分:无成纤维细胞增生,1 分:成纤维细胞轻度增生,2 分:成纤维细胞中度增生,3 分:成纤维细胞重度增生。腺腔:0 分:腺腔大,1 分:腺腔中等,2 分:腺腔小,3 分:腺腔闭锁或消失。分泌物:0 分:分泌物多,1 分:分泌物中等,2 分:分泌物少,3 分:无分泌物[8]。
1.3.4 大鼠血清免疫球蛋白测定 按照试剂盒要求采用免疫比浊法测定IgA、IgM、IgG 水平。
1.3.5 大鼠血清炎症因子测定 按照试剂盒要求采用酶联免疫(ELISA)双抗体夹心法测定IL-1β、IL-10、TNF-α、hs-CRP 水平。
1.3.6 大鼠前列腺组织激素水平测定 按照试剂盒要求采用电化学发光法测定睾酮(T)水平。
1.4 统计学处理
采用SPSS27.0 和Graphpad Prism9.4.1 软件进行数据处理和统计分析处理,计量资料采用均数±标准差(±s)的形式,组间比较若方差齐采用单因素方差分析(ANOVA 检验),若不满足正态分布或方差不齐,则采用校正检验,组间多重比较采用Bonferroni 检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组的一般情况
各组Wistar 大鼠按相应造模方式进行饲养,去势激素组大鼠于第2 天死亡2 只,高EAP 组大鼠2只36 d 死亡。所有未死亡大鼠一般情况良好,无异常现象,进食量、饮水量正常,其中去势激素组大鼠和高、中、低EAP 组大鼠毛色明显变黄,光泽度下降,反应稍缓。每7 d 对所有大鼠称重,较假手术组,去势激素组从第1 周开始具有显著差异(P<0.05);高EAP 组、中EAP 组、低EAP 组大鼠分别从第2 周、第4 周、第5 周差异具有统计学差异(P<0.05)。见表1。
表1 造模期间各组大鼠体质量变化(g,±s)Tab 1 Changes in body mass of rats in each group during the modeling period(g,±s)

表1 造模期间各组大鼠体质量变化(g,±s)Tab 1 Changes in body mass of rats in each group during the modeling period(g,±s)
注:与假手术组相比,# P<0.05;## P<0.01。
组别假手术组去势激素组高EAP 组中EAP 组低EAP 组取材前430.00±13.04 411.17±13.50#418.83±10.68#413.17±6.91#414.17±8.23#5.580<0.001 n66666 FP第0 周181.75±7.13 179.33±3.93 186.16±4.46 182.67±4.72 184.83±4.62 1.239 0.320第1 周220.50±2.08 209.67±3.39#220.33±9.22 226.00±5.97 220.17±3.92 5.715 0.001第2 周268.50±2.38 255.67±4.30#256.00±7.32#268.50±3.73 261.50±5.35 6.002<0.001第3 周310.00±4.40 293.33±5.43#298.83±7.22#312.00±9.86 308.50±7.26 6.845<0.001第4 周352.50±15.41 331.83±8.40#330.67±7.47#333.33±7.87#339.33±7.20 5.307 0.020第5 周386.75±13.22 363.67±10.42#362.67±9.2#366.67±4.97#366.00±8.94#7.705<0.001第6 周420.75±10.69 402.16±13.60#408.33±11.88#404.16±6.97#410.10±13.94#5.481 0.010
取材时称量前列腺湿重,计算前列腺指数。去势激素组大鼠前列腺腺体极度萎缩,腺体软,体积减小,与周围组织有黏连,与假手术组和EAP 组相比,大鼠前列腺指数具有极显著差异(P<0.01,P<0.01)。肉眼观察高、中、低EAP 3 组和假手术组无明显变化(P>0.05),较假手术组体积稍小,前列腺腺体稍硬;高、中、低EAP 组大鼠3 组组间无明显差别(P>0.05)。见图1。

图1 各组大鼠前列腺指数Fig 1 Prostate index of rats of each group
2.2 各组大鼠前列腺组织病理学的比较
假手术组大鼠前列腺组织结构完整,界限清晰,腺腔规则,腺体上皮细胞形态正常,无炎症反应,见图2A。去势激素组大鼠前列腺组织存在明显腺体结构破坏,上皮细胞形态发生病变,间质明显水肿,腺腔显著扩大,可见大量炎性细胞弥漫性浸润,血管扩张充血,见图2B。高EAP 组大鼠存在腺体结构破坏,腺腔扩大,可见少量炎性细胞浸润,见图2C。;中EAP 组大鼠存在腺体结构破坏,腺腔稍扩大,腺上皮减少,间质内可见部分炎性细胞浸润,见图2D。;低EAP 组大鼠腺体结构有破坏,腺腔疏松,间质内可见少量炎性细胞浸润[8],见图2E。

图2 各组大鼠前列腺组织观察(HE,×100)Fig 2 Observation of prostate tissue in rats of each group (HE,×100)
2.3 各组大鼠前列腺组织炎症病理评分的比较
造模后,与假手术组相比,去势激素组大鼠前列腺组织炎性细胞、成纤维细胞、腺腔大小、腺腔内分泌物显著上升,具有显著差异(P<0.05);与假手术组相比,高、中、低EAP 组大鼠前列腺组织炎症病理评分变化无显著差异(P<0.05);与自身免疫组相比,去势激素组与高、中、低EAP 组炎症病理评分各指标具有显著差异(P<0.05);高、中、低EAP 组组间对比未见明显差异,无显著差异(P>0.05)。见表2。
表2 各组大鼠前列腺组织炎症评分比较(±s)Tab 2 Comparison of inflammation scores of prostate tissue in each group of rats(±s)
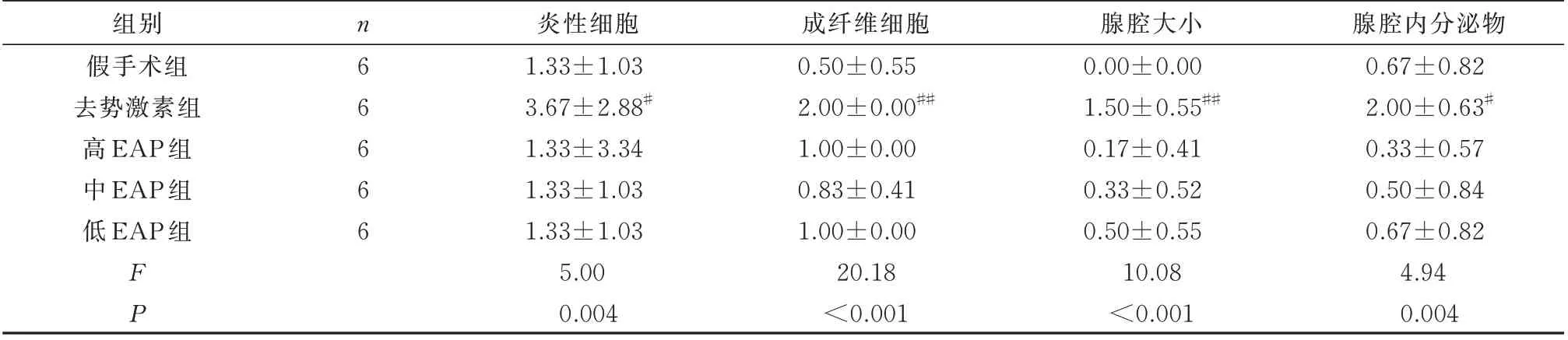
表2 各组大鼠前列腺组织炎症评分比较(±s)Tab 2 Comparison of inflammation scores of prostate tissue in each group of rats(±s)
注:与假手术组相比,# P<0.05,## P<0.01。
腺腔内分泌物0.67±0.82 2.00±0.63#0.33±0.57 0.50±0.84 0.67±0.82 4.94 0.004组别假手术组去势激素组高EAP 组中EAP 组低EAP 组n66666 FP炎性细胞1.33±1.03 3.67±2.88#1.33±3.34 1.33±1.03 1.33±1.03 5.00 0.004成纤维细胞0.50±0.55 2.00±0.00##1.00±0.00 0.83±0.41 1.00±0.00 20.18<0.001腺腔大小0.00±0.00 1.50±0.55##0.17±0.41 0.33±0.52 0.50±0.55 10.08<0.001
2.4 各组大鼠血清免疫球蛋白的比较
与假手术组相比,去势激素组大鼠IgA、IgG、IgM 显著上升,差异具有显著差异(P<0.05);与假手术组相比,高、中、低EAP 组大鼠仅IgM 具有显著差异(P<0.05);与自身免疫组相比,去势激素组与高、中、低EAP 组炎症病理评分各指标具有显著差异(P<0.05);高、中、低EAP 组组间对比未见明显差异,无显著差异(P>0.05)。见表3。
表3 各组大鼠血清IgA、IgG、IgM 水平比较(±s)Tab 3 Comparison of serum IgA,IgG and IgM levels of rats in each group(±s)
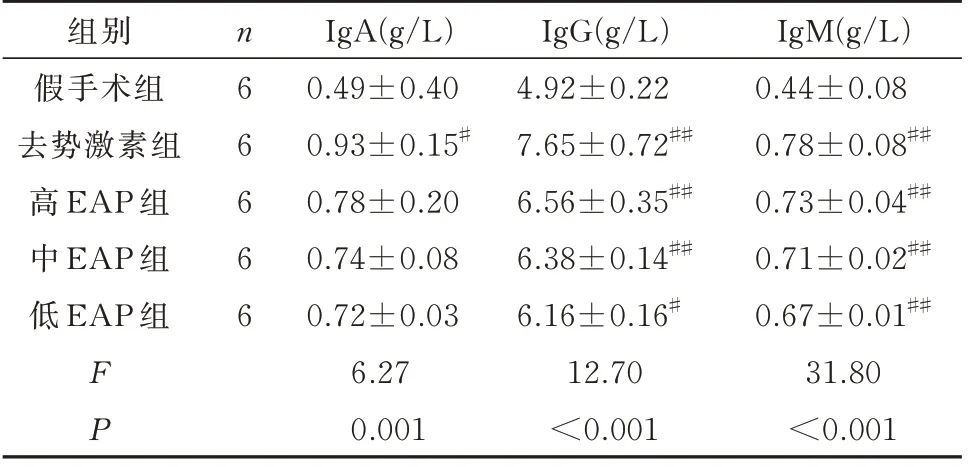
表3 各组大鼠血清IgA、IgG、IgM 水平比较(±s)Tab 3 Comparison of serum IgA,IgG and IgM levels of rats in each group(±s)
注:与假手术组相比,# P<0.05;## P<0.01。
组别假手术组去势激素组高EAP 组中EAP 组低EAP 组IgM(g/L)0.44±0.08 0.78±0.08##0.73±0.04##0.71±0.02##0.67±0.01##31.80<0.001 n66666 FP IgA(g/L)0.49±0.40 0.93±0.15#0.78±0.20 0.74±0.08 0.72±0.03 6.27 0.001 IgG(g/L)4.92±0.22 7.65±0.72##6.56±0.35##6.38±0.14##6.16±0.16#12.70<0.001
2.5 各组大鼠血清炎症因子的比较
与假手术组相比,去势激素组IL-1β、TNF-α、CRP、IL-10 未见明显差异(P>0.05);与假手术组相比,低EAP 组大鼠IL-1β、TNF-α、CRP、IL-10 均显著变化,差异具有极显著差异(P<0.01),中EAP 组大鼠IL-1β、TNF-α 具有统计学意义(P<0.05);高EAP 组大鼠各指标未见显著差异(P>0.05);高、中、低EAP 组组间对比,以低EAP 组大鼠指标变化最为敏感,极显著差异(P<0.01)。见表4。
表4 各组大鼠血清IL-1β、IL-10、TNF-α、CRP 水平比较(±s)Tab 4 Comparison of serum IL-1β,IL-10,TNF-α and CRP levels of rats in each group(±s)

表4 各组大鼠血清IL-1β、IL-10、TNF-α、CRP 水平比较(±s)Tab 4 Comparison of serum IL-1β,IL-10,TNF-α and CRP levels of rats in each group(±s)
注:与假手术组相比,# P<0.05;## P<0.01。
CRP(mg/L)6.39±0.42 6.07±0.84 6.96±0.39 7.86±0.83 9.38±1.64##10.84<0.001组别假手术组去势激素组高EAP 组中EAP 组低EAP 组n66666 FP IL-1β(pg/mL)21.25±1.48 21.77±2.88 25.89±3.34 28.96±4.96#35.30±3.83##14.13<0.001 IL-10(pg/mL)14.04±0.53 15.11±0.81 13.24±0.72 11.77±0.61##10.38±0.69##37.82<0.001 TNF-α(pg/mL)49.84±13.02 51.12±10.01 58.59±9.38 65.05±3.83 72.61±4.83##7.36<0.001
2.6 各组大鼠前列腺组织激素水平的比较
与假手术组分别相比,去势激素组、高EAP 组大鼠T 水平均未见显著差异(P>0.05),中EAP 组大鼠T 水平明显降低,差异具有显著差异(P<0.05),低EAP 组大鼠T 水平均具有极显著差异(P<0.05);高、中、低EAP 组组间以低EAP 组大鼠T水平变化最为明显(P<0.05)。见表5。
表5 各组大鼠前列腺组织T 水平比较(ng/mL,±s)Tab 5 Comparison of T levels in prostate tissue of rats in each group(ng/mL,±s)

表5 各组大鼠前列腺组织T 水平比较(ng/mL,±s)Tab 5 Comparison of T levels in prostate tissue of rats in each group(ng/mL,±s)
注:与假手术组相比,# P<0.05,## P<0.01。
组别假手术组去势激素组高EAP 组中EAP 组低EAP 组n66666 T 1.01±0.05 0.93±0.65 0.87±0.42 0.88±0.31#0.67±0.03##0.84 0.54 FP
3 讨论
CNP 是泌尿外科常见病,临床病因和发病机制仍未阐明,常规西药治疗也存在局限性,因此建立理想合适的、模拟人类CNP 发病机制及病理状态的动物模型大鼠具有很重要的意义。
去势结合雌激素诱导慢性非细菌性前列腺炎大鼠模型特点,免疫因素CNP 大鼠模型主要包括去势结合雌激素诱导CNP 模型、自身免疫反应诱导CNP 模型、自发性CNP 模型等。自发性CNP 模型选用老年雄性大鼠自发产生CNP,虽然病理表现与临床相似,病理特异性良好,稳定性良好,但因对大鼠种类和周龄要求严格,造模时间长,成本高,个体偏差大,模型难以复制等缺点限制其在实验研究中的应用,目前相关文献中选用该模型进行实验研究十分罕见。去势结合雌激素方法可致大鼠体内睾酮激素水平失衡,一氧化氮合酶增高,引起前列腺组织局部免疫机能亢进,介导免疫炎症反应,造成前列腺组织细胞损伤,形成CNP,较自发性CNP 模型造模方法简单、造模成本低,且病理变化不劣于CNP 模型,此外在模型持续时间、稳定性方面也具有优良特性。该方法的主要缺点在于是该模型产生原理尚有商榷之处,是单纯雄激素剥夺和雌激素治疗、亦或是自发性或基因型多因素结合促使产生炎症并不清楚;并且此模型严重影响大鼠体内激素水平,大鼠经过去势,理论上睾酮急剧下降,但是否因此体内产生负反馈作用仍未可知,因此有激素水平评估或性功能检测要求时,该类动物模型并不适合[9]。本研究去势结合雌激素诱导CNP 大鼠模型发现,去势激素组大鼠T 与假手术组相较虽然有所下降,但未见统计学意义,这可能大鼠体内肾上腺弥补部分功能有关。
自身免疫反应诱导慢性非细菌性前列腺炎大鼠模型特点,通过纯化前列腺蛋白刺激诱导CNP 是制备CNP 大鼠模型的常用方法,原理为同种别雄性附性腺匀浆液可诱发大鼠产生自身免疫反应,从而选择性地诱导细胞免疫及前列腺间隙单个核细胞浸润,形成CNP。此类造模方法操作简便,模型维持时间与去势结合雌激素方法相当,但较为繁琐的是前期需搜取大鼠前列腺制备蛋白匀浆。目前大多文献对蛋白匀浆液浓度以及注射时间的选择,尚未形成统一共识,尽管在相关规范草案中推荐选用20 mg/mL[7],连续注射45 d 的方法制备CNP 大鼠模型,但并未指出这一推荐的具体依据。Galmarini等[10]采用大鼠雄性副腺提取物配制成15 mg/mL 的蛋白匀浆液和完全弗氏佐剂等比配成1 mL 于 0,30和 45 d 对 Wistar 大鼠进行多点注射,每7 d 对大鼠细胞免疫反应动力学进行研究,发现所有大鼠在第35、42、49 天时靶器官出现明显的组织学改变,前列腺及附腺产生炎症反应,小血管周围存在单核细胞浸润。周晓辉等[11]在此方法上进一步探索,采用第0 天和30 天多点注射的方法,发现注射蛋白匀浆液为 15 mg/mL 时大鼠可在45 d 后形成 CNP 模型,而浓度为 5 mg/mL、10 mg/mL 时均未出现明显病理改变和炎症反应。宋国宏等[12]选用20、40、60 和80 mg/mL 的蛋白匀浆液研究浓度与大鼠模型成功率的量效关系,各组分别第0 天和第30 天多点皮下注射 1 次,结果显示蛋白匀浆液浓度40、60 mg/mL两组造模 45 d 后能产生较好炎症反应且保持稳定。综上而言,目前常用大鼠前列腺蛋白匀浆液浓度有15、40、60 mg/mL 可供选择,和完全弗氏佐剂1∶1 配比成1 mL 后多点注射,注射间隔时间少到1 d 1 次、注射45 次,长至15 d 1 次、注射2~3 次;SD 大鼠或Wistar 大鼠均可形成EAP 模型。本研究采40、20、10 mg/mL 三种浓度构建大鼠CNP 模型,造模后可见三组免疫球蛋白指标未见明显变化;与假手术组相比,10 mg/mL 组炎症因子指标IL-1β、TNF-α、CRP、IL-10 明显改变,20 mg/mL 组病理变化更为明显。
两种模型在造模过程中均出现进食及饮水量较假手术组减少,体质量降低,去势激素组前列腺指数显著性下降。其中去势激素组模型死亡2 只,考虑大鼠可能对规定麻醉剂量不耐受而死亡;高EAP 组死亡2 只,可能与伤口感染、大鼠同类撕咬有关。
两种模型病理均有不同程度改变,其中去势激素组前列腺指数腺体结构破坏、腺腔弥漫性分布炎性细胞,变化最为明显;高、中、低EAP 组病理变化各有优劣,中EAP 组大鼠腺体结构破坏、炎性细胞浸润较多,3 组较假手术组有明显改变,但仍逊于去势激素组。两种模型比较,去势激素组造模更符合CNP 的病理变化,炎性细胞浸润较高、中、低EAP 3组均明显。
前列腺组织炎症病理评分以去势激素组上升变化最为明显,相较于假手术组和自身免疫组,去势激素组炎性细胞、成纤维细胞、腺腔大小、腺腔内分泌物均可见明显异常;相较假手术组,高、中、低EAP 组未见显著差异;高、中、低EAP 组组间差异亦未有统计学意义。
血清免疫球蛋白IgA[13]、IgG[14]、IgM[15]是检测大鼠是否产生免疫反应的重要指标。IgA 分布于机体黏膜局部,是抗感染免疫的第一防线;IgG 能够激活补体、吞噬病菌、中和毒素,是感染免疫的主要力量,并且能在体内维持较长时间;IgM 是机体受感染的标志物,受到抗原刺激后会第一时间激活免疫应答反应,在早期机体免疫防御中意义重大,因此血清免疫球蛋白水平高低也提示CNP 免疫反应的强弱。本研究发现去势激素组和高、中、低EAP 组大鼠IgA、IgG、IgM 水平较假手术组均有不同程度上升,其中以去势激素组大鼠变化最为明显,差异均具有显著意义(P<0.05)。
促炎性细胞因子包括IL-1β[16]、TNF-α[17]、CRP[18]等,在炎症中起到促进作用,加速细胞间黏附因子表达、增加前列腺素,造成前列腺组织局部损伤;抗炎性细胞因子IL-10 可强烈抑制单核巨噬细胞,减少炎症介质产生,达到修复组织的功能[19]。本研究中相较假手术组,低EAP 组大鼠IL-1β、IL-10、TNF-α、CRP 均显著变化,差异均具有统计学意义(P<0.05),去势激素组未见明显差异(P>0.05)。
雄激素对前列腺正常发育起主导作用,具有抑制体液免疫的作用,当雄激素含量水平降低,便可诱发自身免疫反应的发生[20]。本研究中相较假手术组,中、低EAP 组大鼠T 水平均具有统计学意义(P<0.05),去势激素组大鼠T 水平亦有所下降,但未见明显差异(P>0.05)。
综上所述,去势结合雌激素诱导法和自身免疫反应诱导法均可成功构建CNP 模型。一般情况方面去势激素组前列腺指数明显下降;病理方面,去势激素组可导致明显的腺体破坏、间质水肿,前列腺组织炎性细胞浸润十分明显,更符合CNP 的病理变化;免疫指标中,去势激素组大鼠优于高、中、低EAP 组;在炎症因子指标中及性激素指标中,低EAP 组(10 mg/mL)大鼠明显优于其他各组变化。根据制备草案计算权重[7],可得去势激素组CNP 模型总积分为0.81,高、中、低EAP 组分别为0.62、0.73、0.67分,根据本研究结果,一般情况下,去势结合雌激素诱导法造模是两者之间更为合适的一种方法。具体而言,去势结合雌激素诱导法更适合研究CNP 病理及免疫应答反应变化,更适用于研究CNP 长期改变;而对于研究CNP炎症因子指标及性激素指标,10 mg/mL 的前列腺蛋白匀浆液是制备大鼠CNP 更为合适的理想浓度,更适用于研究CNP 早期炎症指标变化。
作者贡献度说明:
唐益文、王雄:负责造模实验、数据整理、统计及文章书写;周艳艳、陈豪特、张泽家、王忠:协助实验进行以及核对实验数据;高庆和、刘建刚:负责理论指导、审阅文章;高瞻:工作支持,提供经费。
所有作者声明无利益冲突关系。
