牙周炎伴类风湿性关节炎患者牙龈浆细胞表型及RANKL 表达特点分析
2023-07-18于程程韩亚琨
于 艳, 于程程, 韩亚琨
(吉林医药学院附属医院口腔科,吉林 吉林 132013)
牙周炎是牙周致病菌感染所引发的牙周支持组织进行性破坏性疾病[1]。除牙龈组织炎症外,牙周炎患者还表现出典型的牙槽骨吸收和牙周袋形成。牙周炎晚期患者还会出现宿主牙齿松动和脱落[2]。除影响口腔功能外,牙周炎也被证实与多种系统性疾病存在交互作用[3]。类风湿性关节炎(rheumatoid arthritis,RA)是一种以关节区骨组织破坏和炎症性滑膜为主要临床症状的关节炎症[4]。RA 可累及手、足、肩、膝甚至颞下颌等关节部位,除引发关节畸形和功能障碍外,还可伴发心、肾和肺等多器官功能异常[5]。研究[6]发现:牙周炎和RA 之间存在相关性。相比于普通患者,RA患者的牙周炎发病率更高且进展更为迅速,牙周炎的治疗也可在一定程度上促进RA 的缓解,但牙周炎和RA 在病理机制上的内在联系尚未完全阐明[7]。研究[8]发现:B 淋巴细胞介导的骨免疫在牙周炎和RA 的骨破坏进程中均发挥了重要作用。作为B 淋巴细胞的重要功能性亚群,浆细胞既可分泌抗体参与体液免疫,也可表达多种细胞因子调节免疫反应[9]。浆细胞是牙周炎患者局部核因子κB 受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)等多种骨免疫因子的主要来源[10]。RANKL 可与位于前破骨细胞表面的核因子κB 受体活化因子(receptor activator of nuclear factor-κB,RANK)结合,并进一步诱导破骨细胞的分化和成熟。该机制在牙槽骨炎症性破坏中发挥了重要作用[11]。国外研究[12]也证实了浆细胞在RA 病程中有同样的效应。采用B 淋巴细胞拮抗疗法可有效抑制关节区的炎症反应并抑制骨组织的破坏[13]。因此,浆细胞的增殖活化和RANKL表达可能是牙周炎与RA 间的潜在交互机制。本研究采用临床评价、免疫分析和细胞实验等多种方法分析不同类型研究对象牙周临床指标、牙龈浆细胞表型特点及RANKL 表达情况,评价牙龈组织中增殖 诱 导 配 体 (a proliferation-inducing ligand,APRIL)及B 淋巴细胞刺激因子(B lymphocyte stimulator,BLyS)等B 淋巴细胞生长分化效应因子表达水平,为探讨牙周炎与RA 的致病机制及交互作用提供参考。
1 资料与方法
1.1 研究对象选择2019 年1 月—2019 年12 月于吉林医药学院附属医院口腔科就诊的研究对象60 例。纳入标准:① 年龄18~60 岁;② 无系统性疾病、口腔基本健康且余留牙不少于20 颗;③ 近期无重大手术和近半年未接受过牙周治疗;④ 3 个月内无抗生素、非甾体药物和免疫调节剂服药史;⑤非妊娠期或哺乳期女性;⑥无其他不能配合本项研究的因素。将60 例研究对象按入组标准分为健康组、牙周炎组和牙周炎+RA 组,每组20 例。健康组:符合纳入标准,且牙周组织健康;牙周炎组:符合纳入标准,且明确诊断为慢性牙周炎(依据1999 年美国牙周病分类研讨会标准[14]);牙周炎+RA 组:符合纳入标准,且明确诊断为慢性牙周炎,明确诊断为RA(依据1987 年美国风湿病学会标准[15])。
1.2 主要试剂和仪器RPMI 1640 培养基(美国赛默飞公司),PBS 缓冲液(北京索莱宝公司),流式细胞术抗体CD38、CD138 和RANKL(美国BD公司),青-链霉素双抗(北京索莱宝公司),实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(美国普洛麦格公司),抗酒石酸酸性磷酸酶 (tartrate-resistant acid hosphatase,TRAP)染色试剂盒(美国西格玛公司),淋巴细胞分离液(武汉云克隆公司)。RTqPCR 仪(美国ABI 公司),恒温CO2培养箱(美国Labconco 公司),流式细胞仪(美国BD 公司),酶标仪(德国珀金埃尔默公司)。
1.3 牙周指标评价牙周指标包括各组研究对象余留牙的牙龈指数(gingiva index,GI)、牙周袋探诊深度(probing depth,PD)、探诊出血指数(bleeding on probing,BOP)和临床附着丧失量(clinical attachment loss,CAL)。所有评价均由同一医师采用双盲模式完成。记录上述指标并进行对比分析。
1.4 RT-qPCR 法检测各组研究对象牙龈组织中APRIL 和BLyS mRNA 表达水平健康组研究对象取拔除智齿时或口内手术时切除的健康牙龈,牙周炎组和牙周炎+RA 组患者取病变不保留患牙的牙龈组织。制备单细胞悬液,裂解细胞并提取总RNA,采用逆转录法制备cDNA,采用RT-qPCR法检测各组研究对象牙龈组织中APRIL 和BLyS mRNA 表达水平。引物序列:APRIL F 5′-GGGGGGCAGTTCTGGGGGCT-3′,R 5′-CCAGGCTCCCAGGACATCAGG-3′;BLyS F 5′-TGCCACCACCGCGCCTCTGT-3′,R 5′-CGCGGACAACCCTGGAGCCC-3′。反应条件:95 ℃、30 s;95 ℃、5 s;60 ℃、30 s;95 ℃、15 s;60 ℃、1 min;95 ℃、15 s;60 ℃、15 s;共40 个循环。采用2-ΔΔCt法计算各组研究对象牙龈组织中目的基因表达水平。
1.5 流式细胞术检测各组研究对象牙龈组织中CD38+和CD138+细胞百分率按“1.3”步骤方法获取各组研究对象牙龈组织,制备单细胞悬液。采用密度梯度离心分离牙龈组织中的淋巴细胞,采用CD19 磁珠分选法提取总淋巴细胞中的B 淋巴细胞。采用流式细胞术检测各组研究对象牙龈组织中CD38+和CD138+细胞百分率。
1.6 流式细胞术和酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)法检测各组研究对象牙龈浆细胞中RANKL+细胞百分率和细胞培养上清液中RANKL 水平取上述分选的牙龈浆细胞置于RPMI 1640 培养基中,并按20 μg·L-1加入佛波醇12-十四酸酯13-乙酸酯,于37 ℃、5%CO2条件下培养72 h。离心法分离培养基上清液和细胞。采用流式细胞术检测各组细胞中RANKL+细胞百分率,采用ELISA 法检测各组细胞培养基上清液中RANKL 水平。
1.7 TRAP 染色观察各组研究对象破骨样细胞生长情况取同源外周血单核细胞作为前破骨细胞,置于“1.6”步骤中分离的培养基上清液中培养。于培养基内加入 25 μg·L-1巨噬细胞集落刺激因子,将正常诱导破骨样细胞作为anti-RANKL 对照组。所有细胞于37 ℃、5%CO2条件下培养72 h 后,采用TRAP 染色观察培养基内破骨样细胞生成情况,记录并分析各组研究对象破骨样细胞数。
1.8 RT-qPCR 法检测各组研究对象牙龈浆细胞中RANKL 、RANK 和肿瘤坏死因子受体相关分子6(tumor necrosis factor receptor associated factor 6,TRAF6)mRNA表达水平按“1.6”和“1.7”步骤中方法收集各组研究对象牙龈浆细胞,RT-qPCR法检测各组研究对象牙龈浆细胞中RANKL、RANK 和TRAF6 mRNA 表达水平。反应条件同“1.4”步骤。引物序列:RANKL F 5′-CAGCACTCACTGCTTTTATAGAATCC-3′,R 5′-AGCTGAAGATAGTCTGTAGGTACGC-3′;RANK F 5′-AGATCGCTCCTCCATGTACCA-3′,R 5′-GCCTTGCCTGTATCACAAACTTT-3′;TRAF6,F 5′-ATGCGGCCATAGGTTCTGC-3′,R 5′-TCCTCAAGATGTCTCAGTTCCAT-3′。采用2-ΔΔCt法计算各组研究对象牙龈浆细胞中目的基因表达水平。
1.9 统计学分析采用GraphPad Prism 8 统计软件进行统计学分析。各组研究对象GI、PD、BOP和CAL,牙龈组织中APRIL 和BLyS mRNA 表达水平,CD38+细胞、CD138+细胞和RANKL+细胞百分率,破骨样细胞数,牙龈浆细胞中RANKL、RANK 和TRAF6 mRNA 表达水平均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组研究对象临床牙周指标与健康组比较,牙周炎组和牙周炎+RA 组患者GI、PD、BOP 和CAL 均升高(P<0.05)。与牙周炎组比较,牙周炎+RA 组患者GI 和BOP 差异无统计学意义(P>0.05),PD 和CAL 升高(P<0.05)。见表1。
表1 各组研究对象GI、PD、BOP 和CALTab.1 GI, PD, BOP,and CAL of subjects in various groups(n=20,±s)

表1 各组研究对象GI、PD、BOP 和CALTab.1 GI, PD, BOP,and CAL of subjects in various groups(n=20,±s)
*P<0.05 compared with health group;△P<0.05 compared with periodontitis group.
Group Health Periodontitis Periodontitis+RA CAL(l/mm)1.20±0.44 4.20±1.48*4.80±1.64*△GI 0.40±0.55 2.40±0.89*2.60±0.55*PD(l/mm)2.00±1.00 5.40±1.82*6.40±2.41*△BOP 2.00±1.58 13.80±3.11*12.00±3.81*
2.2 各组研究对象牙龈组织中APRIL 和BLyS mRNA 表达水平与健康组比较,牙周炎组和牙周炎+RA 组患者牙龈组织中APRIL 和BLyS mRNA 表达水平均升高(P<0.05)。与牙周炎组比较,牙周炎+RA 组患者APRIL mRNA 表达水平升高(P<0.05)。见表2。
表2 各组研究对象牙龈组织中APRIL 和BLyS mRNA 表达水平Tab.2 Expression levels of APRIL and BLyS mRNA in gingiva tissue of subjects in various groups (n=20,±s)

表2 各组研究对象牙龈组织中APRIL 和BLyS mRNA 表达水平Tab.2 Expression levels of APRIL and BLyS mRNA in gingiva tissue of subjects in various groups (n=20,±s)
*P<0.05 compared with health group;△P<0.05 compared with periodontitis group.
BLyS mRNA 1.00±0.00 10.20±1.48*10.70±2.09*Group Health Periodontitis Periodontitis+RA APRIL mRNA 1.00±0.00 5.94±1.52*7.95±1.01*△
2.3 各组研究对象牙龈组织中CD38+ 和CD138+细胞百分率与健康组比较,牙周炎组和牙周炎+RA 组患者牙龈组织中CD38+ 和CD138+细胞百分率升高(P<0.05)。与牙周炎组比较,牙周炎+RA 组患者牙龈组织中CD38+细胞百分率差异无统计学意义(P>0.05),CD138+细胞百分率升高(P<0.05)。见表3。
表3 各组研究对象牙龈组织中CD38+和CD138+细胞百分率Tab.3 Percentages of CD38+ and CD138+ cells in gingiva tissue of subjects in various groups(n=20,±s,η/%)

表3 各组研究对象牙龈组织中CD38+和CD138+细胞百分率Tab.3 Percentages of CD38+ and CD138+ cells in gingiva tissue of subjects in various groups(n=20,±s,η/%)
*P<0.05 compared with health group;△P<0.05 compared with periodontitis group.
Percentage of CD138+ cells 15.70±6.97 33.90±7.51*38.30±5.35*△Group Health Periodontitis Periodontitis+RA Percentage of CD38+ cells 21.80±5.32 53.20±10.10*54.90±7.86*
2.4 各组研究对象牙龈浆细胞中RANKL+细胞百分率和RANKL水平 与健康组比较,牙周炎组和牙周炎+RA 组患者牙龈浆细胞中RANKL+细胞百分率升高(P<0.05);与牙周炎组比较,牙周炎+RA 组患者牙龈浆细胞中RANKL+细胞百分率升高(P<0.05)。与健康组比较,牙周炎组和牙周炎+RA 组患者牙龈浆细胞中RANKL 水平升高(P<0.05);与牙周炎组比较,牙周炎+RA组患者牙龈浆细胞中RANKL 水平差异无统计学意义(P>0.05)。见表4。
表4 各组研究对象牙龈浆细胞中RANKL+细胞百分率和RANKL 水平Tab.4 Percentages of RANKL+cells and RANKL levels in plasma cells of gingiva of subjects in various groups(n=20,±s)
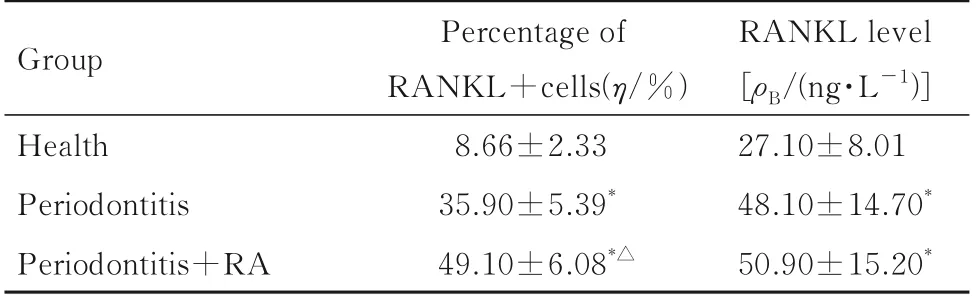
表4 各组研究对象牙龈浆细胞中RANKL+细胞百分率和RANKL 水平Tab.4 Percentages of RANKL+cells and RANKL levels in plasma cells of gingiva of subjects in various groups(n=20,±s)
*P<0.05 compared with health group;△P<0.05 compared with periodontitis group.
RANKL level[ρB/(ng·L-1)]27.10±8.01 48.10±14.70*50.90±15.20*Group Health Periodontitis Periodontitis+RA Percentage of RANKL+cells(η/%)8.66±2.33 35.90±5.39*49.10±6.08*△
2.5 各组研究对象TRAP+破骨样细胞数破骨诱导实验中,各组培养基均可诱导TRAP+破骨样细胞生成。正常诱导破骨样细胞中,与健康组比较,牙周炎组和牙周炎+RA 组培养基诱导生成的正常诱导TRAP+破骨样细胞数增加(P<0.05);与牙周炎组比较,牙周炎+RA 组培养基诱导生成的正常诱导TRAP+破骨样细胞数增加(P<0.05)。与正常诱导破骨样细胞比较,各组anti-RANKL 诱导的TRAP+破骨样细胞数均减少(P<0.05)。见表5。
表5 不同培养基诱导的各组破骨样细胞数Tab.5 Numbers of osteoclasto-like cells in various groups after induced with different kinds of medium (n=20,±s)
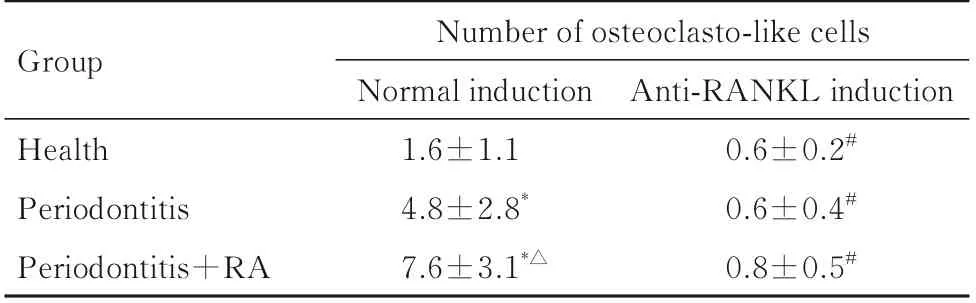
表5 不同培养基诱导的各组破骨样细胞数Tab.5 Numbers of osteoclasto-like cells in various groups after induced with different kinds of medium (n=20,±s)
*P<0.05 compared with health group;△P<0.05 compared with periodontitis group;#P<0.05 compared with normal induction.
Group Number of osteoclasto-like cells Normal induction 1.6±1.1 4.8±2.8*7.6±3.1*△Anti-RANKL induction 0.6±0.2#0.6±0.4#0.8±0.5#Health Periodontitis Periodontitis+RA
2.6 各组研究对象牙龈浆细胞中RANKL、RANK和TRAF6 mRNA 表达水平与健康组比较,牙周炎组和牙周炎+RA 组患者牙龈浆细胞中RANKL、RANK 和TRAF6 mRNA 表达水平均升高(P<0.05);与牙周炎组比较,牙周炎+RA 组患者牙龈浆细胞中RANKL、RANK 和TRAF6 mRNA 表达水平均升高(P<0.05)。见表6。
表6 各组研究对象牙龈浆细胞中RANKL、RANK 和TRAF6 mRNA 表达水平Tab.6 Expression levels of RANKL,RANK,and TRAF6 mRNA in plasma cells in gingiva of subjects in various groups(n=20,±s)
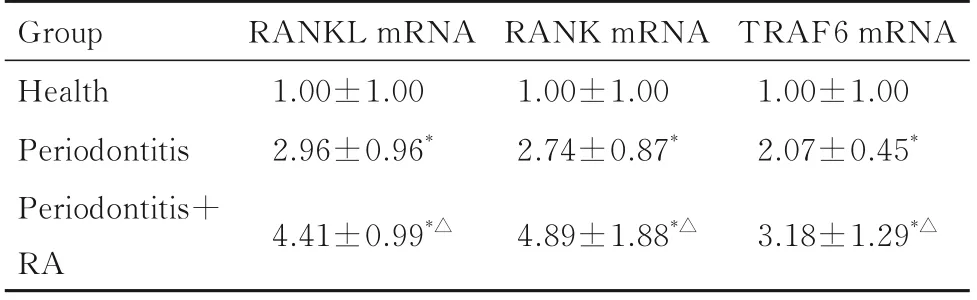
表6 各组研究对象牙龈浆细胞中RANKL、RANK 和TRAF6 mRNA 表达水平Tab.6 Expression levels of RANKL,RANK,and TRAF6 mRNA in plasma cells in gingiva of subjects in various groups(n=20,±s)
*P<0.05 compared with health group;△ P<0.05 compared with periodontitis group.
Group Health Periodontitis Periodontitis+RA RANKL mRNA 1.00±1.00 2.96±0.96*RANK mRNA 1.00±1.00 2.74±0.87*TRAF6 mRNA 1.00±1.00 2.07±0.45*4.41±0.99*△4.89±1.88*△3.18±1.29*△
3 讨 论
牙周炎和RA 累及部位不同,但二者在发病机制和骨破坏形式上存在较多共同点。研究[16]表明:牙周炎与RA 间可能存在着交互作用,相较于单纯牙周炎患者,RA 患者不仅罹患牙周炎的概率更高,其牙龈组织炎症和牙槽骨吸收等临床指标进展也更为迅速。提示RA 对牙周炎存在潜在的促进作用。本研究结果表明:RA 增加牙周炎患者的CAL和PD,提示RA 进一步加剧了牙周炎导致的牙槽骨吸收。
B 淋巴细胞在牙周炎和RA 的病理进程中发挥了重要的作用。研究[17]表明:B 淋巴细胞浸润与牙槽骨及关节骨的侵蚀性破坏呈显著正相关关系。作为B 淋巴细胞最主要的功能性亚群,浆细胞不仅可表达特异抗体参与体液免疫,也同时分泌多种细胞因子参与多项炎症反应的调节。本研究结果显示:牙周炎组患者CD38+和CD138+细胞百分率均明显高于健康组研究对象。与牙周炎组比较,牙周炎+RA 组患者牙龈浆细胞中CD138+细胞百分率升高,提示RA 可进一步促进牙周组织内的浆细胞成熟。RA 患者局部自免疫反应导致Th 细胞大量活化,Th 细胞可经循环系统流至牙周组织,诱导牙龈浆细胞的分化和成熟[18]。同时,在RA 病灶区活化的浆细胞也可入血,并在趋化因子的作用下进入牙周组织参与炎症反应。这种双重效应导致了牙周炎伴RA 患者牙周局部成熟浆细胞较单纯牙周炎患者数量更多且效能更强。除抗体分泌外,B 淋巴细胞也是牙周炎病灶内RANKL 的主要来源。在RA 病灶内,B 淋巴细胞也被证实可提供大量的RANKL 并主要诱导破骨细胞的分化[19]。本研究结果显示:与健康组比较,牙周炎组和牙周炎+RA 组患者牙龈浆细胞中RANKL mRNA 表达水平升高;与牙周炎组比较,牙周炎+RA 组患者牙龈浆细胞中RANKL mRNA 表达水平更高,这可能与浆细胞的成熟度密切相关。CD138+与RANKL 呈正相关关系,升高成骨细胞CD138+表达水平,其RANKL 水平也随之上升,反之亦然[20]。这种分子间的交互作用可能是CD138+在成熟浆细胞中RANKL 表达上调的机制之一。作为破骨细胞分化中最重要的调控信号,RANKL/RANK 通路参与了牙槽骨的破坏调节[21]。该效应在牙周炎和牙周炎伴RA 患者中均有体现[22]。在本研究中,牙周炎和牙周炎+RA 组患者牙龈浆细胞均通过表达RANKL 促进了破骨样细胞的分化,这与先前的研究结果一致[23]。与牙周炎组比较,牙周炎+RA 组患者牙龈浆细胞经RANKL/RANK 通路调控,破骨样细胞分化的能力更强,可能是牙周炎伴RA 患者临床上牙槽骨吸收更严重的内在因素之一。
除细胞作用外,局部组织中APRIL 和BLyS mRNA 表达水平升高也是RA 伴牙周炎患者牙龈浆细胞表型变化的诱导因素。本研究结果显示:CD138+细胞百分率升高,且牙龈组织中APRIL和BLyS mRNA 表达水平升高。APRIL 是B 淋巴细胞分化成熟过程中的重要因子[24]。牙周致病菌可通过Toll 样受体信号刺激牙龈上皮促使其分泌APRIL[25]。本研究结果显示:APRIL 多出现于上皮下方的炎症区域,其分布与浆细胞广泛重叠。该区域也是BLyS 的主要分布区,提示APRIL 和BLyS 可在牙周炎病程中富集于炎症区域,诱导浆细胞的分化与成熟。此外,APRIL 和BLyS mRNA表达水平与RANKL+细胞百分率呈正相关关系。研究[26]显示:牙龈组织浆细胞和RANKL+细胞百分率降低,牙槽骨吸收也有所缓解。本研究结果显示:RA 使牙周炎患者牙龈组织中APRIL mRNA表达水平升高。APRIL 是活动期RA 的特异性标记物之一。在RA 患者的血清中,APRIL 水平较高,APRIL+单核细胞水平也升高[27]。当RA 患者罹患牙周炎时,血清中的APRIL 迁移至牙龈组织,进一步诱导牙龈浆细胞的发育成熟,并分泌RANKL等骨免疫因子,介导骨破坏。
综上所述,牙周炎伴RA 患者牙龈组织浆细胞的成熟度和表达RANKL 的能力更强,可能是加剧牙周炎伴RA 患者牙槽骨吸收的因素之一。上述效应与牙周炎伴RA 患者牙龈组织中促B 淋巴细胞生长因子APRIL 和BLyS 表达水平升高有关。
