槐耳清膏对乳腺癌他莫昔芬耐药细胞的影响及其作用机制
2023-07-18薛姣姣张毓秀代贺阳张丽霞郭少伟张晶晶李庆霞
薛姣姣, 郝 磊, 张毓秀, 代贺阳, 张丽霞, 郭少伟, 张晶晶, 李 阳, 李庆霞
(1.河北省人民医院肿瘤四科,河北 石家庄 050000;2.河北医科大学研究生院,河北 石家庄 050000;3.南方医科大学第七附属医院肿瘤防治科,广东 佛山 528200;4.华北理工大学研究生院,河北 唐山063000;5.河北省人民医院保健处,河北 石家庄 050000)
目前乳腺癌已成为全球发病率排名第一位的癌症和全球第五大死亡原因[1]。乳腺癌中雌激素受体(estrogen receptor,ER)阳性患者约占70%,雌激素与ER 结合后使其活化,在乳腺癌扩增基因1(amplified in breast cancer 1,AIB1)等共激活因子的辅助下启动靶基因的转录[2-3]。他莫昔芬(tamoxifen,TAM)是ER 阳性乳腺癌患者使用最多的抗雌激素药物,其通过竞争性干扰雌激素与ER 结合,而阻断雌激素受体α(estrogen receptor α,ERα)的信号传导[4]。临床上接受TAM 治疗的乳腺癌患者约有30%会出现继发性耐药,从而导致肿瘤的复发和转移[5]。AIB1 扩增代表肿瘤分级较高、预后较差和TAM 耐药[6]。survivin 在多种肿瘤组织中高表达,研究[7]发现:survivin 与乳腺癌内分泌耐药有关。通过调控ERα、AIB1 和survivin 蛋白可调节乳腺癌TAM 耐药LCC2 细胞的增殖、凋亡及其对TAM 的耐药性,可能对乳腺癌TAM 耐药患者的治疗提供一定的参考价值。
槐耳是常用的中药材,槐耳清膏(Huaier aqueous extract,HAE)是槐耳的水溶性提取物,其主要组分是蛋白多糖,因其疗效好和安全性高等特点已被广泛应用于多种恶性肿瘤的治疗[8-9]。研究[10]报道:在ER 阳性乳腺癌中,HAE 可通过失活hedgehog 通路干扰ERα 信号传导,从而抑制乳腺癌干细胞的自我更新活性。然而关于HAE 在乳腺癌TAM 耐药方面的研究较少。本研究以MCF-7和LCC2 细胞为研究对象,探讨HAE 调控ERα、AIB1 及survivin 蛋白对LCC2 细胞增殖、迁移和凋亡等功能的影响,为槐耳未来应用于乳腺癌TAM耐药的辅助治疗提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人乳腺癌TAM 敏感MCF-7 细胞由中国医学科学院肿瘤研究所馈赠,人乳腺癌TAM 耐药LCC2 细胞由美国托马斯杰斐逊大学肿瘤生物学研究所馈赠。HAE 购自江苏启东盖天力药业有限公司,将精确称量的HAE 用DMEM 基础培养基配成20 g·L-1母液,采用孔径为0.22 μm 的滤器过滤除菌后置于4 ℃冰箱保存供1 周内使用[11];TAM 购自美国Med Chem Express公司,Transwell 小室购自美国 Corning 公司,细胞周期检测试剂盒购自上海碧云天生物技术有限公司,细胞凋亡检测试剂盒购自杭州联科生物科技有限公司,MTT 和二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自北京索莱宝生物科技有限公司,ECL 发光液购自上海Biosharp 有限公司,β-actin、ERα、AIB1 和survivin 多克隆抗体购自武汉三鹰生物技术有限公司。流式细胞仪购自美国Beckman Coulter 公司,酶联免疫检测仪购自芬兰Labsystems 公司。
1.2 细胞培养和分组LCC2 细胞和MCF-7 细胞经37 ℃水浴复苏后,采用含10%胎牛血清(fetal bovine serum,FBS)的DMEM 高糖培养基重悬,并在37 ℃、5% CO2培养箱中培养。实验设置对照组(给予DMEM 基础培养基)、TAM 组(给予2 μmol·L-1TAM)、TAM+HAE组(给予2 μmol·L-1TAM+4 g·L-1HAE)和0、2、4、8 及16 g·L-1HAE 组。
1.3 MTT 法检测各组细胞存活率消化细胞后,以每孔4×103个细胞的密度接种于96 孔细胞培养板,细胞培养24 h 后加入不同浓度HAE(0、2、4、8 和16 g·L-1)工作液200 μL,每组至少3 个复孔。分别培养24 和48 h 后弃去药液,每孔加入20 μL、0.5% MTT 溶液,继续培养4 h 后吸去孔内培养液,每孔加入150 μL 二甲基亚砜(dimethyl sulfoxide,DMSO),摇床震荡10 min,酶标仪检测各组细胞于波长490 nm 处吸光度(A)值,计算各组细胞存活率。细胞存活率=[(实验组A值-空白组A 值)/(对照组A 值-空白组A 值)]×100%。
1.4 细胞划痕实验检测各组细胞迁移率消化收集细胞,采用含2.5% FBS 的DMEM 培养基混匀后接种于6 孔细胞培养板,24 h 后采用200 μL 枪头垂直划线,加入0 和4 g·L-1HAE 工作液,并于0、24 和48 h 观察拍照。采用Image J 软件的Fiji 模块分析图像,测定各组细胞在不同时间点的迁移面积,并计算各组细胞迁移率。细胞迁移率=[(迁移前面积-迁移后面积)/(迁移前面积)]×100%。
1.5 流式细胞术检测各组不同细胞周期细胞百分率将LCC2 细胞以适当浓度接种于6 cm 培养皿中,24 h 完全贴壁后加入0 和4 g·L-1HAE。培养48 h 后胰酶消化、1 500 r·min-1,离心5 min,收集细胞,预冷乙醇固定,染色30 min 后可上机检测。采用流式细胞仪检测细胞中DNA 含量判定各组在G0/G1期、S 期和G2/M 期细胞百分率。
1.6 流式细胞术检测各组细胞凋亡率将LCC2细胞以适当浓度接种于培养瓶,贴壁后加入0和4 g·L-1HAE,培养48 h 后用无水乙二胺四乙酸(ethylene diamine tetraaceticacid,EDTA)的胰酶消化、离心,收集细胞于1×Binding Buffer 中,Annexin Ⅴ-FITC/PI 染色,暗室孵育5 min 后采用流式细胞术检测,并计算各组细胞凋亡率。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/细胞总数×100%。
1.7 Transwell 小室实验检测各组迁移细胞数接种细胞于6 孔细胞培养板,采用含10%FBS 的培养基培养24 h 后更换为无血清药物工作液,继续培养48 h 后弃去药液,胰酶消化细胞,离心,空白培养基重悬计数,Transwell 小室上室加入150 μL 2×104个细胞悬液,下室加入700 μL 含20%血清的培养基,培养24 h。经甲醇固定、0.1%结晶紫染色和PBS 缓冲液洗涤后置于倒置显微镜下观察并拍照,采用Image J 软件自动计数功能计算各组迁移细胞数。
1.8 Western blotting 法检测各组细胞中ERα、AIB1 和survivin 蛋白表达水平收集培养好的细胞,RIPA 裂解含1% PMSF 和1% 蛋白磷酸酶抑制剂缓冲液裂解蛋白,采用BCA 法测定蛋白浓度,煮沸后取30 μg 蛋白上样量进行SDS-PAGE 电泳转膜,再用5%脱脂奶粉室温封闭2 h。孵育一抗:β-actin (1∶2 000)、ERα (1∶1 000)、AIB1 和survivin(1∶500)4 ℃过夜,1×TBST 溶液洗涤3 次,二抗(1∶5 000)孵育1 h,ECL 试剂发光显影并拍照。采用Image J 软件分析各组细胞蛋白条带灰度值,以β-actin 和GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.9 统计学分析采用SPSS 21.0 统计软件进行统计学分析。各组细胞存活率、细胞迁移率、不同细胞周期细胞百分率、细胞凋亡率、迁移细胞数和细胞中ERα、AIBI 和survivin 蛋白表达水平均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组乳腺癌LCC2 细胞存活率作用24 h 时,与0 g·L-1HAE 组比较,4、8 和16 g·L-1HAE 组细胞存活率明显降低(P<0.01);与4 g·L-1HAE组比较,8 g·L-1HAE 组细胞存活率差异无统计学意义(P>0.05)。作用48 h 时,与0 g·L-1HAE 组比较,2、4、8 和16 g·L-1HAE组细胞存活率明显降低(P<0.01);与4 g·L-1HAE组比较,8 g·L-1HAE 组细胞存活率降低(P<0.05)。与作用24 h 时比较,作用48 h 时,2、4、8 和16 g·L-1HAE 组细胞存活率明显降低(P<0.01)。HAE 作用48 h 的半数抑制浓度(half inhibitory concentration,IC50)为7.13 g·L-1。HAE 呈时间和剂量依赖性抑制乳腺癌LCC2 细胞生长,选择4 g·L-1HAE 进行后续实验。见图1。作用48 h时,与对照组(100%±0.0%)比较,TAM 组细胞存活率(102.00%±1.41%)差异无统计学意义(P>0.05)。与TAM 组(102.00%±1.41%)和4 g·L-1HAE 组(76.00%±1.83%)比较,TAM+HAE 组细胞存活率 (69.50%±2.65%)明显降低(P<0.01)。
2.2 各组细胞迁移率作用24 h 时,与0 g·L-1HAE 组(18.36%±2.95%)比较,4 g·L-1HAE 组细胞迁移率(14.44%±2.48%)差异无统计学意义(P>0.05)。作用48 h 时,与0 g·L-1HAE 组(25.99%±4.05%)比较,4 g·L-1HAE 组细胞迁移 率 (16.21%±3.14%)降 低 (P<0.05)。见图2。

图2 细胞划痕实验检测2 组LCC2 细胞迁移情况Fig.2 Migration of LCC2 cells in two groups detected by cell scratch assay
2.3 各组不同细胞周期细胞百分率作用48 h 时,与0 g·L-1HAE组(14.40%±1.53%)比较,4 g·L-1HAE 组S 期细胞百分率(29.30%±4.60%)明显升高(P<0.01)。见图3。
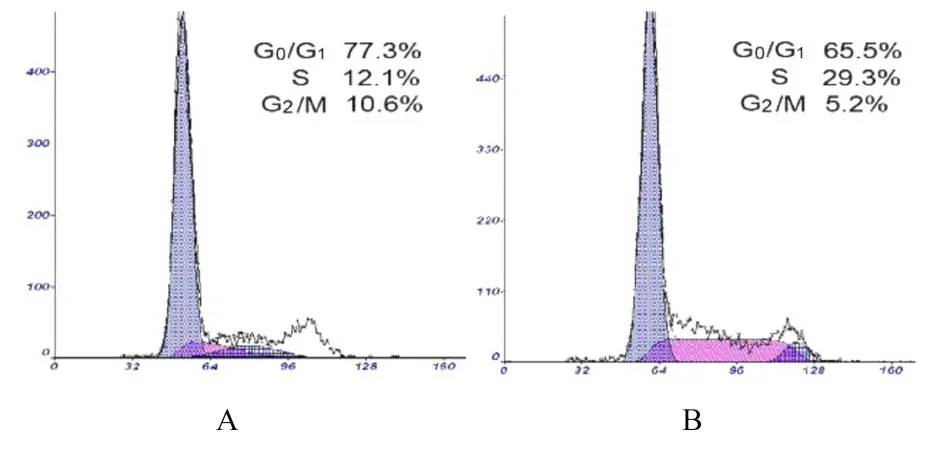
图3 流式细胞术检测2 组不同细胞周期细胞百分率Fig.3 Percentages of LCC2 cells at different cell cycles in two groups detected by flow cytometry
2.4 各组乳腺癌LCC2 细胞凋亡率作用48 h 时,与0 g·L-1HAE 组(17.70%±7.15%)比较,4 g·L-1HAE 组(37.63%±5.39%)细胞凋亡率升高(P<0.05)。见图4。

图4 2 组LCC2 细胞凋亡率Fig.4 Apoptotic rates of LCC2 cells in two groups
2.5 各组乳腺癌LCC2 细胞的迁移细胞数作用48 h 时,与对照组(95.00 个±21.58 个)比较,TAM 组迁移细胞数(90.22 个±15.06 个)差异无统计学意义(P>0.05);与TAM 组(90.22 个±15.06 个)和4 g·L-1HAE 组(59.78 个±5.09 个)比较,TAM+HAE 组迁移细胞数(37.44 个±7.31 个)明显减少(P<0.01)。见图5。
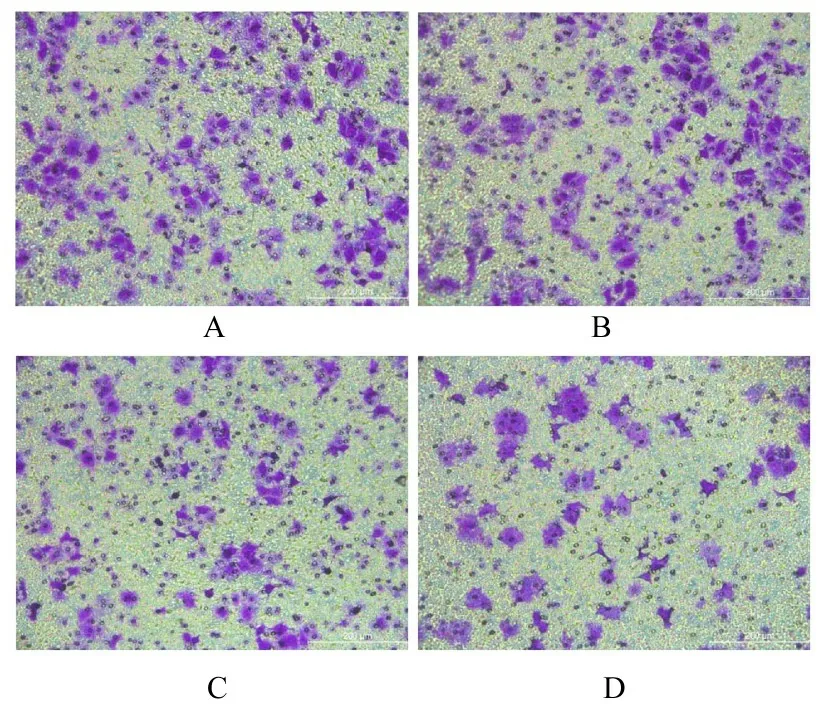
图5 Transwell小室实验检测各组LCC2细胞的迁移情况(Bar=200 μm)Fig.5 Migration of LCC2 cells in various groups detected by Transwell chamber assay(Bar=200 μm)
2.6 各组乳腺癌MCF-7 和LCC2 细胞中ERα、AIB1 和survivin 蛋白表达水平与MCF-7 细胞比较,LCC2 细胞中ERα、AIB1 和survivin 蛋白表达水平明显升高(P<0.05 或P<0.01)。作用48 h时,与0 g·L-1HAE 比较,2、4、8 和16 g·L-1HAE 组MCF7 和LCC2 细胞中ERα、AIB1 及survivin 蛋白表达水平明显降低(P<0.01)。见图6 和7。

图6 MCF-7 和LCC2 细胞中ERα、AIB1 和survivin 蛋白表达电泳图(A,C)和直条图(B,D)Fig.6 Electrophoregrams(A,C) and histograms(B,D) of expressions of ERα, AIB1, and survivin proteins in MCF-7 and LCC2 cells
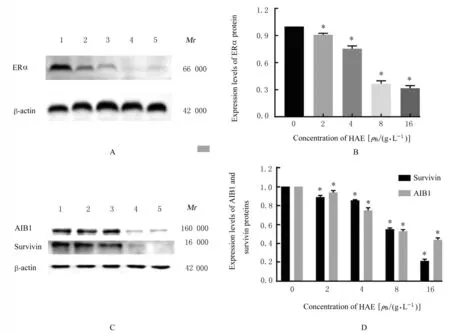
图7 不同浓度HAE 组LCC2 细胞中ERα、AIB1 和survivin 蛋白表达电泳图(A,C)和直条图(B,D)Fig.7 Electrophoregrams(A,C) and histograms(B,D) of expressions of ERα, AIB1 and survivin proteins in LCC2 cells in different concentrations of HAE groups
3 讨 论
TAM 耐药是乳腺癌患者内分泌治疗长期生存获益的主要障碍,目前芳香化酶抑制剂、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂、CDK4/6 抑制剂和HDAC 抑制剂等新药的出现改善了乳腺癌内分泌耐药患者的预后,但其较高的费用及不良反应,已严重影响了患者的依从性和治疗效果。而中药因其多途径、多通路和多靶点的作用优势及特色在抗肿瘤治疗中的作用日益显著[12]。
HAE 在肝癌、肺癌、胃癌和乳腺癌等多种肿瘤中发挥抗肿瘤作用[11],但关于其在乳腺癌TAM耐药中作用的研究较少。研究[13-14]证实:肿瘤细胞具有激活增殖、无限复制、侵袭转移和逃避凋亡等特征。抗肿瘤药物诱发肿瘤细胞死亡大多是通过抑制肿瘤细胞增殖和转移,诱导其凋亡和阻滞周期而实现[15-16]。本研究结果显示:HAE 对LCC2 细胞有明显的生长和迁移抑制作用,并可诱导细胞周期阻滞和凋亡从而发挥抗肿瘤作用。低剂量TAM 对LCC2 细胞的增殖和迁移无抑制作用,而HAE 与低剂量TAM 联合作用后,LCC2 细胞增殖活性和迁移能力受到更好的抑制,且该抑制作用较HAE和TAM 单药更明显。提示HAE 与TAM 有协同作用,HAE 作用后,LCC2 细胞中某些TAM 耐药通路或分子发生改变,在一定程度上增加了耐药细胞对TAM 的敏感性。
ERα 是位于细胞核中的ER,发挥转录因子功能,ERα 在乳腺癌组织中显著高表达,约占70%,而在正常乳腺上皮组织中表达不足10%[17-18]。研究[19]显示:ERα 可通过表皮生长因子受体(epidermal growth factor receptor,EGFR)/人表皮生长因子受体2 (human epidermal growth factor receptor 2,HER2)信号通路促进乳腺癌细胞的增殖,同时ERα 构象改变可导致不依赖激素的肿瘤细胞增殖和内分泌耐药。ERα 还可通过激活膜起始的信号通路如丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated,ERK)和磷脂酰肌醇3(phospoinositide 3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)等通路,促进TAM 的激动剂作用[20]。AIB1 是核受体共激活剂SRC 家族的成员,在乳腺癌中AIB1 和ER 相互作用促进雌激素依赖性基因转录[21]。研究[22]表明:高水平AIB1 可能通过增强药物的雌激素激动剂活性导致TAM 耐药性。survivin 是在多种恶性肿瘤中过表达的凋亡基因,主要起调节细胞周期和抑制凋亡细胞死亡的作用[23]。研究[24]显示:TAM 促进细胞凋亡的作用是通过抑制survivin 基因表达而实现的。表明ERα、AIB1 和survivin 蛋白的高表达可介导TAM 耐药,这与本研究结果一致。同时本研究结果显示:不同浓度HAE 对LCC2 细胞中ERα、AIB1 和survivin 蛋白表达产生明显的抑制作用,且呈剂量依赖性。表明ERα、AIB1 和survivin 蛋白表达下调可能是介导HAE 对LCC2 细胞生物学行为改变和改善TAM 耐药作用的机制。
综上所述,HAE 可抑制LCC2 细胞增殖和迁移,诱导细胞发生凋亡和细胞周期阻滞,改善细胞对TAM 的耐药性,其机制可能是通过下调ERα、AIB1 和survivin 等蛋白表达实现的。本研究为HAE 改善乳腺癌患者TAM 耐药提供了新的依据,对于采用HAE 作为乳腺癌内分泌耐药患者的补充治疗具有一定的临床参考价值。
