circ_EFCAB2 在癫痫细胞模型中的表达及其作用机制
2023-07-18张舒雅孙洪英孟晨曦巴格隆
张舒雅, 孙洪英, 毛 戬, 孟晨曦, 巴格隆
(1.内蒙古科技大学包头医学院第一附属医院神经内科,内蒙古 包头 014010;2.内蒙古科技大学包头医学院第三附属医院老年病科,内蒙古 包头 014030;3.内蒙古科技大学包头医学院第三附属医院功能科,内蒙古 包头 014030)
癫痫是常见的神经系统慢性疾病,全世界约有7 000 万人受该疾病的影响,患病人群主要集中在中低收入国家[1]。癫痫被认为是由中枢神经系统兴奋性神经元和抑制性神经元失衡引起的神经网络异常超同步放电,其典型临床特征是反复发作性的痫样发作和广泛或局部的肌肉痉挛和抽搐[2-3]。癫痫的致死率和致残率严重影响癫痫患者及其家庭,也给社会带来了沉重的经济负担。随着细胞生物学和分子生物学的不断发展,越来越多的研究者对癫痫的发病机制进行了探索。环状RNA (circular RNA,circRNA)是非编码RNA (non-coding RNA,ncRNA)重要的组成部分,其结构上无信使RNA 的5′(cap)和3′ poly(A)结构,其通过外显子、内含子或2 个外显子-内含子的反向剪接和融合形成共价键后连接形成闭合环状结构,通过充当微小RNA (microRNA,miRNA)分子海绵来调控基因表达[4-9]。近年来,部分circRNA 被强调为人类疾病的关键参与者,包括癫痫等疾病[10]。GONG 等[11]发现:在癫痫患者中,circ_0067835 mRNA 表达水平明显降低,过表达circ_0067835 可通过充当miR-155 分子海绵调控叉头框蛋白O3a(forkheacd box O3a,FOXO3a)基因的表达,从而抑制SH-SY5Y 细胞增殖并增加细胞凋亡。ZHENG 等[12]发现:circ_DROSHA 过表达可通过靶向miR-106b-5p 调控心肌细胞增强因子2C(myocyte enhancer 2C,MEF2C),减轻无镁溶液诱导的TLE 细胞模型损伤。LIN 等[13]发现:circ_ANKMY2 通过miR-106b-5p/叉头框蛋白P1(frokhead box P1,FOXP1)轴调控颞叶癫痫的进展。CHEN 等[14]发现:circ_0003170 通过调节miR-421/CCL2 轴在癫痫细胞模型中加重人海马神经元损伤。研究[10]证实:在癫痫患者脑组织中circ_EFCAB2 mRNA 表达水平明显升高,提示其具备成为诊断癫痫生物标志物和治疗靶点的潜在可能性。然而,circ_EFCAB2 在癫痫发病机制中的作用尚不明确。本研究探讨circ_EFCAB2 在体外癫痫细胞模型中的差异表达和亚细胞定位分析,阐明其可能的作用机制,为circ_EFCAB2 参与癫痫发病机制中作用的研究提供理论依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人神经母细胞瘤LAN-5 细胞(上海百晔生物科技有限公司)。TRIzol试剂(美国 Sigma 公司),反转录试剂盒(南京诺唯赞生物科技有限公司),实时荧光定量PCR(real-time fluorescence quantitative PCR,RTqPCR)试剂盒(美国 ABI 公司),核质分离试剂盒(上海碧云天生物科技有限公司),核糖核酸酶(ribonuclease,RNase)R 核酸外切酶(美国赛默飞公司),CCK-8 检测试剂盒(上海初态生物科技有限公司),RPMI 1640 细胞培养基和DMEM 培养基(大连美仑生物技术有限公司)。酶联免疫检测仪(美国 Bio-Rad 公司),全自动PCR 扩增仪(美国ABI 公司),流式细胞仪和培养箱(美国赛默飞公司),-80 ℃超低温冰箱(日本三洋公司),电子恒温水浴箱(上海新苗医疗器械制造公司),微量移液器(德国艾本德科技公司)。
1.2 癫痫细胞模型制备和分组LA-N-5 细胞置于37 ℃、5% CO2培养箱中培养。细胞系保存在必需培养基中,培养基含10%胎牛血清、10%青-链霉素。实验分为对照组和模型组。对照组为LA-N-5 细胞中加入正常细胞外液,于37 ℃、5%CO2培养箱中培养 3 h,更换为正常培养基继续培养24 h。模型组即无镁致痫组:建立体外颞叶癫痫细胞模型,将LA-N-5 细胞在无镁细胞外液(145 mmol·L-1NaCl、2.5 mmol·L-1KCl、2 mmol·L-1氯化钙、10 mmol·L-1葡萄糖、10 mmol·L-14-羟乙基哌嗪乙磺酸和0.001 mmol·L-1甘氨酸,pH 7.4)于37 ℃、5%CO2培养箱培养3 h,更换为正常培养基继续培养24 h。使用电流钳记录癫痫细胞模型自发高频率,痫样放电频率高于3 Hz 表明癫痫细胞模型建立成功。
1.3 RT-qPCR 法检测2 组细胞中circ_EFCAB2 mRNA 表达水平采用 TRIzoI 法提取细胞中总RNA,按照逆转录试剂盒说明书操作将其逆转录为cDNA,配置PCR 反应体系并设置反应条件,其中反应体系为10 μL,以GAPDH 为内参,所用引物由苏州金唯智生物科技有限公司设计合成,引物序列见表1。反应条件:95 ℃、10 s;95 ℃、5 s,60 ℃、30 s,72 ℃、30 s,40 个循环。每组设置5 个复孔,采用2-△△Ct法计算细胞中circ_EFCAB2 mRNA 表达水平。实验重复 3 次。

表1 引物序列Tab.1 Primer sequences
1.4 RNA 酶消化实验和RT-qPCR 法检测细胞中circ_EFCAB2 和线性EFCAB2 mRNA 表达水平癫痫细胞模型提取总RNA,52 μL DEPC 水重悬。将细胞分为2 组,一组进行RNase R 消化(RNase R 消化组),另一组作为对照(RNase R 未消化组)。RNase R 消化组加入3 μL 10×RNase R Reaction Buffer,0.1 μL 20 U·μL-1RNase R,未消化组加入3 μ L 10× RNase R Reaction Buffer,0.1 μL DEPC 水,37 ℃、1 h。采用RT-qPCR 法检测2 组细胞中circ_EFCAB2 和线性EFCAB2 mRNA 表达水平。以GAPDH 为内参,采用 2-ΔΔCt法计算目的基因mRNA 表达水平,实验重复3 次。
1.5 核质分离实验检测癫痫细胞中circ-EFCAB2 mRNA 表达水平癫痫模型细胞,按照核质分离试剂盒说明书操作。分离的RNA 采用RT- qPCR法检测细胞中circ_EFCAB2 mRNA 表达水平。在细胞质和细胞核中分别以GAPDH 和U6 作为内参,采用 2-ΔΔCt法计算目的基因mRNA 表达水平,实验重复3 次。
1.6 CCK-8 法检测2 组细胞增殖能力于96 孔细胞板中接种细胞悬液,每孔100 μL,培养板置于培养箱中预培养2 h 细胞,每孔加入10 μL CCK-8 溶液,培养箱内孵育4 h。酶标仪测定波长450 nm 处吸光度(A)值,以A 值代表细胞增殖能力。每组设置 5 个复孔,实验重复3 次。
1.7 流式细胞术检测2 组细胞凋亡率待测细胞消化离心,PBS 缓冲液洗涤细胞1 次,胰酶消化,重新悬浮于PBS 缓冲液中,预冷的PBS 缓冲液洗涤细胞2 次,加入 Annexin Ⅴ-APC 和 PI 染料,避光染色20 min,采用流式细胞术检测细胞凋亡情况,采用FlowJo 软件分析流式细胞术测得的原始数据。细胞凋亡率=凋亡细胞数/细胞总数×100%。实验重复3 次。
1.8 流式细胞术检测2 组不同细胞周期细胞百分率待细胞生长至覆盖率约为 80%时取待测细胞,消化离心,PBS 缓冲液洗涤细胞1 次,胰酶消化,重新悬浮于PBS 缓冲液中,4 ℃下将细胞固定在70%乙醇中过夜,加入PI 染料,避光染色30 min,流式细胞术检测,实验重复3 次。记录激发波长488 nm 处红色荧光,采用DNA MultiCycle 软件进行统计学分析。
1.9 统计学分析采用SPSS 25.0 和 GraphPad Prism 6.0 统计软件进行统计学分析。各组细胞中circ_EFCAB2 mRNA 和线性EFCAB2 mRNA 表达水平、细胞增殖能力、细胞凋亡率及不同细胞周期细胞百分率均符合正态分布,以±s 表示,组间样本均数比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 癫痫细胞模型鉴定全细胞电流钳记录方式下显示:模型组细胞有自发高频率的痫样放电,频率高于3 Hz,对照组细胞仅有少量的偶发动作电位,提示癫痫细胞模型建立成功。
2.2 2 组细胞中circ_EFCAB2 和线性EFCAB2 mRNA 表达水平与对照组(0.99±0.02)比较,模型组细胞中circ_EFCAB2 mRNA 表达水平(1.34±0.03)升高(P<0.05)。
2.3 RNA 酶处理后2 组细胞中circ_EFCAB2 和线性EFCAB2 mRNA 表达水平与RNase R 未消化组比较,RNase R 消化组细胞中线性EFCAB2 mRNA 表达水平明显降低(P<0.01),circ_EFCAB2 mRNA 表达水平差异无统计学意义(P>0.05)。见表2。
表2 2 组细胞中circ_EFCAB2 和线性EFCAB2 mRNA 表达水平Tab.2 Expression levels of circ_EFCAB2 and linear EFCAB2 mRNA in cells in two groups (n=3,±s)
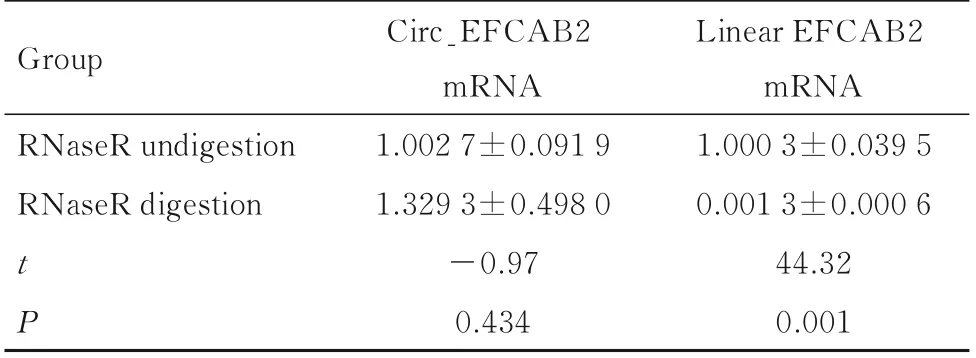
表2 2 组细胞中circ_EFCAB2 和线性EFCAB2 mRNA 表达水平Tab.2 Expression levels of circ_EFCAB2 and linear EFCAB2 mRNA in cells in two groups (n=3,±s)
Group RNaseR undigestion RNaseR digestion tP Circ_EFCAB2 mRNA 1.002 7±0.091 9 1.329 3±0.498 0-0.97 0.434 Linear EFCAB2 mRNA 1.000 3±0.039 5 0.001 3±0.000 6 44.32 0.001
2.4 癫痫模型细胞中circ_EFCAB2 mRNA 表达水平癫痫细胞的细胞质中circ_EFCAB2 mRNA 表达水平为(47.13%±2.76%),在细胞核中表达水平为(52.87%±2.76%),组间比较差异无统计学意义(P>0.05)。
2.5 2 组细胞增殖能力CCK-8 法检测结果显示:转染72 h 时,与对照组比较,模型组细胞增殖能力明显降低(P<0.01)。见图1。
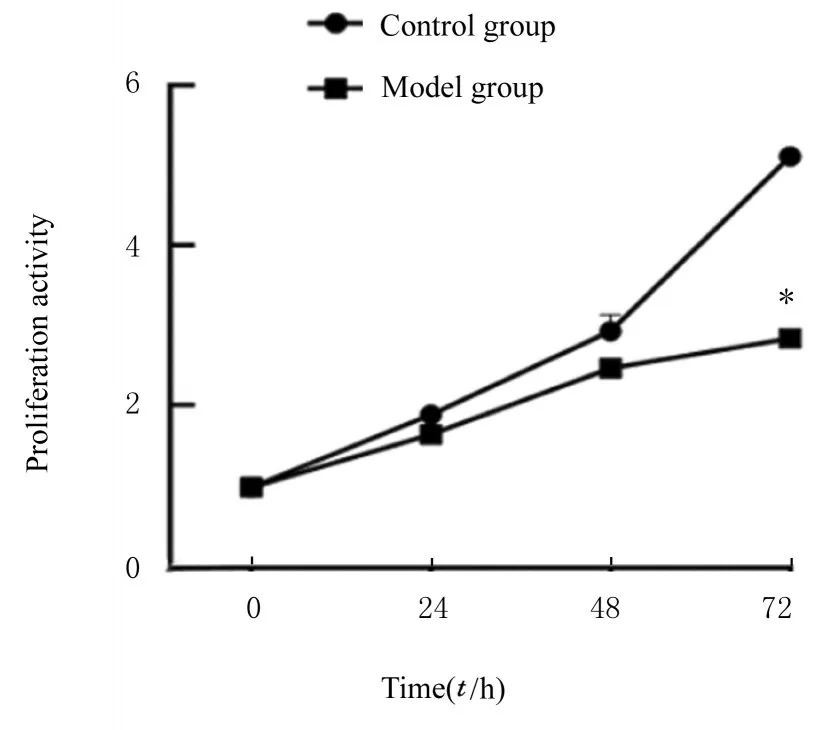
图1 CCK-8 法检测2 组细胞增殖能力Fig.1 Proliferation activities of cells in two groups detected by CCK-8 method
2.6 2 组细胞凋亡率与对照组(4.78%±0.64%)比较,模型组细胞凋亡率(21.11%±0.72%)明 显 升 高 (P<0.01)。见图2。

图2 流式细胞术检测2 组细胞凋亡率Fig.2 Apoptotic rates of cells in two groups detected by flow cytometry
2.7 2 组不同细胞周期细胞百分率对照组S 期细胞百分率为(50.11%±3.44%),G1+G2期细胞百分率为(49.89%±3.44%)。与对照组比较,模型组S 期细胞百分率(23.20%±1.03%)明显降低(P<0.01),G1+G2期细胞百分率(76.80%±1.03%)明显升高(P<0.01)。见图3。
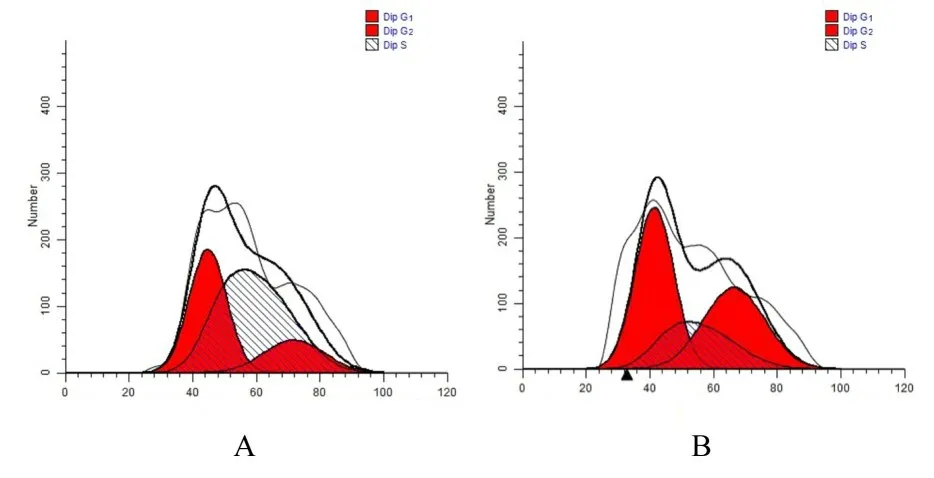
图3 2 组不同细胞周期细胞百分率Fig.3 Percentages of cells at different cell cycles in two groups
3 讨 论
circRNA 在中枢神经系统中表达丰富且较为稳定[15-16]。circRNA 是由多种神经元特异性基因产生的,其可能参与大脑发育和突触可塑性,circRNA表达异常可能与神经退行性疾病和急性中枢神经系统损伤后的继发性脑损伤有关。因此,识别circRNA 在中枢神经系统疾病中的表达改变和功能作用,可能提供新的诊断工具和治疗靶点。研究[10]显示:采用高通量测序法检测癫痫患者,发现442 个circRNA 异常表达,在癫痫患者脑组织中circ_EFCAB2 表达水平较正常人明显上调。结合本课题组前期研究[17]证实:癫痫患者血清中circ_EFCAB2 表达水平明显升高,提示circ_EFCAB2 与癫痫的发生发展可能存在相关性。circ_EFCAB2 可能是通过调节miRNA 海绵分子circRNA-miRNA 基因轴来调控癫痫的发生发展,且circ_EFCAB2 通过与miR-485P 相互作用增加氯通道6 的表达水平,其与电兴奋性和离子稳态等多种生理过程有关[10]。
综上所述,癫痫患者血清和癫痫细胞模型中circ_EFCAB2 mRNA 表达水平升高,circ_EFCAB2可能通过触发神经元损伤,包括细胞周期阻滞、细胞凋亡和细胞增殖等方式促进癫痫的发生发展。这可能为癫痫提供了一种新的诊断标志位和治疗靶点。
