缺氧条件下HIF-1α/ROS 对肺癌A549 细胞凋亡和侵袭的作用及其机制
2023-07-18郭红荣王红娟徐建群
黄 波, 丁 洁, 郭红荣, 王红娟, 徐建群, 郑 泉
(1.湖北省武汉市第三医院 武汉大学附属同仁医院呼吸与危重症医学科,湖北 武汉 430070;2.湖北省武汉市第三医院 武汉大学附属同仁医院血液透析室,湖北 武汉 430070)
肺癌是癌症相关死亡的主要原因,其中非小细胞肺癌发病率约占全部肺癌发病率的85%。肺癌具有较高的死亡率和发病率,因此其早期诊断十分重要[1-2]。随着人们生活方式的改变和社会经济的发展,肺癌的发病率逐年升高,给人类健康造成极大威胁[3]。以顺铂为基础的化疗是目前治疗肺癌的主要方法,但化疗药物缺乏特异性且具有明显不良反应,因此寻找新的靶点对肺癌诊断和治疗具有重要意义[4]。
研究[5]表明:缺氧诱导因子1α (hypoxia inducible factor-1α,HIF-1α)在肺癌患者血清中的表达明显上调。常氧条件下,HIF-1α 表达的蛋白会被迅速降解,而缺氧条件下降解途径被破坏,肿瘤细胞中的HIF-1α 通过调控糖酵解途径相关酶的表达促进葡萄糖代谢为乳酸,使HIF-1α 能够在缺氧环境中生存[6]。自噬在人类肿瘤等疾病的过程中发挥关键作用[7]。缺氧条件下,活性氧(reactive oxygen species,ROS)和HIF-1α 均可诱导自噬,并影响肿瘤的进展[8-9],但在肺癌中的具体作用机制尚不明确。因此,本研究以A549 细胞作为研究对象,构建缺氧细胞模型,探讨HIF-1α 和ROS 的相互作用及其对A549 缺氧细胞模型自噬及生物学行为的影响,为肺癌的靶点治疗提供参考。
1 材料与方法
1.1 细胞、主要试剂和仪器人非小细胞肺癌A549 细胞购于中科院细胞库。HIF-1α 抑制剂利非西呱(lificiguat,YC-1)和ROS 抑制剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)购于上海阿拉丁生化科技股份有限公司,F12K 和胎牛血清购于美国Gibco 公司,CCK-8 试剂、抗荧光衰减封片剂、结晶紫和BCA 蛋白浓度测定试剂盒购于北京索莱宝科技有限公司,TRIzol 试剂购于美国Ambion 公司,SYBR FAST qPCR Master Mix 购于美国KAPA Biosystems 公司,反转录试剂盒购于日本TaKaRa 公司,ROS 检测试剂盒购于上海碧云天生物技术有限公司,荧光集团488 标记的羊抗兔抗体、微管相关蛋白轻链 3 Ⅱ(microtubuleassociated protein light chain 3-Ⅱ,LC3-Ⅱ)、HIF-1α 和人甲酰肽受体1 (formy peptide receptor,FPR1)抗体购于武汉贝茵莱生物科技有限公司,AnnexinⅤ-FITC/PI 凋亡检测试剂盒和Matrigel 购于美国BD 公司,PVDF 转移膜和化学发光试剂购于美国Millipore 公司。CO2恒温培养箱(311)和直热式CO2三气培养箱(FormaTM8000)购于美国Thermo 公司,倒置荧光显微镜(DMIL LED)和切片机(S6E)购于德国Leica 公司,PCR 仪(GE48527)购于杭州柏恒科技有限公司,实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)仪(CFX-Connect 96)和电泳仪(mini protean 3 cell)购于美国Bio-Rad 公司,超微量分光光度计(Nano-300)购于杭州奥盛仪器有限公司,流式细胞仪(NovoCyte)购于杭州艾森生物有限公司,透射电镜(HT7700)购于日本日立公司,酶标仪(MK3)购于芬兰雷勃公司,全自动化学发光分析仪(Tanon-5200)购于上海天能科技有限公司。
1.2 细胞培养和缺氧细胞模型构建采用含10%胎牛血清的F-12K 培养基于37 ℃、5% CO2条件下培养A549 细胞,细胞汇合度达80%时,按1∶2 比例进行传代。收集细胞,调整细胞悬液浓度,接种于6 孔细胞培养板中,每孔5×105个细胞,每孔2 mL,置于37 ℃、5% CO2培养箱中培养24 h,取对数生长期的细胞,更换无血清培养液培养12 h,使细胞周期同步化,将细胞置于含94% N2、1% O2和5% CO2混合气体的缺氧培养箱中培养12、24、48 和72 h,收集细胞进行后续检测[10]。
1.3 模型鉴定以常氧培养(21% O2)的A549细胞作为对照,RT-qPCR 法检测不同处理时间细胞中HIF-1α mRNA 表达水平,TRIzol 法提取细胞总RNA,按照逆转录试剂盒说明书操作合成cDNA,RT-qPCR 法检测细胞中HIF-1α mRNA 表达水平。引物序列:HIF-1α F 5′-GAAGTGTACCCTAACTAGCCG-3′,HIF-1α R 5′-TCACAAATCAGCACCAAGC-3′;GAPDH F 5′-GGGAAACTGTGGCGTGAT-3′,GAPDH R 5′-GAGTGGGTGTCGCTGTTGA-3′。以GAPDH 为内参,采用2-△△Ct法计算HIF-1α mRNA 表达水平。取出细胞培养板,每孔加入10 μL CCK-8溶液,培养4 h,酶标仪检测波长450 nm 处各孔吸光度(A)值,以A值代表细胞增殖能力,实验重复3 次。缺氧条件下细胞增殖能力较好,HIF-1α 高表达表明缺氧诱导细胞模型构建成功,并由此确定最佳诱导时间。
1.4 细胞分组和处理将A549 细胞分为对照组、模型组、NAC 组、NAC+YC-1 组和YC-1 组。对照组细胞在常氧(21% O2)条件下培养,其余4 组细胞均按照“1.3”步骤中方法诱导24 h;模型组只进行缺氧诱导,不做其他处理;NAC 组缺氧诱导后采用20 mmol·L-1NAC 诱导24 h[8];NAC+YC-1 组缺氧诱导后采用20 mmol·L-1NAC 和100 μmol·L-1YC-1 诱导24 h[11];YC-1 组缺氧诱导后采用100 μmol·L-1YC-1 诱导24 h。干预完成后,进行后续实验。
1.5 RT-qPCR 法和Western blotting 法检测各组细胞中HIF-1α 和FPR1 mRNA 及蛋白表达水平
收集细胞,TRIzol 法提取细胞总RNA,RT-qPCR 法检测各组细胞中HIF-1α 和FPR1 mRNA 表达水平。引物序列:HIF-1α 上游引物,5′-TGCTTGGTGCTGATTTGTG-3′,HIF-1α 下游引物,5′-TGTCCTGTGGTGACTTGTCC-3′;FPR1 上游引物,5′-GTCGCAGCAGCCTTTTTT-3′,FPR1 下游引物,5′-CCAGGGCACTTGTCACATC-3′;GAPDH 上游引物,5′-GGGAAACTGTGGCGTGAT-3′,GAPDH 下游引物,5′-GAGTGGGTGTCGCTGTTGA-3′。以GAPDH 为内参,采用2-△△Ct法计算各组细胞中HIF-1α 和FPR1 mRNA 表达水平。同时提取细胞总蛋白,BCA 法测定蛋白含量,Western blotting 法检测各组细胞中HIF-1α 和FPR1 蛋白表达水平,采用Image J 软件分析蛋白条带灰度值,实验重复3 次,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.6 流式细胞术检测各组细胞中ROS 水平采用无血清培养液按照1∶1 000 的比例稀释DCFHDA,使终浓度为10 μmol·L-1。采用1 mL 稀释的DCFH-DA 重悬细胞,使细胞浓度为1×106mL-1,置于37 ℃、5% CO2细胞培养箱内孵育20 min,使探针和细胞充分接触。无血清细胞培养液洗涤3 次,收集细胞并用500 μL PBS 缓冲液重悬,采用流式细胞仪检测荧光强度。以荧光强度表示各组细胞中ROS 水平。
1.7 透射电镜观察各组细胞自噬体结构取1×107个细胞,采用2.5%戊二醛4 ℃预固定30 min 以上,PBS 缓冲液洗涤3 次,1% 锇酸后固定1 h,PBS 缓冲液洗涤3 次后进行梯度脱水,丙酮和环氧树脂812 按照1∶1 的比例40 ℃半浸透6 h,纯环氧树脂40 ℃全浸透4 h,包埋板包埋,加入包埋剂,置于聚合包埋箱聚合,采用切片机进行超薄切片。醋酸铀避光染色20 min,双蒸水洗涤3 次,枸橼酸铅避光染色15 min,洗去多余铅液,吸干后透射电镜观察并拍照,实验重复3 次。
1.8 免疫荧光法检测各组细胞中LC3-Ⅱ表达情况
收集各组细胞接种于12 孔细胞培养板,加入1 mL 4%多聚甲醛室温固定30 min,PBS 缓冲液洗涤2 次,加入1 mL 0.5%Triton X-100 室温通透30 min,PBS 缓冲液洗涤2 次,加入1 mL 5%BSA 37 ℃封闭1 h,弃封闭液,加入一抗稀释液,4 ℃孵育过夜,PBS 缓冲液洗涤后加入二抗稀释液,37 ℃孵育1 h,PBS 缓冲液洗涤后加入含DAPI 的抗荧光淬灭封片液,置于荧光显微镜下拍照并记录,实验重复3 次。
1.9 流式细胞术检测各组细胞凋亡率收集各组细胞,取1×106个培养基重悬的细胞,400 g、4 ℃离心5 min,弃上清,加入1 mL 预冷的PBS 缓冲液,混匀后弃上清,200 μL PBS 缓冲液重悬细胞,加入10 μL Annexin Ⅴ-FITC 和10 μL PI,混匀后4 ℃避光孵育30 min,加入300 μL PBS 缓冲液,采用流式细胞仪检测细胞凋亡率。细胞凋亡率=(右上象限凋亡细胞数+右下象限凋亡细胞数)/细胞总数×100%。
1.10 Transwell 小室实验检测各组侵袭细胞数
收集各组细胞,采用无血清培养基重悬细胞至1×105mL-1,稀释基质胶并铺在Transwell 小室中,干燥后取200 μL 细胞悬液接种于Transwell 小室中,下层24 孔细胞培养板中每孔加入0.75 mL含10% 胎牛血清培养液,培养24 h,加入4%多聚甲醛室温固定30 min,PBS 缓冲液洗涤,加入1 mL 0.5%结晶紫溶液,染色30 min,取出小室,用棉签擦去上层细胞,光学显微镜下观察并计数,采用Image J 软件计算各组侵袭细胞数,实验重复3 次。
1.11 统计学分析采用GraphPad Prism 8.0 统计软件进行统计学分析。不同处理时间各组细胞中HIF-1α 和FPR1 mRNA 表达水平,各组细胞中HIF-1α 和FPR1 蛋白表达水平,各组细胞中ROS水平,不同处理时间各组细胞增殖能力,各组细胞凋亡率和侵袭细胞数均符合正态分布且方差齐,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 缺氧环境下A549 细胞HIF-1α mRNA 表达水平和增殖能力与0 h 比较,低氧诱导12、24、48和72 h 时,细胞中HIF-1α mRNA 表达水平明显升高(P<0.05 或P<0.01),随着A549 细胞在低氧环境中的时间延长,HIF-1α mRNA 表达水平升高。与对照组比较,低氧诱导24、48 和72 h 时,模型组细胞增殖能力明显升高(P<0.01)。结合两部分结果确定低氧诱导时间为24 h。见图1 和2。
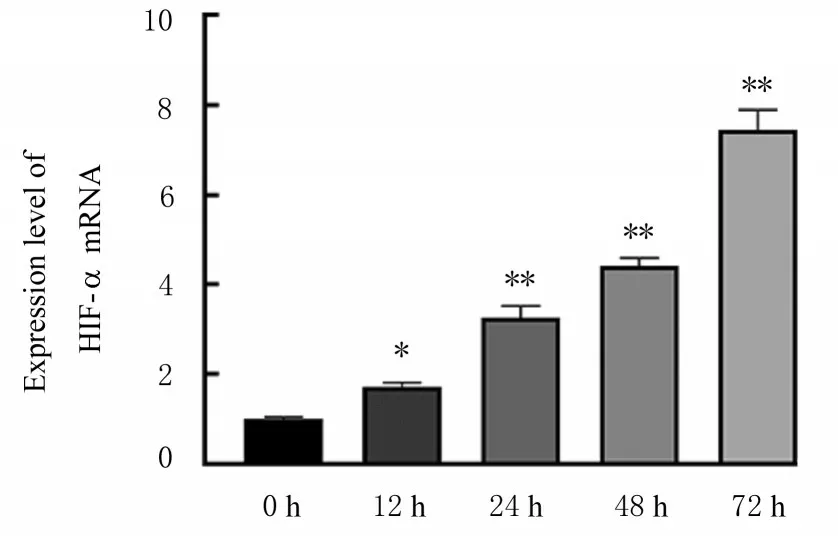
图1 缺氧条件下A549 细胞中HIF-1α mRNA 表达水平Fig.1 Expression levels of HIF-1α mRNA in A549 cells under hypoxia condition
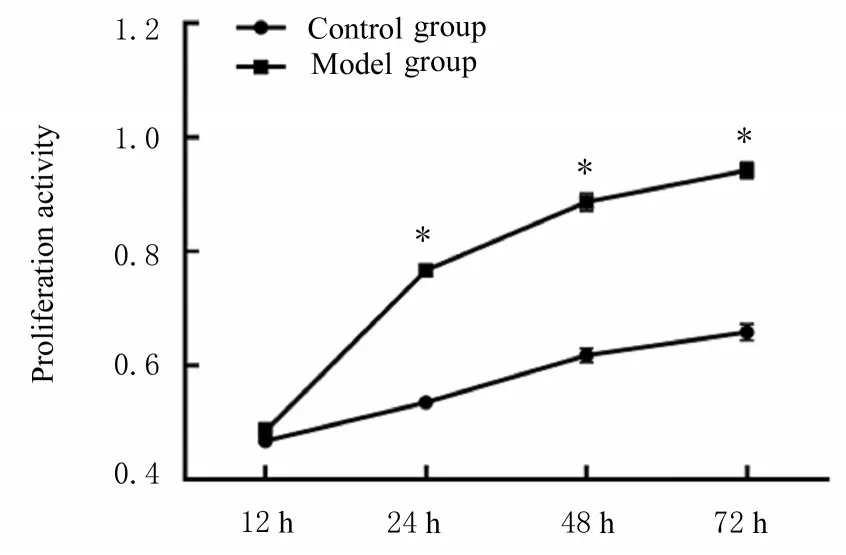
图2 缺氧条件下A549 细胞增殖能力Fig.2 Proliferation activities of A549 cells under hypoxia condition
2.2 各组A549 细胞中HIF-1α 和FPR1 mRNA 及蛋白表达水平与对照组比较,模型组细胞中HIF-1α 和FPR1 mRNA 及蛋白表达水平均明显升高(P<0.01)。与模型组比较,NAC 组、NAC+YC-1 组和YC-1 组细胞中HIF-1α 和FPR1 mRNA及蛋白表达水平均明显降低(P<0.01),其中NAC+YC-1 组细胞中HIF-1α 和FPR1 mRNA 表达水平最低。与NAC 组比较,NAC+YC-1 组细胞中HIF-1α 和FPR1 mRNA 及蛋白表达水平明显降低(P<0.01)。见图3 和4。
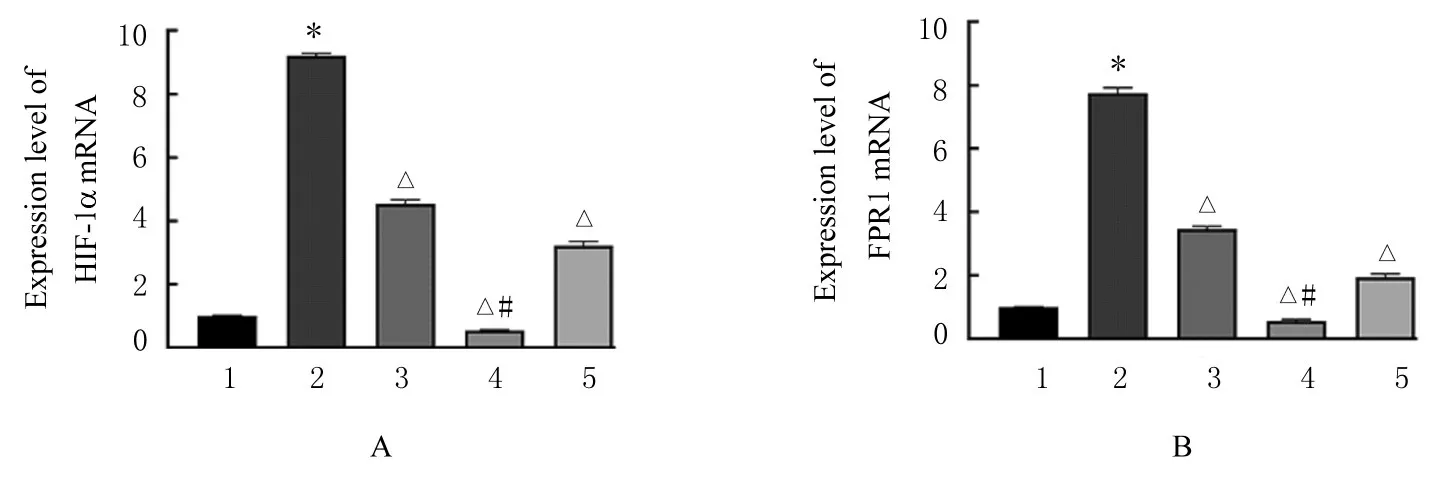
图3 各组细胞中HIF-1α(A)和FPR1(B) mRNA 表达水平Fig.3 Expression levels of HIF-1α(A) and FPR1(B) mRNA in cells in various groups
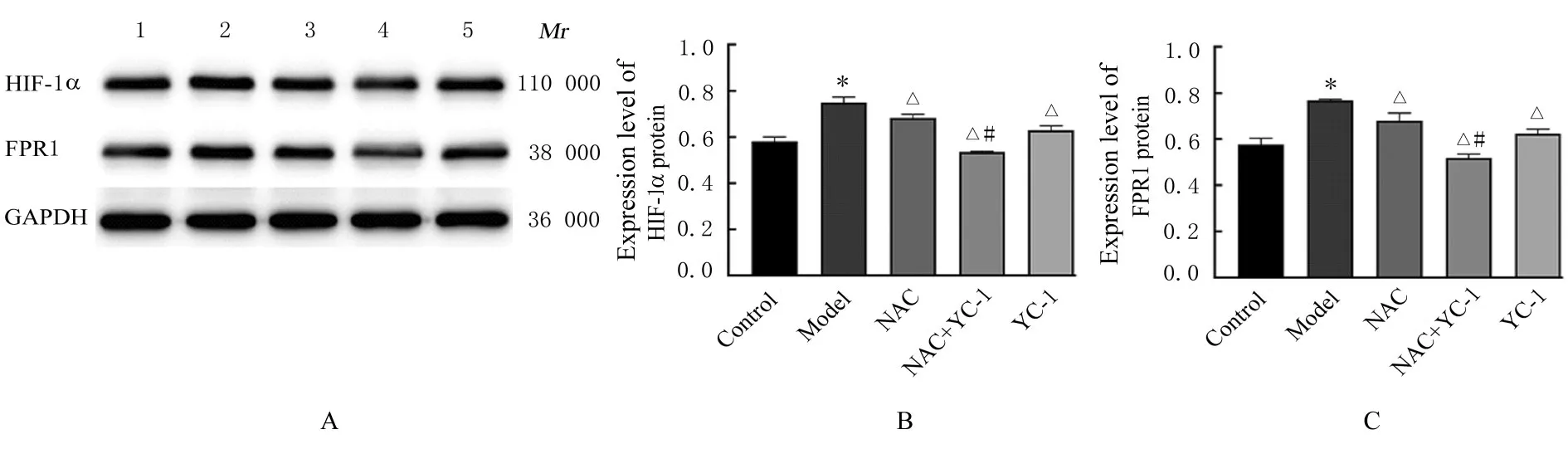
图4 各组细胞中HIF-1α 和FPR1 蛋白表达电泳图(A)和直条图(B,C)Fig.4 Electrophoregram(A) and histograms(B,C) of expressions of HIF-1α and FPR1 proteins in cells in various groups
2.3 各组A549 细胞中ROS 水平与对照组比较,模型组细胞中ROS 水平明显升高(P<0.01)。与模型组比较,NAC 组、NAC+YC-1 组和YC-1 组细胞中ROS 水平均明显降低(P<0.01),其中NAC+YC-1 组细胞中ROS 水平最低。与NAC 组比较,NAC+YC-1 组细胞中ROS 水平明显降低(P<0.01)。见图5 和6。
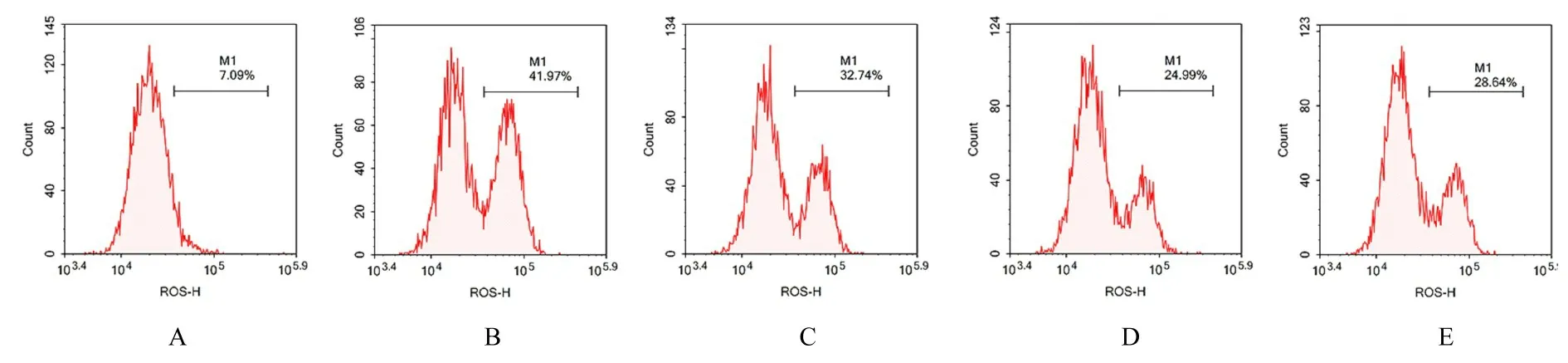
图5 流式细胞术检测各组细胞中ROS 水平Fig.5 ROS levels in cells in various groups detected by flow cytometry
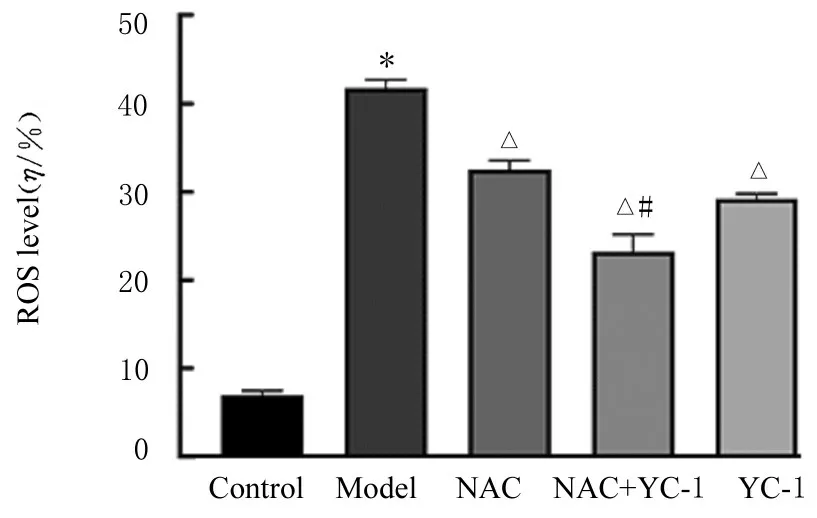
图6 各组细胞中ROS 水平Fig.6 ROS levels in cells in various groups
2.4 各组A549 细胞自噬体超微结构对照组细胞中细胞器结构完整,未见自噬体结构;模型组细胞中可见大量自噬体,可见明显空泡,细胞中细胞器也被降解;与模型组比较,NAC组、NAC+YC-1 组和YC-1 组细胞中自噬体减少,其中NAC+YC-1 组细胞中自噬体最少。见图7。
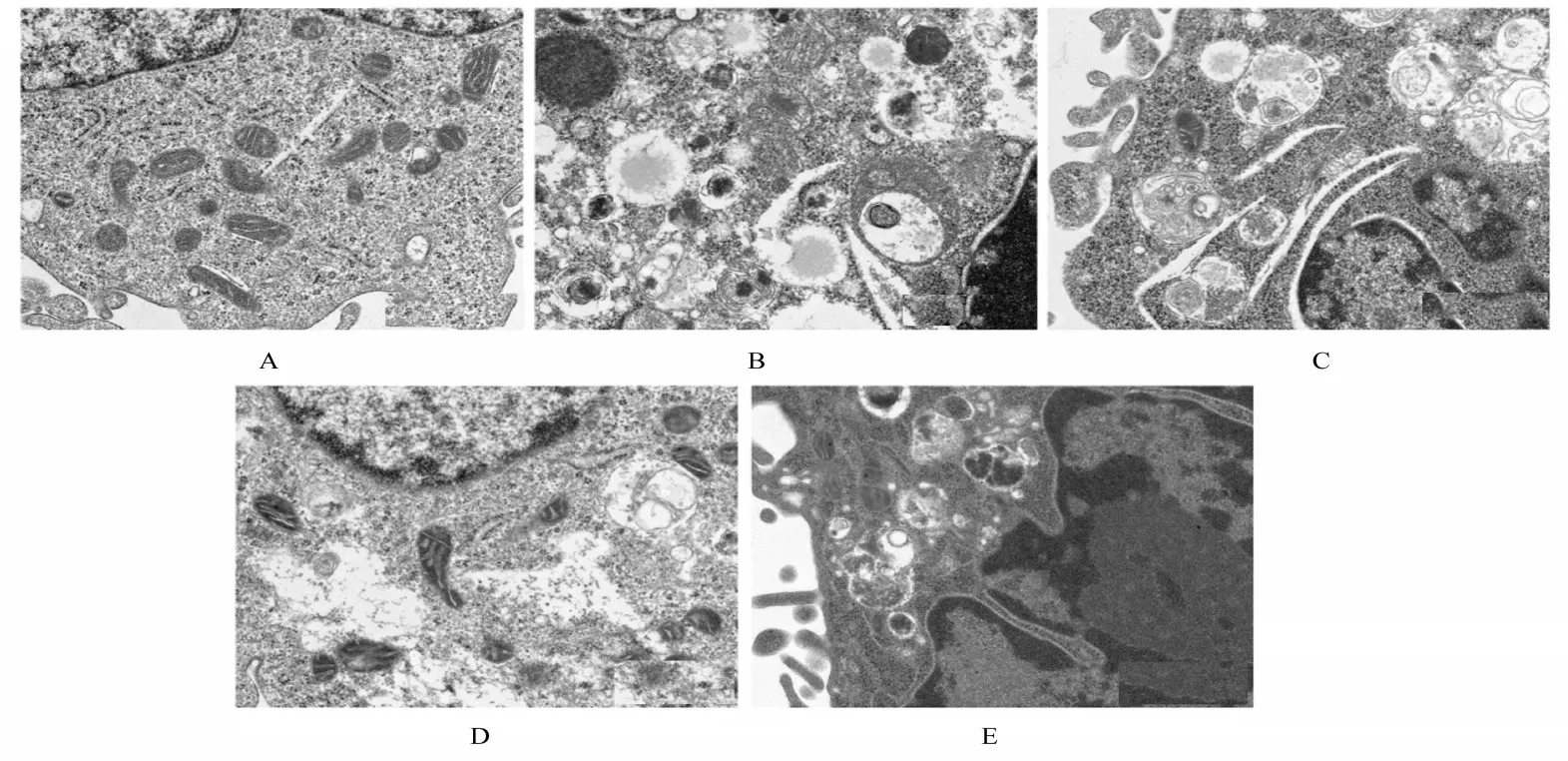
图7 透射电镜观察各组细胞中自噬体超微结构(×12 000)Fig.7 Ultrastructures of autophagosomes in cells in various groups observed by transmission electron microscope(×12 000)
2.5 各组A549 细胞中LC3-Ⅱ表达情况与对照组比较,模型组细胞中LC3-Ⅱ表达强度明显增加。与模型组比较,NAC组、NAC+YC-1组和YC-1组细胞中LC3-Ⅱ表达明显减少,其中NAC+YC-1 组细胞中LC3-Ⅱ表达最少。见图8。
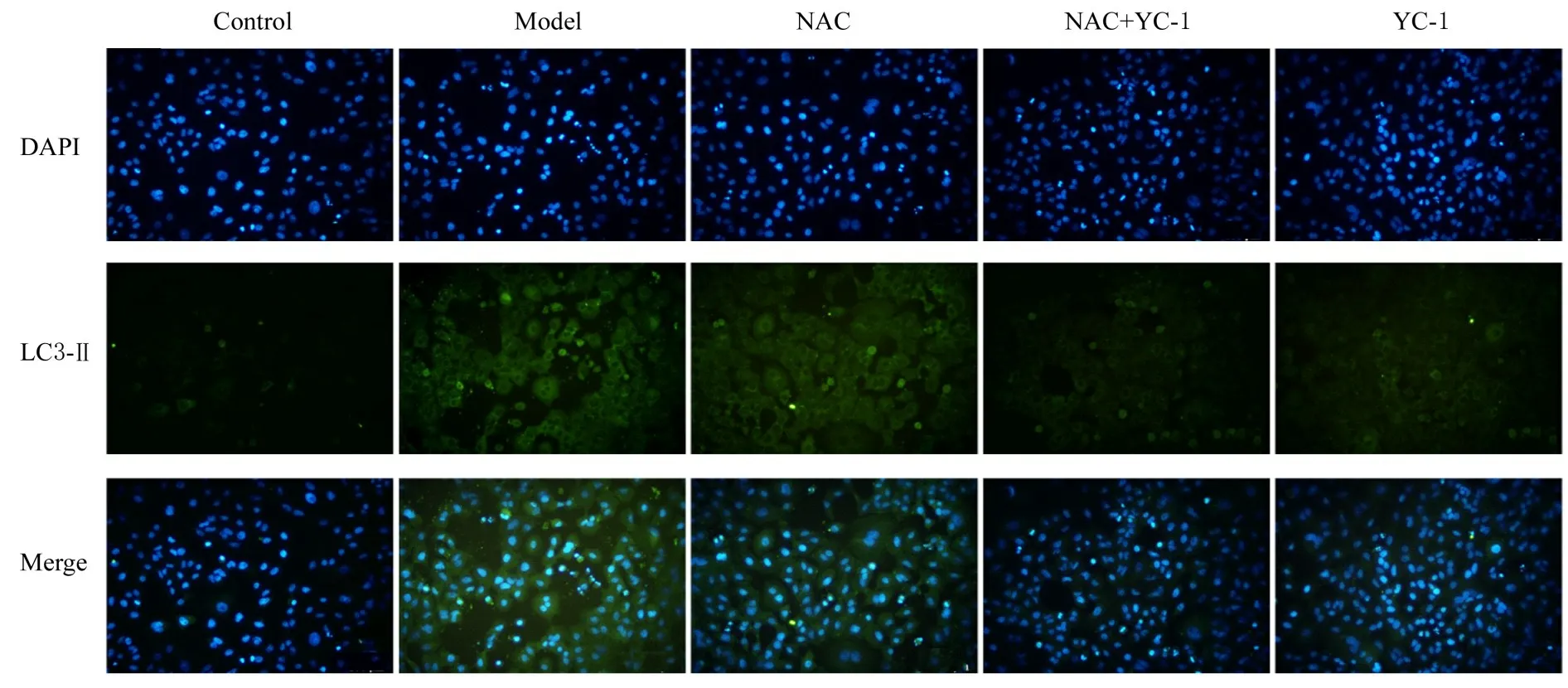
图8 免疫荧光法检测各组细胞中LC3-Ⅱ表达强度(×200)Fig.8 Expression intensities of LC3-Ⅱ in cells in various groups detected by immunofluorescence method(×200)
2.6 各组A549 细胞凋亡率与对照组比较,模型组细胞凋亡率明显降低(P<0.01)。与模型组比较,NAC 组、NAC+YC-1 组和YC-1 组细胞凋亡率明显升高(P<0.01),其中NAC+YC-1 组细胞凋亡率升高最明显。与NAC 组比较,NAC+YC-1 组细胞凋亡率明显升高(P<0.01)。见图9 和10。
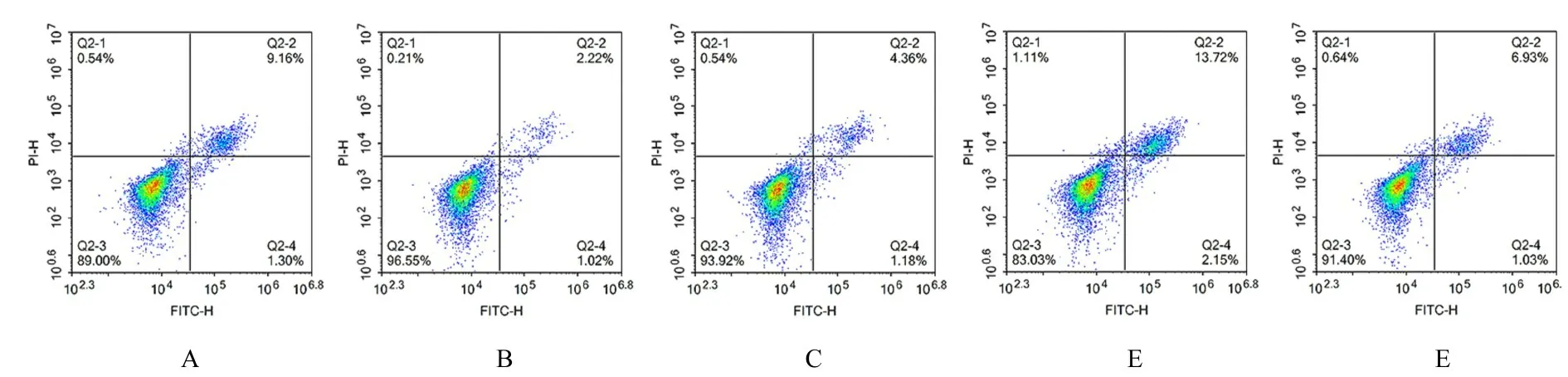
图9 流式细胞术检测各组细胞凋亡率Fig.9 Apoptotic rates of cells in various groups detected by flow cytometry
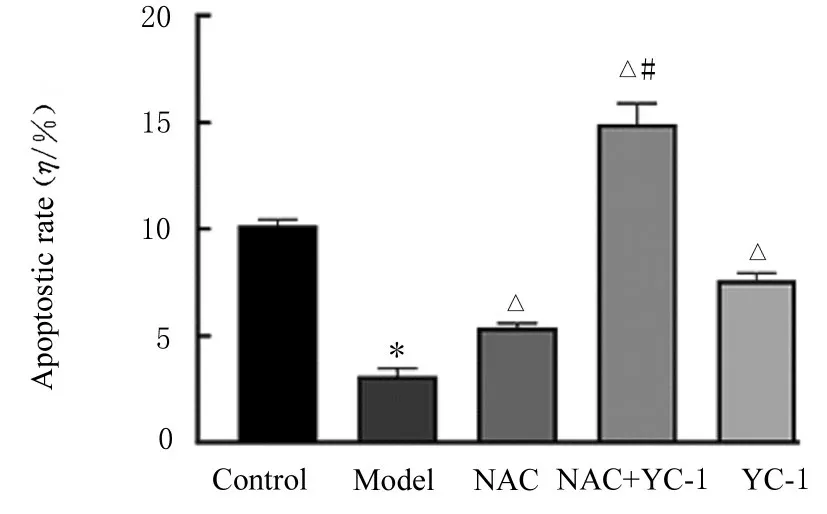
图10 各组细胞凋亡率Fig.10 Apoptotic rates of cells in various groups
2.7 各组A549 侵袭细胞数与对照组比较,模型组侵袭细胞数明显增加(P<0.01)。与模型组比较,NAC 组、NAC+YC-1 组和YC-1 组侵袭细胞数均明显减少(P<0.01),其中NAC+YC-1组侵袭细胞数减少最明显。与NAC组比较,NAC+YAC-1组侵袭细胞数明显减少(P<0.01)。见图11和12。
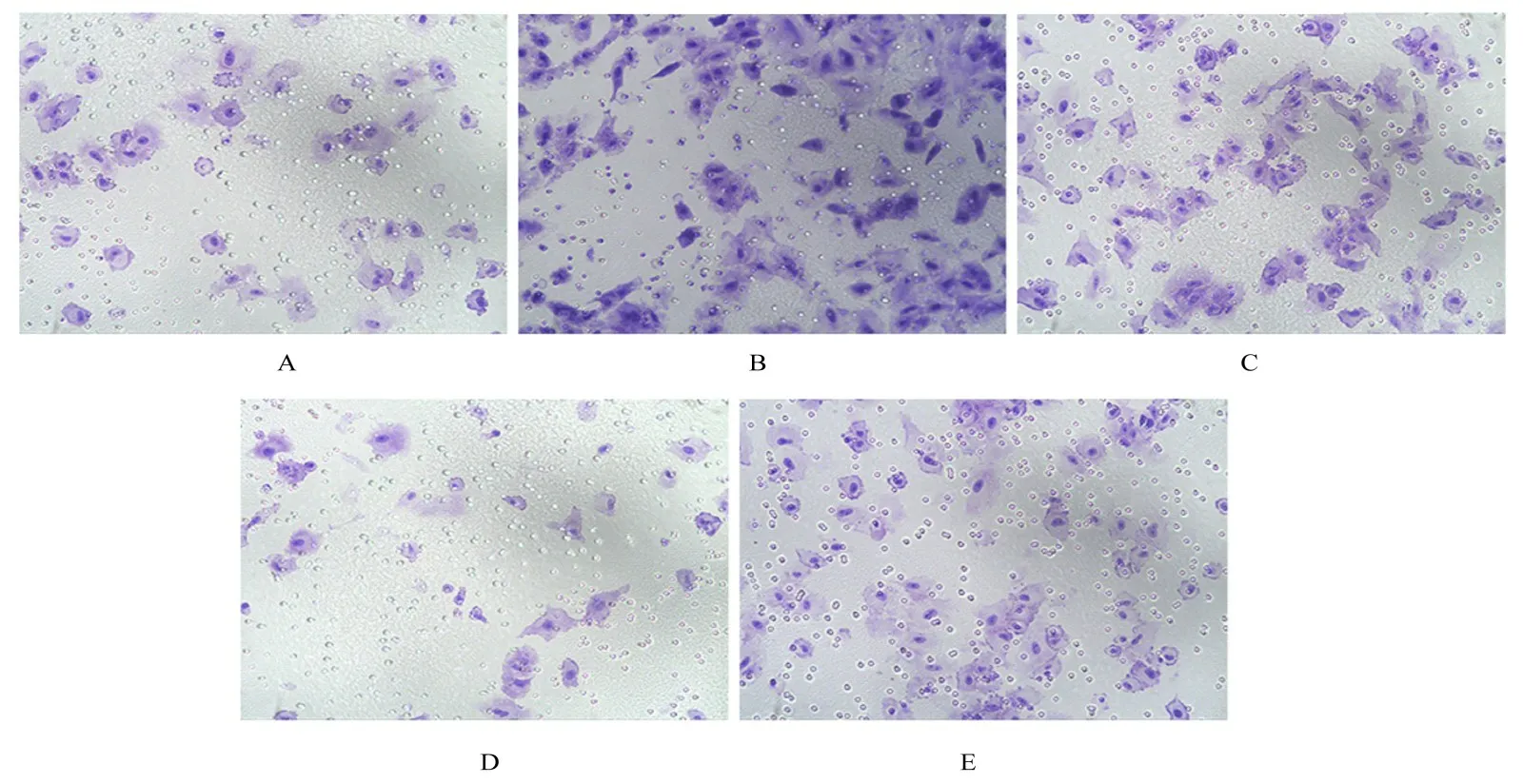
图11 Transwell 小室实验检测各组细胞侵袭情况(结晶紫,×200)Fig.11 Invasion of cells in various groups detected by Transwell chamber assay (Crystal violet,×200)
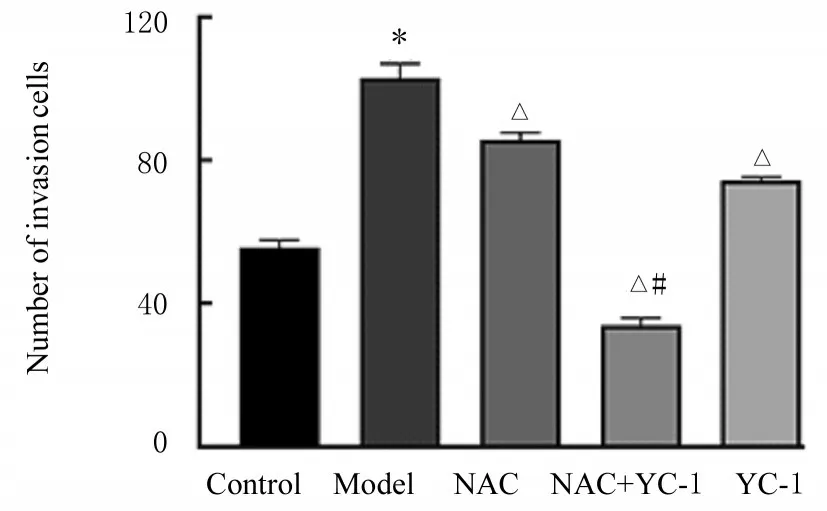
图12 各组侵袭细胞数Fig.12 Numbers of invasion cells in various groups
3 讨 论
缺氧是肺癌患者肿瘤微环境的一个重要特征,肿瘤细胞缺氧时细胞代谢会发生改变,导致脂质积累,使肿瘤细胞免受氧化和内质网应激的影响,并能够促进肿瘤细胞的增殖[12-13]。研究[14]显示:HIF-1α 表达是缺氧的标志,HIF-1α 在维持缺氧状态下肿瘤细胞的增殖和浸润中发挥关键作用。本研究结果显示:A549 细胞在缺氧状态下的时间越长,HIF-1α mRNA 表达水平越高;肿瘤细胞增殖能力随着缺氧时间的延长而逐渐增加,提示缺氧细胞模型构建成功。
缺氧条件下细胞发生氧化应激,引起ROS 的过量合成[15]。本研究结果显示:NAC 与YC-1 效果相同,均能明显降低缺氧细胞模型中ROS 和HIF-1α 水平,且NAC 和YC-1 联合处理细胞时降低ROS 和HIF-1α 水平作用更明显,提示ROS 与HIF-1α 能够相互作用和影响。研究[16]表明:FPR1 与肺癌的发生发展有密切关联,FPR1 表达水平升高能够促进肺癌细胞的迁移和成瘤能力。本研究结果显示:NAC 和YC-1 均可下调FPR1 表达,表明ROS 和HIF-1α 可能通过调节FPR1 的表达来影响肺癌的发生发展。
自噬对于维持应激状态下细胞内稳态具有重要作用,已被证实为包括癌症在内的多种疾病的治疗和干预靶点[17-19]。研究[8-9,20-21]显示:缺氧可介导ROS 和HIF-1α 通过不同的途径促进结肠癌、胰腺癌、胃癌和肺癌等细胞的自噬,并影响肿瘤的发生发展。本研究结果显示:NAC 和YC-1 单独和联合应用均可改变A549 细胞中自噬体结构,并减少细胞器的损伤。微管相关蛋白轻链3(microtubuleassociated protein light chain 3,LC3)是最早被发现的自噬标志物,有LC3-Ⅰ和LC3-Ⅱ两种形式,其中LC3-Ⅱ水平与细胞中自噬体的数量呈正相关关系,是反映细胞自噬活性的重要指标[22-23]。NAC 和YC-1 处理后细胞中LC3-Ⅱ表达明显下调,且NAC 和YC-1 联合处理后LC3-Ⅱ表达最低,表明缺氧条件下抑制HIF-1α 和ROS 水平可抑制肺癌细胞的自噬。NAC 和YC-1 单独和联合处理均可提高缺氧肿瘤细胞凋亡率,并抑制细胞侵袭能力。
综上所述,缺氧条件下抑制HIF-1α/ROS 可通过抑制肺癌细胞自噬促进肿瘤细胞凋亡,并抑制细胞侵袭,进而影响肿瘤的发生发展。
