PAX3 基因沉默对P19 细胞向心肌样细胞分化的影响及其机制
2023-07-18万朝辉雷长城
万朝辉, 曾 良, 李 晶, 雷长城
(1.南华大学衡阳医学院附属第二医院急诊科,湖南 衡阳 421001;2.南华大学衡阳医学院附属第三医院急诊科,湖南 衡阳 421900;3.南华大学衡阳医学院附属第二医院心血管内科,湖南 衡阳 421001)
先天性心脏病 (congenital heart disease,CHD)是最常见的出生缺陷之一,在我国每年有十几万CHD 患儿出生,其严重威胁新生儿健康,给患儿家庭和社会带来沉重负担[1-3]。心脏发育是一个复杂的过程且容易受到干扰,涉及多种信号的精确调控[4-5]。Notch 信号在哺乳动物心脏发育过程中发挥重要作用,参与房室管、主动脉瓣、心室和心脏流出道的发育,Notch 信号突变与多种类型CHD 有关[6-8]。配对盒因子(paired box,PAX)家族是一个高度保守的转录基因家族,普遍存在于多种生物体中[9]。PAX3 作为其中一员,是人体重要的转录调节因子,对于组织和器官的发育和分化均具有重要的调节作用。PAX3 促进胚胎发育和神经嵴(neural crest,NC)形成,胚胎时期NC 细胞活动与心脏的发育有密切关联,NC 细胞是促进心脏流出道分隔发育完善的关键,提示PAX3 可能是维持心脏正常发育的重要转录因子[10-11]。然而,PAX3 是否通过Notch 信号调控心脏发育有待进一步研究。本研究选用P19 细胞,通过体外实验探讨PAX3 对P19 细胞向心肌样细胞分化的影响,阐明其可能作用机制,为CHD 的防治提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器P19 细胞购自美国菌种保藏中心(American Type Culture Collection,ATCC)。α-MEM 培养基和胎牛血清购自美国Invitrogen 公司,二甲基亚砜(dimethyl sulfoxide,DMSO)和嘌呤霉素和4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)购自美国Sigma 公司,反转录试剂盒和实时荧光定量PCR(real-time fluorescence quantitative PCR,RTqPCR)试剂盒购自日本TaKaRa 公司,Notch1 激动剂Jagged1 肽购自美国Anaspec 公司,PAX3 抗体和Notch1 抗体均购自英国Abcam 公司,Notch 胞内结构域(Notch intracellular domain,NICD)抗体、Hes 家族bHLH 转录因子1 (Hes family bHLH traspription factor 1,Hes1)抗体和GAPDH 抗体均购自于美国Cell Signaling Technology 公司,标记辣根过氧化物酶二抗购自北京中杉金桥公司,心肌肌钙蛋白(cardiac troponin,cTn)I 抗体购自深圳重链生物科技有限公司,TRIzol 试剂和IgG488 绿色免疫荧光二抗购自上海碧云天生物技术有限公司。超净工作台(Hfsafe-1500)购自苏州净化设备有限公司,倒置显微镜(BM2100)购自南京江南永新光学有限公司,凝胶成像仪(5200)购自上海天能公司,PCR 扩增仪(5331)购自德国艾本德公司。
1.2 细胞培养和诱导分化P19 细胞加入含10%胎牛血清的α-MEM 完全培养基,置于37℃、5%CO2培养箱中培养。取生长状况良好的对数期细胞用于后续实验。将P19 细胞向心肌样细胞诱导分化,取P19 细胞以1×106mL-1密度接种于含10%胎牛血清的α-MEM 完全培养基的培养皿中,加入1% DMSO 进行诱导,记作第0 天。第2 天进行半量换液,并于第4 天取30~40 个胚胎样小体接种至含10% 胎牛血清的α-MEM 完全培养基(无DMSO)的6 孔细胞培养板中培养,随后每隔2 d进行全量换液,收集诱导第0 天和第10 天的细胞作为0 d 组和10 d 组。
1.3 慢病毒感染和分组取P19 细胞,以每孔2.5×105个细胞密度接种至6 孔细胞培养板中,将细胞分为对照组、sh-NC 组(阴性对照)和sh-PAX3 组(PAX3 干扰)。待细胞密度达到60%时,按照病毒感染比例50∶1 (病毒滴度为1.5×107mL-1)感染细胞5~6 h 后,换液继续培养。48 h 后,加入终浓度为0.5 mg·L-1嘌呤霉素筛选稳定表达细胞株。采用RT-qPCR 法和Western blotting 法检测慢病毒感染后P19 细胞中PAX3 mRNA 和蛋白表达水平以检测PAX3 基因沉默的P19 细胞构建情况。sh-PAX3 及其阴性对照sh-NC慢病毒载体构建、扩增和包装及慢病毒浓缩、纯化和滴度测定均由和元生物技术(上海)股份有限公司完成。在P19 细胞向心肌样细胞诱导分化过程中每次换液为含1 mg·L-1Jagged1 的完全培养基,进行Jagged1 处理。观察诱导过程中细胞形态表现。采用Notch 信号激动剂Jagged1 处理慢病毒感染后的P19 细胞,并用DMSO 诱导分化10 d,将细胞分为DMSO 组、DMSO+sh-NC组、DMSO+sh-PAX3 组、DMSO+Jagged1 组和DMSO+sh-PAX3+Jagged1 组。
1.4 RT-qPCR 法检测各组细胞中GATA 结合蛋白4(GATA binding protein 4,GATA4)、心房利钠尿多肽(atrial natriuretic peptide,ANP)、cTnT、PAX3、Notch1、NICD 和Hes1 mRNA 表达水平采用TRIzol 试剂提取P19 细胞总RNA,分光光度计对RNA 进行定量,采用反转录试剂盒将RNA 逆转录为cDNA,依照RT-qPCR 试剂盒说明书操作,采用RT-qPCR 法检测mRNA 表达水平。引物序列:GATA4 上游引物5′-ACGGAAGCCCAAGAACCTG-3′,GATA4 下游引物5′-GCTGCTGTGCCCATAGTGAG-3′;ANP 上游引物5′-GCTTCCAGGCCATATTGGAG-3′,ANP 下游引物5′-GGGGGCATGACCTCATCTT-3′;cTnT 上游引物5′-GAAGGAAAGGCAGAACCG-3′,cTnT下 游 引 物 5′-ACCCTCCAAAGTGCATCA-3′;PAX3 上游引物5′-CAGCCCACGTCTATTCCACA-3′,PAX3 下游引物5′-CACGAAGCTGTCGGTGTAGC-3′;Notch1 上游引物5′-TGAATGGCGGGAAGTGTGAAG-3′,Notch1 下 游 引 物5′-GGTTGGGGTCCTGGCATCG-3′;NICD 上游引物5′-ACCAATACAACCCTCTGCGG-3′,NICD 下游引物 5′-GGCCCTGGTAGCTCATCATC-3′;Hes1 上游引物5′-GCACAGAAAGTCATCAAAGCC-3′,Hes1 下游引物5′-TTGATCTGGGTCATGCAGTTG-3′;GAPDH 上游引物5′-ACTAGGCGCTCACTGTTCTC-3′,GAPDH下游引物5′-ATCCGTTGACTCCGACCTTC-3′。反应条件:95 ℃预变性10 min,95 ℃、15 s、60 ℃、1 min,共40 个循环。以GAPDH 为内参,采用2-ΔΔCt法计算目的基因表达水平。
1.5 Western blotting 法检测各组细胞中PAX3、Notch1、NICD 和Hes1 蛋白表达水平RIPA 裂解缓冲液裂解各组细胞,提取总蛋白,并采用BCA法对蛋白进行定量。各组取30 μg 蛋白进行SDSPAGE 电泳分离并转至PVDF 膜。5% 脱脂奶粉封闭2 h,加一抗PAX3(1∶200)、Notch1(1∶500)、NICD (1∶1 000)、Hes1 (1∶500)和GAPDH(1∶1 000),4 ℃轻摇过夜。加入二抗室温孵育1 h,采用化学发光法检测目的蛋白条带。采用Image J 软件分析蛋白条带灰度值,以GAPDH 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.6 免疫荧光染色法检测各组细胞中cTnI 阳性表达情况和心肌样细胞分化率P19 细胞诱导分化第9 天,将细胞以每孔2.5×105mL-1的密度接种至放有盖玻片的6 孔细胞培养板中,培养24 h。吸弃培养基,PBS 缓冲液轻洗盖玻片上的细胞,4% 多聚甲醛室温固定15 min,加入0.4% Triton X-100透化20 min,采用5% 山羊血清封闭30 min;加cTnI 单克隆抗体(1∶50),4 ℃孵育过夜;加IgG488 荧光二抗(1∶500),室温避光孵育30 min;加入DAPI 复染细胞核,滴加防猝灭剂封片。将封好的玻片置于荧光显微镜下观察拍照,每组随机选择5 个视野,对cTnI 阳性细胞进行计数,计算各组心肌样细胞分化率。心肌样细胞分化率=cTnI 阳性细胞数/总细胞数×100%。
1.7 统计学分析采用SPSS 22.0 统计软件进行统计学分析。0 d 组和10 d 组细胞中GATA4、ANP 和cTnT mRNA 表达水平及PAX3、Notch1、NICD 和Hes1 mRNA 和蛋白表达水平,各组细胞中PAX3 mRNA 和蛋白表达水平,GATA4、ANP和cTnT mRNA 表达水平,Notch1、NICD 和Hes1蛋白表达水平,心肌样细胞分化率均符合正态分布且方差齐,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 P19 细胞向心肌样细胞诱导分化后形态表现
P19 细胞在复苏贴壁后,经1% DMSO 诱导分化,第3 天可以观察到胚胎样小体,第7 天胚胎样小体生长晕中细胞迅速生长,第10 天胚胎样小体生长晕中细胞连成一片,并可以观察到自发性节律收缩的心肌样细胞簇。见图1。

图1 P19 细胞向心肌样细胞诱导分化后形态表现(×200)Fig.1 Morphology of P19 cells after induction and differentiation into cardiomyocyte-like cells(×200)
2.2 慢病毒感染后P19 细胞中PAX3 mRNA 和蛋白表达水平RT-qPCR 和Western blotting 法检测结果显示:慢病毒感染后,与对照组和sh-NC 组比较,sh-PAX3 组P19 细胞中PAX3 mRNA 和蛋白表达水平均降低(P<0.05),表明PAX3 基因沉默的P19 细胞构建成功。见图2 和3。
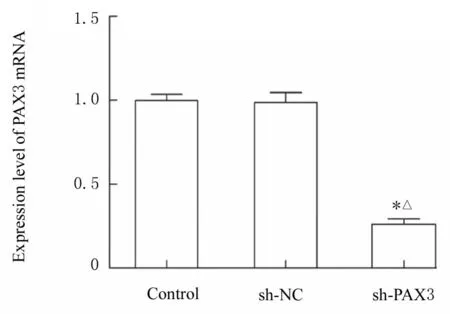
图2 慢病毒感染后P19 细胞中PAX3 mRNA 表达水平Fig.2 Expression levels of PAX3 mRNA in P19 cells after infected with lentivirus
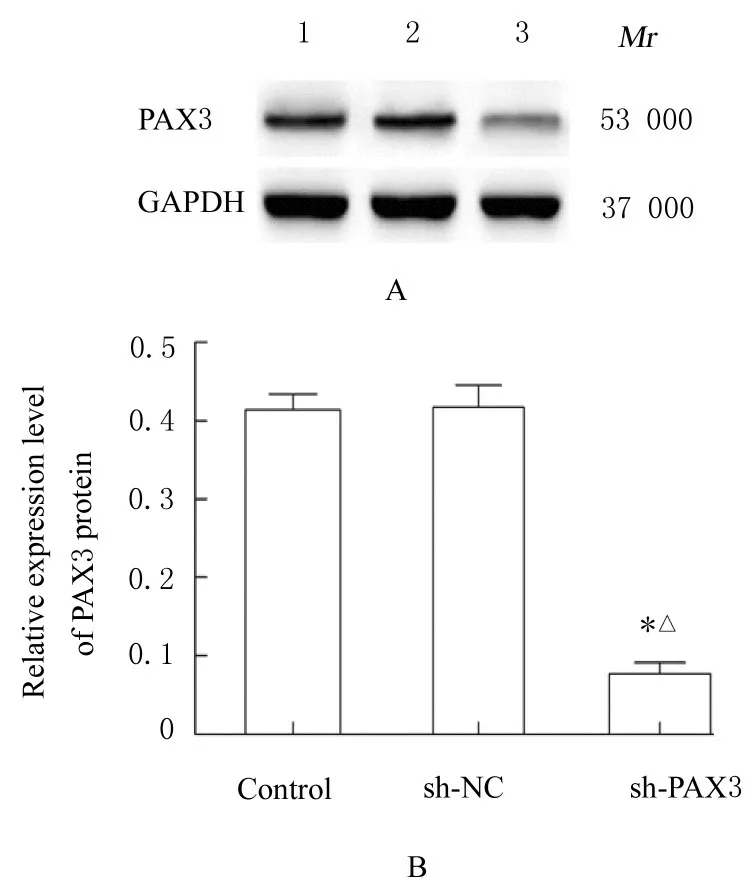
图3 慢病毒感染后P19 细胞中PAX3 蛋白表达电泳图(A)和直条图(B)Fig.3 Elelctrophoregram(A) and histogram(B) of expressions of PAX3 protein in P19 cells after infected with lentivirus
2.3 各组细胞中GATA4、ANP、cTnT、PAX3、Notch1、NICD 和Hes1 mRNA 表达水平RTqPCR 法检测结果显示:DMSO 诱导P19 细胞向心肌样细胞分化,与0 d 组比较,10 d 组细胞中GATA4、ANP 和cTnT mRNA 表达水平均升高(P<0.05),表明成功诱导P19 细胞向心肌样细胞分化。与0 d 组比较,10 d 组细胞中PAX3、Notch1、NICD 和Hes1 mRNA 表达水平均升高(P<0.05)。见图4。
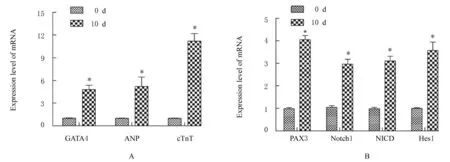
图4 诱导分化过程中细胞中目的基因mRNA 表达水平Fig.4 Expression levels of target gene mRNA in cells during process of induction and differentiation
慢病毒感染后,与DMSO 组和DMSO+sh-NC 组比较,DMSO+sh-PAX3 组细胞中GATA4、ANP 和cTnT mRNA 表达水平均降低(P<0.05)。与DMSO 组和DMSO+sh-NC 组比较,DMSO+Jagged1 组细胞中GATA4、ANP 和cTnT mRNA表达水平均升高(P<0.05)。与DMSO+sh-PAX3组比较,DMSO+sh-PAX3+Jagged1 组细胞中GATA4、ANP 和cTnT mRNA 表达水平均升高(P<0.05)。见图5。
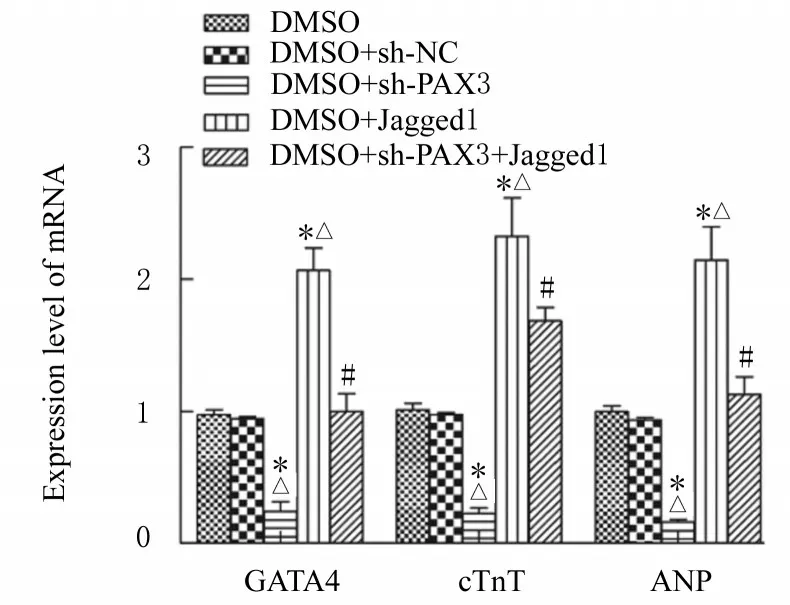
图5 慢病毒感染后各组细胞中GATA4、cTnT 和ANP mRNA 表达水平Fig.5 Expression levels of GATA4, cTnT, and ANP mRNA in cells in various groups after infected with lentivirus
2.4 各组细胞中PAX3、Notch1、NICD 和Hes1 蛋白表达水平Western blotting 法检测结果显示:DMSO 诱导P19 细胞向心肌样细胞分化,与0 d 组比较,10 d 组细胞中PAX3、Notch1、NICD 和Hes1 蛋白表达水平均升高(P<0.05)。见图6。
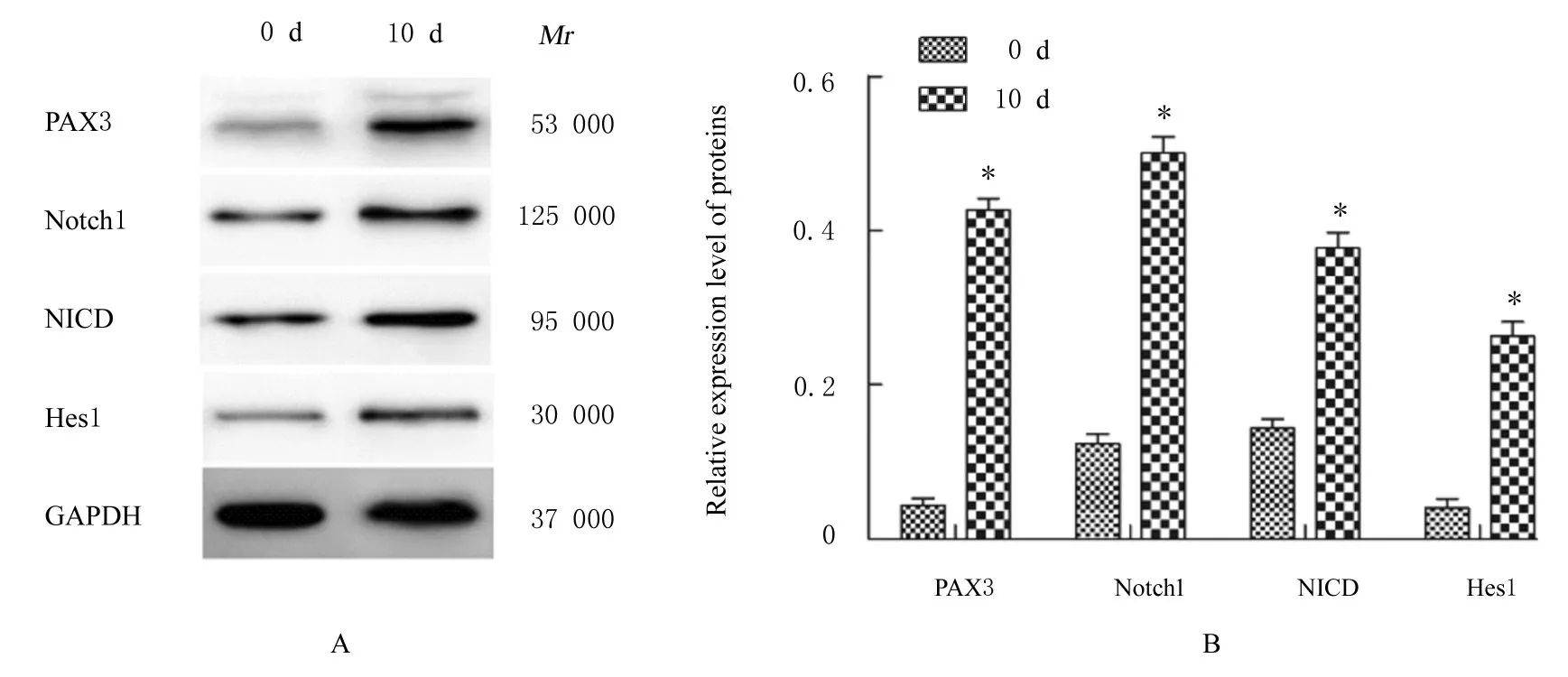
图6 Western blotting 法检测2 组细胞中PAX3、Notch1、NICD 和Hes1 蛋白表达电泳图(A)和直条图(B)Fig.6 Electrophoregram (A) and histogram(B) of expressions of PAX3,Notch1,NICD,and Hes1 proteins in cells in two groups detected by Western blotting method
慢病毒感染后,与DMSO 组 和 DMSO+sh-NC 组比较,DMSO+sh-PAX3 组细胞中Notch1、NICD 和Hes1 蛋白表达水平均降低(P<0.05),而DMSO+Jagged1 组细胞中Notch1、NICD 和Hes1 蛋白表达水平均升高(P<0.05)。与DMSO+sh-PAX3 组比较,DMSO+sh-PAX3+Jagged1 组细胞中Notch1、NICD 和Hes1 蛋白表达水平均升高(P<0.05)。见图7。
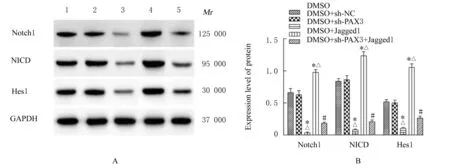
图7 慢病毒感染后各组细胞中Notch1、NICD 和Hes1 蛋白表达电泳图(A)和直条图(B)Fig.7 Electrophoregram (A) and histogram(B) of expressions of Notch1,NICD,and Hes1 proteins in cells in various groups after infected with lentivirus
2.5 各组细胞中cTnI 蛋白阳性表达和心肌样细胞分化率免疫荧光法检测结果显示:慢病毒感染后,各组细胞中均有cTnI 蛋白阳性表达,与DMSO 组(65.02%±5.66%)和DMSO+sh-NC组(62.73%±3.15%)比较,DMSO+sh-PAX3组细胞中cTnI 蛋白阳性表达减少,心肌样细胞分化率(14.18%±7.03%)降低(P<0.05)。与DMSO 组和DMSO+sh-NC 组比较,DMSO+Jagged1 组细胞中cTnI 蛋白阳性表达增加,心肌样细胞分化率 (88.38%±5.15%)升高 (P<0.05)。与DMSO+sh-PAX3 组比较,DMSO+sh-PAX3+ Jagged1 组细胞中cTnI 蛋白阳性表达增加,心肌样细胞分化率(41.88%±6.07%)升高(P<0.05)。见图8 和9。
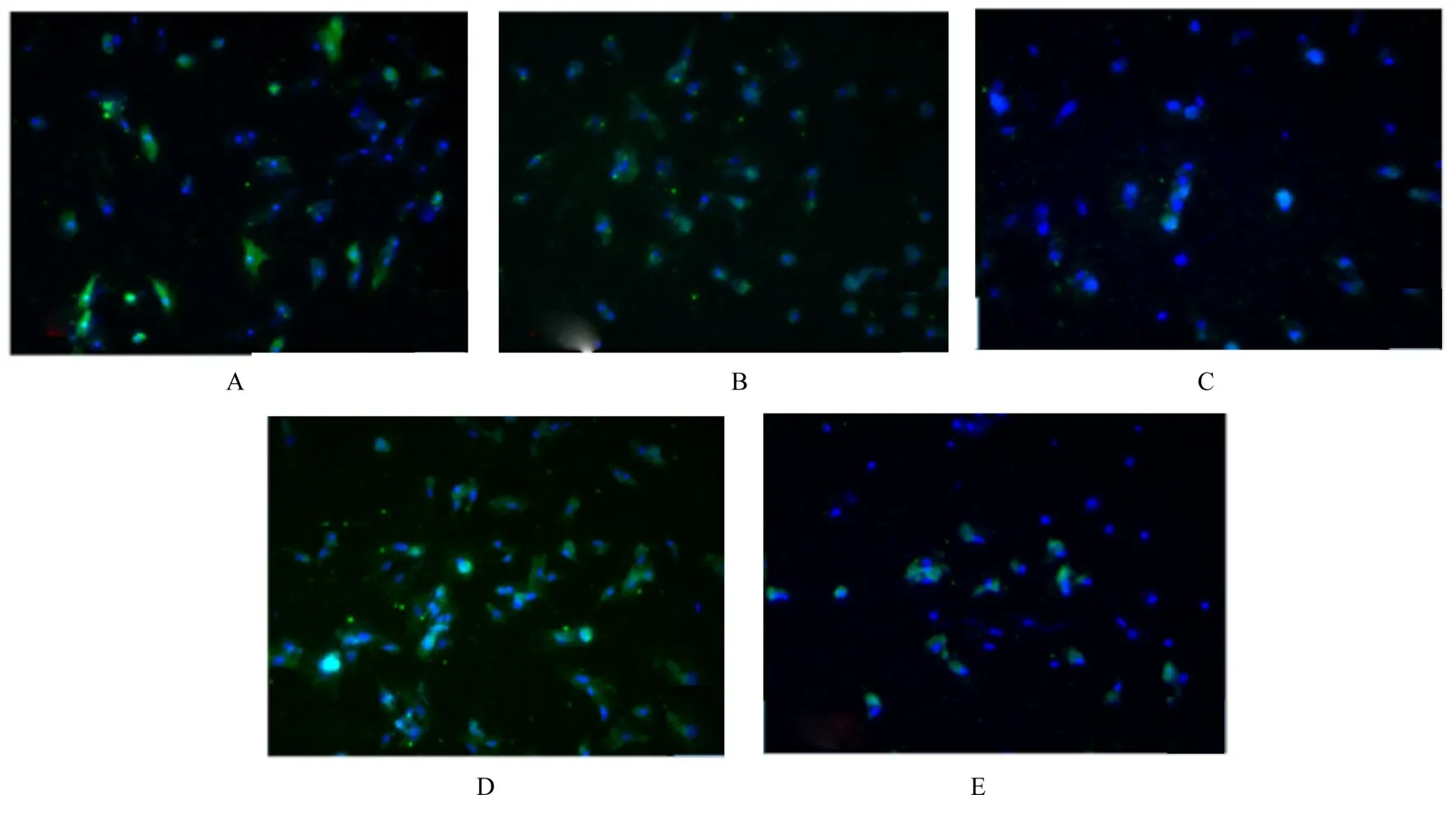
图8 慢病毒感染后各组心肌样细胞中cTnI 蛋白表达(×200)Fig.8 Expressions of cTnI protein in cardiomyocytes in various groups after infected with lentivirus(×200)
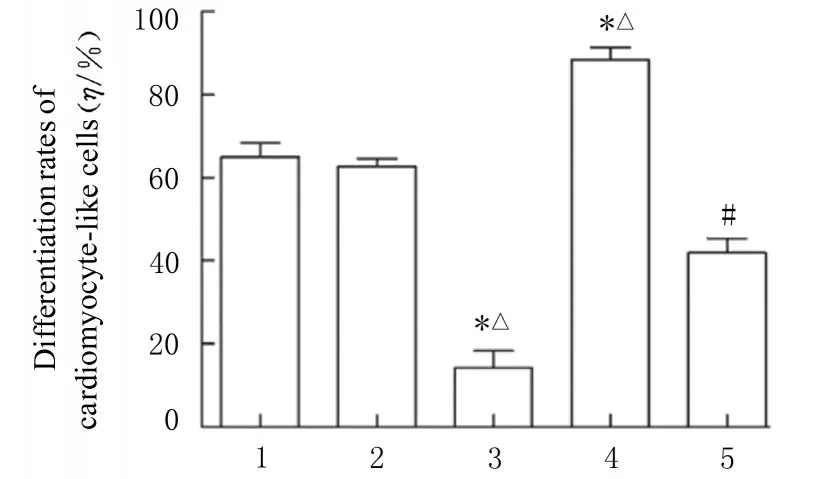
图9 慢病毒感染后各组心肌样细胞分化率Fig.9 Differentiation rates of cardiomyocyte-like cells in various groups after infected with lentivirus
3 讨 论
PAX 家族是一个高度保守的转录基因家族,普遍存在于多种生物体中,其中成员PAX3 是人体重要的转录调节因子,其基因位于人类2 号染色体长臂上,对于组织和器官的发育及分化均具有重要的调节作用[10]。NC 细胞是一种多能胚胎细胞群,在神经板边缘形成,随后在整个胚胎中迁移,可分化为多种细胞类型,包括周围神经系统的神经元和神经胶质细胞、颅面软骨细胞、平滑肌细胞和色素细胞等[12-13]。NC 可轴向分为颅NC 和躯干NC,其中只有前颅NC 可以分化成软骨、骨骼、结缔组织和平滑肌。心脏NC(cardiac NC,CNC)细胞是NC 的亚群之一,其迁移并有助于咽弓动脉的重塑和心脏流出道的分隔[12]。PAX3 可以促进NC 细胞迁移,并且其功能丧失会导致NC 细胞增殖、存活及分化的缺陷,使CNC 逐渐消失,进而导致主肺动脉间隔形成缺陷及主动脉和肺动脉的结构异常[10,14]。研究[15]显示:PAX3 基因的甲基化水平与CHD 密切相关,提示PAX3 可能是维持心脏正常发育的重要转录因子。P19 细胞系可分化为内胚层表型、中胚层表型和神经元表型,在低浓度DMSO 处理下,聚集并被诱导分化为心肌样细胞,被广泛用作体外心肌样细胞分化的心肌样细胞模型[4]。本研究结果显示:在分化过程中PAX3 基因mRNA 和蛋白表达水平均升高。通过DMSO 诱导分化sh-PAX3 慢病毒感染的P19 细胞,发现下调PAX3 基因表达可抑制P19 细胞向心肌样细胞分化。
Notch 信号通路在哺乳动物心脏发育过程中发挥重要作用,其参与房室管、主动脉瓣、心室和流出道的发育,并且可以促进心肌再生,避免心肌缺血,诱导血管生成,抑制心脏成纤维细胞向肌成纤维细胞转化,具有心脏保护作用,而且异常的Notch 信号与多种类型的CHD 有关[6,16-17]。研究[18]显示:在小鼠模型中,miR-34a 通过调节Notch 信号通路下调Notch1,从而增加CHD 的风险。本研究结果显示:P19 细胞向心肌样细胞诱导分化过程中Notch 信号通路关键基因Notch1、NICD 和Hes1 mRNA 表达水平均升高,而PAX3 基因 mRNA 表达水平降低后,P19 细胞向心肌样细胞诱导分化被抑制,同时细胞中Notch1、NICD 和Hes1 等蛋白表达水平均降低。研究[19]报道:miR-25-3p 下调ADAM10 表达阻断Notch 信号通路可以抑制P19 细胞向心肌样细胞分化。研究[20]显示:PAX3 在骨骼肌原性谱系中可激活Notch 信号通路。本研究结果显示:Jagged1 处理细胞可以显著逆转由于下调PAX3 基因表达对P19 细胞向心肌样细胞分化的抑制作用,同时上调Notch 信号通路相关蛋白Notch1、NICD 和Hes1 蛋白的表达。提示PAX3 基因沉默可能通过抑制Notch 信号通路影响P19 细胞向心肌样细胞分化。
综上所述,PAX3 基因在P19 细胞向心肌样细胞分化过程中表达上调,该基因沉默可抑制P19 细胞向心肌样细胞分化,其机制可能是通过降低PAX3 基因表达抑制Notch 信号通路活化实现的。
