水消毒副产物卤代苯醌的结构与毒性分析
2023-07-18杜海英姜永莉韦英惯李金华卢日峰
杜海英, 姜永莉, 韦英惯,3, 李金华, 卢日峰
(1.吉林大学公共卫生学院卫生毒理学教研室,吉林 长春 130021;2.吉林国际旅行卫生保健中心长春海关口岸门诊部,吉林 长春 130062;3.广西壮族自治区河池市疾病预防控制中心,广西 河池 547000)
卤代苯醌(halobenzoquinones,HBQs)是一类新型未受控水消毒副产物(disinfection byproducts,DBPs),在消毒处理后的饮用水和泳池水中均有检出[1-2]。QIN 等[3]于2009 年首次在氯和氯胺消毒饮用水中检出2,6-二氯-1,4-苯醌(2,6-dichloro-1,4-benzoquinone,2,6-DCBQ)。目前,在消毒水中已测得的HBQs 有12 种[1]。流行病学和定量构效关系研究[4]表明:HBQs 是一类具有致癌风险的DBPs。HBQs 可观察到的有害效应最低水平 (lowest observed adverse effect levels,LOAELs)较常见的DBPs 如三卤代甲烷和卤代乙酸低1 000 倍[5],表明HBQs 具有更强的毒性。HBQs 的毒性特征与其结构密切相关。HBQs 是一类结构多样的化合物,取代基团的种类、数量和取代位置均会影响其毒性[6]。目前,关于HBQs 的研究尚不多见。因此,针对HBQs 类化合物定量结构-毒 性 关 系 (quantitative structure-toxicity relationship,QSTR)的进一步研究具有重要意义。本研究选取水DBPs 中的5 种HBQs,通过细胞毒性检测获取细胞生长的半数抑制浓度(median inhibitory concentration,IC50),探讨不同取代基HBQs 的QSTR,分析影响HBQs 细胞毒性的结构参数,为预测HBQs 潜在的健康风险提供参考。
1 材料与方法
1.1 细胞、主要试剂和仪器人肝癌HepG2 细胞由吉林大学公共卫生学院卫生毒理学实验室保存。2,6-DCBQ(CAS#697-91-6)、2,5-二溴-1,4-苯醌(2,5-dibromo-1,4-benzoquinone,2,5-DBBQ)(CAS#1633-14-3)和中性红摄取试验(neutral red uptake,NRU)试剂盒(美国Sigma 公司),2,6-二溴-1,4-苯醌(2,6-dibromo-1,4-benzoquinone,2,6-DBBQ)(CAS#19643-45-9)和2,6-二氯-3-甲基-1,4- 苯 醌 (2,6-dichloro-3-methyl-1,4-benzoquinone,DCMBQ)(CAS#40100-98-9,加拿大TRC 公司),2,3,6-三氯-1,4-苯醌(2,3,6-trichlorocyclohexa-1,4- benzoquinone,TCBQ)(CAS#634-85-5,上海艾康睿医药科技有限公司),MTS 检测试剂盒(美国Promego 公司),DMEM培养基和胎牛血清(fetal bovine serum,FBS)(美国Gibco 公司)。荧光酶标仪(美国Bio-Rad 公司)。
1.2 细胞培养和分组取对数生长期HepG2 细胞制备单细胞悬液,细胞终浓度为1×104mL-1,细胞悬液以每孔100 μL 的密度接种于96 孔细胞培养板,每组5 个平行孔,继续培养24 h 后,弃原液,采用不同浓度HBQs 溶液作用细胞。HBQs 原液由甲醇(methanol,MeOH)溶解配制,稀释后HBQs 溶液中MeOH 浓度均低于1.33%。采用含10%FBS 的DMEM 培养基稀释至实验所需浓度。实验设空白对照组(10%FBS+DMEM 培养基)和阴性对照组(10%FBS+DMEM 培养基+1.33% MeOH)。
1.3 MTS 法检测人肝癌HepG2 细胞存活率人肝癌HepG2 细胞给予不同浓度HBQs 培养24 h 后,于96 孔细胞培养板中每孔加入20 μL MTS 溶液,继续培养4 h,室温下震荡10 min,采用荧光酶标仪于490 nm 波长处检测吸光度(A)值,计算细胞存活率。每个作用浓度重复试验 3 次,以log[HBQ]为横坐标,细胞存活率为纵坐标绘制剂量-反应曲线。细胞存活率=(实验组A 值-空白对照组A 值)/(阴性对照组A 值-空白对照组A 值)×100%。
1.4 NRU 法检测人肝癌HepG2 细胞存活率人肝癌HepG2 细胞给予不同浓度HBQs 培养24 h 后,于96 孔培养板中每孔加入1%中性红溶液20 μL,37 ℃孵育2 h,弃原液,PBS 缓冲液冲洗1 次,每孔加入50 μL 助溶剂(1%乙酸溶于50%MeOH),震荡混匀10 min,采用荧光酶标仪于540 nm 波长处检测A 值,计算细胞存活率。每个作用浓度重复试验3 次,绘制剂量-反应曲线。细胞存活率=(实验组A 值-空白对照组A 值)/(阴性对照组A 值-空白对照组A 值)×100%。
1.5 HBQs 对人肝癌HepG2 细胞的细胞毒性检测采用OriginPro 8.5 统计软件计算不同浓度HBQs 作用24 h 时各组细胞IC50,即细胞存活率达到50%时抑制剂的浓度,并计算lgIC50。以各组细胞IC50代表HBQs 对人肝癌HepG2 细胞的细胞毒性。
1.6 HBQs 结构参数的选择和计算根据参考文献[6]预测可能会影响HBQs 细胞毒性的结构参数,包括辛醇-水分配系数(logP)、解离常数(pKa)、摩尔折射率(R)、摩尔表面积(S)、摩尔体积(V)、偶极矩(μ)、最高占据轨道能量(EHOMO)和最低未占轨道能量(ELUMO)。采用量子化学计算模块MOPAC 计算各HBQs 的结构参数。
1.7 QSTR 模型构建采用单因素线性回归分析方法,根据每种HBQs 的lgIC50和HBQs 结构参数构建QSTR 模型,分析每种HBQs 的lgIC50与HBQs 结构参数的相关性。
1.8 统计学分析采用SPSS 18.0 统计软件和GraphPad Prism 5 软件进行统计学分析和绘图。每种HBQs 的IC50与HBQs 结构参数相关性分析采用单因素线性回归分析方法。以P<0.05 为差异有统计学意义。
2 结 果
2.1 MTS 法和NRU 法检测HBQS 的作用浓度
MTS 法确定HBQs 的作用浓度:2,6-DCBQ为75、100、125、150、175、200、225 和250 μmol·L-1,DCMBQ 为175、200、225、250、275、300 和325 μmol·L-1,TCBQ 为200、225、250、275、300 和325 μmol·L-1,2,5-DBBQ 为75、100、125、150、175 和200 μmol·L-1,2,6-DBBQ为200、225、250、275、300 和325 μmol·L-1。NRU 法确定HBQs 的作用浓度:2,6-DCBQ 为25、50、75、100 和125 μmol·L-1,DCMBQ 为125、150、175、200、225 和250 μmol·L-1,TCBQ 为175、200、225、250、275 和300 μmol·L-1,2,5-DBBQ 为75、100、125、150 和175 μ mol·L-1,2,6-DBBQ 为125、150、175、200 和225 和250 μmol·L-1。
2.2 MTS 法检测人肝癌HepG2 细胞存活率和IC50各组HepG2 细胞存活率随HBQs 浓度的升高明显降低,呈现剂量-反应关系。见图1。5 种HBQs 的 IC50见表1。以IC50代表细胞毒性,IC50越低,HBQs 的细胞毒性越大。5 种HBQs 对HepG2细胞毒性作用为 2,6-DCBQ>2,5-DBBQ>DCMBQ>TCBQ>2,6-DBBQ。
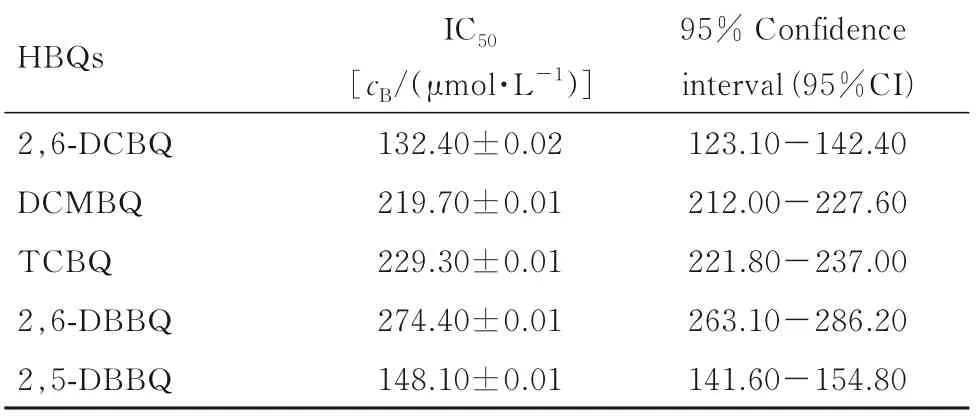
表1 MTS 法检测HBQs 作用于HepG2 细胞的IC50Tab.1 IC50 of HBQs on HepG2 cells detected by MTS method(n=3)
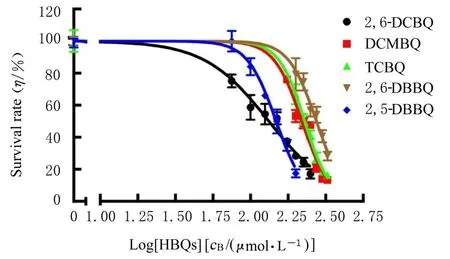
图1 MTS 法检测各组HepG2 细胞存活率与HBQs 的剂量-反应曲线Fig.1 Dose-response curves of survival rates of HepG2 cells and HBQs in various groups detected by MTS method
2.3 NRU 法检测人肝癌HepG2 细胞存活率和IC50各组HepG2 细胞存活率,随HBQs 浓度的升高明显降低,呈剂量-反应关系,见图2。5 种HBQs 的 IC50见表2。5 种HBQs 对HepG2 细胞毒性作用为2,6-DCBQ>2,5-DBBQ>DCMBQ>2,6-DBBQ>TCBQ。

表2 NRU 法检测HBQs 作用于HepG2 细胞的IC50Tab.2 IC50 of HBQs on HepG2 cells detected by NRU method(n=3)

图2 NRU 法检测各组HepG2 细胞存活率与HBQs 的剂量-反应曲线Fig.2 Dose-response curves of survival rates of HepG2 cells and HBQs in various groups detected by NRU method
2.4 HBQs 的结构参数采用量子化学计算模块MOPAC 计算5 种HBQs 的结构参数,HBQs 结构参数见表3。
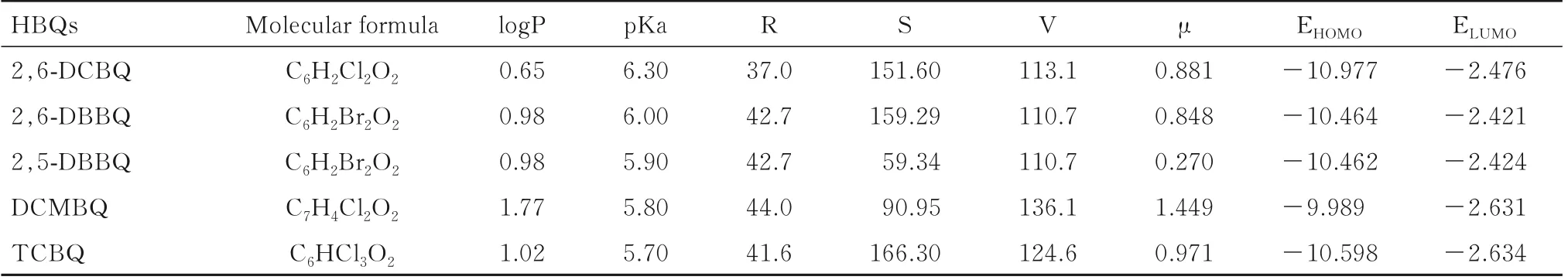
表3 HBQs 的结构参数Tab.3 Structural parameters of HBQs
2.5 单因素线性回归分析QSTR 模型MTS 法和NRU 法检测HBQs 的lgIC50与HBQs 结构参数之间相关性较低(R2<0.5),差异无统计学意义(P>0.05)。见表4。由于DCMBQ 包含1 个甲基取代基和2 个卤素取代基,而其他HBQs 仅包含卤素取代基,DCMBQ 与其他HBQs 在结构上存在差异,因此从总体数据中剔除了DCMBQ,再对4 种HBQs的lgIC50与HBQs 结构参数进行单因素线性回归分析,MTS 法和NRU 法检测4 种HBQs 的lgIC50与HBQs结构参数之间相关性较低(R2<0.5),差异无统计学意义(P>0.05)。见表5。
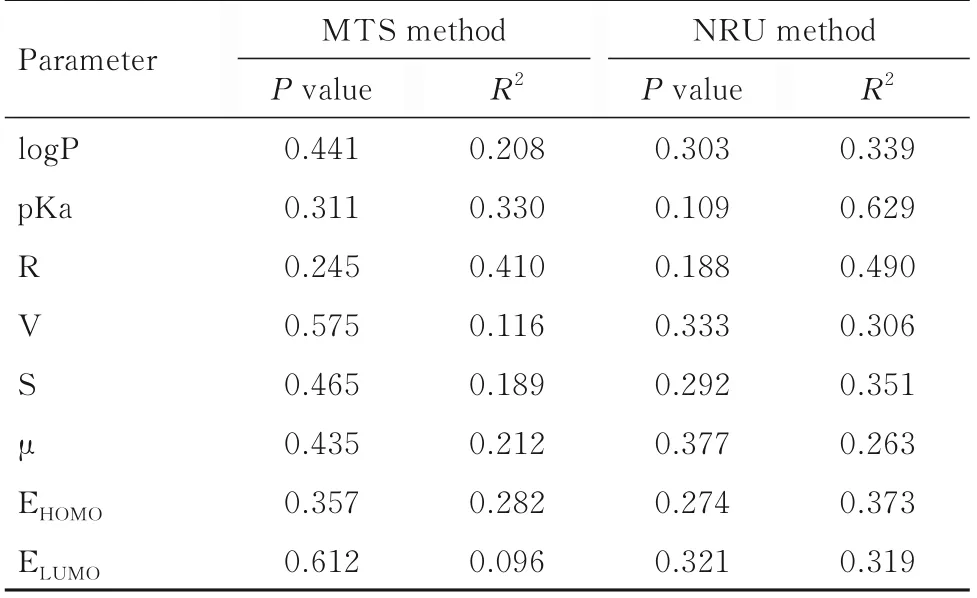
表4 MTS 和NRU 法检测HBQs 的lgIC50 与HBQs 结构参数的相关性Tab.4 Correlations between lgIC50 of HBQs and structural parameters of HBQs detected by MTS and NRU methods
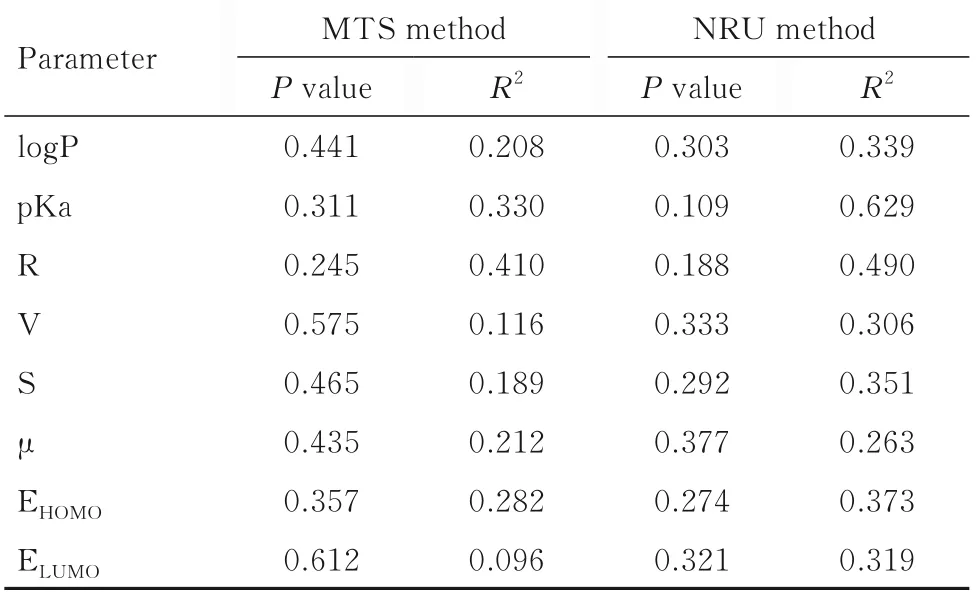
表5 MTS 和NRU 法检测剔除DCMBQ 后HBQs 的lgIC50与HBQs 结构参数的相关性Tab.5 Correlations between lgIC50 of HBQs and structural parameters of HBQs after removal of DCMBQ detected by MTS and NRU method
3 讨 论
人肝癌HepG2 细胞有较完整的代谢酶,是进行毒理学试验特别是遗传毒物检测中常用的细胞。目前关于HBQs 及其代谢产物尚未完全阐明,有研究[5]表明HBQs 具有潜在的遗传毒性和致癌性。因此,本研究采用HepG2 细胞探讨HBQs 的细胞毒性作用,结果表明:5 种HBQs 对HepG2 细胞的作用浓度范围差异较大,其检测到最低有效作用浓度的差异较大,表明5 种HBQs 的细胞毒性存在显著差异。采用MTS 法和NRU 法检测每种HBQs 细胞毒性作用大小的顺位结果基本一致,其差异在于2,6-DBBQ 和TCBQ 的细胞毒性大小不同,可能与两种方法的检测机制不同有关。
本研究结果显示:与2,6-DBBQ 比较,2,5-DBBQ 对HepG2 细胞的毒性作用更大,表明在HBQs 的同分异构体中,卤素原子不同的取代位置可影响HBQs 类化合物的毒性,其毒性大小与卤代原子的数量亦有相关性。ZUO 等[7]研究显示:CHO-K1 细胞经HBQs 染毒6、12 和24 h 后,2,5-DBBQ 和2,5-DCBQ 的细胞毒性均明显高于相应的2,6-HBQ 异构体;且氯代HBQs 的细胞毒性随1、2、3或4个氯取代基的存在而变化。LECURIEUX等[8]研究发现:在比较相同的异构结构时,HBQs 的氯代、溴代和碘代细胞毒性呈递减趋势,即二碘-HBQ >二溴- HBQ >二氯-HBQ。此结果与报道的其他DBPs 的细胞毒性一致,如卤乙酸,其中碘乙酸>溴乙酸>氯乙酸[9-11],该毒性顺位存在于多种哺乳动物和人类细胞系中,证实HBQs 的异构结构、取代原子种类和数量可以明显影响其产生的细胞毒性作用。
化学物质的理化性质可影响其在细胞内的吸收、代谢、生物转化和在细胞内外的转运。本研究选取8 种可能会影响HBQs 细胞毒性的结构参数,并采用量子化学计算模块MOPAC 计算HBQs 的结构参数。ELUMO代表电子的亲和度,与自由基代谢物形成的还原电位相关性较大[12-14]。LIU 等[15]使用双参数多线性回归分析评估ELUMO与HBQs 细胞毒性的相关性,结果表明两者之间有较好的相关性。与ELUMO比较,EHOMO具有供电子能力,且与氧化电位相关性较大[16]。ELUMO和EHOMO均可代表氧化还原电位[17]。在芳香卤代DBPs 的发育毒性比较研究[18]中发现:EHOMO是影响毒性比较重要的理化参数。反映分子的平均电荷分离和电子分布,S 和R均可用来描述分子的三维结构[19]。QSTR 研究[20]显示:R 与BQ 化合物诱导的人肝细胞毒性呈中度相关。logP 描述了物质在油质与水质两相中的分配特点。PLEWA 等[10]研究发现:logP 与DBPs 的细胞毒性和遗传毒性均具有较大相关性。但也有研究[7,21]认为logP 与细胞毒性不相关,在QSTR 研究中,最常使用的定量分析方法是线性回归分析[22]。本研究通过单因素多元线性回归分析,采用MTS 法和NRU 法测得HBQs 的lgIC50与结构参数之间相关性较低,未能建立起QSTR。这可能是由于样本数较少,难以对结构参数进行较为准确的估计和计算,使分析结果产生较大的偏差。此外,在计算结构参数前,需要将化合物的结构图规则化,否则会因手绘角度的差别而造成计算出的参数产生偏差,以致准确值难以重现,使结构参数值的计算结果不够准确和数据分析结果无统计学意义。
综上所述,HBQs 类化合物中卤素原子的取代位置和种类可影响其对HepG2 细胞的毒性作用,苯环上卤素的取代基数量也可影响其细胞毒性,并呈现卤素取代越多其毒性越小的趋势。
