沉默CD147 对前列腺癌LNCaP 细胞糖酵解的影响
2023-07-18张斯琦孙美琪李泽颢刘丹丹王国庆
张斯琦, 孙美琪, 李泽颢, 刘丹丹, 胡 城, 方 芳, 王国庆
(1.北华大学医学技术学院临床生化检验教研室,吉林 吉林 132013;2.吉林医药学院检验学院免疫学技术教研室,吉林 吉林 132013)
肿瘤细胞中的能量代谢与正常细胞不同,其倾向于进行活跃的葡萄糖摄取和有氧条件下的糖酵解,即Warburg 效应。研究[1]显示:糖酵解促进了肿瘤进展和不良预后。前列腺癌(prostate cancer,PCa)是全球男性发病率排名第二位的肿瘤,已经成为影响全球男性健康的主要原因之一[2]。肿瘤细胞具有独特的葡萄糖代谢特点,在PCa 细胞移植瘤模型中,药物联合靶向Warburg 效应和自噬导致肿瘤消退[3]。CD147 是免疫球蛋白超家族Ⅰ型跨膜糖蛋白,在多种癌细胞中高表达[4]。PCa 发展与CD147 表达密切相关[5]。研究[6]表明:在胰腺导管腺癌细胞中,低表达CD147 可降低丙酮酸激酶M2(pyruvate kinase M2,PKM2)蛋白表达水平进而抑制糖酵解作用。在肝星状细胞中,低表达的CD147 抑制糖酵解相关蛋白乳酸脱氢酶(lactic dehydrogenase,LDH)活性和己糖激酶(hexokinase,HK)2 及葡萄糖转运蛋白1(glucose transporter 1,Glut1)的表达[7]。CD147 可通过多种方式调节肿瘤细胞的糖酵解作用。但CD147 对PCa 细胞糖酵解的作用及其机制尚未完全阐明。因此,本研究通过构建低表达CD147 的PCa 细胞系LNCaP,分析糖酵解中的产物及催化糖酵解限速酶的活性,探讨CD147 对PCa 细胞糖酵解的影响,为PCa 临床诊断和治疗提供新的分子标志物及其靶点。
1 材料及方法
1.1 细胞、主要试剂和仪器LNCaP/shCD147 细胞和阴性对照LNCaP/scramble 细胞由本实验室保存[8]。RPMI-1640、胎牛血清(fetal bovine serum,FBS)、胰酶和青-链霉素双抗购自美国Gibco 公司,反转录试剂盒和实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR)试剂盒购自美国Gene Copoeia 公司,PCR 引物由上海生工生物工程股份有限公司合成,β-actin、CD147、PKM2、HK2 和 肌 肉 磷 酸 果 糖 激 酶(phosphofructokinase of muscle,PFKM)抗体购自美国Signalway Antibody 公司,BCA 蛋白浓度检测试剂盒购自沈阳万类生物科技有限公司,丙酮酸激酶(pyruvate kinase,PK)活性、HK 活性、6-磷酸果糖激酶1(6-phosphofructokinase 1,PFK1)活性检测试剂盒和总RNA 提取试剂盒购自北京索莱宝公司,腺嘌呤核苷三磷酸 (adenosine triphosphate,ATP)试剂盒购自美国Biovision 公司,乳酸(lactic acid,LA)和丙酮酸(pyruvic acid,PA)试剂盒购自上海酶联生物公司。凝胶成像仪购自美国Bio-Rad 公司,多功能荧光酶标仪购自德国BMG 公司,掌上离心机购自美国Scilogex 公司,RT-qPCR仪购自美国Applied Biosystems公司。
1.2 细胞培养和分组利用慢病毒感染系统建立沉默CD147 的LNCaP/shCD147 细胞作为LNCaP/shCD147 组,同时将LNCaP/scramble 细胞作为阴性对照组(LNCaP/scramble 组),采用含10%FBS和青-链霉素双抗的RPMI-1640 培养基孵育细胞,并置于37 ℃、5%CO2培养箱中培养,隔日换液。
1.3 RT-qPCR 法检测2 组LNCaP 细胞中CD147 mRNA 表达水平收集LNCaP/scramble 组和LNCaP/shCD147 组各细胞样本,采用TRIzol 法提取各样本中总RNA,NaNoDroP 2000 仪器检测总RNA 浓度和纯度,取1 μg 总 RNA 采用逆转录试剂盒合成cDNA,以cDNA 为模板,β-actin 为内参,进行RT-qPCR 反应。引物序列:β -actin上游引物5′-CACTGTGCCCATCTACGAGG-3′,β-actin 下游引物5′-TAATGTCACGCACGATTTCC-3′;CD147 上游引物5′-CAGAGTGAAGGCTGTGAAGTCG-3′,CD147 下游引物5′-TGCGAGGAACTCACGAAGAA-3′。反应条件:95 ℃预变性5 min,95 ℃变性 15 s,60 ℃退火30 s,72 ℃延伸30 s,共40 个循环。采用2-ΔΔCt法计算目的基因表达水平。
1.4 2 组LNCaP 细胞培养上清液中LA 浓度检测收集LNCaP/scramble 组和LNCaP/shCD147 组细胞培养上清液,1 000 g 离心20 min 去除沉淀物,即刻检测。提前取出LA 试剂盒,平衡至室温,具体操作步骤严格按照试剂盒说明书进行。于波长450 nm 处测定各孔吸光度(A)值,以A 值为横坐标,标准品浓度为纵坐标,绘制标准曲线并计算各样本浓度,样本浓度单位为mmol·L-1。
1.5 2 组LNCaP 细胞中PA 浓度检测收集LNCaP/scramble 组和LNCaP/shCD147 组细胞沉淀,PBS缓冲液重悬,超声裂解后600 g离心10 min。采用PA 试剂盒检测样本中PA 浓度,具体方法严格按照试剂盒操作要求进行。于波长450 nm 处测定各孔的A 值,以A 值为横坐标,标准品浓度为纵坐标,绘制标准曲线。根据标准曲线计算各样本浓度值,样本浓度单位为mg·g-1。
1.6 2 组LNCaP 细胞中ATP 浓度检测收集LNCaP/scramble 组和LNCaP/shCD147 组细胞,将细胞沉淀迅速匀浆于100 μL 的1×反应缓冲液中,16 000 g 离心30 s 去除碎片,将样本移入新EP管中备用。采用ATP 试剂盒对样本中ATP 浓度进行检测,具体操作步骤严格按照试剂盒要求进行,并计算ATP 浓度。ATP 浓度(mmol·L-1)=Sa·Sv-1。Sa 为标准曲线上的ATP 浓度,单位为mmol;Sv 为孔中加入的样本体积,单位为L。
1.7 2 组LNCaP 细胞中PK、PFK1 和HK 酶活性
收集LNCaP/scramble组和LNCaP/shCD147 组5×106个细胞,加入1 mL 蛋白提取液,冰浴条件下超声波破碎,4 ℃条件下8 000 g 离心10 min,取上清,置于冰上待测。采用BCA 试剂盒测定蛋白浓度,绘制标准曲线,根据标准曲线计算各样本蛋白浓度。采用试剂盒检测2 组LNCaP 细胞中酶活性,分别按照PK、PFK1 和HK 酶活性测定说明书进行,分光光度计测定各组A 值,计算PK、PFK1 和HK 酶活性。PK 酶活性(U·mg-1)=2 613×ΔA/样本蛋白浓度(g·L-1);PFK1 酶活性(U·mg-1)=450×ΔA/样本蛋白浓度(g·L-1);HK 酶活性(U·mg-1)=1 113×ΔA/样本蛋白浓度(g·L-1);ΔA=初始A 值-定时测定A 值。
1.8 Western blotting 法检测2 组LNCaP 细胞中CD147、HK2、PFKM 和PKM2 蛋白表达水平收集LNCaP/scramble 组和LNCaP/shCD147 组细胞样本,无菌PBS 缓冲液清洗3 次,RIPA 细胞裂解液4 ℃裂解10 min,12 000 r·min-1离心10 min,取上清液,对蛋白浓度进行定量,加入上样缓冲液,100 ℃煮沸8 min。10%SDS-聚丙烯酰胺凝胶电泳中每个泳道加入30 μg 总蛋白电泳分离,转印至PVDF 膜上,5%脱脂奶粉室温封闭2 h,采用1×TBST 洗膜液洗膜3 次,每次10 min。分别加入β-actin、CD147、PKM2、PFKM 和HK2 抗体(1∶1 000),4 ℃孵育过夜;1×TBST 洗膜液洗膜3 次,每次10 min,二抗浓度为1∶5 000,室温孵育2 h,1×TBST 洗膜液洗膜3 次,每次10 min;ECL 化学发光液显影,采用Image J 1.8.0 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/ β-actin 蛋白条带灰度值。
1.9 统计学分析采用SPSS 20.0 统计软件进行统计学分析。2 组LNCaP 细胞中CD147 mRNA 和蛋白表达水平,PA、LA 和ATP 浓度,PK、PFK1和HK 酶活性,HK2、PFKM 和PKM2 蛋白表达水平均符合正态分布,以±s 表示,组间样本均数两两比较采用独立样本t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 2 组LNCaP 细胞中CD147 mRNA 和蛋白表达水平与LNCaP/scramble 组比较,LNCaP/shCD147 组细胞中CD147 mRNA 表达水平明显降低 (P<0.01)。与 LNCaP/scramble 组比较,LNCaP/shCD147 组细胞中CD147 蛋白表达水平明显降低(P<0.01)。见图1 和2。
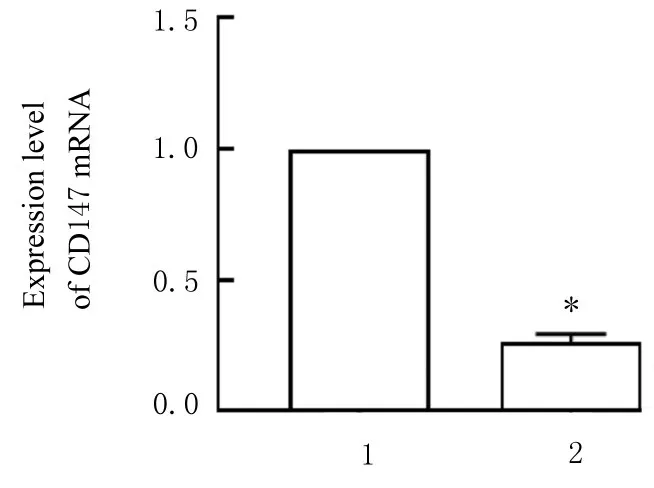
图1 2 组LNCaP 细胞中CD147 mRNA 表达水平Fig.1 Expression levels of CD147 mRNA in LNCaP cells in two groups
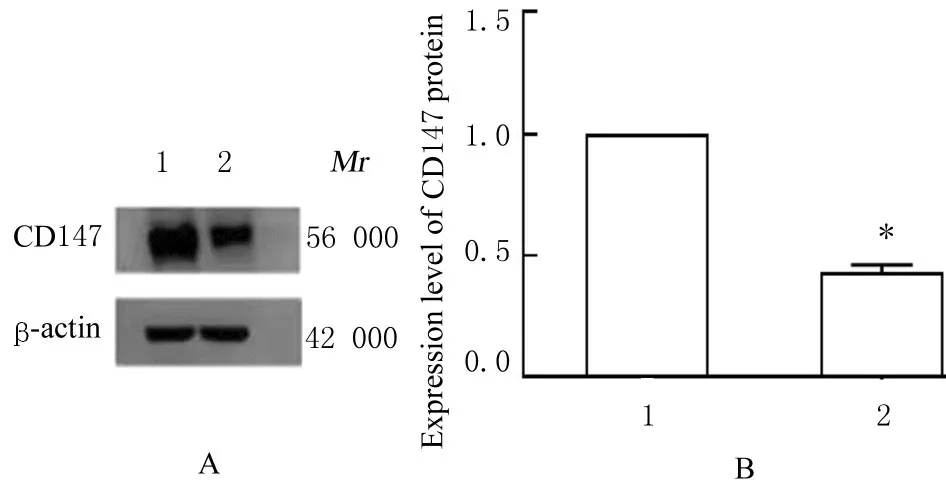
图2 2 组LNCaP 细胞中CD147 蛋白表达电泳图(A)和直条图(B)Fig.2 Electrophoregram (A) and histogram (B) of CD147protein in LNCaP cells in two groups
2.2 2 组LNCaP 细胞中LA、PA 和ATP 浓度与LNCaP/scramble 组比较,LNCaP/shCD147 组细胞中LA 浓度明显降低(P<0.01),PA 浓度和ATP浓度降低(P<0.05)。见表1。
表1 2 组LNCaP 细胞中LA、PA 和ATP 浓度Tab.1 Concentrations of LA, PA, and ATP in LNCaP cells in two groups (n=3,±s)

表1 2 组LNCaP 细胞中LA、PA 和ATP 浓度Tab.1 Concentrations of LA, PA, and ATP in LNCaP cells in two groups (n=3,±s)
*P<0.05,**P<0.01 compared with LNCaP/scramble group.
Group LA[cB/(mmol·L-1)]PA[wB/(mg·g-1)]ATP[cB/(mmol·L-1)]10.34±1.60 5.99±0.82*LNCaP/scramble LNCaP/shCD147 0.91±0.12 0.51±0.07**4.41±0.76 2.82±0.42*
2.3 2 组LNCaP 细胞中PK、PFK1 和HK 酶活性与LNCaP/scramble 组比较,LNCaP/shCD147 组细胞中PK 酶活性降低(P<0.05),PFK1 和HK酶活性明显降低(P<0.01)。见表2。
表2 2 组LNCaP 细胞中PK、PFK1 和HK 酶活性Tab.2 Activities of PK, PFK1, and HK enzymes in LNCaP cells in two groups (n=3,±s)
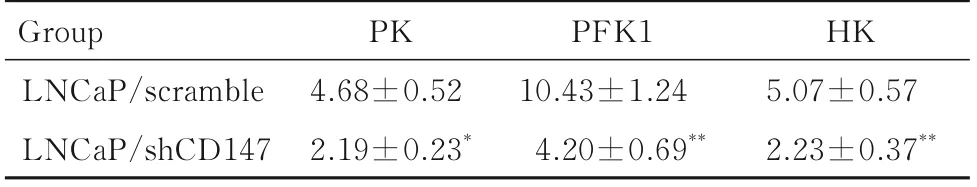
表2 2 组LNCaP 细胞中PK、PFK1 和HK 酶活性Tab.2 Activities of PK, PFK1, and HK enzymes in LNCaP cells in two groups (n=3,±s)
*P<0.05,**P<0.01 compared with LNCaP/scramble group.
Group LNCaP/scramble LNCaP/shCD147 HK 5.07±0.57 2.23±0.37**PK 4.68±0.52 2.19±0.23*PFK1 10.43±1.24 4.20±0.69**
2.4 2 组LNCaP 细胞中HK2、PKM2 和PFKM 蛋白表达水平与 LNCaP/scramble 组 比 较,LNCaP/shCD147 组细胞中HK2 蛋白表达水平明显降低(P<0.01),PKM2 和PFKM 蛋白表达水平差异无统计学意义(P>0.05)。见图3。
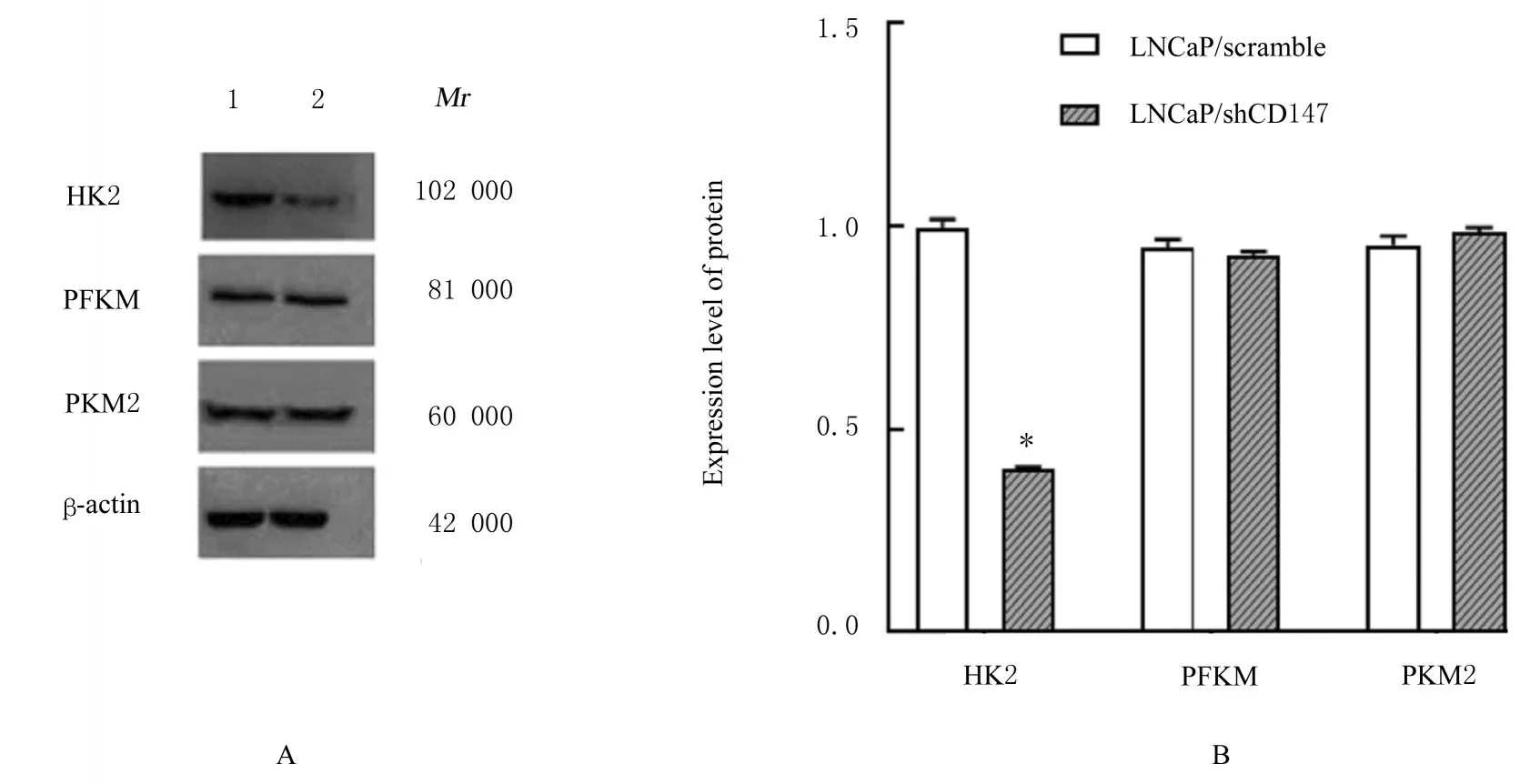
图3 2 组LNCaP 细胞中HK2、PKM2 和PFKM 蛋白表达电泳图(A)和直条图(B)Fig.3 Electropherogram (A) and histogram (B) expressions of HK2, PKM2, and PFKM proteins in LNCaP cells in two groups
3 讨 论
恶性肿瘤不仅存在基因异常,且通常发生代谢异常,尤其是能量代谢异常[9]。糖酵解是指在无氧或缺氧条件下,细胞内葡萄糖被分解成为PA,不再进行三羧酸循环,而在细胞质中合成LA 的过程。研究[10]表明:糖酵解是为肿瘤细胞提供能量和维持其生长的重要机制。随着生活水平的提高,人口老龄化加快,PCa 发病率也逐年增加。因此,发现能够调节PCa 细胞中糖酵解过程的分子,对PCa 的治疗至关重要。
研究[11]显示:低表达CD147 可以抑制肝癌细胞的糖酵解水平。本研究结果表明:通过RNAi 干扰技术敲低LNCaP 细胞中CD147 的表达可以抑制细胞中糖酵解代谢产物PA、LA 和ATP 浓度,与相关研究结论一致[12]。研究[13]发现:糖酵解水平受其代谢酶的表达水平、表型差异和活性等调控,尤其是糖酵解代谢中HK、PFK1 和PK 限速酶,三者在调控肿瘤细胞的糖酵解代谢过程中起重要作用。糖酵解过程中的第1 个限速酶HK 可催化葡萄糖转化为葡萄糖-6-磷酸,包含HK1、HK2、HK3和HK4 共4 种亚型,其中HK2 在正常细胞中几乎不表达,是肿瘤细胞Warburg 效应的一个关键调节因子[14]。第2 个限速酶PFK1,催化6-磷酸果糖生成1,6-二磷酸果糖,包含PFKM、PFKP 及PFKL 3 种亚型。PFKM 的激活促进了肝癌细胞Warburg 效应和细胞增殖[15]。第3 个限速酶PK,将磷酸烯醇式PA 转化为PA,具有L、R、M1 和M2 共4 种亚型。在肺癌细胞中,沉默PKM2 可以抑制肺癌细胞的葡萄糖摄取和LA 生成率及细胞增殖能力,表明PKM2 的稳定表达是肺癌细胞产生Warburg 效应和细胞增殖所必需的[16]。研究[6-7]显示:CD147 在肿瘤细胞中可以调节糖酵解,但在不同的肿瘤细胞中调节糖酵解的方式不一致。在胰腺导管腺癌细胞中,低表达CD147 降低PKM2 蛋白表达水平,进而抑制糖酵解作用;在肝星状细胞中,低表达CD147 抑制LDH 活性、HK2 和Glut1蛋白表达进而抑制糖酵解。本研究结果显示:在LNCaP 细胞中,CD147 主要通过调节PK、PFK1和HK 3 种限速酶活性及HK2 蛋白表达水平,从而调节糖酵解作用。
低表达CD147 对3 种限速酶活性均有抑制作用,但仅调节HK2 蛋白的表达,这可能是由于限速酶的活性是通过限速酶亚型的表达来维持的,也可能是酶激活翻译后修饰机制影响其酶活性[17-18]。综上所述,本研究探讨沉默CD147 对PCa 细胞糖酵解的作用,为进一步丰富CD147 介导糖代谢重编程的机制网络和寻找PCa 治疗的潜在靶点提供依据,提示CD147 具有作为PCa 治疗新靶点的潜能。
