小陷胸汤加味方对2 型糖尿病大鼠肝损伤的保护作用及其机制
2023-07-18刘鹏举
关 敬, 哈 森, 袁 颢, 陈 颖, 刘鹏举, 刘 智, 姜 爽
(1.长春中医药大学临床医学院药理学教研室,吉林 长春 130117;2.长春中医药大学健康管理学院预防医学教研室,吉林 长春 130117)
糖尿病作为一种常见的内分泌系统疾病,发病率高且并发症较多。国际糖尿病联盟的最新数据[1]显示:2019 年全球糖尿病患者超过4.6 亿,预计在2045 年将会超过7 亿,在糖尿病患病人群中又以2 型糖尿病(type 2 diabetes mellitus,T2DM)为主。T2DM 的病因和发病机制目前尚不明确,但对其病理生理学的研究已较为充分,其主要特征为胰岛素调控葡萄糖代谢能力的下降,即胰岛素抵抗,并伴胰岛B 细胞功能缺陷所导致的胰岛素分泌相对减少。肝脏作为糖脂代谢的主要器官,是胰岛素抵抗发生的重要部位。研究[2]显示:T2DM 患者中有超过50%以上伴有肝损伤的发生。因而,改善肝损伤对于治疗T2DM 具有积极意义。
小陷胸汤原方由瓜萎、黄连和半夏组成,具有清热化痰及宽胸散结的功效,主要用于由痰热互结所引起的心下痞满不适或小结胸证,具有治疗消化系统疾病、心血管疾病、抗肿瘤和镇静安神等作用[3]。研究[4]显示:小陷胸汤能够明显改善糖尿病患者的临床症状,降低血糖水平,并且小陷胸汤治疗可以提高患者对胰岛素的敏感性。刘冬恋等[5]证实:小陷胸汤在改善T2DM 痰热互结模型大鼠血糖水平、体质量、饮水量和尿量方面有良好效果。同时,尚筱雯等[6]认为:“态靶辨证”的临床治疗方法可以使小陷胸汤在糖尿病的治疗方面得到更为广泛的关注及应用。但目前针对小陷胸汤治疗T2DM 并发症的研究较少,对其治疗糖尿病肝损伤的作用尚未完全阐明。本研究探讨小陷胸汤加味方(Modified Xiao-Xian-Xiong Decoction,MXD)对T2DM 大鼠肝损伤的保护作用,阐明其作用机制,旨在为其防治糖尿病肝损伤的临床应用提供依据。
1 材料与方法
1.1 实验动物、药物、主要试剂和仪器60 只雄性大鼠,均为Wistar 品系,体质量200~240 g,购自长春亿斯实验动物公司,动物生产许可证号:SCXK(吉)2020-0002。本研究通过长春中医药大学动物实验伦理委员会批准(2021559),大鼠饲养在长春中医药大学动物中心,动物使用许可证号:SYXK(吉)2018-0014;饲养条件为室温22 ℃~24 ℃、相对湿度50%~60%、明暗12 h∶12 h。严格按照中国实验动物管理法规处理动物,遵守3R原则,1 周的适应性喂养后开始实验。高脂高糖饲料由10%粗蛋白、15%粗脂肪、55%碳水化合物和20%糖组成,购自长春亿斯实验动物公司[吉饲证(2019)01092]。MXD 处方:瓜蒌30 g、黄连15 g、半夏15 g 和大黄10 g,均由长春中医药大学附属医院中药房提供并协助煎煮,最终浓缩至2 g·mL-1生药量,4 ℃保存备用。盐酸二甲双胍购自上海施贵宝制药有限公司,链尿佐菌素(streptozotocin,STZ)购自上海MACKLIN 公司,白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒均购自上海黄石科研有限公司,超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽 (reduced glutathione,GSH)和 丙 二 醛(malondialdehyde,MDA)等试剂盒购自南京建成工程研究所,核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)、血红素加氧酶1(heme oxygenase-1,HO-1)、β-肌动蛋白(β-actin)抗体和IgG 二抗均购自武汉三鹰生物技术有限公司,增强型化学发光试剂(enhanced chemiluminescence,ECL)购自上海碧云天生物技术有限公司。电子天平(LE403E 型,上海梅特勒-托利多公司),血糖仪(卓越型,瑞士罗氏公司),全自动生化分析仪(SMT-120V 型,成都斯玛特公司),超微量分光光度计(N60 型,德国IMPLEN 公司),酶标仪(Spectra Max M2e 型,美国Molecular Devices 公司),电泳及转印设备(DYCZ-24D 型,北京六一生物科技公司),化学发光成像系统(K3000mini型,北京科创锐新生物科技公司)。
1.2 实验动物造模、分组和给药大鼠T2DM 模型制备参照王志塔等[7]的方法。60 只Wistar 大鼠分为对照组(n=10)和实验组(n=50),对照组大鼠给予标准饲料喂养,实验组大鼠给予高糖高脂饮食。实验开始4 周后,实验组大鼠经由腹腔注射1%STZ 溶液(30 mg·kg-1·d-1),连续2 d,共2 次;对照组大鼠腹腔注射等体积柠檬酸钠缓冲液。T2DM 大鼠模型造模成功标准:末次STZ 溶液腹腔注射72 h后通过血糖仪检测空腹血糖(fasting blood glucose,FBG)水平,当FBG≥16.7 mmol·L-1即为造模成功。共44 只大鼠造模成功(造模成功率为88.00%),剔除FBG 水平最高和最低的大鼠各2 只,将剩余40 只T2DM 模型大鼠随机分为模型组、二甲双胍组(200 mg·kg-1·d-1)和低及高剂量MXD组(630和1 260 mg·kg-1·d-1),灌胃给药,每组10 只;同时采用等体积蒸馏水灌胃对照组和模型组大鼠,疗程共计4 周。实验期间观察各组大鼠一般情况,并记录给药前及给药第1、2、3 和4 周后各组大鼠体质量及FBG 水平。
1.3 全自动生化分析仪检测各组大鼠血清中丙氨酸氨基转氨酶(alanine aminotransferase,ALT)和天冬氨酸氨基转氨酶(aspartate aminotransferase,AST)活性给药结束后,大鼠禁食不禁水12 h,经由腹腔注射10%水合氯醛(0.35 mL·kg-1)实施麻醉,腹主动脉采血,4 500 r·min-1,离心10 min,取部分上清用于检测,剩余血清存于-80 ℃冰箱备用。采用全自动生化分析仪检测各组大鼠血清中ALT 和AST 活性。
1.4 HE 染色观察各组大鼠肝组织病理形态表现腹主动脉采血后,取大鼠部分肝组织,置于4%多聚甲醛溶液中固定,做好标记,行石蜡包埋和切片染色,在光学显微镜下观察并记录各组大鼠肝组织病理形态表现。剩余部分肝组织存放于-80 ℃冰箱中,保存待用。
1.5 ELISA 法检测各组大鼠血清中IL-1β、IL-6 和TNF-α 水平取留存的大鼠血清,采用ELISA 法检测各组大鼠血清中IL-1β、IL-6 和TNF-α 水平,操作方法按照试剂盒说明书进行。
1.6 分光光度计检测各组大鼠肝组织中SOD 活性和GSH 及MDA 水平取出存放于-80 ℃冰箱中的肝组织,采用生理盐水按照1∶9 的比例制成10%肝组织匀浆,按照试剂盒说明书中操作检测各组大鼠肝组织中SOD 活性和GSH 及MDA 水平。
1.7 Western blotting 法检测各组大鼠肝组织中Nrf2 和HO-1 蛋白表达水平于相同部位取各组大鼠肝组织0.1 g,根据试剂盒说明书操作提取肝组织中蛋白。二喹啉甲酸法检测蛋白表达水平后加入上样缓冲液,100 ℃煮沸10 min,制作上样蛋白。上样后,通过聚丙烯酰胺凝胶电泳分离蛋白,湿法转至聚偏二氟乙烯膜上,5%脱脂奶粉室温封闭2 h,TBST 溶液洗涤10 min,共3 次。滴加Nrf2(1∶2 000)、HO-1 (1∶2 000)和β-actin (1∶5 000)一抗,4 ℃孵育过夜;TBST 溶液洗涤5 min,共5 次,滴加IgG 二抗(1∶5 000)后室温孵育2 h。TBST 溶液洗涤5 min,共5 次,滴加ECL 显色。采用Image J 1.8 软件分析蛋白条带灰度值,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.8 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组大鼠体质量,FBG 水平,血清中ALT 和AST 活性及IL-1β、IL-6 和TNF-α 水平,肝组织中SOD 活性和GSH 及MDA 水平,肝组织中Nrf2 和HO-1 蛋白表达水平经正态性检验均符合正态分布,以±s 表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠一般情况和体质量对照组大鼠毛色干净光滑,摄食和摄水量适中,均无骤增和骤减的情况,大小便颜色和大小便量均正常。模型组大鼠在注射STZ 溶液后每日摄食和摄水量出现骤增现象,排尿量增加,毛发变黄、粗糙,活动量减少,出现糖尿病的典型症状。与模型组比较,二甲双胍组、低剂量MXD 组和高剂量MXD 组大鼠糖尿病症状均有不同程度的改善。造模前各组大鼠体质量比较差异均无统计学意义(P>0.05)。灌胃给药治疗1、2、3 和4 周后,与对照组比较,模型组大鼠体质量明显减小(P<0.01);与模型组比较,二甲双胍组、低剂量MXD 组和高剂量MXD组大鼠体质量增加,但差异均无统计学意义(P>0.05)。见表1。
表1 各组大鼠体质量Tab.1 Body mass of rats in various groups(n=10,±s,m/g)

表1 各组大鼠体质量Tab.1 Body mass of rats in various groups(n=10,±s,m/g)
*P<0.01 compared with control group.
Body mass Group 4 weeks after administration Control Model Metformin Low dose of MXD High dose of MXD Before administration 307.61±3.34 303.45±22.41 308.24±23.86 310.42±37.47 309.96±17.18 1 weeks after administration 316.32±11.95 265.19±30.98*288.33±21.93 281.80±40.95 278.04±14.79 2 weeks after administration 325.40±12.64 242.24±27.48*255.85±25.78 261.11±30.92 251.36±11.24 3 weeks after administration 340.59±11.02 234.23±24.75*255.83±25.38 255.01±41.42 249.07±13.67 361.10±12.79 219.89±23.82*242.63±27.65 230.78±24.81 232.56±17.48
2.2 各组大鼠FBG 水平与对照组比较,各时间点模型组大鼠FBG 水平均明显升高(P<0.01)。与模型组比较,给药前二甲双胍组及低和高剂量MXD 组大鼠FBG 水平差异均无统计学意义(P>0.05);给药第2、3 和4 周,二甲双胍组和高剂量MXD 组大鼠FBG 水平明显降低(P<0.01);给药第3 和4 周,低剂量MXD 组大鼠FBG 水平明显降低(P<0.05 或P<0.01)。见表2。
表2 各组大鼠FBG 水平Tab.2 FBG levels of rats in various groups[n=10,±s,cB/(mmol·L-1)]
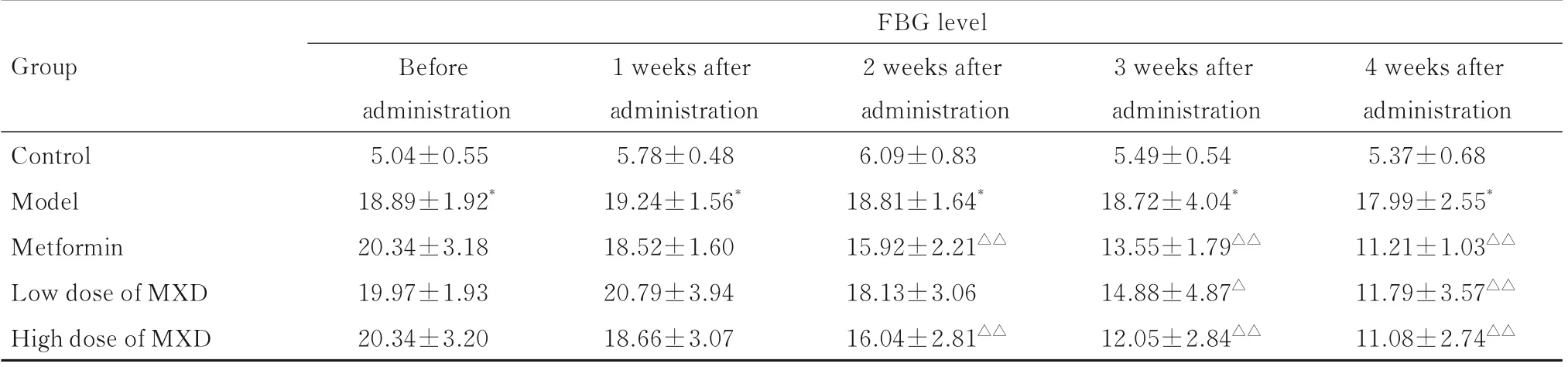
表2 各组大鼠FBG 水平Tab.2 FBG levels of rats in various groups[n=10,±s,cB/(mmol·L-1)]
*P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with model group.
FBG level Group 1 weeks after administration 2 weeks after administration 3 weeks after administration 4 weeks after administration Control Model Metformin Low dose of MXD High dose of MXD Before administration 5.04±0.55 18.89±1.92*20.34±3.18 19.97±1.93 20.34±3.20 5.78±0.48 19.24±1.56*18.52±1.60 20.79±3.94 18.66±3.07 6.09±0.83 18.81±1.64*15.92±2.21△△18.13±3.06 16.04±2.81△△5.49±0.54 18.72±4.04*13.55±1.79△△14.88±4.87△12.05±2.84△△5.37±0.68 17.99±2.55*11.21±1.03△△11.79±3.57△△11.08±2.74△△
2.3 各组大鼠血清中ALT 和AST 活性与对照组比较,模型组大鼠血清中AST 和ALT 活性均明显升高(P<0.01)。与模型组比较,二甲双胍组及低和高剂量MXD 组大鼠血清中ALT 和AST 活性明显降低(P<0.01)。见表3。
表3 各组大鼠血清中ALT 和AST 活性Tab.3 Activities of ALT and AST in serum of rats in various groups[n=10,±s,λB/(U·L-1)]
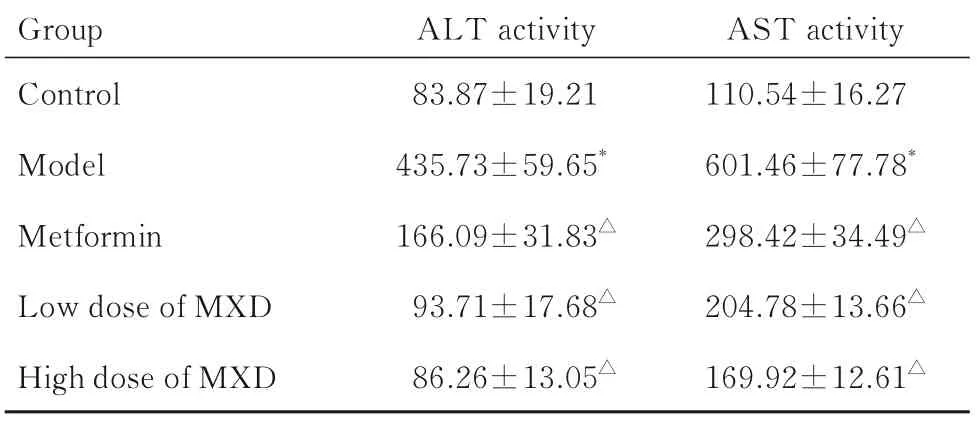
表3 各组大鼠血清中ALT 和AST 活性Tab.3 Activities of ALT and AST in serum of rats in various groups[n=10,±s,λB/(U·L-1)]
*P<0.01 compared with control group;△P<0.01 compared with model group.
AST activity 110.54±16.27 601.46±77.78*298.42±34.49△204.78±13.66△169.92±12.61△Group Control Model Metformin Low dose of MXD High dose of MXD ALT activity 83.87±19.21 435.73±59.65*166.09±31.83△93.71±17.68△86.26±13.05△
2.4 各组大鼠肝组织病理形态表现对照组大鼠肝细胞具有清晰的结构,细胞核形态正常,未见炎症细胞浸润。模型组大鼠肝组织结构排列松散不规则,形态发生改变,可见水肿和充血,且呈现严重的炎症细胞浸润及肝细胞肿胀、肝血窦变窄和淤血;同时,可见细胞核发生固缩、分裂甚至消失不见的现象。二甲双胍组大鼠肝细胞排列较整齐,形态结构有所好转,可见少量炎症细胞浸润。低和高剂量MXD 组大鼠肝细胞排列整齐,形态恢复良好,炎症细胞浸润现象基本消失。见图1。
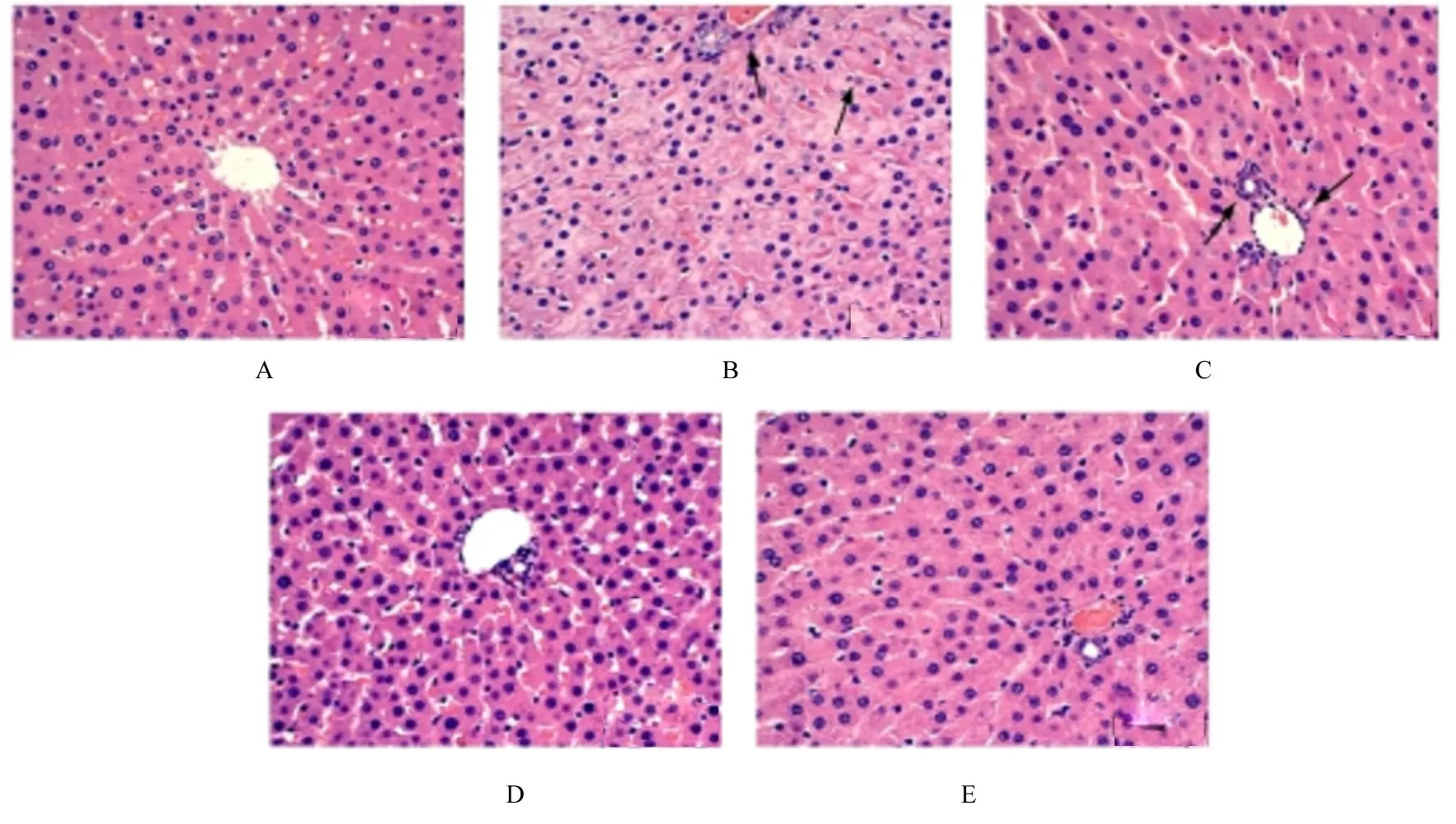
图1 各组大鼠肝组织病理形态表现(HE,×400)Fig.1 Pathomorphology of liver tissue of rats in various groups (HE,×400)
2.5 各组大鼠血清中IL-1β、IL-6 和TNF-α 水平与对照组比较,模型组大鼠血清中IL-1β、IL-6 和TNF-α 水平均明显升高(P<0.01)。与模型组比较,二甲双胍组、低剂量MXD 组和高剂量MXD组大鼠血清中IL-1β、IL-6 和TNF-α 水平均明显降低(P<0.01)。见表4。
表4 各组大鼠血清中IL-1β、IL-6 和TNF-α 水平Tab.4 Levels of IL-1β, IL-6 and TNF-α in serum of rats in various groups [n=10,±s,ρB/(ng·L-1)]
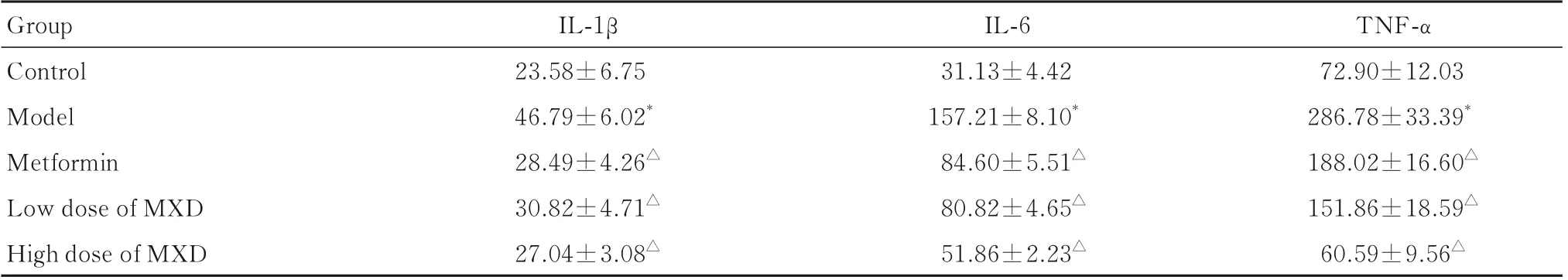
表4 各组大鼠血清中IL-1β、IL-6 和TNF-α 水平Tab.4 Levels of IL-1β, IL-6 and TNF-α in serum of rats in various groups [n=10,±s,ρB/(ng·L-1)]
*P<0.01 compared with control group;△P<0.01 compared with model group.
Group Control Model Metformin Low dose of MXD High dose of MXD TNF-α 72.90±12.03 286.78±33.39*188.02±16.60△151.86±18.59△60.59±9.56△IL-1β 23.58±6.75 46.79±6.02*28.49±4.26△30.82±4.71△27.04±3.08△IL-6 31.13±4.42 157.21±8.10*84.60±5.51△80.82±4.65△51.86±2.23△
2.6 各组大鼠肝组织中SOD 活性和GSH 及MDA水平与对照组比较,模型组大鼠肝组织中SOD活性和GSH 水平明显降低(P<0.01),MDA 水平明显升高(P<0.01)。与模型组比较,二甲双胍组、低剂量MXD 组和高剂量MXD 组大鼠肝组织中SOD 活性和GSH 水平均明显升高(P<0.01),低和高剂量MXD 组大鼠肝组织中MDA 水平明显降低(P<0.05 或P<0.01)。见表5。
表5 各组大鼠肝组织中SOD 活性和GSH 及MDA 水平Tab.5 SOD activities and levels of GSH and MDA in liver tissue of rats in various groups(n=10,±s)
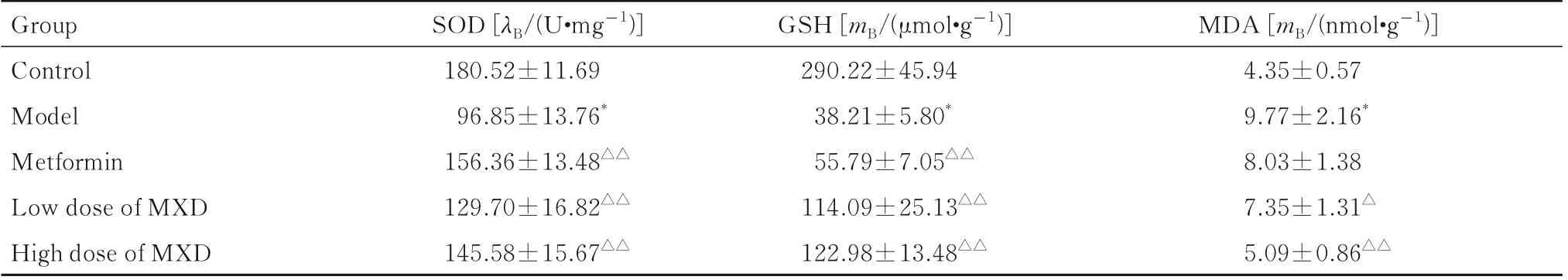
表5 各组大鼠肝组织中SOD 活性和GSH 及MDA 水平Tab.5 SOD activities and levels of GSH and MDA in liver tissue of rats in various groups(n=10,±s)
*P<0.01 compared with control group;△P<0.05,△△P<0.01 compared with model group.
Group Control Model Metformin Low dose of MXD High dose of MXD MDA [mB/(nmol·g-1)]4.35±0.57 9.77±2.16*8.03±1.38 7.35±1.31△5.09±0.86△△SOD [λB/(U·mg-1)]180.52±11.69 96.85±13.76*156.36±13.48△△129.70±16.82△△145.58±15.67△△GSH [mB/(μmol·g-1)]290.22±45.94 38.21±5.80*55.79±7.05△△114.09±25.13△△122.98±13.48△△
2.7 各组大鼠肝组织中Nrf2 和HO-1 蛋白表达水平与对照组比较,模型组大鼠肝组织中Nrf2 和HO-1 蛋白表达水平明显降低(P<0.01)。与模型组比较,二甲双胍组、低剂量MXD 组和高剂量MXD 组大鼠肝组织中Nrf2 和HO-1 蛋白表达水平均明显升高(P<0.05 或P<0.01)。见图2。
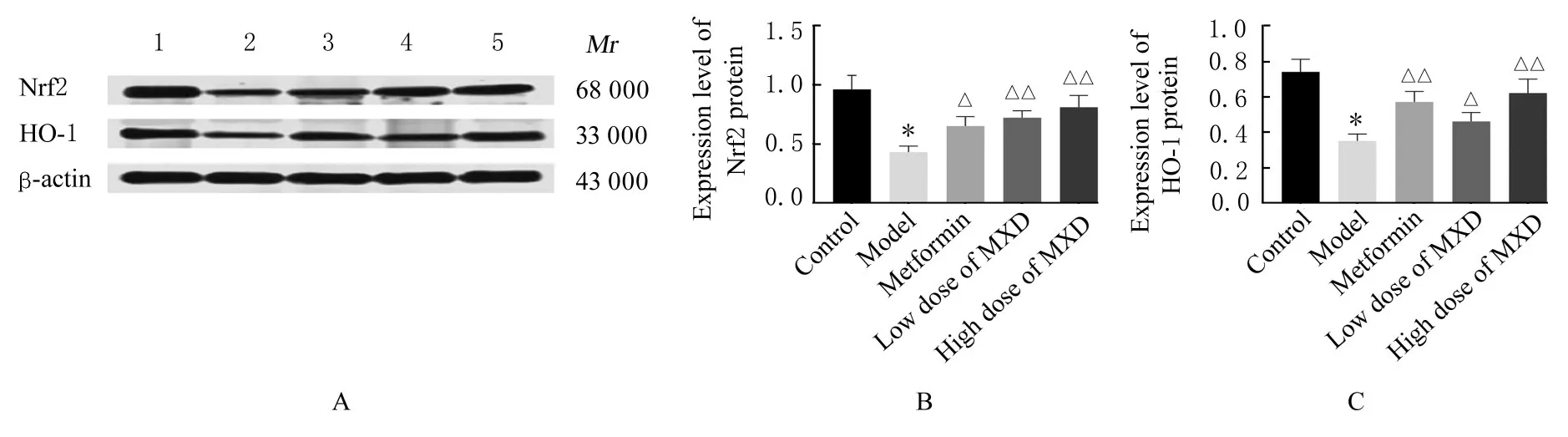
图2 各组大鼠肝组织中Nrf2 和HO-1 蛋白表达电泳图(A)和直条图(B,C)Fig.2 Electrophoregram(A) and histograms(B,C) of expressions of Nrf2 and HO-1 proteins in liver tissue of rats in various groups
3 讨 论
T2DM 患者早期和中期发病的主要原因多为“热与郁”,患者大多喜食肥甘厚味,久积内热,胃肠稽热不下,日久则消;中焦脾胃二者纳运失司,长此以往则肠燥津伤,肝郁之热亦可加重胃肠积热,反之亦然[8-9]。清·唐宗海《血证论》曰:“食气入胃……则水谷乃化”,提示若情志失调,肝郁化火,肝郁克脾犯胃,进而导致脾胃升降及胆汁分泌和排泄失常,加重食郁化热,故而T2DM 多伴有肝损伤的发生。施岚尔等[10]发现:小陷胸汤治疗T2DM 的机制可能与阻断胰高血糖素信号通路、升高细胞中钙离子浓度、降低氧化应激和抗炎作用等有关。本研究采用小陷胸汤为基础方,从肠热肝郁论治。
小陷胸汤出自《伤寒论》,其中瓜蒌有清心润肺和化痰解热之功效,能清热润燥,又能疏肝缓急;黄连可苦寒泄热除痞,有保肝利胆之功效,从而改善肝脏功能;半夏有辛燥化痰散结之功效,除辛温化痰外,还可以降逆肝之气机,现代医学研究[11-12]显示:其具有改善肝脏酪氨酸转氨酶活性的作用。大黄具有保护肝脏功能的作用,不但可以促使肝细胞再生,还可以促进体内毒素的排出,是一味公认具有良好保肝和护肝效果的中药[13]。在小陷胸汤原方基础上,加入大黄以解决T2DM 患者肝损伤问题,最终达到保护肝脏功能的目的。
T2DM 的治疗药物品类繁多,但以二甲双胍的临床应用最为广泛,在本研究中被选为阳性药物是因其同时兼有良好的降低FBG 水平效果和肝损伤的保护作用[14-15]。本研究结果显示:给予T2DM大鼠二甲双胍和MXD 治疗4 周后,大鼠一般状态均有所改善,体质量减小情况也有不同程度的缓解;与模型组比较,二甲双胍组、低剂量MXD 组和高剂量MXD 组大鼠FBG 水平均降低。ALT 和AST 活性是评价肝损伤程度的常用指标,研究[16]显示:当发生肝损伤时,血清中ALT 和AST 活性明显升高。本研究结果显示:MXD 可改善大鼠T2DM 症状并降低FBG 水平,也可抑制大鼠血清中ALT 和AST 活性,进而发挥保护T2DM 大鼠肝损伤的作用。
T2DM 被认为是一种全身性慢性低度炎症性疾病,炎性通路过度活化是其相关病症发生的分子基础,当肝脏中的炎性反应被激活后,IL-1β、IL-6和TNF-α 等炎症因子水平升高,不仅参与肝脏炎症损伤,还参与糖脂代谢紊乱和胰岛素抵抗等[17]。IL-1β 可直接作用于肝细胞,是炎症状态下的主要细胞因子,除可触发其他细胞因子和促炎介质的产生外,还参与刺激T 和B 淋巴细胞的增殖及诱导黏附分子的释放过程,从而对肝脏产生损伤作用[18-20]。IL-6 是与全身免疫反应和局部血管损伤有关的炎症因子,一方面可以引起 T 和B 淋巴细胞异常增殖和过度活化,另一方面也可促进单核细胞对内皮细胞的黏附作用,最终加剧其他炎症介质的损伤[21]。TNF-α 直接激活中性粒细胞,增强中性粒细胞的聚集和浸润,从而促使炎症反应发生[22]。本研究结果显示:T2DM 大鼠血清中IL-1β、IL-6和TNF-α 水平升高,MXD 可以抑制炎症反应,表明MXD 保护T2DM 大鼠肝损伤的作用可能与减少IL-1β、IL-6 和TNF-α 的表达和释放,抑制T2DM肝脏炎症反应有关。
研究[23-24]证实:氧化应激的激活被认为是T2DM 肝损伤的中心环节和起始因素。SOD 和GSH 是体内抗氧化系统的重要组成部分,对维持抗氧化系统和氧化系统之间的平衡有重要意义;MDA 作为脂质过氧化的终产物,是反映体内氧化应激水平的重要指标[25]。本研究结果显示:T2DM 大鼠肝组织中SOD 活性和GSH 水平降低,MDA 水平升高,提示T2DM 大鼠肝组织处于高氧化应激状态,存在氧化损伤;经MXD 治疗后,T2DM 大鼠肝组织中高氧化应激水平得到了改善,表明MXD 可以抑制T2DM 大鼠的氧化应激反应。Nrf2/HO-1 信号通路是机体抗氧化应激反应不可或缺的信号通路,其中Nrf2 作为重要的转录因子,可以调节氧化应激反应;HO-1 是血红素分解代谢过程中的限速酶,为Nrf2 发挥抗氧化作用的重要媒介[26-28]。本研究结果显示:MXD 有升高Nrf2 和HO-1 蛋白表达水平的作用,提示活化Nrf2/HO-1信号通路是MXD 发挥抗氧化应激作用的潜在机制。
综上所述,MXD 对T2DM 大鼠肝损伤有保护作用,其机制可能与抗炎及活化Nrf2/HO-1 信号通路进而抑制氧化应激有关。
