免疫检查点B7-H3在癌症中作用研究进展
2023-07-17陈沛然赵立文黄凤杰
陈沛然 ,赵立文,黄凤杰
(1. 中国药科大学生命科学与技术学院,江苏 南京 211198;2. 南京圣和药业股份有限公司,江苏 南京210049)
1 B7-H3简介
B7-H3(又称CD276)是B7超家族中的一员,是一种Ⅰ型跨膜糖蛋白,是近年来新发现的免疫检查点。B7-H3具有B7-H3家族的结构特征和典型的免疫球蛋白样分子结构。与其他B7-H3家族成员一样,人源B7-H3拥有4个保守的结构半胱氨酸,一个由IgC样和IgV样结构域组成的胞外域及许多不同的胞内结构域(见图1)。

图1 B7-H3的结构示意图Figure 1 Graphical structure of B7-H3
B7-H3的异常表达与癌症的发生与进展密切相关,研究人员通过对临床样本使用基于单克隆抗体8H9的免疫组化分析发现,人体正常组织中B7-H3仅在腹部、肝脏、胰腺、肾皮质、唾液腺腺泡细胞、胃上皮细胞具有非特异性细胞质内表达[1-2]。然而对于临床样本的研究发现,B7-H3在非小细胞肺癌、胰腺癌、原发性肝癌、结直肠癌(colorectal cancer,CRC)、乳腺癌、前列腺癌、咽喉癌、黑色素瘤等多种肿瘤组织中有异常大量表达,且在肿瘤微环境(tumor microenvironment,TME)中的基质细胞、纤维原细胞、上皮细胞等表面也有表达,其在肿瘤组织中的过量表达往往伴随患者不良预后与较短的总生存期和无进展生存期[3-15]。B7-H3在单核细胞和粒细胞及人体正常组织中均无表达,而在一些树突状细胞、T细胞、自然杀伤(natural killing,NK)细胞和B细胞上有表达,这使得B7-H3成为具有潜在临床治疗价值的免疫检查点。B7-H3不仅可通过抑制免疫系统促成肿瘤细胞的免疫逃逸,还可通过一些非免疫途径介导肿瘤的转移、耐药、血管生成从而促进癌症进展。鼠源B7-H3主要是一种2Ig-B7-H3二聚体的构型[16],人类B7-H3包含2种异构体即4Ig-B7-H3和2Ig-B7-H3,其中4Ig-B7-H3是B7-H3的主要表达形式,其在多种肿瘤细胞上异常表达,但其功能与2Ig-B7-H3并无区别[17-18]。目前B7-H3的配体尚未发现,其作用机制还需进一步研究。本文综合目前的研究进展,针对B7-H3的免疫调节作用、促肿瘤细胞转移作用、促血管生成作用、促肿瘤细胞耐药作用及其他作用这几方面的机制分别进行介绍(见图2)。

图2 B7-H3作用通路示意图Figure 2 B7-H3 signaling pathway
2 B7-H3在癌症中的免疫调节作用
B7-H3在癌症中的免疫调节作用最早被发现,尽管早期研究指出B7-H3对免疫系统具有激活作用,但随后大量实验证明B7-H3是免疫抑制受体。早在2001年有研究者将从健康捐献者体内提取的T细胞与转染B7-H3质粒并可表达B7-H3的624mel黑色素瘤细胞共培养发现,B7-H3可促进CD8+T和CD4+T细胞增殖,增强细胞毒作用和对624mel细胞的杀伤效果,并上调CD8+T和CD4+T细胞的干扰素-γ(interferon-γ,IFN-γ)分泌[19]。有研究人员用体内模型对B7-H3的免疫调节作用进行了验证,将重组表达B7-H3的P815细胞移植到小鼠体内,发现相对于不表达B7-H3的P815细胞,B7-H3表达可显著抑制肿瘤生长,研究发现其通过刺激抗原特异性CD8+T细胞增殖从而增强其细胞毒作用[20]。但随后越来越多的研究得出相反结论,在小鼠T细胞的体外实验中发现,外源B7-H3-Ig可通过抑制转录因子激活蛋白-1(activator protein-1,AP-1)和减少细胞因子白细胞介素-2(interleukin-2,IL-2)产生抑制CD4+T细胞激活与增殖的作用,抗鼠源B7-H3的单克隆抗体可激活T细胞[21]。2009年的一项研究也得出相似的结论:体外模型中B7-H3可抑制CD8+T和CD4+T细胞增殖和活性,减少IFN-γ分泌[22]。B7-H3敲除小鼠表现出增强的CD8+T细胞与NK细胞增殖和细胞毒作用,B7-H3沉默可增加小鼠的CD8+T细胞的IFN-γ分泌和颗粒酶B的表达,并上调NK细胞颗粒酶B的表达,提高NK细胞的细胞杀伤功能[23]。一项对癌症基因组图谱(the cancer genome atlas,TCGA)和中国胶质瘤基因组图谱(Chinese glioma genome atlas,CGGA)的神经胶质瘤组织基因组数据的大规模分析发现,B7-H3可改变固有免疫反应、炎症反应、T细胞共刺激、T细胞激活等相关基因的表达,特别是调节T细胞免疫反应相关基因,从而介导免疫抑制的发生[24]。B7-H3也有调节免疫细胞募集的作用,在对一些非小细胞肺癌患者的组织研究中发现,B7-H3在肿瘤微环境中的表达往往伴随着更多的CD45+免疫细胞、CD8+T细胞、CD3+T细胞、NK细胞、浆细胞样树突状细胞的聚集,以及更高的程序性死亡配体-1(programmed death ligand-1,PD-L1)表达[6]。
由于目前对B7-H3的配体还知之甚少,尚无法对B7-H3的免疫调节机制做出详尽的解释,在某些研究中证实B7-H3具有免疫激活作用,在另一些研究中发现B7-H3具有免疫抑制作用,这可能与实验中所用的细胞类型、实验动物基因型以及实验方法的不同有关,但目前普遍认为B7-H3是可以促使癌细胞免疫逃逸的免疫抑制分子[13,25-27]。
3 B7-H3的促癌细胞转移作用
细胞从原位点的扩散与转移是癌症恶化的重要标志,癌症的扩散往往伴随不良预后和高死亡率。在临床上,B7-H3在多种肿瘤组织中的过表达与癌症扩散有关,常伴随不良预后。
上皮间质转化赋予细胞侵袭和转移的能力,是癌细胞发生转移的重要特征。在肺腺癌细胞A549中使用小干扰RNA(small interfering RNA,siRNA)沉默B7-H3的表达,可以下调如基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、波形蛋白、Snail、N-钙黏蛋白等上皮间质转化标志蛋白的表达,削弱肺腺癌细胞A549的侵袭和转移能力[28]。对肝癌的临床研究发现,B7-H3的高表达与癌症转移的发生和不良预后显著相关,对临床样本研究发现其通过Janus激酶2(Janus kinase 2,JAK2)/信号转导与转录因子3(signal transducer and activator of transcription 3,STAT3)/Snail通路调节N-钙黏蛋白、E-钙黏蛋白、波形蛋白的表达使肝癌细胞发生上皮间质转化从而促使其转移[29]。在黑色素瘤中,B7-H3也被发现可以通过JAK2/STAT3/Snail通路上调MMP-2、MMP-9等促癌细胞转移蛋白表达,并且下调基质金属蛋白酶组织抑制因子-2(tissue inhibitor of metalloproteinase-2,TIMP-2)、TIMP-1等抑制癌细胞转移的蛋白表达[30]。有研究发现,B7-H3对JAK2/STAT3/Snail通路的激活作用部分是通过诱导其上游的癌症相关蛋白激酶Src激活,并下调其对应负调节物细胞因子信号转导抑制蛋白3(suppressor of cytokine signaling-3,SOCS-3)/含SH2结构蛋白酪氨酸激酶-1(SH2-containing protein tyrosine phosphatese,SHP-1)的表达[31]。在体外实验中,使用JAK2/STAT3通路抑制剂FLLL32可以有效阻断B7-H3的促癌细胞转移作用。JAK2抑制剂AG490也可以有效减少B7-H3在结直肠癌细胞中的促迁移和侵袭作用[32]。综上,B7-H3主要通过JAK2/STAT3通路促进癌细胞上皮间质转化的发生,从而促使癌细胞转移。IL-8是促癌细胞转移的细胞因子[33],在黑色素瘤细胞系MDA-MB-435和FEMX-I移植的小鼠模型中IL-8大量表达,敲除B7-H3可以显著减少IL-8的表达,并减少癌细胞转移[30]。另有研究指出,B7-H3可使胰腺癌细胞Toll样受体4(Toll like receptor 4,TLR4)/核因子-κB(nuclear factor-κB,NF-κB)通路激活,上调其下游血管内皮生长因子(vascular endothelial growth factor,VEGF)和IL-8的表达,提高胰腺癌细胞的转移和侵袭能力[34]。循环上皮癌细胞(circulating epithelial tumor cells,CETCs)在外周循环中的出现是癌细胞转移的先决条件,Ki-67是癌细胞增生的生物标志物,在针对乳腺癌临床样本的检测中发现,超过80%的CETCs中B7-H3的表达异常,并且其表达与Ki-67在CETCs中的表达显著相关[35]。
4 B7-H3在肿瘤组织中的促血管生成作用
肿瘤组织周围异常的血管生成也是癌症进展的一个重要标志,癌细胞可以通过改变自身周围的血管结构来为其输送生长所需的营养物质和输出代谢废物,构建适宜癌细胞增生的微环境。
人脐静脉内皮细胞是血管内皮实验常用细胞,在血管生成中起重要作用,有研究者通过慢病毒转染B7-H3基因至人脐静脉内皮细胞,相比于对照组,其在体外模型和体内模型中均有更强的血管生成能力,该血管生成能力的提高是通过细胞内VEGF上调实现的[36]。
在CRC患者的组织中发现,B7-H3表达量与肿瘤组织的微血管密度呈正相关,研究者提取了过表达B7-H3的CRC细胞培养基,将其用于培养人脐静脉内皮细胞,在B7-H3 CRC培养基的刺激下,人脐静脉内皮细胞表现出更强的血管生成、迁徙和侵袭能力。B7-H3可提高CRC细胞的血管内皮生长因子A(vascular endothelial growth factor A,VEGF-A)表达量和促血管生成能力,经实验证明该作用部分是通过激活NF-κB通路实现的[37]。Tie-2是一种可与促血管新生蛋白因子结合的酪氨酸激酶受体,可以不依赖VEGF调节肿瘤微血管。B7-H3在透明细胞肾细胞癌患者的肿瘤血管上皮组织中大量表达,检测发现B7-H3与Tie-2表达量呈正相关,且两者的表达位点有一定重叠,B7-H3与Tie-2表达量均与肿瘤组织中的微血管密度呈正相关,这说明B7-H3的促血管生成作用可能部分是通过Tie-2通路实现的[38]。在三阴乳腺癌中,B7-H3在肿瘤相关巨噬细胞(tumor associated macrophage,TAM)上的大量表达与不良预后相关,研究发现高表达B7-H3的TAM具有促血管生成功能,在注射了B7-H3highTAM的4T1小鼠乳腺癌模型中,比对照组检测出更多的血管生成和VEGF-A等血管生成相关蛋白表达,而且B7-H3highTAM组的血管结构更混乱、形状更扭曲,形态更像是肿瘤组织周围异常生成的血管[39]。
5 B7-H3的促癌细胞耐药的作用
现如今,化疗仍然是治疗癌症的主要手段,一些化疗药物可诱导癌细胞凋亡,然而通过一段时间的治疗,一些癌细胞会演化出对化疗药物的耐药性。耐药性是影响化疗疗效的一个主要障碍。
诱导癌细胞凋亡是许多化疗药物的作用机制,在CRC细胞中,B7-H3的表达量与其中抗凋亡蛋白B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)、B细胞淋巴瘤-xl(B cell lymphoma-xl,Bcl-xl)表达呈正相关,且与促凋亡蛋白BCL2相关蛋白X(BCL2-associated X protein,Bax)表达量呈负相关,在高表达B7-H3的CRC细胞系SW620-B7-H3-EGFP中,与对照组相比,SW620-B7-H3-EGFP对5-氟尿嘧啶和奥沙利铂均表现出更好的耐药性和更强的抗凋亡能力,进一步研究发现其抗凋亡作用部分是通过激活JAK2/STAT3通路实现的[40]。紫杉醇是一种常用的化疗药物,在乳腺癌细胞中,B7-H3的表达也可通过JAK2/STAT3加强癌细胞对紫杉醇的抗性;敲除B7-H3的乳腺癌细胞对紫杉醇敏感性显著增强,其中髓样细胞白血病-1(myeloid cell leukemia,Mcl-1)、生存素等STAT3通路下游的抗凋亡蛋白表达量显著下降[41]。吉西他滨是一种嘧啶类抗肿瘤代谢药,B7-H3可通过上调生存素的表达从而提高癌细胞对吉西他滨的抗性[42]。含BRCA1/BRCA2复合体亚基3(BRCA1/BRCA2 containing complex subunit 3,BRCC3)参与细胞中DNA修复过程[43],5-氟尿嘧啶的细胞毒性会因DNA修复的激活而减少,有研究发现B7-H3介导的对5-氟尿嘧啶耐药性伴随着BRCC3上调而增强,使用siRNA敲除BRCC3可以逆转B7-H3介导的对5-氟尿嘧啶抗药性[44]。B7-H3还可以通过激活磷脂酰肌醇三羟基激酶(phosphoinositide-3 kinase,PI3K)/AKT通路增强癌细胞对顺铂和紫杉醇的耐药性,当加入PI3K或AKT抑制剂时癌细胞的耐药性显著下降[45]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路调节增殖、应激、凋亡等多种细胞过程,在癌细胞耐药中也发挥作用。MAPK的去磷酸化失活受到上游一组名为MAP激酶磷酸化酶(MAP kinase phosphatases,MPK)的双特异性磷酸酶的调控。最近一项研究通过DNA微阵列技术辨别出一种名为双特异性磷酸酶10(dual specificity phosphatase,DUSP10)的MPK,其参与了B7-H3介导的癌细胞对达卡巴嗪和顺铂的获得耐药性,B7-H3可通过下调DUSP10的表达来提高MAPK通路的活性,增强癌细胞抗凋亡能力,从而提高癌细胞对达卡巴嗪和顺铂的耐药性[46]。传统化疗方式往往只能杀死普通癌细胞,但无法有效杀死肿瘤干细胞(cancer stem cells,CSCs),普通肿瘤细胞可以转变为CSCs,从而获得药物抗性。丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MAPKK,又称MEK)是促使癌细胞干性转化的重要因子,B7-H3高表达可磷酸化激活主要穹隆蛋白(major vault protein,MVP),MVP通过增强鼠类肉瘤病毒癌基因同源物B1(V-raf murinesar-coma viral oncogene homolog B1,B-RAF)和MEK之间的互相作用,从而激活MEK促使更多普通癌细胞发生干性转化[47]。
阿霉素可通过介导细胞衰老使癌细胞生长停滞,而B7-H3可通过上调跨膜四家族成员1(transmembrane 4 superfamily member 1,TM4SF1)抑制阿霉素介导的细胞生长停滞和G2/M滞阻,B7-H3对TM4SF1的调节作用依赖于AKT[48]。奥沙利铂可导致癌细胞的细胞周期在G2/M滞阻,限制其复制增殖。有研究表明,B7-H3在CRC细胞中的表达可通过激活STAT3通路上调M期诱导磷酸酶1(cell division cyclin 25A,又称CDC25A)表达,促使癌细胞越过G2/M滞阻,从而提高CRC细胞对奥沙利铂的抗性,并且在CRC患者组织中发现CDC25A和B7-H3的表达也呈正相关[49]。
放射性治疗可破坏癌细胞的DNA结构,致使癌细胞凋亡。B7-H3可减少化疗诱导的细胞凋亡、S期滞阻和DNA双链断裂,B7-H3过表达可下调自噬微管相关蛋白轻链3(light chain 3,LC3)、自噬相关蛋白5(autophagy protein 5,Atg5)、Beclin-1等自噬相关蛋白表达,通过降低细胞自噬水平从而增强癌细胞对放射性治疗的抗性[50]。另有一项研究通过对经过X光照射的人结肠腺癌细胞的转录组分析发现,与敲除B7-H3的人结肠癌RKO细胞对比,B7-H3的高表达可通过NF-κB通路上调有丝分裂驱动蛋白家族成员15(kinesin family member 15,KIF15)的表达,KIF15可激活下游的胞外调节蛋白激酶(extracellular regulated protein kinase,ERK),提高RKO细胞对放射性的抗性,KIF15抑制剂或沉默KIF15可以逆转B7-H3介导的放射性耐受[51]。
6 B7-H3在癌症中的其他作用
癌症的产生往往伴随Warburg效应,即在氧气充足的情况下,癌细胞倾向于削弱有氧呼吸,进行糖酵解反应为细胞提供能量,Warburg效应可以创造出适合肿瘤生存的肿瘤微环境,为癌细胞DNA复制、蛋白质合成提供能量和原料,并且抑制微环境中免疫细胞对癌细胞的杀伤功能。缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)是介导Warburg效应的一个重要因子。B7-H3被发现与肿瘤组织的Warburg效应有关,B7-H3可通过PI3K/AKT/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路上调HIF-1α及其下游的糖酵解调节因子,增强口腔鳞状癌细胞的Warburg效应[52]。也有研究发现,B7-H3通过STAT3通路上调有氧糖酵解中的糖酵解酶己糖激酶-2来促进Warburg效应的产生[53]。
在细胞周期中存在G1/S限制点,在这个限制点决定细胞随后进入下一相进行DNA合成和细胞分裂,或在G0期停止,发育成熟并进行分化。癌细胞由于细胞周期出现混乱,往往能逃出这个限制点的限制,进行异常增殖。B7-H3可帮助癌细胞越过G1/S限制点,使用siRNA沉默B7-H3的人组织细胞淋巴瘤细胞U937表现出了G0/G1阻滞现象及对去甲氧柔红霉素和阿糖胞苷的敏感性增强[54]。
7 B7-H3与其他细胞表面受体共表达情况
研究发现,B7-H3与一些其他细胞表面受体存在共表达现象。在一项对胰腺癌(pancreatic carcinoma,PCa)细胞的研究中发现,可溶性B7-H3(soluble B7-H3,sB7-H3)可刺激PCa细胞上调TLR4的表达,从而激活NF-κB通路并上调其下游IL-8和VEGF的表达[34]。进一步研究发现,在脂多糖(lipopolysaccharide,LPS)的刺激下,表达B7-H3的PCa细胞则表达更多的TLR4,B7-H3敲除的PCa细胞TLR4表达量则显著较少,B7-H3对于TLR4的这种调节作用可能是通过溴结构域结合蛋白4(bromodomain-containing protein 4,BRD4)实现的[55]。在一项对包括634个非小细胞肺癌临床样本的研究中发现,其中80.4%的样本中检测到B7-H3表达,17.6%临床患者样本检测到PD-L1与B7-H3的共表达,10%样本检测到B7-H4与B7-H3共表达[56]。一项对接受切除手术后宫颈癌患者的组织样本研究发现,在552个样本中,21.0%存在B7-H3与PD-L1共表达,41.7%有PD-L1或B7-H3单表达,37.3%样本既无PD-L1表达也无B7-H3表达[3]。有研究对31例间皮瘤患者的组织切片PD-L1和B7-H3表达水平进行检测发现,其中28例B7-H3阳性,13例PD-L1阳性,在13例PD-L1阳性中有12例存在B7-H3共表达[57]。另有一项对临床患者样本的小样本量研究发现,在黑色素瘤、肺癌、肾癌、肝癌、乳腺癌、咽喉癌、结肠癌、神经胶质瘤的样本中均检测到B7-H3与CD70的共表达,对TCGA数据库中转录组测序(RNA sequencing,RNA-seq)分析发现,在其他几种癌症中B7-H3与CD70也有共表达现象[58]。
8 基于B7-H3的治疗方法
目前20余个针对B7-H3靶点的临床试验正在进行,以检验其安全性和有效性(见表1)。MacroGenics公司开发的enoblituzumab(MGA271)是靶向B7-H3的单抗药物,目前已完成对B7-H3表达实体瘤的Ⅱ期临床试验,enoblituzumab和ipilimumab(靶向CTLA-4单抗药物)联合治疗黑色素瘤、非小细胞肺癌等实体瘤的Ⅰ期临床试验也已完成[59]。MacroGenics公司构建了靶向CD3×B7-H3的双特异性抗体MGD009,与对照组激活T细胞(activated T cell,ATC)相比,配备了MGD009的ATC对多种黑色素瘤细胞系表现出更强的杀伤力,可以分泌更多的IFN-γ,并且ATC表面表达更多的CD69和CD25,在动物模型中也可以更有效杀伤癌细胞,目前MGD009与抗PD-1单抗MGA012联合治疗的Ⅰ期临床试验正在进行[60]。MacroGenics公司还通过将B7-H3抗体与化学基团vc-seco-DUBA连接,构建了靶向B7-H3的抗体偶联药物(antibody conjugated drug,ADC)MGC018,MGC018不仅对表达B7-H3的癌细胞有杀伤作用,由于其具有易被蛋白酶降解的连接肽,其对癌症病灶处B7-H3阴性的癌细胞也有杀伤作用,在多种异种移植和人源肿瘤异种移植(patient-derived tumor xenograft,PDX)体外模型中均表现出很好的抑癌效果,并且在食蟹猴中进行的毒理实验显示其并无明显毒副作用,MGC018与MGA012联合治疗实体瘤的Ⅱ期临床试验正在进行志愿者招募[61]。靶向B7-H3的放射性免疫疗法也被开发,Y-mAbs Therapeutics(YMAB)公司使用放射性同位素131I或124I连接抗B7-H3抗体,构建124I-omburtamab和131I-omburtamab从而使放射性物质可在癌症病灶处聚集,增强放射性疗法的特异性,针对转移性中枢神经细胞瘤、促结缔组织增生型小圆细胞瘤的临床试验已经开展[62-63]。有研究人员构建出了靶向B7-H3的嵌合抗原受体T细胞(chimeric antigen receptor T cells,CAR-T),通过生物荧光技术检测到B7-H3 CAR-T在动物的实体瘤和血液瘤模型中均可有效减少肿瘤负荷,SCRI-CARB7H3、4-1BBζ B7H3-EGFRt-DHFR这2款靶向B7-H3的CAR-T药物正在进行Ⅰ期临床,4SCAR-276已进入Ⅱ期临床[64]。除了CAR-T疗法,也有研究构建了靶向B7-H3的CAR-NK-92Mi细胞,并且其在非小细胞肺癌异种移植的体外模型中展现了很好的抗癌效果,其抗癌效果显著强于普通的NK-92Mi细胞,可以释放更多的CD107a、颗粒酶B和穿孔素,从而发挥更强的杀伤效果[65]。另有研究发现,使用索拉非尼可抑制人卵巢癌细胞生长但会导致B7-H3显著上调,再使用B7-H3×CD3双特异性抗体联合索拉非尼进行实验结果发现,在SKOV3移植模型中具有很好的协同抑癌效果[66]。
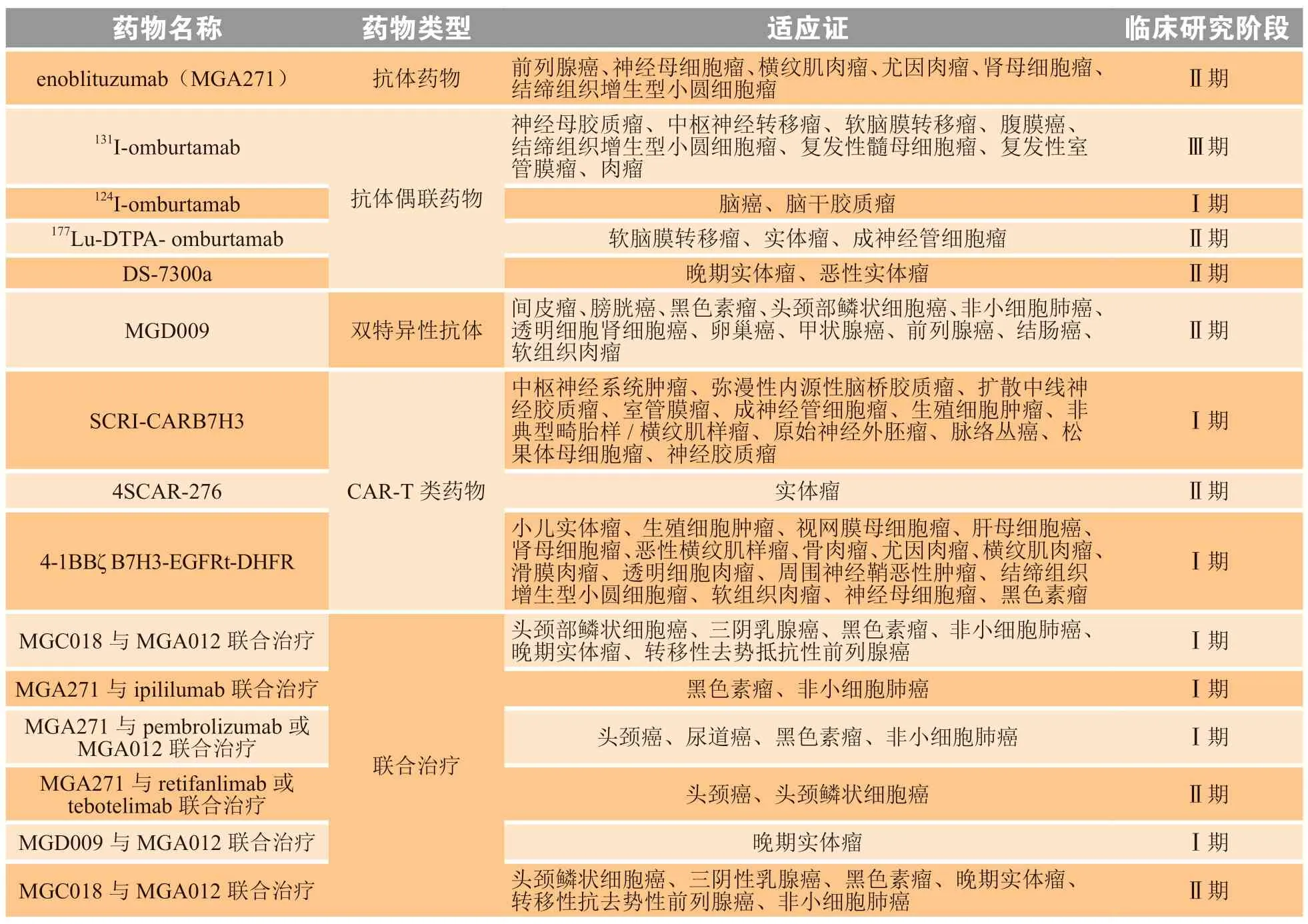
表1 靶向B7-H3的药物临床研究情况Table 1 Clinical research on drugs targeting B7-H3
9 结语与展望
针对PD-1/PD-L1的靶向药物(CAR-T、单克隆抗体药物、ADC药物等)在临床上取得了一定成功,为针对免疫检查点的生物药物发展带来希望,但普遍存在的问题是靶向PD-1/PD-L1的疗法响应率较低,且易产生耐受性,所以目前临床对于靶向新检查点的药物需求很大。B7-H3作为B7家族的一员,虽然与PD-L1作用机制不同,但同样发挥了免疫抑制作用,介导癌细胞的免疫逃逸。由于B7-H3只在癌细胞和一些免疫细胞上有表达,在人体正常组织中均无表达,使得靶向B7-H3药物可以选择性杀伤癌细胞而对正常组织造成较少伤害。针对B7-H3的单抗药物目前已进入临床阶段且无严重毒副作用,另外一些B7-H3相关双特异性抗体药物、CAR-T、CAR-NK、ADC药物等在临床前阶段也表现出很好的抗癌疗效。靶向B7-H3的药物展现出很好的临床前景。B7-H3的配体目前尚未发现,并且其在免疫调节中的作用仍存在一些争论,有待进一步研究。
