下一代测序技术在癌症诊疗中的应用及研究进展
2023-07-17赵熙萌张燕香马同辉胡云富
赵熙萌,张燕香,马同辉,胡云富
(北京泛生子基因科技有限公司,北京 102206)
癌症是一类可发生于多种组织器官的,以细胞生长、增殖失控为主要特征的,由遗传物质改变所引起的疾病。癌症发病的根本机制是多种因素共同作用导致的基因组DNA损伤和基因变异的积累[1]。导致遗传物质改变的因素十分复杂,包括接触环境致癌物(如吸烟、饮酒、过度加工食物、大气污染、电离辐射、紫外线等)[2-5],免疫因素(如炎症反应)[6],内分泌因素(如高雌激素水平)[7]和遗传因素(如胚系易感基因突变和表观遗传学改变)[8-9]。
对癌症遗传学基础的认识水平很大程度上依托近几十年来各类DNA突变分析技术的高速发展,高通量测序或称下一代测序(next-generation sequencing,NGS)技术的出现是此过程中的里程碑事件之一。相较于Sanger测序,NGS具有通量高、以DNA文库代替细菌克隆的DNA片段、测序过程无需电泳3项重要优势[10],极大地降低了测序所需的时间及人力成本,故在其发明后的近20年中获得了大量推广应用,鉴定出大量疾病相关基因突变和染色体变异。NGS推动癌症研究及临床诊疗进入了基因组时代,也使得基于肿瘤突变特征的个性化医疗成为现实。
NGS在癌症临床中的应用方式包括全基因组测序(whole-genome sequencing,WGS)、全外显子组测序(whole-exome sequencing,WES)、靶向基因测序(targeted gene panel sequencing,TS)、转录组测序、表观遗传测序和单细胞测序[11]。WGS、WES和TS在应用层面上的主要区别为覆盖范围。WGS的覆盖范围是全基因组,覆盖率约为95% ~98%[12]。WES和TS则分别需要在测序前针对全外显子或依据具体需求选择性地纳入的目的基因,进行DNA片段捕获测序。由于人类基因组仅有约2%为编码序列,采用WES和TS有利于在节约成本的前提下增加测序深度,以保持测序的精准和高效。在癌症相关的商业化NGS应用中,绝大多数产品均基于TS方法获取癌症相关基因序列或表观遗传信息。随着近年来癌症相关NGS检测理论和技术的持续发展和快速推广,其实际应用场景已覆盖癌症早筛、术后微小残留病灶(minimal residual disease,MRD)检测、晚期癌症患者的伴随诊断等多个临床阶段(见图1)。
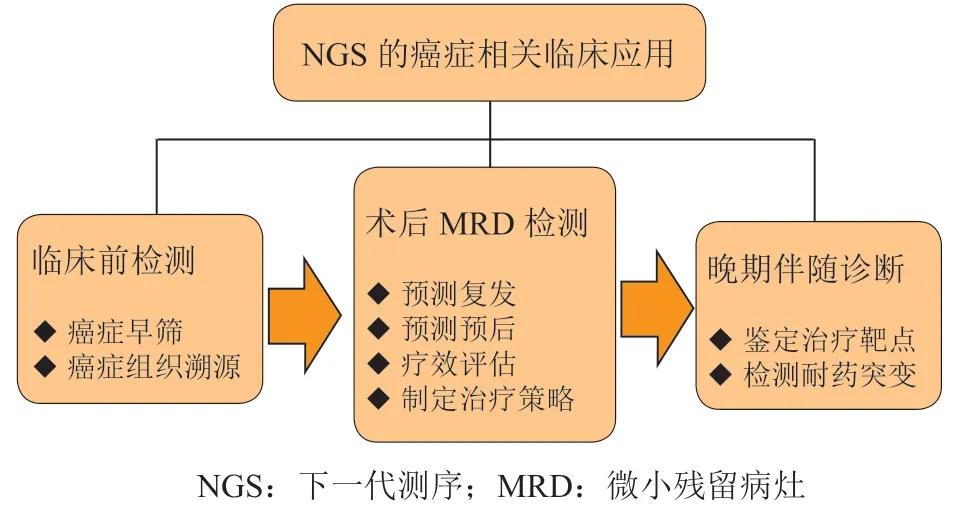
图1 NGS在癌症各临床阶段中的相关应用Figure 1 Related applications of NGS in each clinical stage of cancer
液体活检是近年来开始发展的新型癌症检测技术,即通过采集患者血液、尿液、胸腔积液、脑脊液、唾液或胆汁等体液,检测其中包含的癌症生物标志物。液体活检相比传统组织活检的优势主要为:1)取材的无创性或低创性,使其有利于在多个时间点进行重复检测。2)减少了传统组织活检中由肿瘤内异质性导致的取样偏差,故能更好地反映肿瘤整体特征。液体活检在血液中的分析目标包括循环肿瘤DNA(circulating tumor DNA,ctDNA)、循环肿瘤RNA (circulating tumor RNA,ctRNA)、循环肿瘤细胞(circulating tumor cells,CTCs)、蛋白质、外泌体以及代谢物。其中,外周血ctDNA检测是目前较多采用的液体活检方法。近期发表的一系列研究结果显示,依据不同癌种独特的液体分布特征进行液态样本活检是有前景的癌症诊断发展方向之一。例如针对脑脊液ctDNA的胶质瘤分子检测[13];针对尿液细胞DNA突变和CpG甲基化尿路上皮细胞癌检测[14];针对腹膜灌洗液中的肿瘤细胞,采用个性化订制基因panel预测胃癌腹膜转移和预后[15];针对胆汁中的DNA突变和甲基化进行胰胆管癌诊断等[16]。
ctDNA是循环游离DNA(circulating free DNA,cfDNA)的一部分,一般长度为132 ~ 145 bp,半衰期一般小于2 h。ctDNA主要由肿瘤细胞坏死、凋亡和外分泌过程进入细胞外环境,其携带包括单碱基变异(single nucleotide variation,SNV)、甲基化、拷贝数变异(copy number variation,CNV)、结构变异(structural variation,SV)等肿瘤细胞遗传学特征。在不同肿瘤类型、肿瘤体积、肿瘤分期和多种其他因素的影响下,ctDNA含量在个体间或同一个体的不同疾病阶段均存在巨大变化,其含量范围可低于0.1%或大于90%[17]。在某些极端情况下,例如在携带有低于计算机断层扫描术(computer tomography,CT)分辨率的微小肺癌病灶患者血浆中,ctDNA在cfDNA中的等位基因频率(allele frequency,AF)可低至0.000 18%[18]。大量源于正常细胞和白细胞的cfDNA会对检测结果产生干扰,因此在检测ctDNA时还需采用外周血白细胞作为对照以减少背景信号。即便如此,高度可变的ctDNA含量仍对NGS检测的灵敏度提出了严重挑战。虽然面临以上困难,但依赖于NGS检测技术的进步和液体活检的固有优势,近年来基于NGS的ctDNA检测方法发展迅速。通过聚合酶链式反应(polymerase chain reaction,PCR)多重扩增或杂交捕获等高深度测序方法,NGS的ctDNA检测极限(limit of detection,LOD)已可低至0.000 1%[19],具备了相对于数字PCR(LOD约为0.1%)更高的灵敏度。
本综述分别针对3个主要临床阶段的癌症诊疗,即高危人群的临床前早筛,术后复发和预后预测,以及晚期癌症伴随诊断,重点介绍近年来NGS在癌症诊疗中的研究及应用进展,并讨论其临床价值和发展前景。
1 基于ctDNA的高危人群早期筛查
依据2020年世界卫生组织(World Health Organization,WHO)发布的统计数据,在中国和全球发达国家中,癌症已超过心血管疾病,成为导致过早死亡的最主要因素[20]。据最新研究估计,2022年中国的癌症发病和死亡人数分别可达4 820 000人和3 210 000人[21]。癌症的早期诊断是提高患者5年生存期的最重要因素,目前美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)或美国癌症学会(American Cancer Society,ACS)指南推荐的癌症易患人群早期筛查方法包括针对肝细胞癌(hepatocellular carcinoma,HCC)的超声结合甲胎蛋白(AFP)检测;针对肺癌的低剂量螺旋CT(lowdose helical computed tomography,LDCT);针对结直肠癌(colorectal cancer,CRC)的结肠镜检查;针对乳腺癌的乳腺X线摄影术;针对宫颈癌的宫颈细胞学检查和人类乳头瘤病毒(HPV)检测;针对前列腺癌的前列腺特异性抗原(prostate-specific antigen,PSA)检测;针对子宫内膜癌的组织学检查[22]。以上传统检查方式的共同缺陷是覆盖的癌种单一,灵敏度和特异性较低,且多为有创检查,以致其难以广泛应用于目标人群。ctDNA检测仅需抽取少量外周血即可完成,目前在多个单一癌症类型检测中已获得相比传统筛查方法更高的灵敏度和特异性[23-24],且具有同时对多个癌种进行筛查的能力。ctDNA检测的主要生物标记包括以下3类:1)针对ctDNA序列突变的测序和分析;2)针对以甲基化为主的ctDNA表观遗传特征的测序和分析; 3)针对cfDNA片段长度特征的分析。目前,血浆或血清ctDNA含量与早期癌症的准确对应关系尚不清楚,主流的分析方法通常依赖机器学习建模,并通过算法优化和同时纳入分析多种类型的ctDNA特征以提高结果准确性。下文选取了HCC、肺癌、CRC这3个在液体活检早筛应用领域进展较快的癌种,结合与传统筛查方法的对比,介绍此ctDNA检测技术的最新进展。
1.1 肝细胞癌
HCC是全球致死人数排第3位的癌症[25]。目前针对HCC的传统检测方法为影像学检查,包括CT、磁共振成像(magnetic resonance imaging,MRI)、超声造影(contrast-enhanced ultrasound,CEUS)结合血清AFP水平测定,但以上方法具有明显局限性。AFP水平作为诊断标志物的灵敏度仅为62.4%,易造成假阴性诊断[26]。影像学检查的灵敏度和特异性分别约为82%和90%,但仅能检出直径大于1cm的病灶[27]。肝脏是人体产生cfDNA最多的器官之一,相应地,HCC也是所有癌症中产生ctDNA最多的癌种[28],这十分有利于采用ctDNA进行HCC筛查。基于ctDNA的表观遗传学特征分析是目前HCC主要早筛方法,其灵敏度普遍高于基于突变特征的分析[29],并可有效区分HCC与肝炎、慢性乙肝病毒感染(chronic hepatitis B virus infection,CHB)、肝硬化(liver cirrhosis,LC)等HCC相关早期病变,以减少过度诊断。
较早的一项以CpG甲基化作为标记的研究采用715例HCC患者与560例健康受试者对照(healthy controls,HC),通过靶向重亚硫酸盐测序获取甲基化标记信息,并以随机森林和LASSO算法共同筛选出10个标记并以此构建预测模型,最终在鉴定383例HCC患者与275例HC的模型性能验证中达到了灵敏度83.3%和特异性90.5%[30]。另一研究采用全基因组5-羟甲基胞嘧啶(5-hydroxymethylcytosines,5hmC)水平作为标记,在训练集中纳入具有CHB和LC病史的HCC患者335人,CHB或LC患者263人,以及HC 522人,分别针对HCC与HC和HCC与CHB/LC两组间进行多项逻辑回归建模分析,鉴定出两组间共有的32个HCC的标记基因。该研究团队开发了wd-score(weighted diagnostic score)算法,依据32个标记基因的回归系数和5hmC值进行HCC诊断。该算法在验证集中的灵敏度和特异性分别为82.7%和76.4%[31]。另一项于2021年发表的研究则同时采用了全基因组5hmC、核小体足迹(nucleosome footprint)、5’末端模体(5’end motif)和cfDNA片段化特征这4类特征,并结合以上特征达到了目前基于NGS进行HCC诊断的较高灵敏度和特异性,分别为95.8%和95.0%[32]。此外,Qu等[33]发表的HCCscreenTM技术是准确性较高的HCC早筛方法,其通过检测ctDNA中的一系列肝癌特征性突变,结合血清AFP和异常凝血酶原(DCP)及被测者性别和年龄,在针对HBsAg阳性且AFP和超声检测阴性的无HCC症状人群前瞻性筛查中,灵敏度和特异性分别达到100%和94%。该团队最近发表的研究则采用了新技术MCP(mutation capsule plus),此项技术的主要优势为在一次反应中同时获取全基因组序列突变和甲基化信息,同时保持两种检测的高灵敏度。通过机器学习构建基于突变结合甲基化的预测模型后,在验证集中区分HCC组与HC组的灵敏度和特异性分别达到90%和94%[34]。
1.2 肺癌
肺癌是全球造成死亡人数最多的癌症[25],主要分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)。多数肺癌在出现症状并确诊时已发生转移,是造成其高死亡率的主要原因。目前针对高危人群的肺癌早筛常规方法为低剂量螺旋CT(low-dose spiral CT,LDCT),可有效降低高风险人群死亡率,但其缺陷包括高达90%的假阳性率[35]、具有一定的放射性危害和较低的普及程度。
2020年有研究者采用了基于杂交捕获和NGS的癌症个体化高深度测序方法(personalized profiling by deep sequencing,CAPP-seq),整合了ctDNA的突变频率、突变基因、片段长度和CNV等信息,通过机器学习方法构建了lung-CLiP score预测模型;在98%特异性下,此方法在验证集中检验Ⅰ、Ⅱ、Ⅲ期NSCLC的灵敏度分别为41%、54%和67%[36]。然而相较ctDNA突变,更多的肺癌早筛研究基于血浆或血清的ctDNA甲基化特征。早期相关研究多集中于单一或少量基因的CpG甲基化区域,利用定量甲基化特异性PCR(quantitative methylation specific PCR,qMSP)鉴定患者和HC之间的基因甲基化水平差异,但灵敏度和特异性通常较低[37-38]。在最近发表的研究中,Chemi等[39]采用一种高灵敏度的NGS甲基化测序方法T7-BMD-seq,通过对SCLC患者来源异种移植物(patient-derived xenografts,PDX)和循环肿瘤细胞来源外植体(circulating tumor cellderived explant,CDX)与HC肺组织或ctDNA进行甲基化差异对比,鉴定出4 061个差异化甲基化区域(differentially methylated regions,DMRs)。随后该研究团队采用机器学习方法构建分类模型,并在由41例HC、29例局限期SCLC(LS-SCLC)和49例广泛期SCLC(ES-SCLC)患者cfDNA组成的验证集中进行检验;此模型成功鉴定了93%的LS-SCLC和100%的ES-SCLC,在100%特异性时灵敏度达到了80%以上[39]。另一项研究则采用基于WGS的cfDNA片段分析,通过机器学习构建了算法模型DELFI,并在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期肺癌检测中分别达到91%、94%的灵敏度和80%的特异性[40]。
1.3 结直肠癌
CRC是全球死亡人数排第2位的癌症[25]。针对CRC的非侵入性检查主要为粪便隐血检测(fecal occult blood test,FOBT)和粪便免疫组化检测(fecal immunohistochemical test,FIT),但因其较低的灵敏度易发生漏诊。
针对CRC早筛的ctDNA标记主要为基因甲基化。2013年Church等[41]针对单一的SEPT9甲基化标记,采用定量聚合酶链反应(quantitative PCR,qPCR)方法对CRC进行前瞻性检测,在Ⅰ、Ⅱ、Ⅲ和Ⅳ期CRC中的灵敏度分别为35%、63%、46%和77.4%,特异性为91.5%。近期发表的2项研究采用了多个CRC相关的甲基化标记,结合机器学习大幅提升了检测性能。其中ColonAiQ算法纳入了6个甲基化标记,通过qPCR获取各位点甲基化数据,在鉴定173例CRC患者与136例HC的模型性能验证中达到86%灵敏度和92%特异性[42]。另一项研究采用了LASSO算法,从667个候选的组织甲基化标记中筛选出11个ctDNA甲基化标记,并构建预测模型;此模型在鉴定123例CRC患者与67例HC的性能验证中的灵敏度和特异性分别为84.6%和86.6%,并可较准确地筛查Ⅰ期CRC[43]。
1.4 多癌种
基于cfDNA的多癌种早筛(multi-cancer early detection,MCED)可在一次检测中同时筛查多个器官肿瘤,因此具有极广泛的应用前景。近期的一项研究预测,如将MCED纳入常规诊疗,将有效提高癌症早期诊断率,并使诊断后5年内死亡的患者人数减少39%[44]。MCED并非单一癌种筛查方法的累加,因其会同时累加整体检出的假阳性率和假阴性率,且增加取样难度和检测成本。同时,MCED需具有进行肿瘤组织来源(tissue of origin,TOO)鉴定的能力。
CCGA(Circulating Cell-free Genome Atlas,NCT02889978)是由加拿大和美国多个医学中心推进的一项大规模前瞻性双臂cfDNA研究,也是目前全球规模最大的相关研究。该研究目的为寻找适合的cfDNA癌症标记,并构建机器学习模型以在人群中进行多癌种筛查。第1个CCGA子项目研究发现,相比针对SNV、插入/缺失(indel)、CNV的WGS和靶向测序,针对全基因组甲基化模式的全基因组重亚硫酸盐测序(whole genome bisulfite sequencing,WGBS)具有更好的预测性能,且在TOO分析方面具有显著优势[29]。随后该研究团队使用超过50个癌种的2 482名患者和4 207名对照,进行了基于全基因组甲基化模式的机器学习建模,所构建的2个模型分别用于癌症筛查和预测肿瘤TOO。其中,癌症筛查模型在高于99%的特异性下,对验证集中Ⅰ~Ⅲ期全癌种筛查的灵敏度达到43.9%,其灵敏度随癌症分期而升高。TOO预测模型则在Ⅰ~Ⅳ期癌症中达到了93%(321/344)的准确性[45]。
2 基于ctDNA的术后微小残留病灶检测
微小残留病灶或称分子残留病灶(molecular residual disease,MRD)是指非转移性癌症患者接受手术、放化疗等治疗并达到完全缓解后,仍有相当一部分患者的血液中可检出残留的肿瘤细胞或肿瘤分子标志物。目前已有大量证据表明,MRD可用于早期预测肿瘤的转移和复发。MRD检测主要依赖循环肿瘤细胞(circulating tumor cells,CTCs)和ctDNA,对两者进行检测分析均可在多种癌症中有效评估复发风险[46],但目前基于NGS的ctDNA MRD检测研究相对更加广泛。依据不同的检测时间和目的,ctDNA MRD检测主要分为2种:1)地标检测(landmark analysis),通常在手术或放疗后的某个时间点进行检测,可在术后快速制定进行辅助治疗方案的依据;2)纵向监测(longitudinal surveillance),指在术后随访过程中的多个间隔时间点进行检测,以尽早发现可能出现的MRD,以便在出现影像学指征前提早开展新一轮辅助治疗[26]。
目前已有大量研究显示,ctDNA MRD可有效预测多种癌症的复发和预后。2017年一项肺癌相关研究采用CAPP-seq,对40名Ⅰ~Ⅲ期NSCLC患者接受根治性治疗前的ctDNA进行突变基因检测,并在93%(n= 37)患者中检出ctDNA;于术后进行的ctDNA MRD纵向监测则在54%(n= 20)的术前阳性患者中再次检出ctDNA。进一步随访发现,术后ctDNA阳性患者最终全部复发,且多数患者检出ctDNA的时间点比影像学更早。相较于术后ctDNA阴性患者,阳性患者的无进展期和生存期均显著缩短。此外,该研究中有53%患者在ctDNA检测中发现了与酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)或免疫检查点抑制剂(immune checkpoint inhibitor,ICI)用药相关的突变[47]。Xia等[48]最近发表的前瞻性、多中心、队列研究纳入了330名Ⅰ~Ⅲ期肺癌患者,于术前、术后3天和术后1个月分别采集患者血浆样本,并使用覆盖769基因的panel进行cfDNA测序。结果显示,术后ctDNA阳性是复发的有效指标[风险比(hazard ratio,HR)= 11.1,P<0.001],其预测准确性高于TNM分期。该研究还发现,术后ctDNA阴性患者接受辅助治疗可显著增加其无复发生存期(relapse free survival,RFS)(HR = 0.3,P= 0.008)。在接受新辅助治疗后的早期三阴乳腺癌患者中,ctDNA MRD检测成功预测了79%患者的复发,ctDNA阴性和阳性患者达到24个月无远端疾病生存期(distant disease-free survival,DDFS)的比例分别为56%和81%,且阴性患者具有显著较低的无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)[49]。Li等[50]在接受过一线治疗的弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)患者中,采用Onco-LymScan panel进行ctDNA检测,证明基于ctDNA的MRD检测可有效实现DLBCL的预后预测、复发预测和疗效评估。
为了在保持ctDNA MRD检出准确性的同时提高检测率,可在患者术后对其肿瘤组织和正常白细胞进行平行测序,识别肿瘤组织特异突变,并针对每位患者的肿瘤突变谱订制个性化panel用于后续的一系列ctDNA检测。Gale等[51]近期发表的研究入组了88名Ⅰ~Ⅲ期NSCLC患者,于患者术后采用WES对其原发肿瘤和血液白细胞进行测序,并针对突变基因频率排位前47 ~ 48的突变设计引物,在ctDNA检测中进行多重PCR和NGS;在该panel中还包含部分正常人群携带的SNP,以便对测序结果进行质控。结果显示,术后2周至4个月期间,17%患者中检出ctDNA,此部分患者的RFS(HR =14.8,P<0.000 01)和OS(HR = 5.48,P<0.000 3)均显著较短。在复发的患者中,有64.3%提前检出了ctDNA,相比传统临床检测方法的检出时间中位数提前212.5天。Liu等[52]发表的局部进展期直肠癌(LARC)相关研究入组了60名LARC患者,在其接受新辅助治疗(neoadjuvant therapy,NAT)的前、中、后期和全直肠系膜切除术(TME)前4个阶段进行血样采集,对其肿瘤组织和血液白细胞进行WES或包含509基因的通用panel测序,并采用多至22个体细胞突变设计个性化panel用于cfDNA测序。结果显示,NAT后的ctDNA水平预测复发的灵敏度和特异性分别达到76.47%和97.67%,其预测性能高于所有经典的风险指标,包括癌胚抗原(carcinoembryonic antigen,CEA)水平、癌抗原19-9(carcinoma antigen 19-9,CA19-9)水平和依据欧洲肿瘤学会(European Society for Medical Oncology,ESMO)指南评估的临床风险。NAT后MRD阳性患者的复发风险显著高于MRD阴性患者(HR = 27.38,P<0.000 1),且在3年随访中显示了更短的OS(HR=17.78,P= 0.000 54)以及RFS。该研究还显示,通过全基因组低深度测序获得的基线(即NAT治疗前)CNV也可预测复发,其灵敏度和特异性分别为66.67%和100%。如结合个性化panel结果,则可将灵敏度和特异性提升至82.35%和97.67%(HR = 35.89,P<0.000 1)。
3 晚期癌症患者的伴随诊断
近年来,NGS因其不断提高通量、降低成本,在癌症的伴随诊断(companion diagnostics,CDx)中已广泛应用于鉴定驱动基因突变、可靶突变和耐药位点,并持续取得进展。NGS鉴定的突变类型主要包括SNV、插入/缺失、染色质重排、CNV、微卫星不稳定性、肿瘤突变负荷等。目前已有一系列基于NGS的CDx产品获得美国食品和药品监督管理局(Food and Drug Administration,FDA)批准,包括用于检测实体瘤组织样本的FoundationOne CDx(F1CDx)、FoundationFocus CDx BRCA、Oncomine Dx Target Test、Praxis Extended RAS panel、Myriad myChoice CDx、ONCO/Reveal Dx Lung &Colon Cancer Assay(O/RDx-LCCA)和检测血液样本的FoundationOne Liquid CDx、Guardant360 CDx、Agilent Resolution ctDx FIRST assaym等[53]。2020年,ESMO发布了关于转移性癌症相关的NGS应用指南,指出多基因panel可应用于肺腺癌、结肠癌、乳腺癌、前列腺癌、胆管癌、卵巢癌的体细胞突变检测,大panel可应用于未知原发灶肿瘤的检测,以及宫颈癌、唾液腺癌、甲状腺癌、中等分化至高度分化的神经内分泌肿瘤和会阴癌的肿瘤突变负荷(tumor mutation burden,TMB)检测[54]。ESMO同时发布了依据其分子靶点临床可操作性量表(ESMO Scale for Clinical Actionability of Molecular Targets,ESCAT)[55]分级的多个晚期癌种可靶突变,为临床实践提供了进一步详细指导。近期研究显示,全基因组-转录组测序和分析(whole-genome and transcriptome sequencing and analysis,WGTA)可在83%的晚期转移性泛癌种患者中检出可临床干预靶点,而在接受靶向治疗的患者中有46%取得了临床获益[56],这进一步肯定了NGS在晚期肿瘤临床干预中的重要地位。近期的相关研究主要集中于进一步补充潜在治疗靶点,并在临床试验中明确靶药的治疗效果。随着未来更多靶向药物的获批上市,NGS用于CDx的价值将得到进一步提升。
3.1 肺癌
NGS技术使肺癌的精准治疗获得极大发展,目前经过广泛验证的肺癌可靶向突变多存在于NSCLC的肺腺癌(lung adenocarcinoma,LADC)分型中,LADC约占全部NSCLC的60%,是占比最高的肺癌分型[57]。EGFR、ALK、ROS1、BRAF、KRAS、MET、RET、HER2和NTRK突变是NSCLC主要治疗靶点[58]。2023年第2版NCCN指南推荐使用NGS panel对所有NSCLC进行检测,并指出应在未检出驱动基因突变时考虑采用RNA测序以最大化检出融合基因。美国FDA于2021年批准EGFR/MET双特异性抗体amivantamab用于治疗携带EGFR20号外显子插入突变的NSCLC,同时批准Guardant360 CDx作为其伴随诊断方法。2022年,美国FDA批准cemiplimab结合化疗用于治疗无EGFR、ALK、ROS1突变的晚期成人NSCLC。近期的研究和临床试验仍在不断完善针对以上靶点用药的治疗效果。Yu等[59]发表的一项真实世界研究纳入了2 864名携带EGFR体细胞突变的进展期中国NSCLC患者,以验证EGFR-酪氨酸激酶抑制剂(EGFR tyrosine kinase inhibitor,EGFR-TKI)的治疗效果。结果显示,接受EGFR-TKI治疗的患者OS显著高于其他治疗方式患者,其OS中位数增加6.8个月。此外,接受第1代或第2代EGFR-TKI一线治疗后疾病进展并转用第3代EGFR-TKI治疗的患者,其OS显著高于接受第3代EGFR-TKI一线治疗和进展后未接受第3代EGFR-TKI治疗的患者,进一步明确了EGFR-TKI对中国NSCLC患者的临床价值。ALK融合是临床指南中推荐的重要NSCLC生物标志物和治疗靶点,针对ALK激酶区的靶向抑制剂,包括克唑替尼(crizotinib)和第2代抑制剂色瑞替尼(ceritinib)、阿莱替尼(alectinib)、布加替尼(brigatinib),以及第3代抑制剂劳拉替尼(lorlatinib)均已应用于治疗ALK融合阳性NSCLC患者。最近一项多中心、随机、Ⅲ期临床研究结果显示,第2代ALK抑制剂恩莎替尼(ensartinib)相比克唑替尼对全身病灶,尤其针对颅内转移病灶有更高的反应率(63.6%vs21.1%),提示ensartinib有潜力成为新的一线治疗药物[60]。Shi等[61]针对多癌种的回顾性RET融合研究同时采用DNA和RNA NGS测序,在肺癌中鉴定出GLI3-RET和MALRD1-RET 2个新的功能性融合,进一步完善了潜在的靶向RET融合突变谱。
KRAS是另一常见的NSCLC驱动突变基因,其在LADC中的发生率约为35%[62]。然而由于KRAS具有非常强的三磷酸鸟苷(guanosine triphosphate,GTP)亲和性,加之较小的催化结构域使其难以结合小分子,导致直接针对KRAS靶向药物研发十分困难。与此同时,较早的针对KRAS协同通路[63]或下游通路[64]进行的靶向治疗临床试验同样未取得良好效果。最近,针对KRAS p.G12C新靶点开发的药物索托拉西布(sotorasib)在临床试验中被证明有效[65],并获得FDA快速通道批准,用于已接受过至少一次系统治疗的KRASG12C突变携带者[66]。同时获批的伴随诊断试剂为QIAGEN therascreen®KRAS RGQ PCR kit与Guardant360®CDx,分别用于检测组织和血浆样本。此外,针对KRAS突变热点表达的肿瘤新抗原(tumor neo-antigen,TNA)开发mRNA疫苗是具有良好前景的新型治疗方法,但其有效性尚待临床试验的进一步研究支持[67]。
3.2 结直肠癌
近年来,随着中国的经济发展和民众饮食习惯改变,CRC的发病率和死亡率不断升高。2020年,中国新增CRC患者555 477人,相关死亡人数为286 162人,分别占全球CRC的28.8%和30.6%[68]。
2021年第2版NCCN指南推荐采用NGS或其他方法检测转移性CRC(mCRC)生物标志物,包括KRAS/NRAS突变,BRAFV600E突变,HER2扩增或过表达,缺陷错配修复(deficient mismatch repair,dMMR)/高频率微卫星不稳定性(high microsatellite instability,MSI-H)状态和NTRK融合。该指南建议所有mCRC患者均应进行分子检测,以识别林奇综合征(Lynch syndrome,LS)相关的dMMR/MSI-H,约有5%的mCRC携带此标志物。除与LS相关外,dMMR/MSI-H还可提示免疫治疗有效性[69]。Zhao等[70]最近发表的研究对罕见的同步多原发结直肠癌(synchronous multiple primary colorectal cancer,sMPCC)和单原发结直肠癌(single primary CRC,SPCRC)的分子特征进行了分析,对78名sMPCC的158个病灶和111名SPCRC患者的肿瘤组织进行NGS panel测序,证实sMPCC具有更高的dMMR/MSI-H与高肿瘤突变负荷(high tumor mutation burden,TMB-H)发生率,提示sMPCC患者更可能获益于免疫治疗。
另外,NCCN发布的遗传/家族性高风险评估:结直肠(Genetic/Familial High-Risk Assessment:Colorectal)指南2022年第2版[71]则推荐对高CRC遗传风险的人群进行基于多基因panel的遗传突变检测,其中应至少包含以下风险相关基因:APC,MUTYH,MLH1,MSH2,MSH6,PMS2,PECAM,BMPR,SMAD4,PTEN和STK11。目前,NCCN指南中推荐的遗传性突变筛查年龄为小于50岁的CRC患者,而Jiang等[72]最近发表的CRC胚系突变筛查研究则显示,年龄至70岁及以下的CRC患者均可能携带癌症发病风险相关基因胚系突变。
与NSCLC类似,KRAS在mCRC中具有高达44%的突变率,但针对KRASG12C的靶向抑制剂在mCRC临床试验中未取得与NSCLC相近的反应率[73]。Amodio等[74]针对NSCLC和CRC细胞系的研究发现,CRC细胞系具有更高的受体酪氨酸激酶(receptor tyrosine kinase,RTK)基线活性水平,并可被上游生长因子激活。该研究还发现,EGFR信号通路激活是CRC对KRASG12C抑制剂耐药的重要机制,同时应用EGFR和KRASG12C抑制剂AMG150在CRC细胞系、CRC肿瘤类器官和异种移植体中均取得显著治疗效果,使其成为有前景的KRASG12C突变靶向治疗方法。基于此结论,2023年1月Jänne等[75]报告的Ⅰ~Ⅱ期临床试验对KRASG12C抑制剂adagrasib(MRTX849)单一用药和adagrasib联合EGFR抑制剂cetuximab治疗KRASG12C突变型mCRC进行对比。该研究结果显示,联合用药获得了更高的反应率(46%vs19%)、更长的无进展生存期(progression-free survival,PFS)(6.9 个月vs5.6 个月)和更低的3/4级不良反应发生率(16%vs34%),验证了KRASG12C抑制剂和EGFR抑制剂联合用药的临床价值。
3.3 乳腺癌
女性乳腺癌(breast cancer,BC)是目前所有癌症中发病率最高的种类,约占所有癌症发病人数的11.7%,而在女性癌症中可达24.5%[25]。通过雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和HER2等分子分型可将乳腺癌分为4类:管腔A型(luminal A:ER+,PR+,HER2-,Ki67低表达),管腔B型(luminal B:ER+,PR+,HER2-,Ki67高表达),HER2过表达型和三阴乳腺癌(TNBC:ER-,PR-,HER2-)。其中管腔A/B型亦可称为激素受体阳性、HER2阴性(HR+,HER2-)型[76]。针对HR+乳腺癌目前主要应用内分泌疗法,针对HER2+乳腺癌主要采用HER2靶向治疗结合化疗,而TNBC缺少以上治疗靶点,故主要采用化疗且预后不佳[77]。2020年,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)/美国病理学家协会(college of american pathologists,CAP)更新了乳腺癌HR表达检测的相关指南,由于采用激素疗法治疗ER细胞表达率为1% ~ 10%的乳腺癌的疗效证据有限,故将此部分ER+乳腺癌定义为低ER表达乳腺癌[78]。临床中通常采用免疫组化(IHC)进行上述分型。
目前,NGS主要应用于BC的遗传易感基因检测。全部BC中约有10%具有家族史或遗传易感突变,其中最常见的易感突变基因为BRCA1和BRCA2,其易感突变基因携带者至80岁时BC累积患病风险高达70%[79]。依据2023年更新的NCCN遗传性癌症检测指南[80],发病年龄为50岁及以下或经评估具有家族史的BC患者应进行遗传易感基因突变检测,包括BRCA1,BRCA2,CDH1,PALB2,PTEN和TP53。
由于BC筛查方法的进步,依据监测,流行病学和最终结果(Surveillance,Epidemiology,and End Results,SEER)项目公布的数据显示,2019年美国仅有7.5%BC患者诊断时发生远端转移。然而,远端转移是导致BC患者死亡的主要原因[81]。针对转移性乳腺癌(mBC)的部分患者,目前已有部分治疗方法经FDA批准应用于临床,如PI3K抑制剂alpelisib可用于治疗携带PIK3CA热点突变的HR+/HER2-mBC[82]。mBC中还可检测到部分罕见体细胞突变,如MSI-H,NTRK融合,分别可采用相应的泛实体瘤靶向药物进行治疗[83-84]。近期发表的部分相关研究旨在进一步探索mBC治疗靶点,并验证NGS在mBC临床干预中的作用。Kawaji等[85]采用F1CDx对109名mBC患者肿瘤进行测序,发现有76%患者携带可临床干预的突变,但未对患者实施干预并分析预后。另一项研究中,Andre等[86]入组了1 462名HER2-mBC患者,采用多基因panel结合比较基因组杂交(CGH)对肿瘤进行突变分析;研究者将总计238名携带可临床干预突变且希望接受治疗的患者,其中115名携带ESCAT Ⅰ/Ⅱ级突变的患者,随机分为2组,在组内分别进行维持性化疗和与突变匹配的多种靶向治疗。结果显示,两组内接受靶向治疗的患者PFS均显著长于接受化疗的患者。此结果在ESCATⅠ/Ⅱ级突变携带者中尤为显著,携带此类突变并接受靶向治疗的患者(n= 75)相比接受维持性化疗的患者(n= 40),其PFS中位数延长了6.3个月(9.1个月vs2.8个月,P<0.001);而在携带非ESCATⅠ/Ⅱ级突变的患者中,2种治疗方法的PFS无显著差异。提示,在严谨的突变分级指导下,以NGS为基础的靶点检测和靶向治疗对mBC的预后改善具有重要意义。
3.4 脑胶质瘤
成人弥漫性胶质瘤(diffuse glioma)是最常见的成人脑实质肿瘤,其占比大于70%[87]。在2021年发布的第5版WHO中枢神经系统肿瘤分类(WHO CNS 5)中,分子诊断的重要性得到了大幅提升[88]。依据突变类型,成人弥漫性胶质瘤可分为以下3类:1)星形胶质细胞瘤,IDH突变型;2)少突胶质细胞瘤,IDH突变和染色体1p/19q共缺失型;3)胶质母细胞瘤,IDH野生型。可见,IDH突变仍为最重要的分型依据。欧洲神经肿瘤协会(European Association for Neuro Oncology,EANO)建议,对于小于55岁且IHC检测IDH1 R132H阴性的WHO 2/3级弥漫性星形胶质瘤、少突胶质瘤和全部胶质母细胞瘤患者,应采用测序进行IDH突变检测[89]。另有研究显示,依据现行诊断标准,采用NGS检测IDH1、IDH2突变的可靠性优于IHC[90],结合目前大幅增加的分子分型标记种类,提示NGS有潜力成为胶质瘤分型的首选检测方法,从而提升分子诊断的准确性并指导临床干预。
目前的胶质瘤治疗方法主要为手术切除和术后放化疗,但一系列研究和临床试验为针对胶质瘤突变的靶向治疗提供了新的可能性。Ivosidenib是一种IDH1靶向抑制剂,目前已由FDA批准用于治疗复发性或难治性IDH1突变型急性髓系白血病和IDH1突变型局部晚期或转移性胆管癌。近期的一项多中心Ⅰ期临床试验纳入了66名进展期胶质瘤患者,其中46例纳入剂量扩展阶段(dose expansion phase),接受500 mg、1次/日用药,最佳响应为1名患者的部分缓解和44名患者的病情稳定。该研究还依据对比增强MRI T1加权像将患者分为增强组和非增强组,并发现非增强组经治疗后的PFS中位数长于增强组(13.6个月vs1.4个月)[91]。Vorasidenib是一种IDH1/2双抑制剂,针对其开展的Ⅰ期临床试验显示,vorasidenib治疗非增强胶质瘤的客观缓解率为18%,非增强组与增强组的PFS中位数分别为36.8个月和3.6个月[92]。然而,IDH1抑制剂的治疗效果仍需进一步临床试验评估。
MET14号外显子跳跃(METex14)较常见于继发性胶质母细胞瘤,其发生率约为14%。METex14和功能性MET融合均可导致MET和STAT3通路异常激活[92],从而促进肿瘤细胞增殖和转移。MET抑制剂已在Ⅰ期临床试验中被证明对携带METex14突变或PTPRZ1-MET融合的患者有效[93]。Yang等[94]的近期研究显示,MET融合在脑癌中的携带率为1.1%,除相对常见的PTPRZ1-MET和CAPZA2-MET外,在脑癌中还发现了ST7-MET,BMT2-MET,DNAJB6-MET和CHRM2-MET罕见融合,进一步为MET抑制剂应用于脑癌治疗提供了基础,并明确了NGS在MET融合鉴定中的价值。
4 结语
NGS技术的发展极大地提高了人们对于肿瘤基因组学、表观遗传学和转录组学方面的认识,以及对肿瘤的个体间异质性、肿瘤内时空异质性和肿瘤耐药性形成机制的理解。对各癌种体细胞突变谱和驱动基因突变致癌、促癌机制的深入研究,为靶向药物的研发提供了坚实基础。目前,已有上百种癌症靶向药获批上市,并在NSCLC、CRC、BC等癌症的辅助治疗中取得了突出成效。NGS又可广泛应用于伴随诊断,其高灵敏度、高通量、高覆盖率地检测序列突变、CNV以及基因融合,相较其他方法具有许多不可替代的优势。在伴随诊断应用中,ctDNA检测已被纳入多个国内外癌症诊疗指南或专家共识,可在适当前提下替代组织活检样本。同样,基于ctDNA的MRD检测则依靠CAPP-seq方法获得极高灵敏度,可更早地预测肿瘤复发和患者预后,同时获取复发病灶突变信息以指导临床干预。
近年来,基于液体活检的早筛方法依托其采样简单、低创伤性、高灵敏度和多癌种同时检测溯源等内在优势,获得了较快发展。然而,由于癌症早筛的目标人群基数庞大,即使筛查方法具有较高的特异性,仍将产生相当数量的假阳性结果,导致过度诊断。其次,较高的检测成本同样限制了此项技术在易感人群中的普及。未来随着NGS技术可靠性的进一步提升和成本的降低,结合癌症特异性生物标志物的优化选择和机器学习算法的快速发展,加之相关政策法规的进一步完善,液体活检早筛的优势将进一步体现,并有望广泛地投入临床应用。
