江苏省不同麦区小麦品种(系)对赤霉病的抗性及籽粒DON积累分析
2023-07-17吴雨琦杨红福刘家俊吴琴燕谭小力邓渊钰陈怀谷庄义庆
吴雨琦,徐 超,杨红福,刘家俊,吴琴燕, 谭小力,邓渊钰,陈怀谷,庄义庆
(1.江苏大学生命科学学院,江苏镇江 212000; 2.江苏丘陵地区镇江农业科学研究所,江苏句容212400; 3.江苏省农业科学院,江苏南京210000)
由禾谷镰刀菌(Fusariumgraminearum)引起的小麦赤霉病(Fusarium head blight,FHB)是世界范围内对小麦最具破坏性的病害之一[1]。该病害主要发生在潮湿、半潮湿地区,特别是气候湿润多雨的温带地区[2]。小麦感病后,不仅会造成严重减产,而且影响其品质和食用价值[3-4]。同时,由赤霉病菌产生的真菌毒素,尤其是脱氧雪腐镰刀菌烯醇(DON)毒素严重危害人畜健康[5]。2000-2018年,小麦赤霉病在中国的年平均发生面积约占小麦总种植面积的20%[6],在黄淮麦区、西北麦区和东北春麦区均有发生[7],对中国小麦的安全生产带来了严重威胁。
培育并种植抗病品种是防控小麦赤霉病最经济、有效且环保的措施。目前,国内外已经鉴定出一些高抗赤霉病的材料,如苏麦3号以及地方品种望水白、白三月黄、黄方柱等[8-10]。国外品种如日本小麦Nyubai[11]、巴西小麦Frontana[12-13]以及国际玉米小麦改良中心(CIMMYT)合成衍生品系SYNI[14]等都具有较好的赤霉病抗性。研究表明,小麦对赤霉病的抗性可分为五种类型,即:Type Ⅰ(抗侵染)、Type Ⅱ(抗扩展)、Type Ⅲ(抗毒素积累)、Type Ⅳ(籽粒抗性)和Type Ⅴ(耐病性或耐产量损失)[15-16]。近些年来,已经定位到许多与赤霉病抗性相关的基因。其中,位于3BS染色体上的Fhb1是目前发现的最有效且稳定的主效抗扩展性基因[11, 17-20];Fhb2也是一个抗扩展性基因,位于6BS染色体Xgwm133~Xgwm644区间内[21];Fhb5是一个抗侵入性基因,位于5A染色体Xgwm304~Xgwm415区间内[22],这些抗性基因的遗传均较为稳定。
本研究收集了江苏省淮南和淮北麦区共计69份小麦品种(系),通过调查田间自然发病条件下赤霉病的发病情况以及籽粒中DON毒素积累情况,探究Fhb1、Fhb2和Fhb5基因在供试小麦品种(系)中的分布及其与病情指数和DON含量之间的相关性,以期为小麦赤霉病的防控以及赤霉病抗性品种(系)的选育提供参考。
1 材料与方法
1.1 供试材料
供试材料为江苏省69份小麦品种(系),其中淮南麦区30份,淮北麦区39份。以苏麦3号(高抗赤霉病)、扬麦158(中抗赤霉病)、淮麦20(中感赤霉病)和矮抗58(高感赤霉病)作为对照品种。各小麦品种(系)名称详见表1。
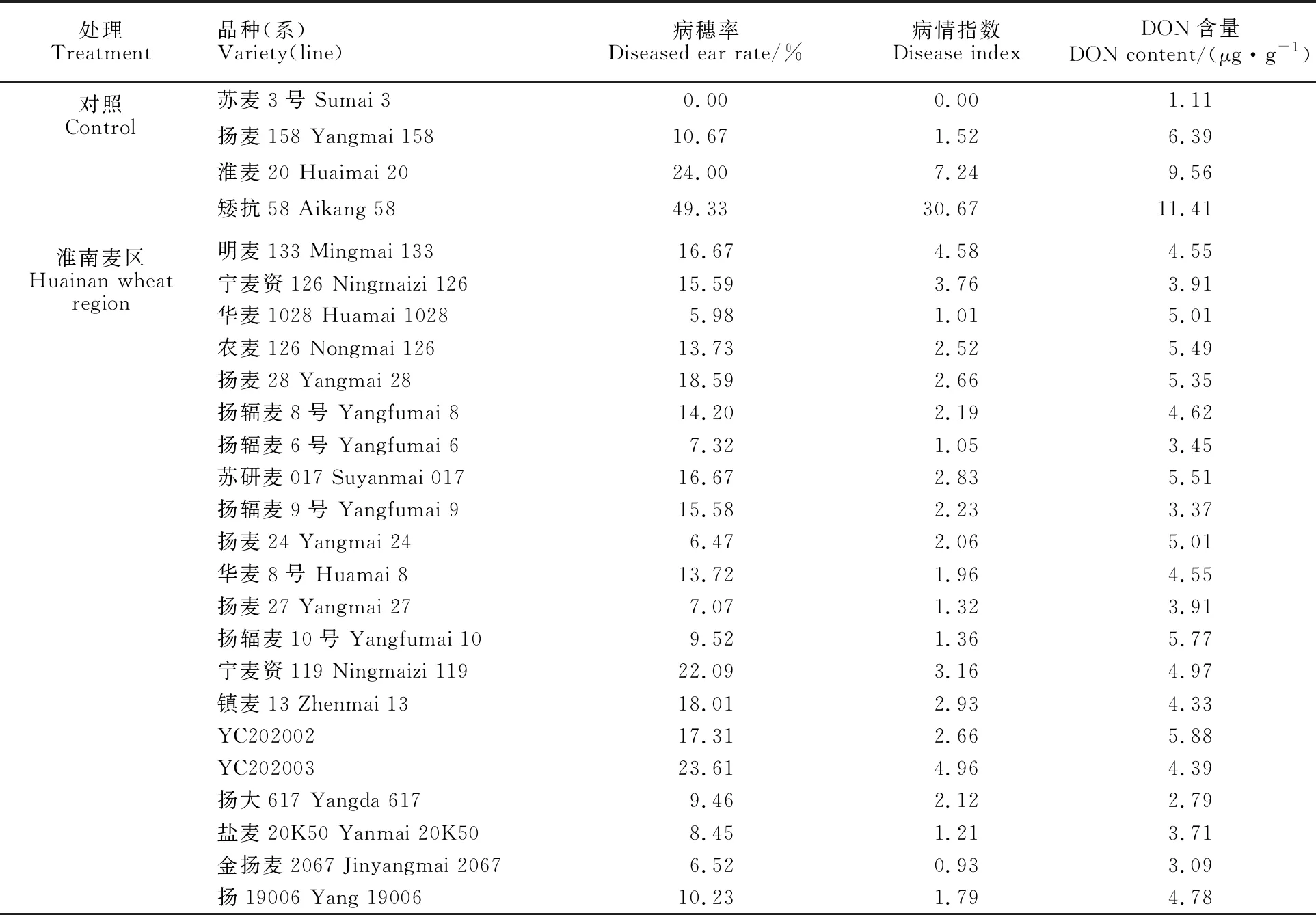
表1 自然发病条件下供试小麦品种(系)的病穗率、病情指数和DON含量
1.2 小麦赤霉病田间自然发病调查
试验在江苏省镇江农业科学研究所试验基地进行。参照朱展望等[23]的方法,将每份品种(系)种植5行,行长1 m,行距0.25 m,每行播种100粒。于病情稳定后(2021年5月15日)按0~4级分级标准对所有材料进行病情调查,每个小区调查50穗,并按照《GB/T 15796-2011 小麦赤霉病测报技术规范》中的方法进行赤霉病病穗率和病情指数计算。
病穗率=(发病穗数/调查总穗数)×100%
病情指数=100× [∑(各级病穗数×相应病级数值)/(调查总穗数×4)]
病情分级标准:0级,全穗无病;1级,病小穗数占全部小穗数的25%以下;2级,病小穗数占全部小穗数的25%~50%;3级,病小穗数占全部小穗数的50%~75%;4级,病小穗数占全部小穗数的75%以上。
1.3 DON毒素含量的测定
将供试小麦品种(系)的麦穗手工脱粒后,用高速研磨粉碎机(YK-200B,青州市益康中药机械配件厂)研磨至粉末状,装入自封袋中,室温保存备用。称取0.5 g样品粉末置于5 mL离心管中,加入2.5 mL去离子水,混匀后充分振荡3 min,在室温下4 000 r·min-1离心5 min。取上清液,用样本稀释液稀释10、50、100倍后,备用。
用呕吐毒素(DON)酶联免疫检测试剂盒(维赛,江苏)检测样品中的DON毒素含量(最低检测限为200 ppb)。在Multiskan FC型酶标仪(赛默飞,美国)上按试剂盒说明书要求分别在450 nm处检测标准样品和待测样品的吸光值。每个样品重复测定3次。当滤液中的DON毒素含量超过检测范围时,更换其他倍数的稀释液。
1.4 相关性分析
用Excel 软件进行数据处理。用SPSS 22.0对供试小麦品种(系)的病穗率、病情指数和DON毒素含量进行相关性分析。
1.5 基因组DNA提取及PCR检测
将供试小麦品种(系)的种子置于25 ℃恒温培养箱(光照16 h/黑暗8 h)中培养7 d后,每个品种(系)随机挑选5株,用消过毒的剪刀小心剪下小麦叶片,置于2 mL离心管中。用植物基因组DNA提取试剂盒(索莱宝,北京)提取DNA,具体操作步骤按照试剂盒说明书进行。
用TaHRC-GSM-F/R引物[24]对Fhb1基因进行检测。PCR反应体系为10 μL,包括PCR Mix 5 μL,上、下游引物(10 μmol·L-1) 各1 μL,DNA模板1 μL,ddH2O 2 μL。PCR反应程序用touchdown程序进行[25]。用2%的琼脂糖凝胶对PCR扩增产物进行电泳检测,用DNA凝胶成像系统(JS-680D,上海培清科技有限公司)进行观察并拍照。
用连锁标记Gwm133和Gwm644[21]检测Fhb2基因,用连锁标记Gwm304和Xhbg394[22]检测Fhb5基因。PCR反应体系同上。PCR反应程序利用三步法进行[21-22]。PCR扩增产物用8%的丙烯酰胺凝胶进行电泳,经过银染及显影后进行观察并拍照。
2 结果与分析
2.1 供试小麦品种(系)的赤霉病抗性及籽粒中DON含量分析
从表1可以看出,供试小麦品种(系)均有不同程度的赤霉病发生,淮北麦区品种(系)的病害发生程度明显高于淮南麦区品种(系)。
淮南麦区30个小麦品种(系)的病穗率平均值为14.88%,姜运麦1624最高(30.43%),华麦1028最低(5.98%);病情指数平均值为2.75,姜运麦1624最高(5.38),金扬麦2067最低(0.93);籽粒DON含量平均值为4.65 μg·g-1,YC202002最高(5.88 μg·g-1),扬大617最低(2.79 μg·g-1)。
淮北麦区39个小麦品种(系)的病穗率平均值为45.91%,富麦668最高(100%),佳麦203最低(18.57%);病情指数平均值为13.97,江麦166最高(48.54),农麦158最低(3.43);籽粒DON含量平均值为10.10 μg·g-1,富麦668最高(11.50 μg·g-1),华麦118最低(6.51 μg·g-1)。
2.2 供试小麦品种(系)病穗率、病情指数和DON含量的相关性
对供试小麦品种(系)的病穗率、病情指数和籽粒DON含量间的相关性进行分析,发现供试小麦品种(系)的籽粒DON含量与病穗率和病情指数均呈极显著正相关(P<0.01),相关系数分别为0.705和0.573;病穗率与病情指数也呈极显著正相关,相关系数为0.864。
2.3 供试小麦品种(系)抗性基因的鉴定结果
以苏麦3号(高抗)、扬麦158(中抗)、淮麦20(中感)和矮抗58(高感)为对照,利用Fhb1基因的功能标记、Fhb2和Fhb5基因的连锁标记对69份小麦品种(系)进行抗性基因鉴定。结果发现,仅携带Fhb1的小麦品种(系)有6份(图1和表2),均来自淮南麦区,分别为扬麦28、扬辐麦9号、华麦8号、宁麦资119、镇麦13和盐麦20K50,占供试品种(系)的8.70%。仅携带Fhb2的小麦品种(系)有2份(图2和表2),分别为郑品麦27号和宁S19040,均来自淮北麦区,占供试品种(系)的2.90%。仅携带Fhb5的小麦品种(系)有9份(图3表2),分别为YC202002、扬19006、扬19124、扬辐麦9246、镇17015、姜运麦1624、宁红17121、中研麦238和农麦330,占供试品种的13.04%,其中只有农麦330来自淮北麦区,其余8个品种(系)均来自淮南麦区。
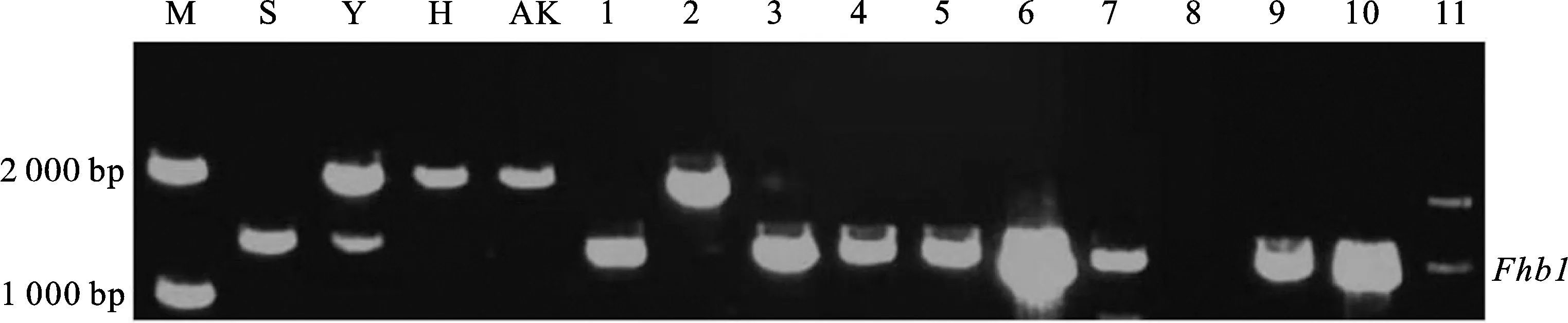
M:DL2000;S:苏麦3号;Y:扬辐麦158;H:淮麦20;AK:矮抗58;1:扬麦28;2:苏研麦017;3:扬辐麦9号;4:华麦8号;5:宁麦资119;6:镇麦13;7:练08;8:YC202002;9:扬大617;10:盐麦20K50;11:金扬麦2067。
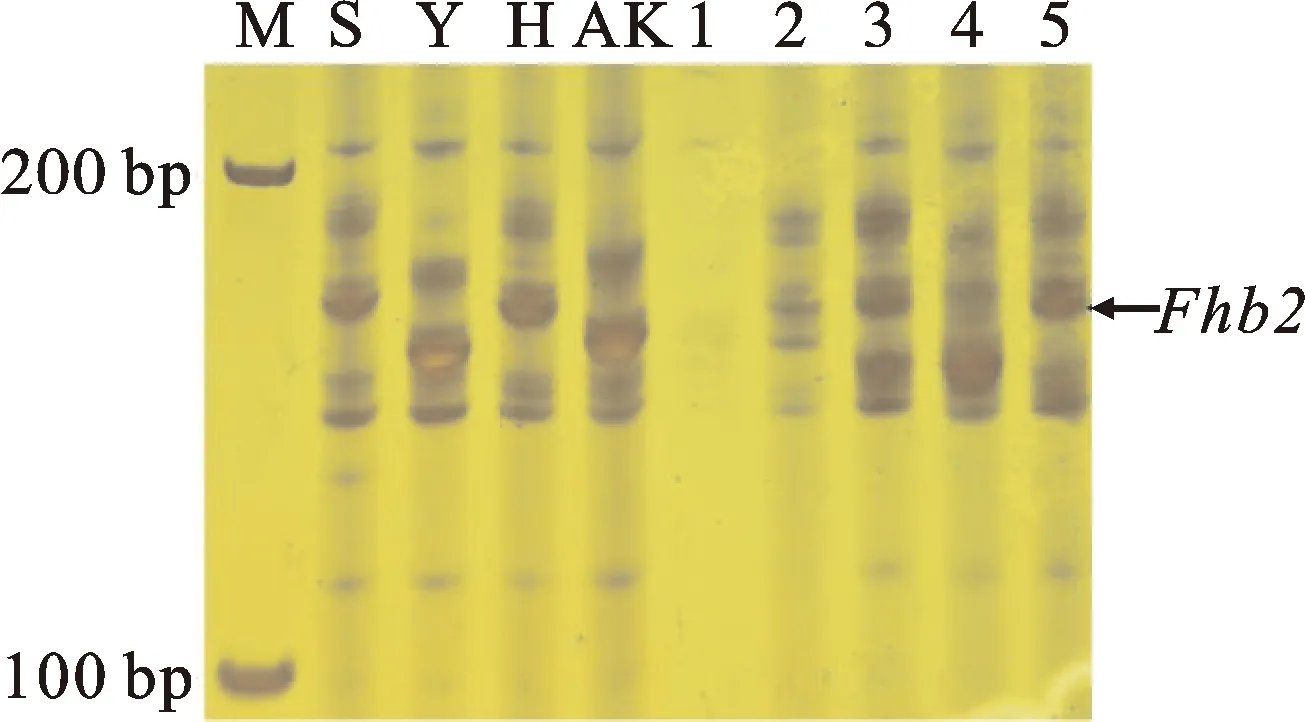
M:DL600;S:苏麦3号;Y:扬辐麦158;H:淮麦20;AK:矮抗58;1:瑞华麦518;2:郑品麦27号;3:宁S19040;4:宁中0183;5:扬大617。
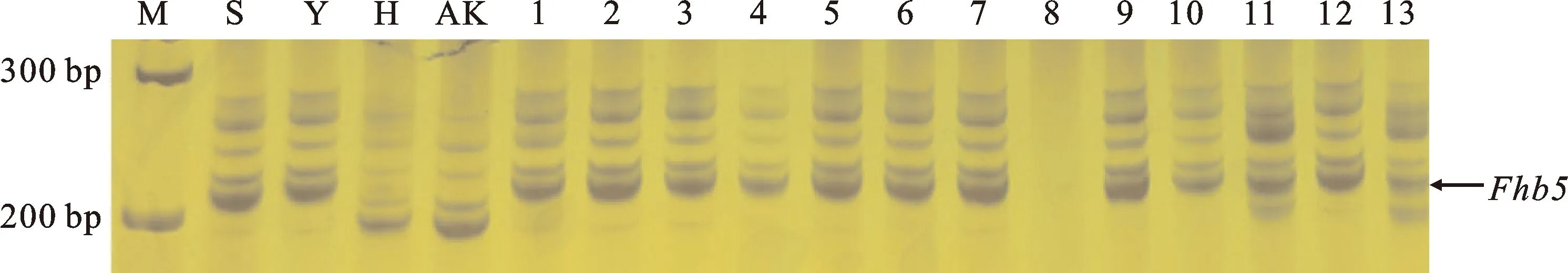
M:DL600;S:苏麦3号;Y:扬辐麦158;H:淮麦20;AK:矮抗58;1:YC202002;2:扬大617;3:金扬麦2067;4:扬19006;5:扬19124;6:扬辐麦9246;7:镇17015;8:农麦208;9:姜运麦1624;10:宁红17121;11:练08;12:中研麦238;13:农麦330。
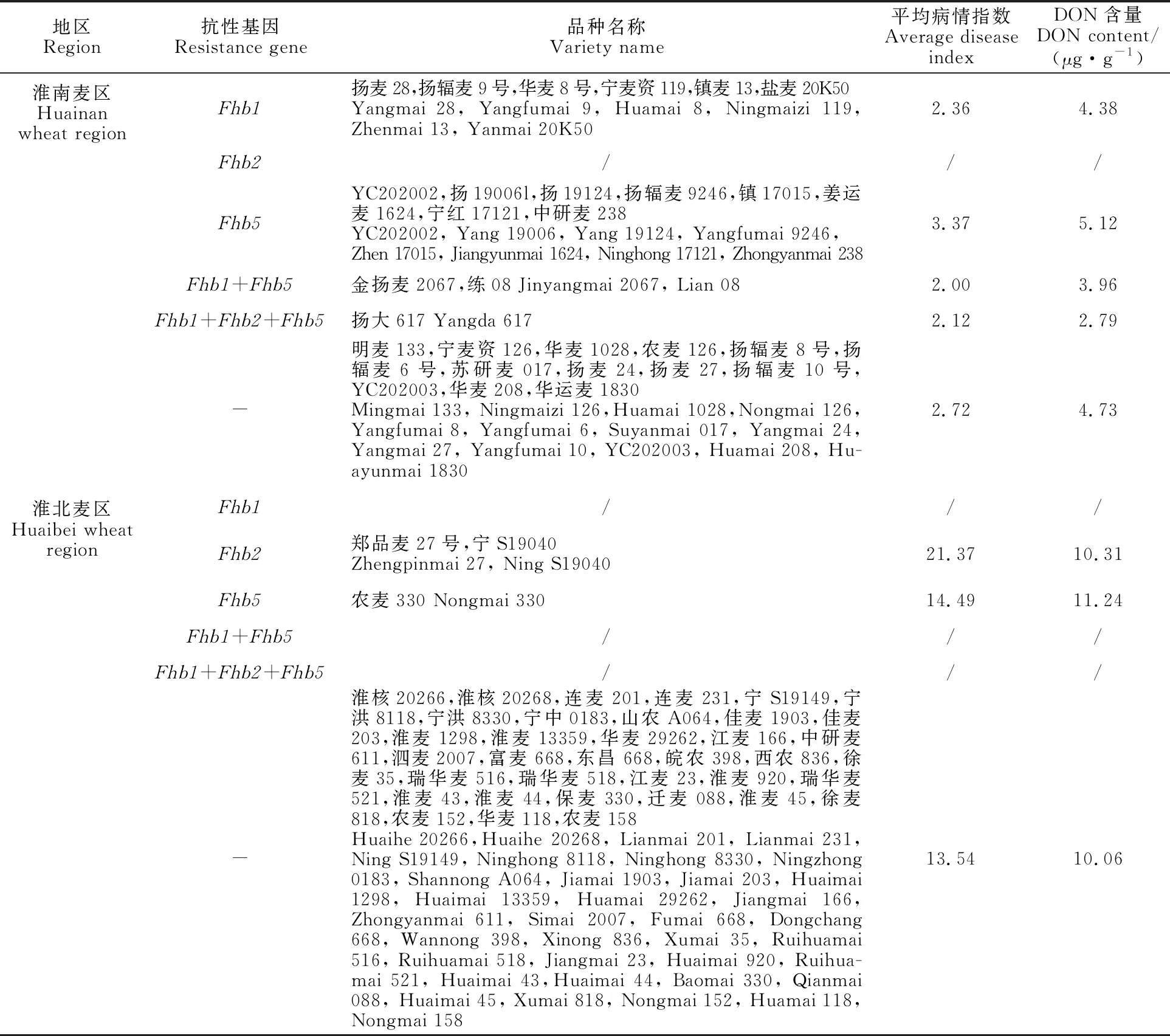
表2 不同抗性基因类型小麦品种(系)的病情指数和DON含量
同时携带2个抗性基因(Fhb1+Fhb5)的小麦品种(系)有2份,分别为金扬麦2067和练08;同时携带3个抗性基因(Fhb1+Fhb2+Fhb5)的小麦品种(系)仅有1份,为扬大617,这3个品种(系)均来自淮南麦区。
2.4 淮南和淮北麦区携带不同抗性基因小麦品种(系)的病情指数和DON含量
从表2可以看出,淮南麦区品种(系)中,与不携带抗性基因的品种(系)相比,仅携带Fhb1以及携带Fhb1+Fhb5和Fhb1+Fhb2+Fhb5的品种(系)病情指数分别降低0.36、0.72和0.60,籽粒DON含量分别降低0.35、0.77和1.94 μg·g-1;仅携带Fhb5的品种(系)病情指数平均值和籽粒DON含量均有所升高;不存在仅携带Fhb2的品种(系)。淮北麦区品种(系)中,仅携带Fhb2和仅携带Fhb5的品种(系)的病情指数平均值分别为21.37和14.49,籽粒DON含量分别为10.31和11.24 μg·g-1,与不携带抗性基因的品种相比,均有所增加;不存在仅携带Fhb1的品种(系)。淮南麦区仅携带Fhb5的品种(系)以及淮北麦区仅携带Fhb2或Fhb5的品种(系)病情指数和籽粒Don含量低于不携带抗性基因的品种(系),原因可能是仅携带这两个基因的品种(系)数目太少,试验误差所致。以上结果说明,淮南麦区大部分小麦品种(系)具有赤霉病抗性。
3 讨论
本研究通过调查田间自然发病条件下淮南和淮北麦区不同小麦品种(系)对赤霉病的抗性以及籽粒中DON的积累情况,发现淮南麦区小麦品种(系)的病害发生程度明显低于淮北麦区品种(系),且籽粒DON含量与病穗率及病情指数均呈极显著正相关,这与徐 飞等[26-27]的研究结果一致。但也有部分小麦品种(系)的病穗率较高,而籽粒中DON含量较低,如华麦118、中研麦611等,说明这些品种(系)可能具有抗毒素积累能力;还有一些品种表现出较高的病情指数,而病穗率较低,如扬19124等,说明这些品种具有抗侵染的能力,但不具有抗扩展的能力。
研究表明,Fhb1和Fhb2基因具有抗扩展性[21,24],Fhb5基因具有抗侵染性[22]。Xie等[28]将苏麦3号中的Fhb1基因导入澳大利亚小麦品种中,发现携带Fhb1的后代对赤霉病的抗性高于亲本。Bernardo等[29]以苏麦3号的衍生品系宁7840为抗源,将抗性基因Fhb1导入到美国硬冬小麦品种Clark中,发现后代中携带Fhb1的品系对赤霉病的抗性显著提高,籽粒DON含量也明显下降。本研究发现,与不携带抗性基因的品种(系)相比,仅携带Fhb1的品种(系)的病情指数平均值和籽粒DON含量均较低,说明Fhb1基因能够提高小麦品种(系)的赤霉病抗性。
与携带单个抗性基因的小麦品种(系)相比,携带多个抗性基因(Fhb1+Fhb5、Fhb1+Fhb2+Fhb5)的品种(系)的赤霉病病情指数和籽粒DON含量均较低,这与Brar等[30]的研究结果一致。由此可见,聚合多个抗性基因不仅能提高赤霉病抗性,还可降低籽粒DON含量。本研究筛选到一个同时携带3个抗性基因(Fhb1+Fhb2+Fhb5)的品种(扬大617),该品种携带与苏麦3号相同的抗性基因组合,其病穗率、病情指数和籽粒DON含量均较低,表明该品种可以作为赤霉病抗性育种的亲本材料。
此外,我们还检测到病穗率较高但DON含量较低的小麦品种(系)(如华麦118、中研麦611等),以及病穗率、病情指数和DON含量均较低的小麦品种(系)(如扬辐麦6号、扬麦27等),在这些材料中均未检测到Fhb1、Fhb2或Fhb5抗性基因,初步推测这些品种(系)中可能携带其他抗性基因,需深入挖掘潜在的抗性位点。
