肠内营养在食管癌根治术患者快速康复中的应用效果研究
2023-07-17徐敬根张静袁敏
徐敬根 张静 袁敏


摘要:目的:研究食管癌患者术后应用肠内营养对患者术后快速康复的意义。方法:回顾性收集2019年1月—2020年6月在我院行食管癌手术治疗的60例患者为研究对象,所有患者行微创胸腹腔镜下行食管癌根治术,术后第 1 天即经空肠造瘘管行肠内营养干预。分别于术前及术后第 1、3、7 天测量血清白蛋白、前白蛋白水平,记录并分析患者并发症发生情况、造瘘管留置时间、正常进食时间,以及下床活动时间和住院天数。结果:60 例行微创下食管癌根治术的患者均无围术期死亡,术后并发症发生率为28.30%,其中吻合口瘘 1 例(1.60%)、造管渗液2例(3.30%)、营养相关并发症14例(23.30%)。患者白蛋白水平在术前及术后均无差异(P>0.05),但术后第1天血清前白蛋白水平显著下降[(206.73±3.861)vs (326.07±3.118)]mg/L,术后第3天已出现增高趋势[(255.68±6.299)vs (206.73±3.861)]mg/L,且较术后第1天差异有统计学意义(P<0.01),术后第7天已恢复至术前状态[(326.08±4.869)vs(326.07±3.118)]mg/L(P>0.05)。患者术后造瘘管平均留置时间为(47.70±15.522)d,平均下床活动时间为(35.78±7.330)h,平均进食时间为(5.52±0.504)d,平均住院天数(9.60±2.196)d。结论:微创胸腹腔镜下行食管癌根治术联合围手术期早期肠内营养可加快患者术后康复,减少并发症发生率,缩短住院时间。
关键词:食管癌;微创手术;肠内营养;加速康复外科
食管癌作为一种世界高发性癌症,在我国肿瘤死因顺位位列第四,仅次于肺癌、肝癌和胃癌,每年死亡人數达到13.68万例[1]。食管癌临床治疗主要采用以手术切除为中心,辅加放疗和化疗的综合手段,可有效提高食管癌的术后生存率[2]食管癌术后为预防吻合口瘘等并发症的发生,常规要求患者禁食1周以上,但食管癌患者术前本就因吞咽困难等原因进食较差,营养状况不良,加之手术创伤和心理应激,术后常处于负氮平衡状态,导致患者免疫力低下,严重影响患者术后康复,针对此现象,临床常辅以肠内营养和肠外营养,以纠正患者的营养不良状态,促进术后康复[3-4]。相比于肠外营养,肠内营养对于患者早期恢复胃肠道功能,刺激小肠正常运动和吸收营养物质至关重要,在临床广泛应用[5]本研究就肠内营养干预术后食管癌患者,探讨术后应用肠内营养对患者快速康复的意义。
1材料与方法
1.1一般资料
收集2019 年 1月— 2020 年 6 月期间在我院行胸腔镜下食管癌手术,且行早期肠内营养支持的60例患者为研究对象。其中男性42例、女性18例,最大年龄75岁、最小45岁。其中病变胃部在食管上段食管者8例、中段45例、下段7例(表1)。所有患者入院即行营养风险筛查(采用NRS 2002量表),对于NRS 2002 评分≥3 分的患者进行术前营养干预。
1.2手术及肠内营养干预方法
所有患者均进行微创胸腹腔镜下行食管癌根治术,术中常规放置空肠造瘘管,术后第 1 天即采用营养泵经空肠造瘘管行肠内营养支持,肠内营养液起始用量为 30mL/h,早期采用TP,根据患者营养状况及病情,用量逐渐增加至 150mL/h,营养液种类过渡到TPF-T。使用肠内营养液期间注意患者胃肠道不良反应、血清营养指标及电解质水平等的变化,及时调整肠内营养液的使用方法、用量及种类。患者排便后行食管碘油造影检查,在无吻合口瘘及胃排空障碍的情况下,逐渐过渡至经口膳食。每日能量摄入量以 25kcal/kg 计算。
1.3观察指标
于术前及术后第 1、3、7 天抽取静脉血做血常规及生化检测,特别关注患者血清白蛋白、前白蛋白水平变化情况。另外,要随时关注患者围手术期并发症的发生情况,包括手术相关并发症及营养相关并发症,如吻合口瘘、造管渗液、腹泻、腹胀等。另外还需记录患者下床活动时间和住院天数以评估患者术后恢复情况。待患者能进食流质饮食,血常规、生化检查、肝肾功能无异常,生活基本自理即可出院。
1.4统计分析
计数资料用频数表示,计量资料用均数±标准差表示,计量资料组间比较采用SPSS软件中的t检验进行统计分析,检验水准为α=0.05。
2结果与分析
2.1食管癌患者术后并发症发生情况
本研究共纳入60例研究对象,并发症发生率为28.30%,其中吻合口瘘1例、造管渗液2例、腹泻9例、腹胀3例,与营养相关并发症发生率为23.30%(14/60)(表2)。所有发生并发症的患者均得到及时处理,得到有效救治。
2.2患者营养状况变化
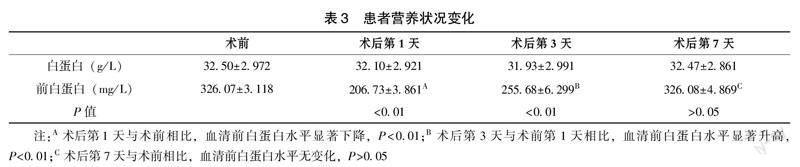
于术前,术后第1、3、7天抽取患者静脉血检测血清白蛋白水平和前白蛋白水平,结果如表3所示,患者白蛋白水平在术前、术后第1天、术后第3天及术后第7天变化无差异,但前白蛋白水平在术后第1天血清前白蛋白水平显著下降[(206.73±3.861)vs (326.07±3.118)] mg/L,术后第3天已出现增高趋势[(255.68±6.299)vs (206.73±3.861)]mg/L,且较术后第1天差异有统计学意义(P<0.01),术后第7天已恢复至术前状态[(326.08±4.869)vs(326.07±3.118)]mg/L(P>0.05)。
2.3患者术后恢复情况
经肠内营养干预和有效护理后,患者造瘘管平均留置时间为(47.70±15.522)d,最长80d、最短15d;患者平均下床活动时间为(35.78±7.330)h;平均进食天数为(5.52±0.504)d;患者最终平均住院天数为(9.60±2.196)d,最长16天、最短7天(表4)。
3讨论
食管癌是我国常见的消化道恶性肿瘤,严重危害公民健康和生活质量,给患者个人、家庭及社会均带来沉重的疾病负担。根据GLOBOCAN 2018报道,我国食管癌发病率和死亡率均占全球50%以上[6]。2015年我国食管癌发病率为17.9/10万,位列恶性肿瘤发病第6位,死亡率为13.68/10万,位列第4位,仅次于肺癌、肝癌和胃癌[1]。食管癌的病因研究及流行病学调查显示,在我国,食管癌主要集中在卫资源欠缺的农村地区,且其发生与烫食、过硬、过快、高盐等不良饮食习惯,摄入高脂、低膳食纤维、少膳食蔬果的膳食摄入,以及吸烟饮酒等不良生活习惯等相关[7-8]。食管癌的治疗,临床以手术切除为主,辅以放疗和化疗的综合治疗方法,研究显示,术后Ⅱ级以上并发症的发生率可高達11.6%,且术后5年总生存率将降至52.9%[7]。虽然综合治疗手段提高了患者长期生存率,但仍有术后并发症的发生,如吻合口瘘、肺部感染、营养不良等,而对于营养不良的患者,其术后康复和生活质量也受到严重影响,临床常加以营养支持。
肠外营养和肠内营养是临床上常用的两种营养支持方式。肠外营养是将人体必需营养素物质(包括葡萄糖、脂肪乳、氨基酸、维生素及微量元素等),经合理配比后经过静脉途径输入体内,此种营养支持方式不需消化道参与即可直接利用营养素,可减轻消化道压力。但是长期肠外营养可引起消化道功能恢复减缓,且会产生如败血症、静脉血栓、电解质紊乱、肝衰竭、增加心肺负担等并发症。关于食管癌的术后营养支持,有研究显示,相比于肠外营养,术后早期给予肠内营养对改善患者营养状况更有效,且可加速患者术后康复[9-10]。对于肠内营养,其优点众多,首先,肠内营养是经胃肠道途径提供营养物质,可维持胃肠道的正常功能和代谢;其次,在降低肠源性感染的基础上,可促进肠道功能恢复,保护肠黏膜屏障;另外,在不影响机体原先代谢的情况下,可更高效地促进蛋白质合成,以满足患者术后高代谢状态,促进术后恢复;并且减少了大量快速静脉营养而可能导致的心肾功能不全等循环衰竭问题。即对于手术患者,即使是在发生严重并发症的情况下,也能够安全有效地给患者提供足够的营养物质,节省医疗费用,因此在临床上应用广泛。肠内营养方式主要有经口途径和外科干预的经管途径,虽然术后早期即给予经口饮食是安全的,但研究发现,对于行食管癌根治术的患者,将经口进食时间推迟至4周以上可减少术后吻合口瘘等并发症的发生,且可缩短术后住院时间[11-12]。空肠造瘘途径是一种常用的肠内营养经管途径,本研究采用此种方式给予肠内营养支持,虽然有手术相关及营养相关并发症的发生,但患者血清前白蛋白水平在术后第3天即开始呈现上升趋势,且术后第7天即恢复至术前水平,但血清白蛋白由于其半衰期长,在围手术期的短时间内无明显变化,但整体而言,患者营养状况得到有效改善。在本研究中,术后即放置空肠造瘘管给予肠内营养液,根据患者恢复情况,在术后第3~4天肠内营养液使用量即可达到生理需要量,这对于本身有循环系统疾病及高龄患者来说,一方面减少了营养不良的发生率,另一方面也降低了肠外营养的静脉补液量,从而减轻心肺负担,降低心肺并发症的发生,促进患者术后恢复。同时,采用肠内营养有助于患者胃肠功能的恢复,患者在恢复排气排便后,平均(5.52±0.504)d即恢复经口进食,且下床时间也大大缩短,平均(35.78±7.330)h,减少了因长期卧床造成血栓等并发症的发生。
肠内营养制剂按氮源分为氨基酸型、短肽型及整蛋白型三种,本研究使用的TP和TPF-T肠内营养液为整蛋白型肠内营养乳液,具有渗透压接近等渗、口感较好、分散均匀,性状稳定等优点,适宜用于管饲及口服[13]其中TPF-T是在平衡型的基础上特别添加了ω-3多不饱和脂肪酸,适用于肿瘤患者。ω-3 多不饱和脂肪酸是一种通过改变细胞膜磷脂构成和增加膜流动性,对细胞膜上受体的空间构象和离子通道产生影响,进而可影响细胞信号传导,调控基因、信号分子和转录因子的表达,从而起到抗炎及改善机体免疫功能的作用,降低机体感染及急性炎症的发生,减少术后并症的发生,增强患者免疫功能,加快患者术后恢复[14-15]。
本研究纳入的患者均行消化道重建,故吻合口瘘并发症发生率偏高(13.30%),但经术后全程肠内营养干预后,患者恢复良好,未出现营养不良现象。另外,肠内营养的使用使患者血清前白蛋白水平在术后第3天即开始呈现上升趋势,且术后第7天即恢复至术前水平,患者营养状况得到有效改善,下床活动时间和出院时间都得到大大缩短,而空肠造瘘管的使用也并未引发并发症的发生。因此认为,对于行经胸腔镜下食管癌根治术的患者,术后采用空肠造瘘管进行早期肠内营养支持,可降低患者术后并发症发生率、加速患者术后早期康复,值得在临床中推广应用。参考文献
[1]郑荣寿,孙可欣,张思维,等. 2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志, 2019, (1): 19-28.
[2]宋勇,张路,刘新星.食管癌患者手术治疗后短期复发影响因素的研究[J].中国肿瘤临床与康复, 2020, 27(10): 1210-1213.
[3]康莉,李晶,王芳.鼻空肠管营养支持在食管癌术后护理中的应用研究[J].实用临床医药杂志, 2017, 21(14): 94-96.
[4]李小丽.空肠造瘘管与鼻肠管行早期肠内营养支持对食管癌术后导管相关并发症及康复的影响[J].智慧健康, 2019, 5(19): 84-85.
[5]朱捷,杨鲸蓉,叶仕新,等.食管癌患者围术期营养研究进展[J].医学综述,2017,23(7): 1310-1315.
[6]Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA, 2018, 68(6): 394-424.
[7]毛友生,高樹庚,王群,等.中国食管癌临床流行特征及外科治疗概况大数据分析 [J]. 中华肿瘤杂志, 2020(3): 228-233.
[8]郑黎阳,陈琼,刘曙正,等. 2015年河南省食管癌发病与死亡估计 [J]. 肿瘤预防与治疗, 2019, 32(11): 978-983.
[9]Rajabi Mashhadi M T, Bagheri R, Ghayour-Mobarhan M, et al. Early Post Operative Enteral Versus Parenteral Feeding after Esophageal Cancer Surgery [J]. Iranian Journal of Otorhinolaryngology, 2015, 27(82): 331-336.
[10]Varadhan KK, Neal KR, Dejong CH, et al. The enhanced recovery after surgery (ERAS) pathway for patients undergoing major elective open colorectal surgery: a meta-analysis of randomized controlled trials [J]. Clinical Nutrition, 2010, 29(4): 434-440.
[11]Lassen K, Kjaeve J, Fetveit T, et al. Allowing normal food at will after major upper gastrointestinal surgery does not increase morbidity: a randomized multicenter trial [J]. Annals of Surgery, 2008, 247(5): 721-729.
[12]Han-Geurts I J, Verhoef C, Tilanus H W. Relaparotomy following complications of feeding jejunostomy in esophageal surgery [J].Digestive Surgery, 2004, 21(3): 192-196.
[13]吕俊玲, 夏路风, 胡咏川, 等. 肠内营养制剂基本特点及治疗中的药学监护[J].临床药物治疗杂志, 2020, 18(10): 76-79.
[14]CHEN W, JIANG H, ZHOU ZY, et al. Is omega-3 fatty acids enriched nutrition support safe for critical ill patients? A systematic review and meta-analysis[J].Nutrients,2014,6(6): 2148-2164.
[15]Pradelli L, Mayer K, Muscaritoli M, et al. n-3 fatty acid-enriched parenteral nutrition regimens in elective surgical and ICU patients: a meta-analysis [J]. Critical Care, 2012, 16(5): R184.
Application Effect of Enteral Nutrition in Rapid Recovery of
Patients Undergoing Radical Esophageal Cancer SurgeryXU Jing-gen ZHANG Jing YUAN Min
(1Department of Oncology, The First People's Hospital of Shuangliu District, Chengdu (West China Airport Hospital of Sichuan University,
Chengdu 610200, China;2 Department of Hematology and Gastroenterology, The First People's Hospital of Shuangliu District, Chengdu
(West China Airport Hospital of Sichuan University), Chengdu 610200, China;3 Department of Nutrition, The First People's Hospital of
Shuangliu District, Chengdu (West China Airport Hospital of Sichuan University), Chengdu 610200, China)Abstract Objective To summarizing the significance of applying enteral nutrition to patients with esophageal cancer in our hospital for rapid postoperative recovery. MethodTotally 60 patients who underwent surgical treatment for esophageal cancer in our hospital from January 2019 to June 2020 were retrospectively collected for the study. All patients underwent minimally invasive thoraco-laparoscopic radical esophageal cancer surgery, and enteral nutrition intervention was administered via a jejunostomy tube on the first postoperative day. Serum albumin and prealbumin levels were measured before surgery and on the first, third and seventh postoperative days, respectively, and the patients' complications, duration of fistula placement, time of normal feeding, time of bed activity and days of hospitalization were recorded and analyzed. Result There were no perioperative deaths in 60 patients who underwent minimally invasive radical esophagectomy for esophageal cancer. The incidence of postoperative complications was 28.30%, including 1 anastomotic fistula (1.60%), 2 cases of stoma leakage (3.30%), and 14 cases of nutrition-related complications (23.30%).There was no difference in the patient's albumin level before and after surgery (P>0.05), but the prealbumin level fluctuated significantly, and the serum prealbumin level decreased significantly on the 1st day after surgery[(206.73±3.861)vs (326.07±3.118)]mg /L, there has been an increasing trend [(255.68±6.299)vs (206.73±3.861)]mg/L on the 3rd day after surgery, and it has recovered to the preoperative state on the 7th day after surgery[(326.08±4.869)vs(326.07±3.118)] mg/L, P>0.05. The average postoperative ostomy tube indwelling time was (47.70±15.522) days, the average recovery time for oral feeding was (5.52±0.504) days postoperatively, the average time to get out of bed was 35.78±7.330h, and the average postoperative hospital stay was (9.60±2.196) days.ConclusionMinimally invasive thoraco-laparoscopic radical esophageal cancer surgery combined with early perioperative enteral nutrition can accelerate patients' postoperative recovery, reduce complication rate and shorten hospitalization time.
Keywords: esophageal cancer; minimally invasive surgery; enteral nutrition; accelerated rehabilitation surgery
