人结节型皮肤基底细胞癌病变组织和细胞株中视蛋白3的表达及功能*
2023-07-13许佳韩宁章俊兰应华辜阳广罗欢欢杨玉麟汪宇陆洪光
许佳, 韩宁, 章俊, 兰应华, 辜阳广, 罗欢欢, 杨玉麟, 汪宇, 陆洪光***
(1.贵州医科大学 临床医学院 皮肤病与性病学教研室, 贵州 贵阳 550025; 2.贵州医科大学附属医院 皮肤科, 贵州 贵阳 550004)
1 材料与方法
1.1 实验材料
1.1.1细胞和组织 TE354T细胞系从ATCC细胞库(货号CRL-7762)购买;选取本院31例结节型基底细胞癌患者的癌组织及距病灶>2 cm的癌旁正常组织(paired adjacent normal skin tissues,PANST)标本分别为病灶组与PANST组,储存于-80 ℃冰箱,研究已获医院临床研究伦理委员会批准(2021-150)及患者知情同意。
1.1.2主要试剂与仪器 胎牛血清(fetal Bovine Serum,FBS;美国 ScienCell ),4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、抗荧光淬灭封片剂(上海碧云天),DMEM高糖培养基(DMEM high glucose,DMEM)、OPTI-MEM 减血清培养基(OPTI-MEM Reduced Serum Medium,OPTI-MEM;美国Gibco),引物(上海生工),0.1%结晶紫染色液、实时荧光定量 PCR (real-time quantitative polymerase chain reaction,RT-qPCR)试剂盒、高效放射免疫沉淀法(radio immunoprecipitation assay,RIPA)组织/细胞裂解液(北京 Solarbio),Lipofectamine 2000(美国赛默飞),兔抗人OPN1抗体、兔抗人OPN2抗体、兔抗人OPN3抗体、兔抗人OPN4抗体、兔抗人OPN5抗体、环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)单克隆抗体、磷酸化CREB(p-CREB)单克隆抗体、钙调蛋白依赖激酶Ⅱ(Ca2+/calmodulin-dependent protein kinaseⅡ ,CAMKⅡ)单克隆抗体、磷酸化CAMKⅡ(p-CAMKⅡ)单克隆抗体、羊抗兔二抗、羊抗鼠二抗(中国MDL公司),Cell Counting Kit-8(CCK-8)检测试剂盒(日本Dojindo),Transwell小室(美国Corning),Annexin V-FITC/ PI双染法细胞凋亡检测试剂盒(上海七海复泰);4%多聚甲醛(国药集团化学试剂),流式细胞仪BD FACSLyricTM(美国BD FACSLyricTM),酶标仪和曝光仪ChemiDoc MP 成像系统(美国Bio-Tek),蛋白垂直电泳仪(美国BIO-RAD),RT-qPCR扩增仪(美国Life Technologies)。
1.2 实验方法
1.2.1标本处理 将PANST组与病灶组患者标本分别置于研钵,加液氮,反复多次用研磨器将其研磨呈粉状,收集于EP管中。
1.2.2组织免疫荧光 取“1.2.1”项下2组标本固定于4%甲醛,石蜡包埋,石蜡切片脱蜡至水,置于EDTA抗原修复液中微波修复抗原,血清封闭,加一抗(OPN3抗体)50 μL,覆盖切片上的组织,4 ℃过夜,加相应种属荧光二抗(山羊抗兔IgG H&L)50~100 μL于37 ℃孵育50 min,加DAPI染液室温避光染色5 min,加抗荧光淬灭剂,盖玻片封片,荧光显微镜下观察,蓝色为DAPI,绿色为OPN3。
1.2.3细胞培养 取人BCC细胞系TE354T于含10%FBS和1%双抗的DMEM培养液,37 ℃的5%CO2培养箱培养;隔天换液,培养细胞数量增殖到培养瓶底部面积的70%,含0.01% EDTA-0.25%胰蛋白酶的胰酶消化液消化细胞,待细胞从壁上脱离,终止消化。
1.2.4RT-qPCR实验 采用TRIzol试剂提取“1.2.1”项下2组标本和“1.2.3”项下TE354T细胞中的总RNA,再逆转录为互补DNA(complementary DNA,cDNA)。设置熔解曲线反应程序,采用熔解曲线分析引物特异性及与该反应体系的适宜条件,内参为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),根据课题组前期研究设计OPNs引物序列[19],OPNs的表达水平按2-ΔΔCt值取对数值后进行分析;反应条件为95 ℃孵育10 min(变性),95 ℃孵育15 s(退火)、60 ℃孵育10 min(延伸)、退火与延伸重复40个循环。
1.2.5蛋白印迹法(Western blot)实验 取“1.2.1”项下2组标本和“1.2.3”项下TE354T细胞置于冰上,组织细胞裂解液(radio immunoprecipitation assay,RIPA):苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)按99∶1的配比比例配置适量1 mmol/L RIPA裂解液进行蛋白裂解,利用聚丙烯酰氨凝胶电泳(dodecyl sulfate,sodium salt-Polyacrylamide gel electrophoresis,SDS-PAGE)将目标蛋白分离,再转移至聚二偏氟乙烯(polyvinylidene fluoride,PVDF)膜上,封闭液封闭2 h,兔抗人的一抗工作液4 ℃孵育过夜,鼠抗兔的二抗工作液室温孵育45 min;化学发光试剂(electrochemiluminescence,ECL)下进行拍照、曝光。采用Image J测量条带灰度值。
1.2.6靶向沉默细胞中的OPN3 待“1.2.3”项下细胞生长至培养板板底面积40%融合时备用。将细胞密度调至1×107个/L,分为对照(Control)组、空白(RNAi-NC)组及实验(RNAi-OPN3)组,于6孔板中分别加Opti-MEM及DMEM培养基,采用Lipofectamine 2000使小干扰RNA转染细胞,其中实验组小干扰RNA浓度为60 nmol/L,继续培养48 h,消化处理细胞。
上海发那科机器人有限公司是上海电气(集团)总公司所属上海电气实业公司与日本FANUC株式会社联合组建的高科技合资企业。公司成立于1997年,主要从事机器人、智能机器以及包含机器人的自动化成套生产系统的销售、安装和保养,为客户提供各种以日本FANUC先进技术为基础的生产自动化系统的设计、生产、销售、技术培训及高品质的应用和维修等全方位一条龙服务。
1.2.7CCK-8实验 取“1.2.3”项下细胞以2×104个/孔的密度均匀地接种于96 孔培养板中,待细胞贴壁后,用siRNA-Lipofectamine 2000工作液转染细胞,分别在0、24、48及72 h加CCK-8 试剂10 μL,放回细胞培养箱培养2 h,450 nm处检测吸光度值;每组设置5个复孔,以保证实验精确性。
1.2.8Transwell迁移实验 取“1.2.6”项下细胞用无血清DMEM培养基1 mL重悬,使细胞浓度为2×108个/L,在24孔板内每孔加入400 μL含10% FBS 的DMEM培养基,将Transwell小室放入孔板内,消化处理细胞,无血清DMEM培养基1 mL重悬,使细胞浓度为2×108个/L,每个小室内加入200 μL细胞悬液,培养6 h以上,取出小室,棉签擦拭上室细胞,4%多聚甲醛固定,0.1%结晶紫染色,拍照。
1.2.9细胞划痕实验 取“1.2.6”项下细胞以2×104/孔的密度均匀地接种在96 孔板上,加DMEM 培养基培养,待细胞长满整个孔板时,10 μL枪头垂直孔板划线,吸弃培养基,磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗划下的细胞,放培养箱中培养;显微镜下拍照,分别检测于划痕后 0 、48及 72 h 观察细胞的划痕宽度。每组设置5个复孔以上。
1.2.10流式双染法细胞凋亡检测Annexin V FITC/PI 用流式离心管收集“1.2.6”项下转染48 h细胞的上清液,利用0.25%的胰酶消化细胞,收集消化好的细胞加入上清液离心,PBS1 mL重悬细胞,再用1×Binding Buffer 400 μL重悬细胞,再加入 Annexim V-FITC 5 μL并用移液器吹匀,在室温下避光孵育15 min,加PI染色液10 μL混匀,冰浴避光放置5 min,30 min内用流式细胞仪检测。Annexin V-FITC 显示的是绿色荧光,代表凋亡的细胞。
1.3 统计学分析

2 结果
2.1 组织中OPN3的表达
免疫荧光检测结果显示,OPN3在PANST组与病灶组中均有表达;Western blot和RT-qPCR结果显示,与PANST组比较,病灶组BBC患者病灶组织中OPN3蛋白和mRNA表达增高(P<0.05)。见图1。
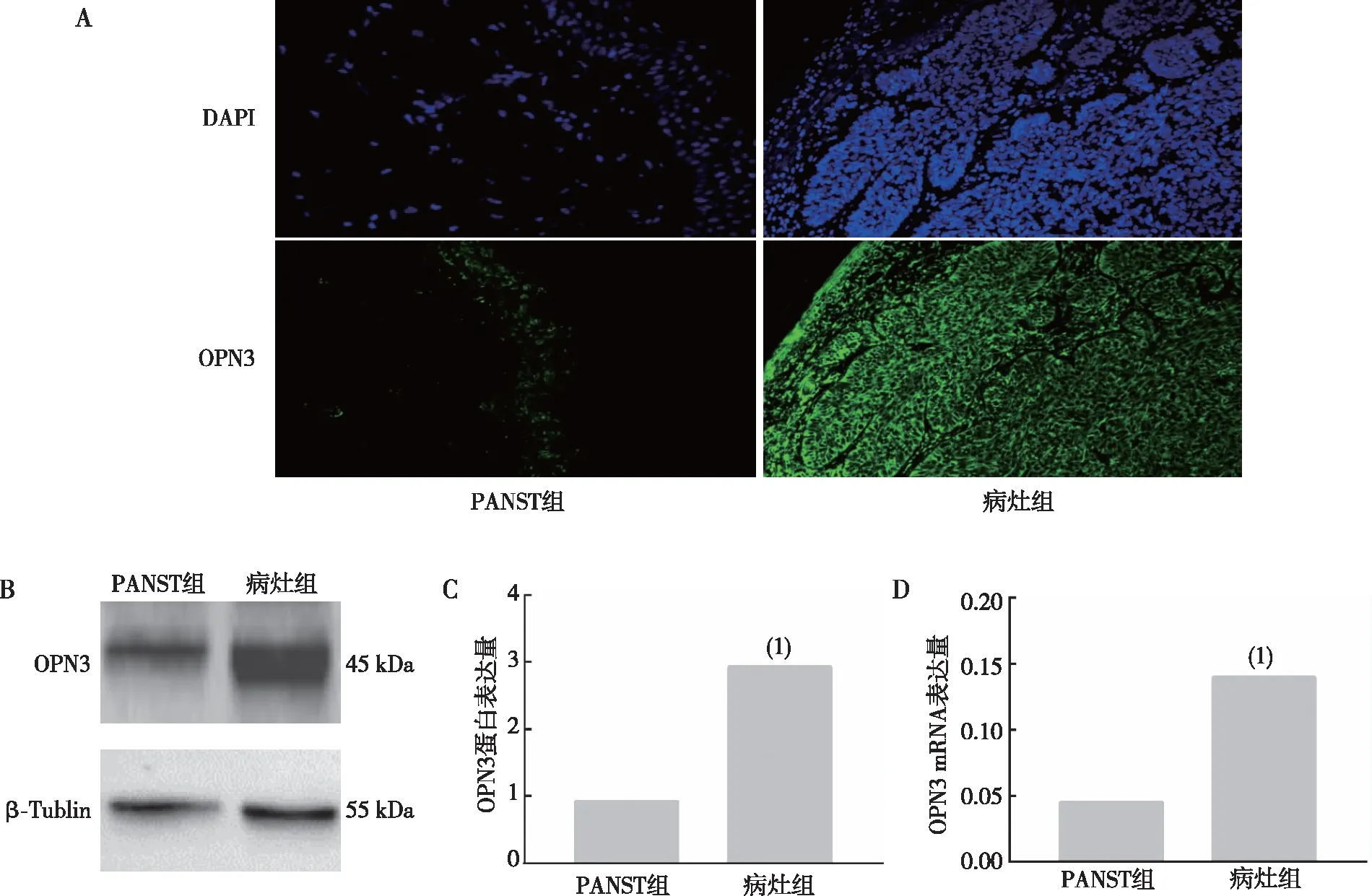
注:A为免疫荧光检测结果(400×),绿色为OPN3,蓝色为DAPI;B、C分别为OPN3蛋白的检测结果和定量结果;D为OPN3 mRNA表达量,(1)与PANST组比较,P<0.05。图1 病灶组和PANST组组织中OPN3的表达Fig.1 Expression of OPN3 in human nodular BCC lesion group and PANST group
2.2 细胞中OPN3的表达
采用Western blot与RT-qPCR分别检测人TE354T细胞系中OPN的蛋白与mRNA水平,结果表明,与OPN1、OPN2、OPN4及OPN5比较,TE354T细胞系中OPN3的蛋白和mRNA水平最高(P<0.05)。见图2。
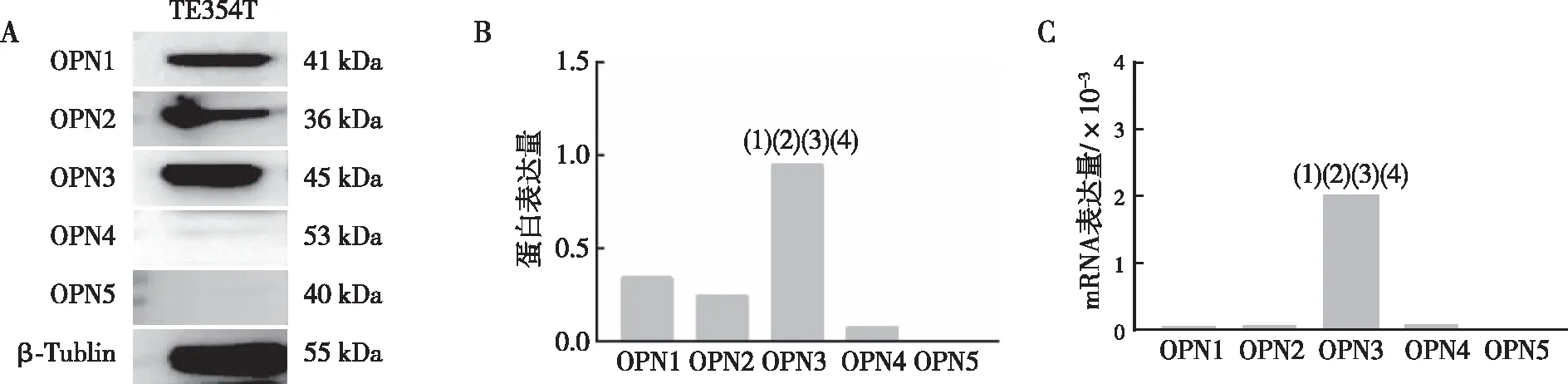
注:A、B分别为OPN蛋白的检测结果和相对定量结果,C 为OPN mRNA相对表达量;(1)与OPN1比较,P<0.05;(2)与OPN2比较,P<0.05;(3)与OPN4比较,P<0.05;(4)与OPN5比较,P<0.05。图2 人BCC细胞株TE354T中 OPN蛋白和mRNA的表达Fig.2 Expression of OPN protein and mRNA in human BCC cell line TE354T
2.3 下调OPN3后细胞中OPN3的表达
小干扰RNA沉默人TE354T细胞系中的OPN3后,Western blot和RT-qPCR实验结果显示,与Control组、RNAi-NC组比较,RNAi-OPN3组TE354T细胞中OPN3的蛋白和mRNA表达下降(P<0.05)。见图3。
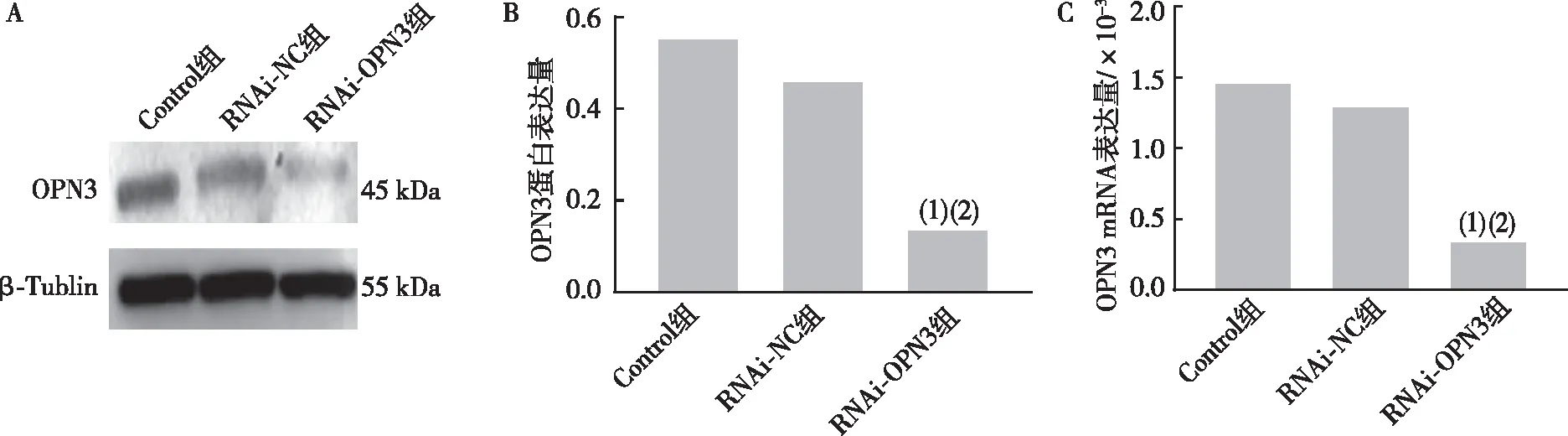
注:A、B分别为OPN3蛋白的表达和定量结果,C为OPN3 mRNA表达量;(1)与Control组比较,P<0.05,(2)与RNAi-NC组相比,P<0.05。图3 下调OPN3后各组人BCC细胞株TE354T中 OPN3蛋白和mRNA的表达Fig.3 Expression of OPN3 protein and mRNA in human BCC cell line TE354T in each group after down-regulation of OPN3
2.4 细胞增殖活力
CCK-8实验结果表明,与RNAi-NC组比较,下调OPN3后72 h时TE354T细胞RNAi-OPN3组增殖水平出现下降(P<0.05)。见图4。
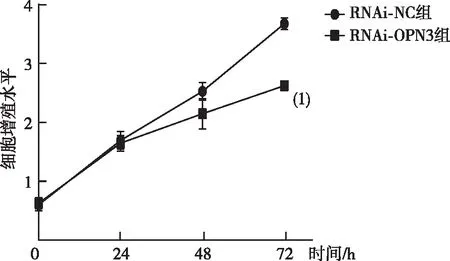
注:(1)与RNAi-NC组72 h比较,P<0.05。图4 下调OPN3后各组人BCC细胞株TE354T细胞增殖水平的变化Fig.4 Changes in the proliferation of human BCC cell line TE354T cells in each group after down-regulation of OPN3
2.5 细胞迁移能力
细胞划痕实验结果显示,与RNAi-NC组相比,下调OPN3 48 h后RNAi-OPN3组TE354T细胞迁移能力下降(P<0.05);Transwell迁移实验结果显示,与RNAi-NC组相比,干预后48 h时RNAi-OPN3组TE354T细胞迁移数量减少(P<0.05)。见图5。
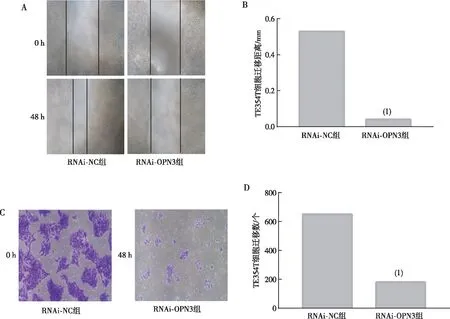
注:A、B分别为细胞划痕实验检测结果及定量结果,C、D分别为Transwell迁移实验检测结果和定量结果;(1)与RNAi-NC组比较,P<0.05。图5 下调OPN3后各组人BCC细胞株TE354T的细胞迁移和划痕实验(结晶紫染色, ×100)Fig.5 Cell migration and scratching experiments of human BCC cell line TE354T in each group after down-regulating OPN3 (crystal violet staining,×100)
2.6 细胞的凋亡
下调OPN3后流式细胞仪检测细胞凋亡情况,结果显示,与RNAi-NC组比较,下调OPN3后RNAi-OPN3组中凋亡细胞数量增加(P<0.05)。见图6。

注:A、B分别为流式细胞术的检测结果和定量结果;(1)与RNAi-NC组比较,P<0.05。图6 下调OPN3后各组人BCC细胞株TE354T的细胞凋亡Fig.6 Apoptosis of human BCC cell line TE354T in each group after down-regulation of OPN3
2.7 钙依赖GPCR信号通路相关蛋白的变化
通过Western blot实验检测钙通路的相关蛋白CREB、p-CREB、CAMKⅡ及p-CAMKⅡ的表达,结果表明,下调OPN3后,与RNAi-NC组相比,RNAi-OPN3组人BCC细胞株TE354T中p-CREB和 p-CAMKⅡ蛋白表达下降(P<0.05)。见图7。
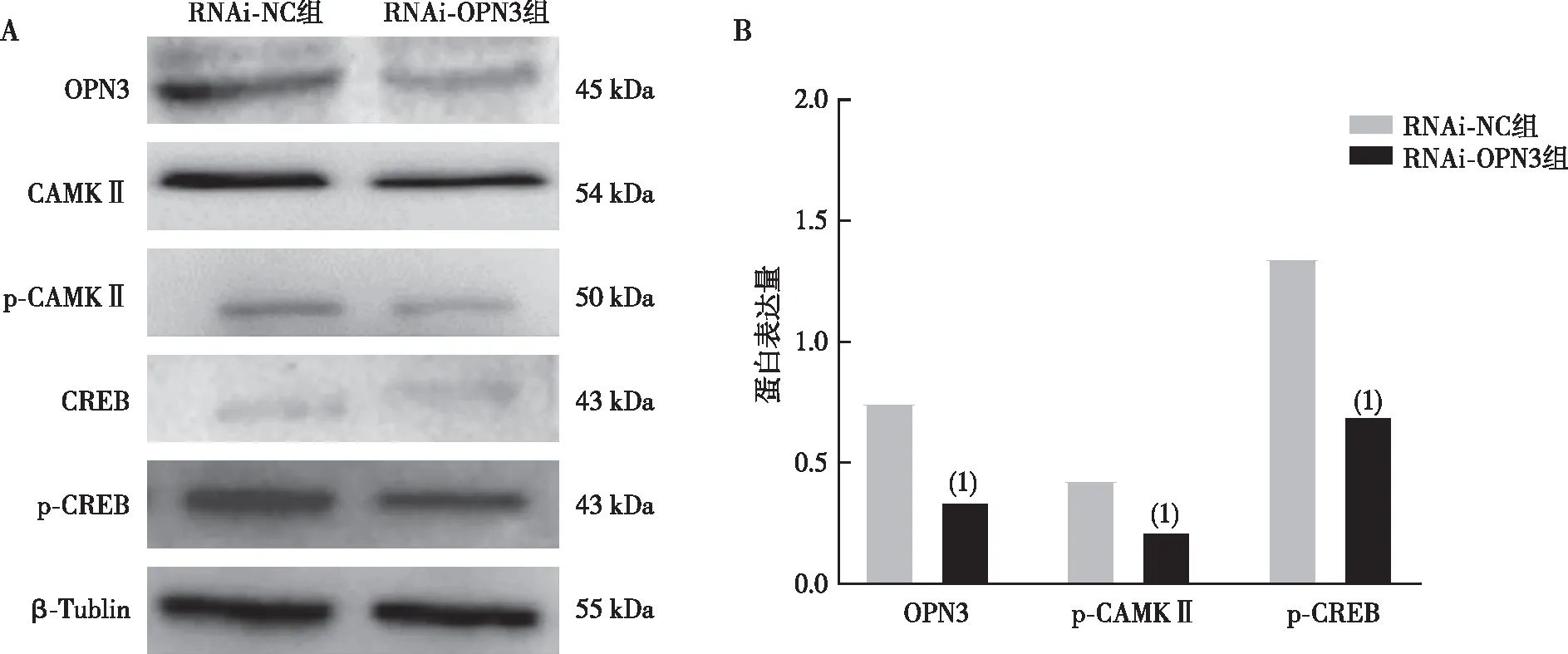
注:A、B分别为钙通路相关蛋白的检测结果和定量结果;(1)与RNAi-NC组比较,P<0.05。图7 下调OPN3后各组TE354T细胞株中钙通路相关蛋白的表达Fig.7 Expression of calcium pathway-related proteins in human BCC cell line TE354T after down-regulation of OPN3
3 讨论
OPNs包括OPN1、OPN2、OPN3、OPN4及OPN5, 是一类光感受器,属于GPCR超家族,广泛参与细胞的增殖、分化、迁移[20]。既往研究中GPCR被证实在多种癌症中起到调控作用,Du等[21]研究表明GPCR30在介导雌激素和他莫昔芬诱导的子宫内膜癌细胞的增殖和侵袭中起到了一定作用;张瑞华等[22]研究认为GPCR48基因表达对皮肤鳞状细胞癌 (squamous cell carcinoma,SCC) 蛋白激酶C(protein kinase C,PKC)信号通路及细胞侵袭能力具有一定的影响。
OPN3作为GPCR家族中的一员,在肝癌、肺癌及结肠癌等多种癌症中发挥重要作用。有研究认为,OPN3能通过调节细胞凋亡通路,从而使肝癌细胞对5-氟尿嘧啶治疗敏感,主要机制是过表达OPN3后使磷酸化蛋白激酶B(protein kinases B,Akt)和B细胞淋巴瘤-2蛋白/Bcl-2相关X蛋白(B cell lymphoma-2 protein/Bcl-2-associated X protein,Bcl-2/bax)比值抗凋亡途径失活[23];Xu等[10]研究显示,OPN3可以促进肺腺癌(lung adenocarcinoma, LUAD)中的上皮间充质转化(epithelial-mesenchymal transition,EMT)和肿瘤转移;已有研究提示,OPN3作为光受体,可能是临床上结肠癌的一个重要治疗靶点,它首先证实了OPN3在结节型BCC病灶组的表达高于PANST组,为进一步探索OPN3表达变化对BCC的影响,接下来利用小干扰RNA靶向沉默人BCC细胞中的OPN3,细胞增殖活性、迁移能力、凋亡细胞数量都发生了明显变化[24]。这些结果均表明OPN3可能在BCC的发生中起到了推动作用。
关于OPN3调控细胞的增殖、迁移及凋亡能力的机制,已有研究显示,BCC的发生与遗传存在一定相关性,其中MC1R基因多态性与基底细胞癌的风险之间存在一定遗传联系,且往往与皮肤颜色较深的人群相关性更大[24]。MC1R基因编码的MCR1蛋白是一种参与黑色素生成的G蛋白耦合受体,MC1R基因变异可见于非黑色素瘤皮肤癌(non-melanoma skin cancer,NMSC)、日光性角化病及明显的弹力纤维增生症患者[25]。此外,BCC发生的高风险还与涉及刺鼠信号蛋白基因(agouti-signaling protein gene,ASIP)和酪氨酸酶相关(tyrosinase-related,TYR)基因的单核苷酸多态性有关,这些基因都与黑色素激素调节有关[26-27]。既往研究显示,OPN3在调节MC1R的信号转导时可作为黑色素生成的负调节因子[17]。另外有研究表明,GPCR可在黑素细胞内储存中驱动钙动员并参与下游信号级联反应,且CAMKⅡ是钙通道中的关键酶,CAMKⅡ的激活会导致CREB的磷酸化,p-CREB在介导环磷酸腺苷(cyclic adenosine monophosphate,cAMP)下游的CREB活化中发挥了一定作用,并且CREB是CAMKⅡ的主要下游靶标[18, 28]。还有研究显示,紫外线诱导的活性氧(reactive oxygen species,ROS)主要通过丝裂原活化蛋白激酶/激活蛋白-1(mitogen-activated protein kinase/ activator protein-1,MAPK/AP-1)信号通路上调基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达[25]。本课题组前期结果也表明,钙依赖性GPCR信号通路暴露于紫外线A(ultraviolet A,UVA)后,OPN3是负责上调正常人真皮成纤维细胞(normal human dermal fibroblasts,NHDF)MMP1、MMP2、MMP3及MMP9的关键传感器[19]。因此可以推测,OPN3是否也是通过钙通道进而调控基底细胞癌细胞的增殖、迁移及凋亡能力。因此,本研究采用Western blot检测了钙通道相关蛋白CREB、p-CREB、CAMKⅡ及pCAMKⅡ,结果表明,下调OPN3后p-CREB和p-CAMKⅡ表达下降。这表明OPN3可能正是通过钙依赖信号转导通路影响了下游CREB和CAMKⅡ的磷酸化,从而影响细胞的迁移、增殖以及凋亡。
综上,本研究主要探讨了OPN3在BCC中的表达及其功能,结果表明OPN3在人结节型BCC病灶中高表达,可能通过钙依赖GPCR信号通路实现调控人BCC细胞的增殖、迁移及凋亡。但因本研究组织样本量较小,可能致使研究有一定的偏倚。此外,OPN3究竟是如何通过钙通道参与调控BCC细胞增殖、迁移及凋亡的具体机制目前尚不清楚,有待进一步的研究。
