显微介导中国对虾基因鲤肌肉蛋白差异表达分析
2023-07-12闫学春张颖栾培贤
闫学春,张颖,栾培贤
(中国水产科学研究院黑龙江水产研究所,淡水鱼类育种国家地方联合工程实验室,农业农村部淡水水产生物技术与遗传育种重点实验室,黑龙江 哈尔滨 150070)
同位素标记的相对和绝对定量(isobaric tags for relative and absolute quantitation)技术(简称iTRAQ)是美国应用生物系统公司(2004 年)推出的一项技术。该技术的优点在于一次实验中同时可进行多个样品的蛋白质组定量比较分析。由于对蛋白样品的任何肽段都可以进行标记,可大幅度提高鉴定蛋白的覆盖度和可信度[1-6]。目前,iTRAQ 技术已广泛应用于蛋白组学的定量研究[7-12]。而随着鲤基因组计划的完成,越来越多的鲤新基因已成功克隆,对于所获得的大量未知基因的功能研究显得日益重要。如今,生命科学已进入了后基因组时代,系统生物学迅速发展,而蛋白组学是系统生物学的重要技术平台,是从整体水平上认识蛋白质的存在及活动方式,而转基因技术则是进行蛋白功能分析和基因表达调控的有力手段[13-15]。本研究依靠显微介导远缘杂交技术,将未经遗传修饰的中国对虾总DNA 导入鲤(Cyprinus carpio)受精卵内,以期通过这种基因组水平的远缘杂交技术来改善鲤肌肉的品质[16-18]。在测序前对显微介导的中国对虾基因鲤进行AFLP检测、产物凝胶测序和双向蛋白电泳分析,通过确定供体基因片段以及肌肉营养成分分析,最终筛选出高氨基酸含量的个体,再通过iTRAQ 技术对这些氨基酸含量高的个体进行蛋白相对定量分析,找到了与氨基酸、脂肪酸密切相关的差异蛋白质,并对这些差异表达蛋白进行GO 功能注释和KEGG 代谢通路分析[17]。这些研究结果,可为培育显微介导中国对虾基因鲤的新品种提供科学依据。
鲤是我国及其他国家重要的淡水养殖的经济鱼类。它具有生长速度快、抗寒能力强等优点,但其肉质欠佳[19,20],而测定鱼类肌肉营养成分是了解鱼类肉质的最直接方法。目前对显微介导中国对虾基因鲤肌肉品质的研究多集中在肉质指标的常规研究上,而从转录和蛋白水平对显微介导中国对虾基因鲤肌肉品质的相关基因的研究还不够深入。因此,有必要对显微介导中国对虾基因鲤进行深度测序和蛋白质功能实验研究,利用现有的转含鲜味氨基酸基因大片段DNA 基因鲤为基础,利用蛋白质谱定量技术,筛选显微介导中国对虾基因鲤与正常鲤之间的差异蛋白,找出这些差异蛋白与哪些生物学功能相关,为培育出肉质好的鲤新品种提供技术参考。
1 材料与方法
1.1 材料
实验用鱼为本课题组生产的1 龄显微介导中国明对虾基因鲤(黑龙江水产研究所生物技术室)和1 龄普通鲤(黑龙江水产研究所呼兰试验站)。测序前先通过普通SDS-PAGE 电泳检测,确定了实验鱼与对照鱼有不同的带型,说明供体基因进入到受体基因组的蛋白表达系统中后,再对这尾实验鱼进行定量蛋白质测序分析。测序样品为实验鱼和对照鱼各取1 尾,体质量分别为228 g 和219 g。由华大基因公司完成测序。
1.2 方法
1.2.1 蛋白质提取
提取蛋白中所用的试剂为:1 mmol/L PMSF、10 mmol/LDTT、丙酮、2 mmol/LEDTA、0.5 mol/L TEAB。将适量的鱼肌肉加入蛋白裂解液溶解,然后依次加入上述各个试剂,通过超声、离心,然后取上清液用于定量分析。详细的蛋白提取方法参照文献[3]。
1.2.2 蛋白质SDS 电泳及酶解
根据华大基因iTRAQ 定量分析报告中提供的方法。SDS 电泳:首先配置12%的SDS 聚丙烯酰胺凝胶,反应条件为95℃5 min,在120 V 恒压下电泳120 min,电泳前,点样量为每个实验鱼和对照鱼的蛋白样品各取30 μg,Marker 的点样量为10 μg,电泳结束后,进行染色和脱色。酶解:各取100 μg 实验鱼和对照鱼的蛋白于试管中,分别加入酶和Trypsin(按蛋白和酶20∶1 的比例),在37℃下酶解4 h(第二次酶解8 h)。
1.2.3 iTRAQ 标记
根据华大基因iTRAQ 定量分析报告中提供的方法。将经胰蛋白酶消化后的实验鱼和对照鱼蛋白质样品用真空离心泵抽干肽段,再复溶肽段(0.5 mol/L TEAB),按照手册进行iTRAQ 标记。
1.2.4 SCX 分离
根据华大基因iTRAQ 定量分析报告中提供的方法。反应试剂为buffer A(25 mmol/L NaH2PO4in 25%A CN,pH2.7)、buffer B(25 mmol/L NaH2PO4,1 mol/L KCl in 25%ACN,pH2.7);仪 器 采 用 岛 津LC-20AB 液相系统;UltremexSCX 柱型号为4.6×250 mm(分离柱)。反应过程为:将经iTRAQ 标记后抽干的各组肽段混合,用buffer A 复溶,再用buffer B(5%、60%、100%)洗脱(214 nm 吸光度检测),除盐(StrataX 除盐柱),最后冷冻抽干。
1.2.5 生物信息学分析
在生物信息分析中,质谱原始文件需要转换成mgf 格式(sample.mgf)后才能被使用,mgf 文件主要包含了二级质谱(MS/MS)谱图的信息。本研究中使用Mascot2.3.02 蛋白鉴定软件。操作时以mgf 文件为原始文件,选择已建立好的鲤全基因组数据库,然后用Mascot 进行数据库搜索和鉴定,对鉴定出的蛋白质用GO 数据库进行功能注释分析和分类,再用COG 和KEGG 数据库对这些蛋白的功能做进一步的分析。
1.2.6 实时荧光定量PCR 检测差异蛋白基因
将在-80℃冰箱保存的对照鱼和显微介导中国对虾基因鲤肌肉组织的总RNA 取出,按照反转录试剂盒说明书进行反转录获得cDNA,选取4 个差异表达蛋白(2 个上调,2 个下调),设计引物,以cDNA 为模板,β-肌动蛋白(beta-actin)作为内参基因,扩增条件为95℃预变性5 min;95℃10 s,60℃15 s,72℃20 s,共40 个循环。在AB7500 定量PCR 仪上进行PCR 反应,按照TB GreenTM premix EX TagTMⅡ(Tli RnaseH Plus)(TaKaRa)荧光定量PCR 试剂盒的操作说明书进行,每个试验样品重复3 次,取平均值来比较不同样品基因表达水平。
2 结果与分析
2.1 显微介导中国对虾基因鲤的蛋白质鉴定
分别对显微介导中国对虾基因鲤和对照鱼进行总蛋白提取和iTRAQ 定量分析(图1),横坐标为鉴定类别,纵坐标为数量。结果表明,共鉴定得到999 个蛋白,3 760 个肽段,其中含3 280 个Unique肽段。
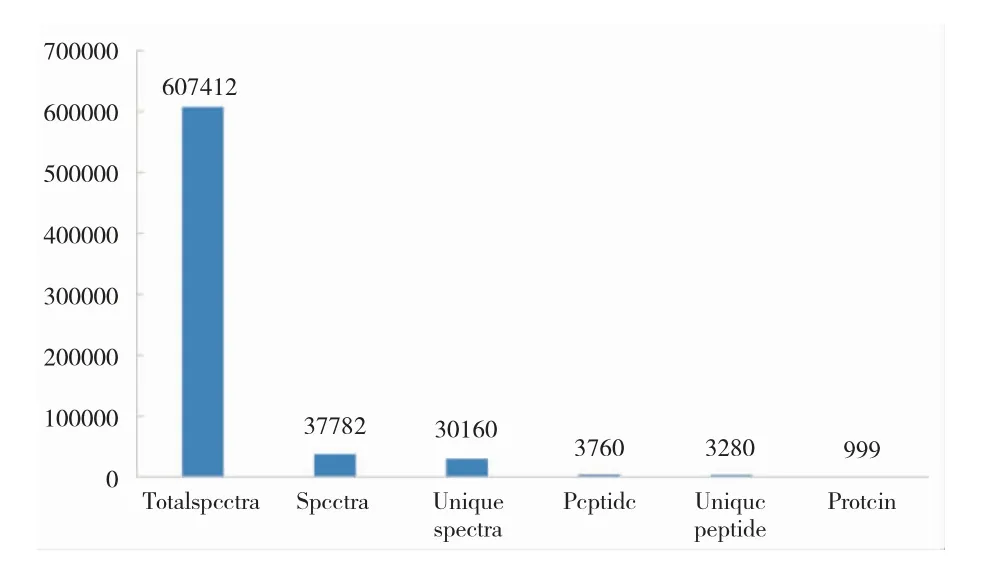
图1 显微介导中国对虾基因鲤蛋白质鉴定基本信息统计图Fig.1 Statistical summary of protein identified in common carp micro-injected with total DNA of Chinese shrimp
2.2 显微介导中国对虾基因鲤的差异蛋白质鉴定
根据差异倍数>1.2 倍,P<0.05 的差异蛋白质的标准,对比显微介导中国对虾基因鲤和对照鱼鉴定的总蛋白质。结果表明,与正常组比较,筛选出差异蛋白92 个,表达上调的蛋白质58 个,其中与脂肪酸有关的9 个,与氨基酸有关的2 个,与蛋白有关的1 个,与未知蛋白有关的1 个,与能量代谢有关的16 个,其他29 个;表达下调的蛋白质有34 个,其中与蛋白有关的5 个,与核糖体有关的6 个,与氨基酸有关的2 个,有2 个与未知蛋白有关,其他19 个。
2.3 显微介导中国对虾基因鲤的蛋白质GO 功能分析
GO 主要分为细胞组分(Cellular Component)、分子功能(Molecular Function)和生物学过程(Biological Process)等3 个本体,在这3 个本体中共有53 个功能组,其中,细胞组分、分子功能和生物学过程分别含有16、14 和23 个功能组。在细胞组分分类功能中主要体现在细胞器(16.66%)、细胞器部分(11.49%)、细胞(20.30%)和细胞部分(20.30%);在分子功能分类相关的蛋白质功能主要是结合(44.99%)和催化活性(33.36%)两部分;而在生物学过程分类中主要集中在细胞过程(14.80%)、单细胞过程(10.81%)和代谢过程(12.53%)(图2)。

图2 显微介导中国对虾基因鲤蛋白质的GO 分类Fig.2 Gene Ontology(GO)categories pattern of proteins in common carp micro-injected with total DNA of Chinese shrimp
2.4 显微介导中国对虾基因鲤的蛋白质COG 功能分析
COG(Cluster of Orthologous Groups of proteins 蛋白相邻类的聚簇)是对蛋白质进行直系同源分类的数据库。研究发现,COG 功能将667 个显微介导中国对虾基因鲤肌肉蛋白分为22 类,数量最多的是预测仅有全局功能的101 个蛋白,并有76 个蛋白注释为能量产生与转换功能,26 个蛋白注释为氨基酸转运和代谢功能,10 个未知功能蛋白。同时发现,功能序列在蛋白质组表达中具有明显的差异。图3中的横坐标为COG 分类条目,纵坐标为功能分类对应的蛋白数量。

图3 显微介导中国对虾基因鲤COG 功能蛋白质的统计数量分类图Fig.3 COG classifications of unigenes in common carp micro-injected with total DNA of Chinese shrimp
2.5 显微介导中国对虾基因鲤的差异蛋白的KEGG 代谢通路分析
通过对显微介导中国对虾基因鲤的差异蛋白Pathway 富集分析表明,共有80 个差异蛋白富集于76 个代谢通路,显著富集于代谢通路、亨廷顿病通路、帕金森氏症通路、氧化磷酸化通路、脂肪酸代谢、蛋白质消化吸收、赖氨酸降解、色氨酸代谢、核糖体、钙信号通道、丙酮酸代谢及精氨酸和脯氨酸等12 个代谢通路。其中在精氨酸和脯氨酸代谢通路中,发现CL7255.Contig2_All(肌酸激酶,7.51 倍)发生了上调,在脂肪酸代谢通路中,发现CL4243.Contig1_All(线粒体三功能蛋白,0.59 倍)发生了下调。这两种蛋白都可能对鱼的肌肉发育和提高机体内多种饱和与不饱和脂肪酸含量起重要作用。
2.6 实时荧光定量PCR 验证
选取CL7255(gi|4027929,肌酸激酶,creatine kinase,上调7.51 倍),U18791(gi|113951767,快速肌球蛋白结合蛋白,myosin binding protein,上调2.78倍),CL4243(gi|148224245,线粒体三功能蛋白,mitochondrial trifunctional protein,下调0.59 倍),U1232(gi|374463379,内皮素,endolepine,下调0.67 倍)4个蛋白质进行实时荧光定量PCR 验证。结果显示,图4 中的2 个上调蛋白和图5 中的两个下调蛋白与iTRAQ 的结果一致。

图4 显微介导中国对虾基因鲤相关基因的定量PCR 验证(上调蛋白)Fig.4 Validation of differentially expressed gene in common carp micro-injected with total DNA of Chinese shrimp(down-regulated protein)by qPCR

图5 显微介导中国对虾基因鲤相关基因的定量PCR 验证(下调蛋白)Fig.5 Validation of differentially expressed gene in common carp micro -injected with total DNA of Chinese shrimp(down-regulated protein)by qPCR
3 讨论
蛋白质是鱼肌肉中的主要组成成分,也是构成鱼肉组织结构的主要物质。它不仅含有很高的营养价值,而且蛋白质的变化也会影响鱼肉品质,因此利用iTRAQ 技术对显微介导中国对虾基因鲤的蛋白质进行测序研究,希望能找出与鱼肉品质相关的标记蛋白质,这对了解鱼肉蛋白质组成特性和结构特性,及鉴定和控制鱼肉的品质具有重要意义[21,22]。虽然将iTRAQ 技术用于显微介导中国对虾基因鲤蛋白组研究还未见有相关报道,但该技术已成功用于其他鱼类蛋白相关的研究中。如向玉婷[23]利用iTRAQ 技术首次对牙鲆(Paralichthys olivaceus)性腺中表达的蛋白进行了测序,鉴定出了1 444 个蛋白,其中上调蛋白118 个,下调蛋白73 个,通过GO和Pathway 分析,鉴定出了牙鲆中的FMR1、CALB2和WDR1 三种蛋白相应的基因,同时进行了Western blot 和荧光定量PCR 检验了上述三个蛋白,二者验证结果一致;陈金涛[24]对长臀(Cranoglanis bouderius)中的未成熟和成熟的精子中蛋白组进行iTRAQ 测序比较,鉴定出了1 941 个可信蛋白质,找到了4 个对精子的发生有重要作用的差异表达蛋白,即PLCγ、PAK、Raf 和GSK-3。Ge 等[25]研究了利用iTRAQ 技术对斑马鱼(Barchydanio rerio var)的卵母细胞成熟过程中蛋白质谱的动态变化。结果发现,有190 个蛋白质在成熟卵母细胞与未成熟卵母细胞中发生明显变化。Kohn 等[26]对长体多锯鲈(Polyprion oxygeneion)早期胚胎蛋白质组学分析中,发现了7 种可能作为生物标志的蛋白质。Yihe等[27]利用iTRAQ 技术去分析经盐度驯化的鳗鱼鳃中蛋白质的变化,发现在盐度为2.5%时,有336 个蛋白表达上调,67 个蛋白表达下调,在盐度为1%时,有33 个蛋白上调,32 个蛋白下调,并指出了在渗透调节中这些差异蛋白有可能存在着相互作用。iTRAQ 技术还在鱼类分子免疫学研究[28,29]、硬骨鱼肌间骨骼和肋骨发育的研究[30]和鱼类感染菌病的免疫机制[31]等都有很强的应用性。由此可见,利用iTRAQ 技术对鱼类进行差异蛋白分析与筛选,已经得到了广泛的应用[32]。本研究利用iTRAQ 技术,定量分析了显微介导中国对虾基因鲤和对照鱼的蛋白质差异,通过差异蛋白Pathway 富集分析表明,显著富集于脂肪酸和氨基酸等代谢通路上的差异蛋白有13 个,其中在精氨酸和脯氨酸代谢通路中发现的上调7.51 倍的肌酸激酶(creatine kinase),在鱼类中有促进肌肉发育的作用;而在脂肪酸代谢通路中发现的下调0.59 倍的线粒体三功能蛋白(mitochondrial trifunctional protein),有提高鱼体内多种饱和与不饱和脂肪酸的作用[33-35]。
本研究中,在蛋白质测序中筛选到的肌酸激酶(又称肌酸磷酸激酶,CK)是呱基磷酸转移酶家族的一员。它是催化某种生化反应发生的酶类,是一个与细胞内能量运转、肌肉收缩和ATP 再生有直接关系的重要激酶[36]。肌酸激酶是一种促进ATP 生成的酶,能够为营养物质的吸收利用储存能量,能可逆地催化肌酸和三磷酸腺苷生成磷酸肌酸和二磷酸腺苷的反应,在pH 中性条件下,以ATP 生成为主,以保证组织细胞的供能,正向反应利于线粒体内氧化磷酸化生成的ATP,以磷酸肌酸的形式进入细胞液,满足细胞生理活动之需要,促进细胞和组织的快速生长和发育[37]。在正常的生理状态下,CK 在细胞内的功能是在肌酸分子上加一个磷酸基因,使肌酸转化为高能分子磷酸肌酸,为细胞活动提供能量,磷酸肌酸在心肌、骨骼肌及大脑中含量丰富,这个反应由肌酸激酶催化。CK 广泛存在于骨骼肌、心肌和脑组织中,在脊椎动物中,肌酸与ATP 反应可逆地生成磷酸肌酸,并储存ATP 的高能磷酸键[38]。而鱼类CK 的表达上升使催化产生大量的膦酸肌酸,为组织生长提供能量,促进肌肉发育[33]。
本实验中筛选的另一个蛋白是线粒体三功能蛋白(Mitochondrial trifunctional protein,MTP),在脂肪酸代谢通路中是下调蛋白。MTP 是一种线粒体内膜上的蛋白质,催化脂肪酸β-氧化四个步骤循环中的2-烯酰CoA 的水合、长链-3-羟基脂酰CoA的脱氢和β-酮脂酰CoA 硫解的三个步骤,可增加脂肪酸合成的原料,使脂肪酸合成增加[39]。它是由四个α 亚基(HADHA)和四个β 亚基(HADHB)组成,其α 亚单位上有长链三羟酰基辅酶A 脱氢酶,是催化脂肪酸氧化的主要代谢酶,因此其表达下调可抑制脂肪酸代谢,使其产生积累,可提高机体内多种饱和与不饱和脂肪酸含量[34,35]。
综上所述,从差异蛋白中寻找可能与含鲜味基因表达的相关蛋白,也就是要把一个基因组表达的绝大多数蛋白质进行精确的定量和筛选,从而阐明性状(高氨基酸)是如何从遗传证据中产生的原因,这对提高鲤品质的研究具有重要作用,有助于用作新靶点在鲤中发挥重要作用。当然,对这些蛋白的进一步深入研究,需要大量的后续分析及表达、功能水平的验证。相信随着分析鉴定工作及功能基因学研究的进一步发展,将会发现更多与品质有关的信号和代谢途径。iTRAQ 的测序结果进一步表明,鲤胚胎导入显微介导中国明对虾全基因组后,肌肉中氨基酸及脂肪酸代谢均发生变化。该技术可应用于结合转基因技术培育优质的鲤新品种。
