不同产地3种脓疮草属药用植物的非挥发性成分分析
2023-07-12张俊红苏志强何艳青钟惠青丁汉朋
张俊红, 苏志强, 何艳青, 钟惠青, 丁汉朋
(1.广州中医药大学第一附属医院药学部,广东广州 510405;2.深圳市龙华区人民医院药学部,广东深圳 518000)
脓疮草又称白益母草,《中华本草》[1]记载:“脓疮草味苦、辛,性凉,可活血调经、消肿止痛。”产地较为狭窄,多分布在内蒙古地区,被蒙医誉为“疮疾之圣药”。唇形科脓疮草属(Panzeria Moench)植物按照《中国植物志》其分为3 个种,即脓疮草(P.alaschanica)、 甘肃脓疮草(P.kansuensis)和小花脓疮草(P.parviflara)[2]。但目前,脓疮草药材资源的有效活性成分及其生物种类成分差异尚不完全清楚。基于此,本研究对甘肃、陕西、新疆、宁夏及内蒙古等不同产地脓疮草属药用植物的脓疮草(P.alaschanica)、甘肃脓疮草(P.kansuensis)和小花脓疮草(P.parviflara)非挥发性成分差异进行分析,现将研究结果报道如下。
1 材料与方法
1.1 仪器冷冻离心机(H1650-W 型,湖南湘仪集团);DNA 提取研磨仪(MM400 型,德国Retsch公司);凝胶成像仪(JYO4S-3C型,北京君意东方电泳设备有限公司);PCR 仪(MG96+型,杭州朗基科仪公司);水平电泳仪(JY300C 型,北京君意东方电泳设备有限公司);3730XL 测序仪(62500200型,美国ABI公司)。
1.2 试剂绿原酸(成都植物纯化公司,批号:Y02J11L113432);柠檬酸、异槲皮苷、山柰酚、芹菜苷、水仙苷、水苏碱等物质的标准品(成都植物纯化公司,批号:P25J9L66554),且标准品纯度均高于98%;高效甲酸、乙腈(美国赛默飞世尔公司)。
1.3 样品本研究中脓疮草属药用植物脓疮草(P.alaschanica)、甘肃脓疮草(P.kansuensis)和小花脓疮草(P.parviflara)的产地分布上包括我国甘肃、陕西、新疆、宁夏及内蒙古等地。样品采集信息见表1。
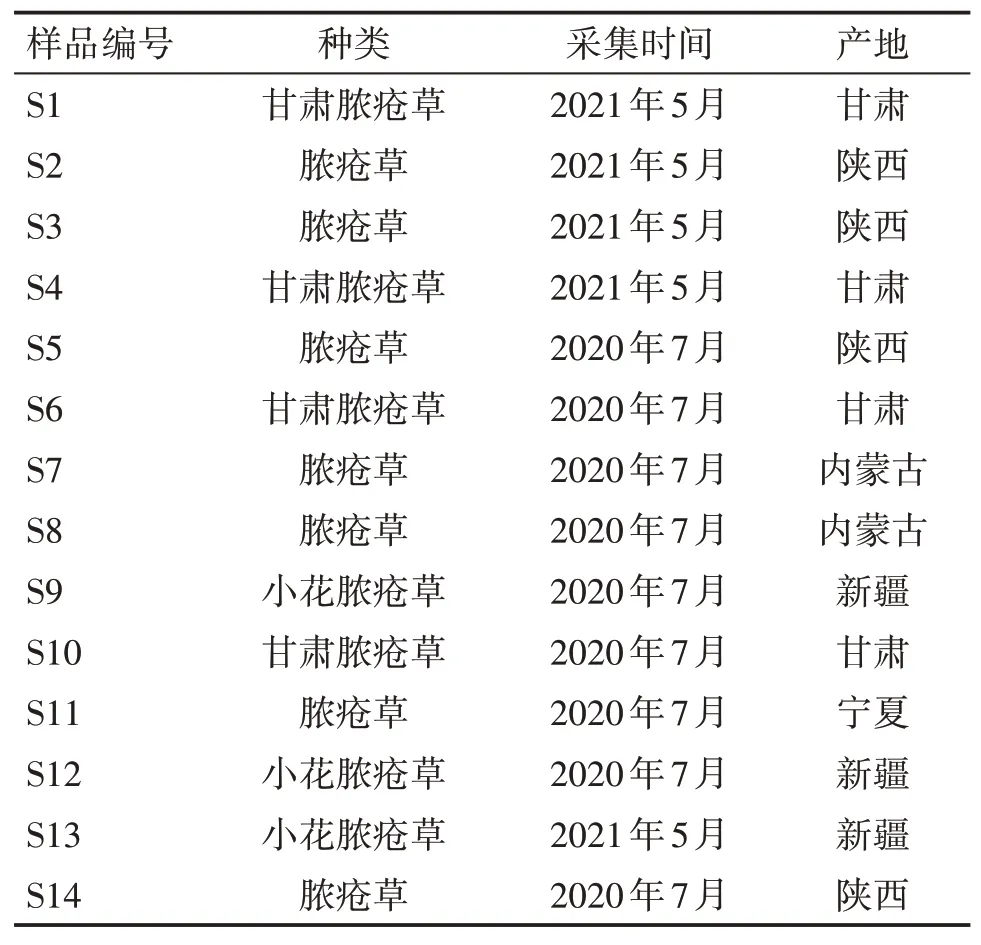
表1 脓疮草属样品采集信息Table 1 Sample collection information of Panzeria Moench samples
1.4 标准品溶液的制备取适量绿原酸、水苏碱和柠檬酸,以蒸馏水溶解制备成终浓度为100 pg/mL的标准品溶液。异槲皮苷以及水苏碱等标准品精确称量,以甲醇/H2O(v/v= 70/30)溶解液制备成终浓度为100 μg/mL 的标准品溶液。所有标准品溶液均于4 ℃冰箱中储存。
1.5 供试品溶液的制备取1 g脓疮草属样品(S1 ~S4)粉末,置于50 mL 锥形瓶内加30 mL 甲醇/H2O(v/v= 70/30)后超声(500 W,40 Hz)提取30 min。收集到的提取溶液用0.22 μg滤膜过滤,备用。
1.6 飞行时间质谱联用(UPLC-Q-TOF/MS)技术色谱柱为ACQUITY BEH C18(100 mm × 2.1 mm,1.7 μm),流动相A 为0.1%甲酸水溶液,流动相B为乙腈,流速0.3 mL/min,柱温40 ℃。梯度程序:0.00 ~0.50 min,10% ~12% B;0.50 ~1.80 min,12% ~13% B;1.80 ~2.00 min,13% ~17% B;2.00 ~7.50 min,17% ~20% B;7.50 ~9.00 min,20% ~34% B;9.00 ~12.00 min,34% ~35% B;12.00 ~13.50 min,35%~45%B;13.50 ~15.00 min,45% ~46% B;15.00 ~19.00 min,46% ~71% B;19.00 ~30.00 min,71%~90%B,31.00 ~32.00 min,90%B。进样量为2 μg。
质谱分析是在配备电喷雾电离源(ESI)的Waters QTOF Synapt G1-Si 质谱仪(Waters Corp,美国)上进行的。所有样本均进行了ESI-以及ESI+多种模式的测定方法,具体参数如下:MSE,质量扫描范围m/z为100 ~1 500 Da,锥电压25 V,脱溶的气流量850 L/h,温度450 ℃,毛细管电压3 000 V,同时,低CE 扫描中,碰撞能量为6 eV、4 eV,高碰撞能量扫描则为35 ~60 eV、12 eV。
1.7 指纹图谱方法学分析将供试样品S14 溶液在同日内进行6次检测,以检测值评估仪器的日内精密水平,而在持续5 d 评估S14 溶液的相对标准偏差(RSD)水平以此评估日间的精密水平。将S14药材平行制作5 份,按照“1.6”项下UPLC-QTOF/MS 方法进行重复性检验。并且于4 ℃温度对0、2、4、8、24、36、48 h S14 样品结果进行统计分析。通过分析数据来评估样品的平稳水平,以RSD表示以上所有评估的变异程度。
1.8 数据处理通过Waters 分析软件MarkerLynx XS 4.1进行数据分析。设定数值如下:样品保留时间为0.4 ~30 min;离子碎片的质量范围设定为50 ~1 000 Da;质量公差设定为50 mDa;干扰信号消除数值为6;同时同位素峰被排除分析。最终应用Simca-p软件进行样品主成分分析。
2 结果
2.1 化合物鉴定
2.1.1 UPLC-Q-TOF/MS 定性分析 本次研究主要对内蒙古产脓疮草(S7、S8)进行UPLC-Q-TOF/MS 定性分析,色谱图如图1 所示。根据标准品、参考文献和相关的数据库,共鉴定了41 种化合物,涵盖黄酮类、生物碱类、有机酸类以及木脂素类等,见表2。

图1 内蒙古产脓疮草基峰离子(BPI)Figure 1 Base peak ion of P.alaschanica from Inner Mongolia(BPI)

表2 内蒙古产脓疮草化学成分UPLC-Q-TOF/MS 分析Table 2 UPLC-Q-TOF/MS analysis of chemical composition in P.alaschanica from Inner Mongolia
2.1.2 黄酮类成分分析 共得到黄酮类成分16种,其中包括槲皮素、异鼠李素及其衍生物。通过对标准品的分析,针对苷元的特征离子进行总结,并以此确定了苷元的类型。之后,依据糖基化以及糖苷位置判断化合物,对槲皮素以及异鼠李素衍生物的鉴定进行分析。
负离子模式中化合物10 于m/z609 区域产生了[M-H]-离子峰。高CE 扫描结果显示,其m/z数值对应151、227、255、300、301,这种裂解规律与槲皮素的相似性较高。同时,m/z301[M-308]-显示出己糖以及脱氧己糖的中性缺失。结果中新橙皮苷[M-H-120]-的特征峰未见展现,m/z300 代表苷元自由基,m/z255、151、227 片段是由自由基裂解而成。见图2。通过标准品的分析能够确认为芦丁物质,异槲皮苷于m/z463 区域中展现出[M-H]-离子,并且在m/z301 区域中展现出了较为明显的碎片离子峰,同时m/z有151、179、227、255、271、300、301 碎片离子峰,由此可见其苷元为槲皮素。经标准品鉴定为异槲皮苷。

图2 芦丁的裂解途径和质谱图分析Figure 2 Cleavage pathway and mass spectrometric analysis of rutin
异鼠李素3-O-葡萄糖苷于m/z477区域产生了[M-H]-离子,且于m/z315 区域中产生了较为明显的碎片离子峰。同时,m/z314 区域展现为苷元自由基峰,且m/z285、271、243 是由苷元自由基裂解后而成的碎片离子峰。见图3。

图3 异鼠李素-3-O-葡萄糖苷的裂解途径及质谱图分析Figure 3 Cleavage pathway and mass spectrometric analysis of isorhamnetin-3-O-glucoside
水仙苷于m/z623 区域中产生了[M-H]-离子,同时,于m/z315 区域中产生了明显的碎片离子峰,因糖基中1→6 键相较于单糖的糖原离子发生率更高,所以在m/z315 区域的离子峰相较于化合物18的表现更强。见图4。结果表明其为水仙苷。

图4 水仙苷裂解途径和MS/MS分析Figure 4 Narcissin cleavage pathway and MS/MS analysis
2.1.3 生物碱类成分分析 对于生物碱类成分的鉴定结果只发现了1 类,正离子模式中,化合物1以m/z287[2M-H]+、m/z144[M]+形式存在,并且高CE 检测结果显示,在m/z58、84、102、116 区域中展现出特征离子峰,相对而言,特征碎片丢失依次为m/z28、42、60、86。见图5。

图5 水苏碱裂解途径以及MS/MS分析Figure 5 Cleavage pathway of hydrastine and MS/MS analysis
2.1.4 有机酸类成分分析 在内蒙古脓疮草中共鉴定出2 种有机酸。化合物2 于m/z191[M-H]-产生了碎片离子峰。高CE 检测结果显示,于m/z173[M-H-H2O]-、m/z111[M-H-H2O]-和m/z85[M-HH2O-2CO2]区域产生较为明显的碎片离子。见图6。
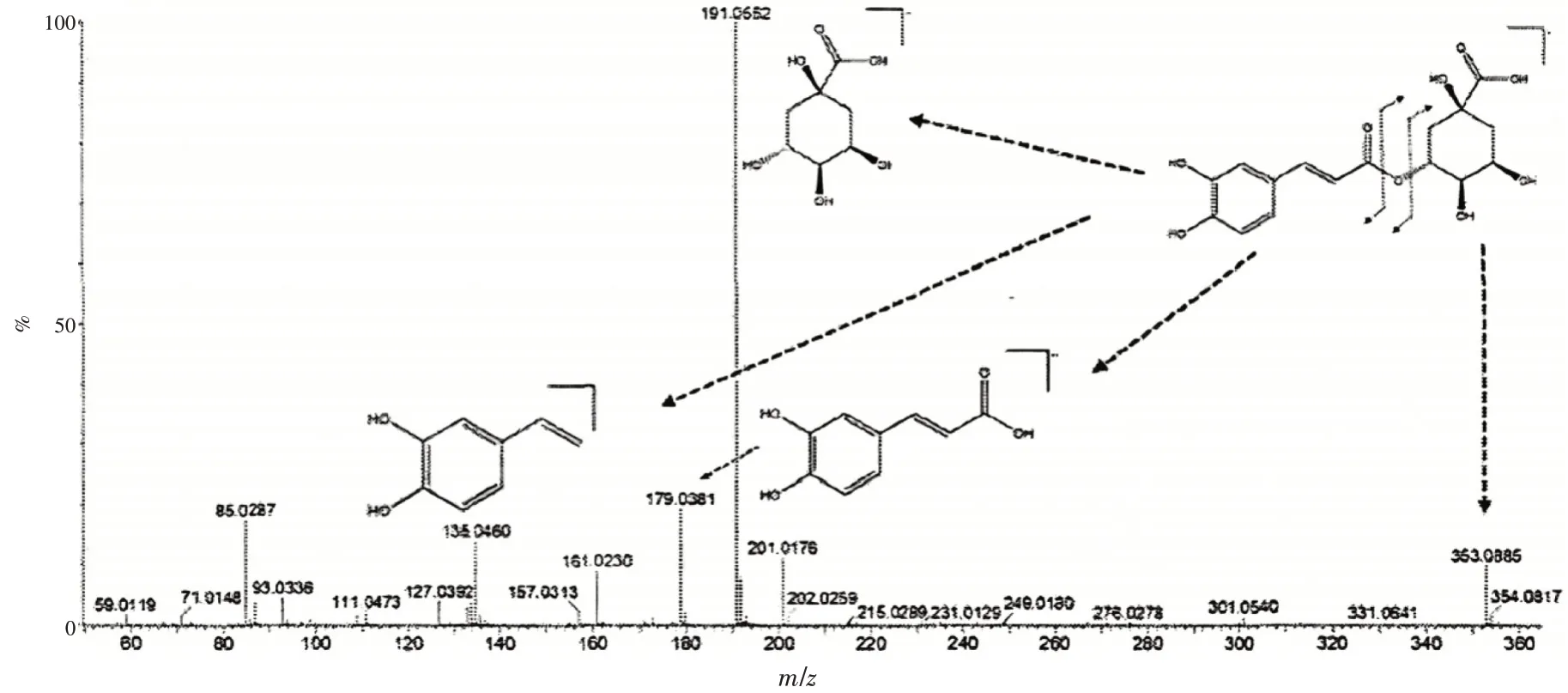
图6 绿原酸破碎途径以及MS/MS分析Figure 6 Chlorogenic acid fragmentation pathway and MS/MS analysis
2.1.5 木脂素类成分分析 毛蕊糖苷于m/z623区域中产生了[M-H]-离子峰,其关键峰分别为m/z461、m/z315和m/z161。见图7。

图7 毛蕊糖苷的质谱以及裂解途径Figure 7 Mass spectra of trichothecene and the cleavage pathway
2.23种脓疮草中药指纹图谱的相似性分析
2.2.1 方法学考察
2.2.1.1 稳定性分析 结果显示,S1 ~S14 各色谱图的相似度均高于0.99,异槲皮素以及芦丁的相对峰面积RSD 水平均低于4.9%,表明样品在室温条件下24 h内的稳定性较好。
2.2.1.2 重复性分析 结果显示,S1 ~S14 各色谱图的相似度均高于0.98,异槲皮素以及芦丁的相对峰面积的RSD 水平处于0.3% ~2.94%之间,表明样品精确度较高。
2.2.2 构建指纹图谱 将数据导入中药指纹图谱相似度计算软件,进行色谱峰差异性评价和整体相似度评价。色谱图相似性评价结果可见,甘肃脓疮草、脓疮草的相似水平均大于0.97,表明相似度较高。由此可见,就成分而言,小花脓疮草与甘肃脓疮草、脓疮草差异性较为明显,甘肃脓疮草和脓疮草两者的成分相似度较高。
2.2.3 主成分分析 图8-A 结果显示,S5 脓疮草与S10甘肃脓疮草的主要成分与其他样品间产生了较大背离效应,表明这2种样品中具有显著的离群水平,另外,S5脓疮草与S10甘肃脓疮草的图示所在位置远高于置信区间,表现出较为明显的异常值。由此可见,S5脓疮草与S10甘肃脓疮草相较于其他样品结果具有很大的偏差。对S5脓疮草与S10甘肃脓疮草的主要成分进行提取分析,结果如图8-B 所示。在17.102、17.845 min 这2 个时间中,样本的主成分差异较大,与S5脓疮草、S10甘肃脓疮草呈负相关,与其他样品呈正相关。在16.184、20.643 min 2 个时间中,样本的主成分差异同样较大,S5 脓疮草与S10 甘肃脓疮草呈正相关。

图8 脓疮草属样品(S1 ~S14)主成分分析Figure 8 Principal component analysis of Panzeria Moench samples(S1-S14)
3 讨论
本研究应用UPLC-Q-TOF/MS 技术揭示了内蒙古产脓疮草中的化学成分,共鉴定了41 种化学成分,包括黄酮类、生物碱类、有机酸类及木脂素类成分。在所鉴定到的成分中,内蒙古产脓疮草中主要含有较多种类的黄酮类成分,包括黄酮和黄酮醇类成分。根据已有的文献报道,黄酮类成分具有多种的生物活性[3],如抗炎[4]、抗氧化[5-6]等。而对于脓疮草的功效记载其解毒消肿的功效,可能与其含有多种黄酮类成分相关[7]。
按照《中国植物志》分类方式,本研究采用中药指纹图谱相似度和主成分分析的方法,对小花脓疮草、甘肃脓疮草和脓疮草等3个种属的成分进行比较分析,结果显示,小花脓疮草在成分种类和含量上,与甘肃脓疮草和脓疮草存在较大的差异,而甘肃脓疮草与脓疮草在成分上则没有明显的差异。且甘肃、陕西、内蒙古产地脓疮草在化学成分上同样呈现出相似性。甘肃脓疮草和脓疮草中含有较多的水仙苷,而小花脓疮草中水仙苷成分的含量相对较少。从成分分析的结果来看,小花脓疮草的生物学活性与脓疮草可能存在药效差异。甘肃脓疮草在非挥发性成分的含量和种类上均与脓疮草呈现出相似性,且无论是中药指纹图谱相似性评价结果还是主成分分析结果,均表现出高度的一致性。
但本次研究未检测挥发性成分,且药用植物对于成分和含量检测的最终目的是确保药效,对于甘肃脓疮草能否与脓疮草发挥同等的生物活性,有待于更深的成分检测分析和药理实验的进一步验证。
