泪小管塞栓治疗重度慢性眼移植物抗宿主病的安全性和有效性
2023-07-11阴小月张照委王仡宁赵颖奕李明新
王 贺,阴小月,,张照委,王仡宁,,张 玲,赵颖奕,李明新
0 引言
干眼(dry eye,DE)是由泪液缺乏或泪液过度蒸发引起的多因素眼表疾病,对眼表微环境造成损伤,并与眼部不适、刺激感和视觉障碍等症状相关[1-2]。干眼的患病率为5%~50%,与多种风险因素有关,包括多种自身免疫性疾病,如眼移植物抗宿主病(ocular graft-versus-host disease,oGVHD),Sjögren综合征和类风湿性关节炎等[3]。干眼的一线治疗包括患者教育、改善环境、饮食优化、眼睑卫生和人工泪液等,然而,对于严重的水液缺乏型干眼,这些治疗往往是不够的,有必要使用泪小管塞栓以增加水液在眼表的停留时间[4]。不仅如此,泪小管塞栓不依赖患者治疗的依从性,可吸收泪小管栓子的应用逐渐成为干眼患者一个有吸引力的选择[5]。
1935年Beetham[6]首次报道了鼻泪道阻塞作为保留眼表水分和改善泪道功能不全引起的症状的有效方法。40a后,Freeman[7]提出用泪点塞阻断鼻泪管是治疗干眼的一种有效且可逆的技术。虽然泪小点栓子放置有助于减轻干眼症状,但频繁的自发性栓子脱落影响了其疗效。研究指出,在2~6mo随访期内,栓子丢失率为15%~50%[8-9]。VisiPlug®泪小管栓子放置于泪小管内无外露部分,自发脱落率明显降低,且自身具有高度的组织相容性和可降解性,并发症也明显减少[10]。
人类白细胞抗原(human leukocyte antigen,HLA)相合供者的同种异体造血干细胞移植(hematopoietic stem cell transplantation,HSCT)是一种治疗恶性和良性血液病的成熟方法[11]。慢性移植物抗宿主病(chronic ocular graft-versus-host disease, cGVHD)是HSCT患者的一种潜在的危及生命的并发症。40%~60% GVHD患者存在眼部受累,称为慢性眼移植物抗宿主病(chronic ocular graft-versus-host disease,coGVHD),通常表现为与干眼相关的症状,包括眼睛砂砾感、疼痛、发红或流泪,严重的oGVHD甚至会出现角膜溃疡、穿孔和视力丧失[12-14]。在coGVHD患者中,供体来源的免疫细胞攻击宿主组织,导致泪腺导管周围区域以及相关分泌器官的炎症、成纤维细胞增殖和纤维化改变[15]。这种炎症介导的组织损伤通常引起泪腺功能的不可逆丧失,引起泪液量减少和泪液成分改变[16]。
全身和局部应用糖皮质激素治疗coGVHD的疗效通常是有限的,并且可能与继发性并发症,如感染、白内障形成和青光眼等有关。除激素外,目前coGVHD的局部治疗选择包括各种润滑剂、自体血清滴眼液、治疗性接触镜或局部使用环孢素等,可以减少部分患者的症状[14]。然而,这些干预措施都没有恢复生理泪膜,对这些治疗反应不佳的患者,泪小管塞栓可能是有效的治疗方法。虽然泪小管塞栓常用于治疗经典的水液缺乏型干眼,但目前国内还没有针对coGVHD患者进行泪小管塞栓治疗的研究,国外有少量的病例报告[17-18],但纳入研究的样本量少,观察指标较为单一,尤其是对于栓子植入后眼表炎症状态的改变缺乏有力的证据。
本研究纳入常规治疗(局部抗炎联合人工泪液)效果不佳的9例coGVHD患者,行双眼下泪小管塞栓术,观察患者植入前后干眼症状、体征和角膜共聚焦显微镜观察指标的变化,旨在初步评估对coGVHD患者行泪小管塞栓治疗的安全性和有效性,为临床治疗方案的选择提供依据。
1 对象和方法
1.1 对象回顾性研究。纳入2022-06/09就诊于徐州医科大学附属医院干眼门诊的重度coGVHD患者9例,其中男4例,女5例,年龄34~64(中位年龄48.2)岁。依据《中国干眼专家共识:检查和诊断(2020年)》的重度干眼诊断标准[19]:(1)裂隙灯显微镜检查角膜损伤范围2个象限及以上和(或)角膜荧光染色点≥30个,泪膜破裂时间(tear breakup time,BUT)<2s。(2)角膜荧光素染点融合成粗点、片状或伴有丝状物。同时参考国际oGVHD共识小组于2013年制定的coGVHD分级标准[20]:筛选严重程度评分为“严重”级别的患者,即:SchirmerⅠ试验(Schirmer Ⅰ test,SⅠt)≤5mm/5min,角膜荧光素染色评分(corneal fluorescein staining scores,CFS)≥4分且眼表疾病指数(ocular surface disease index,OSDI)≥33分。所有患者入组前均局部使用至少一种抗炎药物(激素或免疫抑制剂),且至少使用一种人工泪液(玻璃酸钠、右旋糖酐70、聚乙烯醇或羟糖苷等),所有患者均对常规治疗(局部抗炎联合人工泪液)反应不佳。本研究遵循《赫尔辛基宣言》,在解释研究的性质和可能的不良后果后,所有患者均签署书面知情同意。本研究获得徐州医科大学附属医院伦理委员会批准(No.XYFY2021-KL296-02),并于中国临床试验注册中心注册(No.ChiCTR1900021243)。
1.2 方法所有患者冲洗泪道均通畅,无分泌物。患者于术前3d滴0.5%左氧氟沙星滴眼液每天3次,5%聚维酮碘局部消毒后使用奥布卡因滴眼液表面麻醉,在手术显微镜下嘱患者朝植入点的反方向看;用精细镊将塞栓冲泡沫固定器的沟槽中取出,用棉签牵拉眼睑使其外翻,充分暴露泪点;将塞栓部分推入泪点并松开镊子;用棉棒向侧面牵拉,拉直垂直和水平泪小管之间的角度;用镊子尖端将塞栓送入水平泪小管内,直至肉眼看不到塞子。所有患者均行双眼下泪小管塞栓(直径为0.5mm的可吸收泪小管塞栓)。术后局部使用3d 0.5%左氧氟沙星滴眼液每天3次预防感染。置管后所有患者仍继续使用原有局部抗炎药物及人工泪液。记录患者术前,术后1、3mo眼表疾病指数(OSDI)评分、泪河高度(tear meniscus height,TMH)、非接触式泪膜破裂时间(noninvasive breakup time,NIBUT)、CFS、结膜丽丝胺绿染色评分(conjunctiva lissamine green staining score,CLGS)、SⅠt和角膜朗格汉斯细胞密度。
1.2.1OSDI评分包括“眼部症状”“视觉功能”“环境触发因素”三个维度,共12项,每项为0~4分,其中维度“眼部症状”3项,维度“视觉功能”6项,维度“环境触发因素”3项,最后评分为所有项目总分和与所回答项目数的比值再乘以25,最后评分为0~100分。
1.2.2TMH检查使用眼表综合分析仪的红外线照相功能对患者的泪河图像进行拍摄,并用系统自带的测量工具对瞳孔中央正下方的TMH进行测量,每例患者经同一位眼科医生检查3次,将结果排序后取中间值为最终结果。TMH≤0.2mm是诊断水液缺乏型干眼的界值。
1.2.3NIBUT检查使用眼表综合分析仪的BUT检测功能,基于普拉西多(Placido)环投射原理,患者头摆正,双眼平视前方,嘱患者瞬目2次后保持睁眼,仪器结合自动分析软件,检测泪膜随时间破裂的位点和时间,每次观察时间为10s,检查3次取平均值。NIBUT<10s提示泪膜稳定性下降。
1.2.4 眼表染色评分用1滴生理盐水湿润荧光素钠丽丝胺绿试纸,浸润到试纸边缘后,轻轻甩掉多余的染料。向外轻翻患者下睑,将湿润后的试纸条与下睑结膜囊轻接触,使染料泪液混合。嘱患者自然眨眼3~5次后凝视前方,不眨眼,用钴蓝光在16倍镜下观察角膜荧光素染色,然后用白光在16倍镜下观察丽丝胺绿染色结果,记录角结膜上染色的染色点数。将角膜分为4个象限,结膜分为6个象限,见图1,每个象限为0~3分,无染色为0分,1~30个点状着色为1分,>30个点状着色但染色未融合为2分,3分为出现角膜点状着色融合、丝状物及溃疡等,总分为所有象限分数的总和,最低分为0分,角膜最高分为12分,结膜最高分为18分。
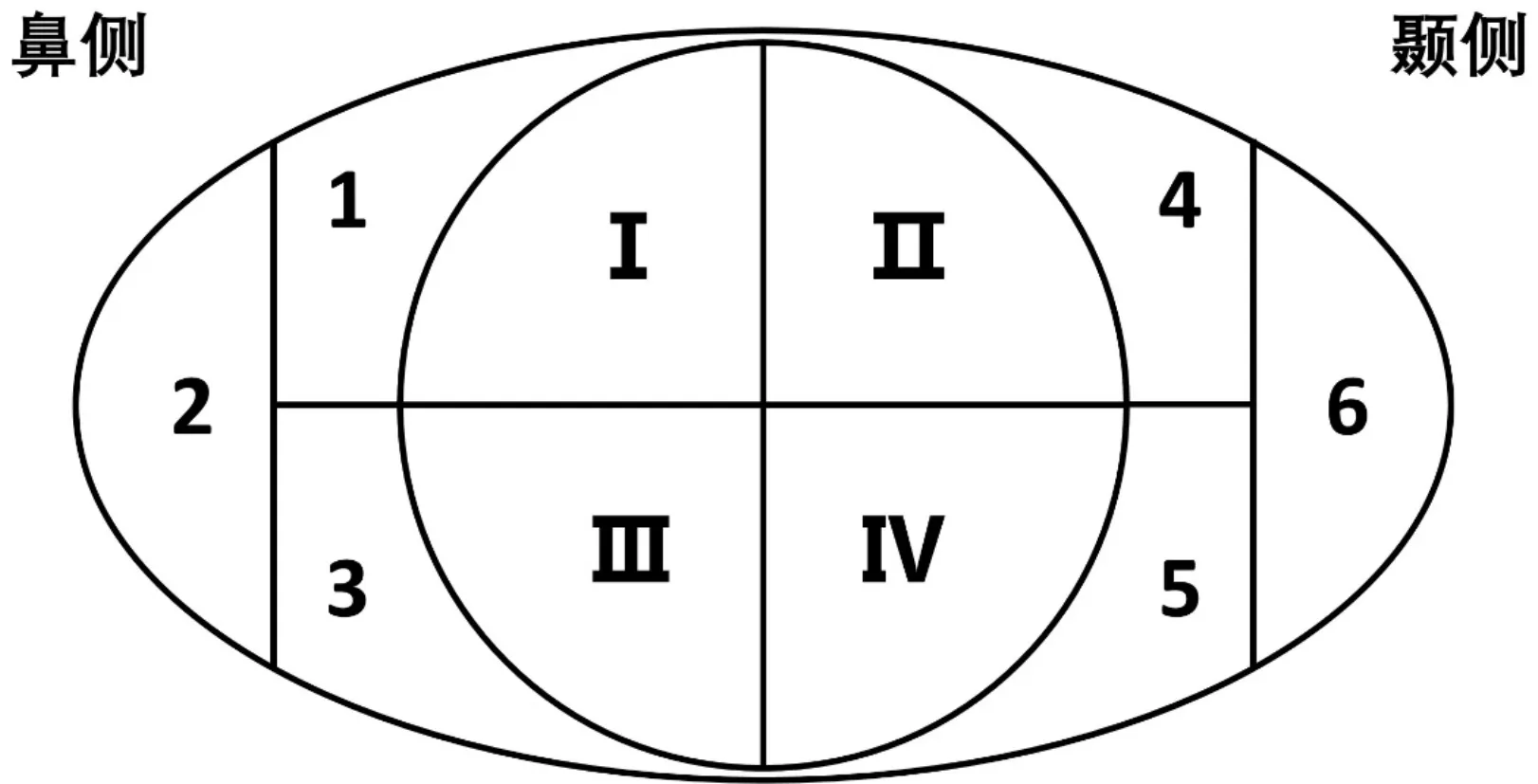
图1 眼表染色分区 Ⅰ~Ⅳ角膜荧光素染色分区; 1~6结膜丽丝胺绿染色分区。
1.2.5SⅠt检查使用标准Schirmer试纸(5mm×35mm)置于下睑结膜囊内中外1/3交界处,嘱患者轻闭双眼,5min后读取泪液浸湿的长度。
1.2.6 角膜朗格汉斯细胞密度检查使用共焦激光显微镜进行角膜形态的观察。机器参数:激光波长670nm,观察视野为400μm×400μm,轴向分辨率为1μm。使用盐酸丙美卡因滴眼液行眼表麻醉后,将患者下颌置于下颌托处,前额固定于前额托,调节电荷耦合元件(charge-coupled device,CCD)摄像头的位置,使CCD摄像头的光轴与激光扫描摄像头的光轴垂直。嘱患者注视指示灯,将摄像头移向患者,直到患者角膜与角膜接触帽的距离为5~10mm。调整物镜位置,使角膜接触帽与患者角膜中央轻微接触。所有操作由同一医师完成。利用共聚焦显微镜内置的细胞计数软件计算中央角膜上皮下浅基质层(深度约40μm)浸润的朗格汉斯细胞密度,观察3个视野取平均值。

2 结果
2.1 纳入患者一般情况本研究共纳入coGVHD患者9例9眼(如双眼结果相同,随机选择1眼纳入研究,如结果不同,选择严重眼纳入研究)。纳入患者一般情况见表1。所有患者从同种异体造血干细胞移植到诊断oGVHD的中位间隔时间为9.2(1~20)mo。从诊断oGVHD到纳入泪小管塞栓治疗的中位间隔时间为23.7(6~50)mo。

表1 纳入患者一般情况
2.2 手术前后干眼相关症状和体征检查结果
2.2.1 手术前后OSDI评分比较手术前后OSDI评分比较差异有统计学意义(F=48.676,P<0.01),各时间点两两比较差异均有统计学意义(P<0.01),见表2。

表2 纳入患者干眼相关症状和体征检查结果
2.2.2 手术前后TMH比较手术前后TMH比较差异有统计学意义(F=36.392,P<0.01),术后1、3mo与术前比较差异均有统计学意义(P<0.05),术后1mo与3mo比较差异无统计学意义(P>0.05),见表2。图2为1例典型病例手术前后TMH照相。

图2 典型患者手术前后TMH变化 A:术前红外照相可见TMH较低;B:术后1mo TMH增加;C:术后3mo TMH增加。
2.2.3 手术前后SⅠt比较手术前后SⅠt比较差异无统计学意义(F=0.059,P=0.943),见表2。
2.2.4 手术前后NIBUT比较手术前后NIBUT比较差异有统计学意义(F=57.410,P<0.01),各时间点两两比较差异均有统计学意义(P<0.01),见表2。图3为1例典型病例手术前后NIBUT分析结果。

图3 典型病例手术前后NIBUT变化 A:术前大多数区域<2s,提示严重的泪膜稳定性下降;B:术后1mo NIBUT明显提高,但平均NIBUT仍小于5s;C:术后3mo NIBUT明显提高,但平均NIBUT仍小于5s。
2.2.5 手术前后CFS比较手术前后CFS比较差异有统计学意义(F=104.216,P<0.01),各时间点两两比较差异均有统计学意义(P<0.01),见表2。
2.2.6 手术前后CLGS比较手术前后CLGS比较差异有统计学意义(F=37.290,P<0.01),各时间点两两比较差异均有统计学意义(P<0.01),见表2。图4为1例典型病例手术前后裂隙灯检查和眼表染色的变化。

图4 典型病例手术前后眼表染色情况 A:术前角膜、结膜各象限呈较多点、片状着染;B:术后1mo片状染色消失,点状染色数量明显减少;C:术后3mo角膜荧光素染色几乎消失,结膜丽丝胺绿染色也明显减轻。
2.2.7 手术前后朗格汉斯细胞密度比较手术前后朗格汉斯细胞密度比较差异有统计学意义(F=41.647,P<0.01),各时间点两两比较差异均有统计学意义(P<0.01),见表2,提示泪小管塞栓术后眼表炎症状态明显改善。图5为1例典型病例手术前后角膜朗格汉斯细胞图像。

图5 典型病例手术前后角膜朗格汉斯细胞图像 A:术前可见角膜组织中大量朗格汉斯细胞浸润;B:术后1mo朗格汉斯细胞明显减少;C:术后3mo朗格汉斯细胞明显减少。
2.2.8 并发症发生情况所有患者均未观察到泪小管塞栓脱落、瘙痒、不适、结膜和角膜病变、溢泪、泪小管炎和化脓性肉芽肿等并发症。
3 讨论
本次研究评估了泪小管塞栓治疗coGVHD的效果,通过观察OSDI评分以及客观的临床参数,包括TMH、NIBUT、CFS、CLGS、SⅠt以及角膜朗格汉斯细胞密度,评估泪小管塞栓治疗重度coGVHD的安全性和有效性。
既往研究报道,50%以上的cGVHD患者在异基因造血干细胞移植后可发生oGVHD,GVHD可累及眼部各部位,但干眼是最常见的眼部表现[3]。干眼常与结膜水肿、假膜形成等结膜炎体征和慢性睑缘炎同时发生,这一过程可导致继发性角膜上皮改变,如点状角膜病变、丝状角膜炎、复发性角膜上皮糜烂和继发性角膜感染,甚至与角膜溃疡和穿孔有关[21-23]。coGVHD患者尤其是在免疫抑制治疗过程中,可发生感染性结膜炎、睑缘炎、角膜炎甚至眼内炎,均可导致永久性视力丧失[24-25]。
免疫介导的泪腺破坏引起的泪液分泌减少是产生GVHD相关眼表异常的重要原因[26]。增加眼表水液的方法很多,包括使用人工泪液和血清滴剂润滑眼表,使用常规眼睑护理技术控制蒸发,使用湿房镜、睑缘缝合术或泪小管塞栓术等[27-28]。泪小管塞栓操作简单、效果可靠,通过影响泪液的引流和补充泪液来部分恢复泪膜结构,这使得泪小管塞栓成为一个有吸引力的治疗策略。泪小管塞栓对泪液潴留和眼表健康的益处已得到充分证实,多项报告表明泪小管塞栓可改善干眼的客观体征和主观症状[5,29-31]。对于oGVHD患者的泪点闭塞治疗,目前有一些争议。Behrens等[32]担心,由于“可能存在非临床明显的炎症,泪点塞可能导致促炎泪液成分滞留在眼表,并可能加剧眼表损伤,加速疾病进程,并给患者带来更大不适”,因此建议不要采用泪点封堵术。另一方面,Couriel等[33]和Riemens等[26]支持使用泪点封堵术作为GVHD患者辅助治疗的选择。
本研究结果表明,泪小管塞栓治疗可显著改善coGVHD所致干眼的症状和体征。泪小管塞栓后,患者OSDI评分明显降低,除SⅠt外,TMH、NIBUT明显提高,CFS和CLGS评分下降。NIBUT和CFS是评价上皮细胞屏障功能和完整性的指标之一,也是我国干眼专家共识中分级诊断的重要参考。以前的研究表明,自发性泪小管栓脱落是泪小管最常见的问题,发生率为30%~50%[34],泪点闭塞的其他已知可能并发症包括瘙痒、不适、结膜和角膜病变、溢泪、泪小管炎和化脓性肉芽肿等[35-36]。在本研究中均未观察到上述并发症,可能由于本研究使用的VisiPlug®泪小管塞栓具有非常优异的组织相容性、生物可吸收性,且放置在泪小管内无外露部分,不易脱落有关。本研究发现SⅠt在手术前后并无显著变化,与Amparo等[37]和Chen等[38]的结论一致,原因可能在于SⅠt观察的主要是泪液分泌的潜力,在观察前需拭去结膜囊中的泪液,而coGVHD患者由于泪腺炎症导致泪液分泌功能下降,因此测得SⅠt结果较低;相反,TMH观察的是泪液的潴留量,因此可以观察到泪小管塞栓术后泪液在结膜囊的存留量明显增加。
尽管之前的文章经常讨论并假设泪点栓子植入后,由于泪液滞留时间延长,泪膜中促炎因子浓度可能会增高,影响泪膜稳定性[32,39],但我们没有发现任何植入后眼部炎症增加的迹象,我们发现术后患者角膜浅层基质中的朗格汉斯细胞密度降低,提示眼表炎症减轻。使用共聚焦显微镜观察角膜朗格汉斯细胞浸润情况是观察干眼炎症状态和判断干眼治疗效果的常用方法,结果较为稳定、可重复性强[40-41]。Ogawa等[42]报道了14例oGVHD患者,每天使用10次自体血清滴眼液(每次2~3滴),在开始治疗至少1mo后病情恶化或无改善的6例患者中,加用硅胶塞进行泪点封堵,所有患者的临床表现都有不同程度的缓解,研究结果与本研究基本一致。Mansour等[43]使用泪点塞栓治疗干燥综合征引起的干眼患者(与GVHD有相似的病理机制),发现这些干眼患者的症状和体征均有显著改善。泪小管塞栓能促进炎症减轻的原因尚不清楚,可能的解释有3个:(1)泪小管塞栓使泪液量增加,泪液渗透压下降,稀释泪液中的促炎细胞因子;(2)增加的泪液量使干眼所致的角膜、结膜上皮损伤容易修复,减少炎症细胞的聚集和炎症因子释放;(3)泪小管塞栓使泪液循环减慢,可能增加局部抗炎药物和人工泪液在眼表的停留时间。
本研究有一些局限性:(1)由于常规治疗效果不佳的重度oGVHD在眼科属于少见病,本研究纳入患者数较少,且基于伦理学考虑,无法设立对照组,因此本研究数据的参考价值不如随机对照临床试验;(2)在非盲法评分中记录的患者主观症状和眼表染色可能不够精确,因此在本研究中尽量使用客观指标,比如TMH、NIBUT、角膜朗格汉斯细胞密度等;(3)本研究未检测患者手术前后泪液中炎症因子浓度的变化,对泪小管塞栓治疗机制的分析不够充分,需要在今后的研究中进一步完善。
总之,泪小管塞栓治疗重度coGVHD安全有效,可明显改善患者的主观症状和客观体征,提高泪膜稳定性。栓子植入的最佳时机以及与其他局部和全身治疗的联合应用仍有待观察。
