番木瓜赖氨酸基序类受体激酶LysM-RLK基因家族鉴定及生物信息学分析
2023-07-11郭盼孔华王雨戴云素贾瑞宗周瑶郭安平纪长绵马春花
郭盼 孔华 王雨 戴云素 贾瑞宗 周瑶 郭安平 纪长绵 马春花

关键词:番木瓜;LysM-RLK 家族;生物信息分析;基因表达;蛋白三维结构
中图分类号:S667.9 文献标识码:A
大多数蛋白质编码基因在植物基因组中以多拷贝或基因家族的形式存在[1–3]。例如,水稻和拟南芥分别有41 908 和31 135 个基因,分别包含13 055 和10 193 个基因家族[1]。ZHANG 等[2]研究发现一个基因家族基因成员的数量不仅在属内物种之间存在差异,而且在一个物种内也存在变化,基因家族成员数量的变化与生物性状的遗传变异显著相关。因此,系统鉴定并解析基因家族进化关系是理解目标基因家族参与植物生物学过程的基础。类受体蛋白激酶家族(receptor-like kinase,RLK)是植物基因组中一个大基因家族,前期研究主要集中于基因家族的结构和系统发育分析[4],较少涉及解析该家族成员的功能和活性。第一个植物RLK 基因在玉米(Zea mays L.)中被鉴定[5]。在双子叶植物模式物种拟南芥( Arabidopsisthaliana)中,至少鉴定了610 个RLK 基因,约占其蛋白质编码基因的2.5%[4]。在单子叶植物模式物种水稻(Oryza sativa L.)中,RLK 家族由1130个基因组成,其成员数量是拟南芥的1.85 倍[6]。
RLK 基因已被证明参与包括植物生长发育、激素信号感知、抗病和抗逆等在内的生物学过程[7]。赖氨酸基序受体激酶(LysM-RLK)是植物中重要的RLK 亚家族之一,其成员属于包含赖氨酸基序(LysM)的蛋白质,是识别微生物相关分子模式( microbe-associated molecular patterns,MAMPs)的模式识别受体(pattern recognitionreceptors, PPR)[8-10]。LysM 首次在芽孢杆菌噬菌体溶菌酶中发现之后,在来自粪肠球菌(Enterococcusfaecalis)的名为肽聚糖水解酶的酶中亦发现了LysM[11-12]。植物细胞膜上有一个识别受体,其包含LysM 结构域,能够与真菌细胞壁上的几丁质结合并传递信号以激活免疫反应,这一类蛋白根据亚细胞定位的预测和结构域的差异,可以分为LysM 类受体激酶(LysM-containing recetor-likekinases, LYKs ) 、LysM 类受体蛋白( LysMcontainingreceptor-like protein, LYPs)、细胞外LysM 蛋白(extracellular LysM, LysMe)及非分泌型胞内LysM 蛋白( intracellular non-secretoryLysM genes, LysMn),不同物种的单个蛋白含LysM结构域的数量有所不同,这是长期进化导致的差异,且与蛋白的功能相关[13]。随着测序技术的快速发展和相关组学数据的积累,已证实LysM 结构域蛋白广泛存在于动植物生物体基因组中[14-15]。
番木瓜(Carica papaya L.)是热带特色水果,具有很高的营养价值和药用价值,属于热区重要经济作物之一。番木瓜基因组小(350.3 Mb)、常年开花结果、种子多、生长快、代际短及遗传转化体系成熟,是果树研究重要模式材料[16]。已有研究报道表明LysM-RLK 家族参与植物抗病和胁迫响应[17],然而其在番木瓜全基因组水平基础特征信息、进化关系及基因表达模式研究的不足严重阻碍了其在番木瓜新品种选育中的开发利用。本研究采用生物信息学方法在全基因组水平系统鉴定了番木瓜LysM 家族基因,并分析了其家族成员的进化关系、染色体分布、基因蛋白和结构特征等。基于已有的84 份代表性转录组样品数据,系统解析了番木瓜LysM 家族成员在不同组织、不同发育过程和不同胁迫处理条件下的转录模式及表达分化。相关研究为理解番木瓜LysM家族起源演化,复制基因表达分化及其在不同生物学过程中转录表达模式提供重要理论基础,将促进其在番木瓜抗病育种中的研究和应用。
1 材料与方法
1.1 材料
从Pfam 数据库下载LysM 种子文件,用hmmer search 方法筛选番木瓜和葡萄(Vitis viniferaL.)基因組中对应的同源基因作为候选基因。
1.2 方法
1.2.1 番木瓜LysM-RLK 成员鉴定及理化性质与亚细胞定位分析 利用NCBI Conserved DomainSearch(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)数据库,基于保守结构域、在线分析工具Pfam( http://pfam.xfam.org/ ) 和SMART(http://smart.emblheidelberg.de/)[18]预测保守域[19]。利用ExPASy(http://expasy.org/)在线软件对从番木瓜基因组中鉴定到的7 条候选类受体蛋白激酶家族的蛋白序列进行分子量、理论等电点预测。利用SMART(http://smart.embi-heidelberg.de/)在线软件对所有基因保守结构域的位置进行预测。进一步利用在线工具WoLFPSORT(http://wolfpsort.hgc.jp)对番木瓜LysM-RLK 基因进行亚细胞定位预测。
1.2.2 番木瓜LysM-RLK 家族蛋白的基因结构、结构域分析及蛋白质三级结构预测 使用TBtools 软件[20]对基因结构进行可视化。利用MEME(http://meme-suite.org/)在线软件基于相似度较高的基序(motif),分析番木瓜LysM-RLK基因家族成员蛋白序列保守特征及特征展示。使用SMART(https://smart.embl.de/)在线软件进行LysM-RLK 基因结构域预测。使用人工智能网络算法工具AlphaFold2[21]预测番木瓜LysM-RLK 家族蛋白三维结构,获得蛋白三维结构PDB 文件。将获得的PDB 文件输入到PyMOL V2.3[22]软件包中,对蛋白三维结构进行可视化展示。
1.2.3 番木瓜LysM-RLK 蛋白系统发育分析及LysM-RLK 基因染色体定位 为了阐明番木瓜(Carica papaya)、拟南芥(Arabidopsis thaliana)和葡萄(Vitis vinifera L.)中的LysM-RLK 家族成员之间的系统发育关系,构建LysM-RLK 家族进化树。采用muscle v3.8.31 软件对来自番木瓜(7个LysM-RLKs)、拟南芥(4 个LysM-RLKs)和葡萄(11 个LysM-RLKs)的22 个LysM-RLK 蛋白质序列进行多重序列比对。使用BMGE1.12 软件,选用参数为默认参数,在多重序列比对中选择适合系统发育推断的高质量比对区域。最后,利用IQ-TREE(V2.1.2)软件[23]构建LysM-RLK亚基因家族的最大似然( maximum-likelihood,ML)系统发育树。
根据番木瓜基因组注释文件,提取番木瓜LysM-RLK 基因在染色体上的位置信息,利用在线程序(http://mg2c.iask.in/mg2c v2.1/)展示其在番木瓜基因组上位置分布特征。
1.2.4 复制基因鉴定及选择压力(Ka/Ks)分析及复制基因共线性鉴定 使用Dup Gen finder[24]流程鉴定番木瓜LysM-RLK 基因家族的复制基因对及复制类型。进一步计算复制基因对的Ka/Ks 值,评估其在进化过程中面临的选择压力。首先利用Muscle(https://www.ebi.ac.uk//Tools/msa/muscle/)在线软件对每一个复制基因对蛋白序列进行全局比对。然后,利用ParaAT(V2.0)软件[25]将比对序列反向翻译成对应的cds 序列。最后,利用KaKscalculator 软件[26]计算非同义替换率(Ka)、同义替换率(Ks)和Ka/Ks[24]值,使用多重序列共线性搜索工具MCscan 搜索番木瓜全基因组的同源共线片段。
1.2.5 番木瓜LysM-RLK 家族启动子分析 根据番木瓜基因组注释gff 文件,提取得到番木瓜LysM 基因翻译起始位点上游2000 bp 的序列作为候选启动子区域。通过在线软件PlantCARE( http://bioinformatic.psb.ugent.be/webtools/plantcare/html/)分析LysM-RLK 家族启动子顺式作用元件。
1.2.6 LysM-RLK 基因在生物与非生物胁迫条件下的表达模式分析 番木瓜转录组数据收集。从NCBI 数据库中下载84 份与番木瓜相关转录组数据,其中非生物胁迫相关的转录组测序数据29条、不同组织转录组测序数据15 条,生物胁迫相关转录组数据40 条,共组成43 组转录组数据,具体信息见附表S1。
基因表达定量。转录原始测序数据经过Fastp软件包质控以后,用HISAT2 软件[27]将高质量的转录组测序数据比对到番木瓜参考基因组得到序列比对文件。然后采用StringTie 软件[28]组装比对上的reads,构建转录本序列,并采用FPKM 算法对read count 做归一化处理计算基因和转录本的表达量。
差异表达及表达分化基因鉴定。最后利用DESeq2 软件[29]鉴定差异表达基因:差异倍数FC≥2,差异显著性FDR>0.05。利用R 语言的heatmap函数绘制LysM-RLK 基因表达量热图。同一组样品中复制基因对之间表达量的比值≥2,定义为表达显著分化的复制基因对。
1.2.7 番木瓜LysM-RLK 家族蛋白的基因结构、结构域分析及蛋白质三级结构预测 使用TBtools[20]软件对基因结构进行可视化。利用MEME(http://meme-suite.org/)在线软件基于相似度较高的基序,即motif,分析番木瓜LysM-RLK基因家族成员蛋白序列保守特征及特征展示。使用在线软件SMART(https://smart.embl.de/)进行LysM-RLK 基因结构域预测。使用人工智能网络算法工具AlphaFold2[21]预测番木瓜LysM-RLK 家族蛋白三维结构,获得蛋白三维结构PDB 文件。将获得的PDB 文件输入到PyMOL V2.3[22]软件包中,对蛋白三维结构进行可视化展示。
1.2.8 番木瓜LysM-RLK 家族加權基因共表达网络分析 通过炭疽病、番木瓜畸形花叶病毒(Papaya leaf-distortion mosaic virus,PLDMV)、禾生素(CTS)、干旱等处理的转录组数据筛选差异表达基因(DEGs)。处理组与对照组差异基因鉴定参数为|log2 FC(FPKM)|≥1,FDR≤0.05。共筛选出10 490 个差异基因。采用R 语言的WGCNA 包构建LysM-RLK 家族基因的加权共表达网络。分析鉴定共表达模块,在模块中鉴定基因共表达差异表达基因作为核心基因(hub-genes),并利用Cytoscape 软件对核心基因的共表达网络(hub-network)可视化。
2 结果与分析
2.1 LysM-RLK 家族基因鉴定及特征分析
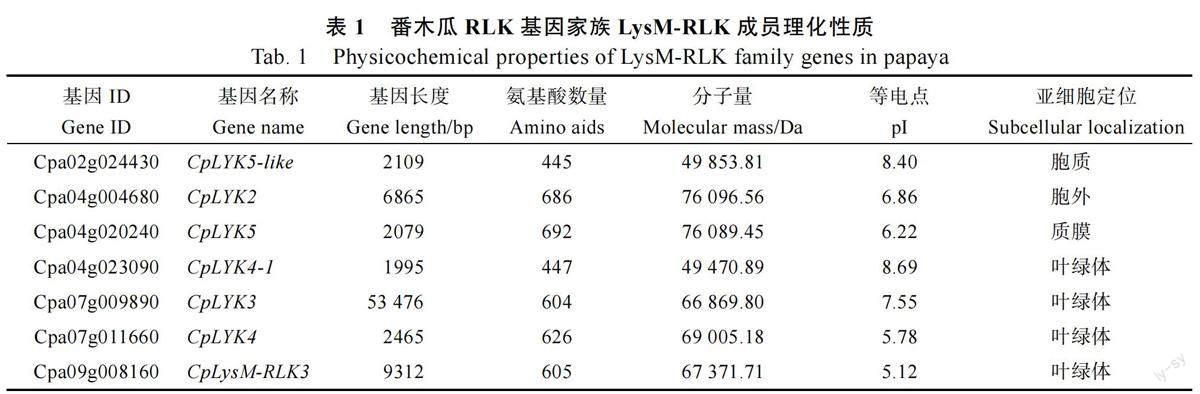
利用5 个拟南芥的LysM-RLK 家族基因作为参考[4],将其比对到番木瓜和葡萄的蛋白序列,根据序列相似性筛选到LysM-RLK 候选同源基因(identify≥45%)。如果其编码区同时存在N 末端LysM 基序、1 个跨膜结构域和C 末端Pkinase保守结构域的经典的LysM-RLK 结构域模式,则认为其属于LysM-RLK 基因家族。本研究在番木瓜、拟南芥和葡萄基因组中分别鉴定到7 个、4个和11 个LysM-RLK 家族基因。为获得番木瓜LysM-RLK 家族蛋白的理化特征信息,利用生物信息学方法解析了番木瓜的7 个LysM-RLK 基因家族成员的蛋白长度、分子量、理论等电点和亚细胞定位。结果表明其氨基酸序列大小为445~692,分子量为49.85~76.10 kDa,等电点为5.12~8.69(表1)。利用在线软件WoLFPSORT 预测番木瓜7 个LysM-RLK 基因的亚细胞定位信息,结果发现这7 个家族成员定位于不同亚细胞区域。其中1 个基因(CpLYK5)位于细胞质膜,1 个基因( CpLYK5-like ) 位于胞质, 1 个基因位于(CpLYK2)胞外区域,其余4 个基因(CpLYK4-1、CpLYK3、CpLysM-RLK3、CpLYK4)定位于叶绿体(表1)。该分析结果暗示不同的LysM-RLK基产物可能被转运到番木瓜不同的亚细胞区域,进而参与不同的生物学过程。
2.2 LysM-RLK 家族的基因结构特征及保守结构域分析
外显子的获得或丢失可能引起基因对应的蛋白质结构域结构和蛋白质功能的变化[30]。因而,本研究比较了LysM-RLK家族成员之间的基因结构特征。结果发现LysM-RLK 基因主要由1~11 个外显子构成,其中CpLYK5 属于单外显子基因,CpLYK3基因长度达到53 476 kb,包含11 个较小的外显子。CpLYK3 存在多个大内含子插入的现象,导致其基因长度明显大于该家族的其他基因(图1A)。外显子数量的增加可以增加mRNA 剪接模式多样性,并导致包括DNA 结合亲和力[31],蛋白质溶解度[32]和蛋白质功能[30]等改变,内含子的插入能够增强目标基因的表达并影响转录本(mRNA)的衰变或定位[30, 33]。以上证据暗示内含子插入和外显子数量差异可能会引起番木瓜LysM-RLK 家族不同成员之间的结构差异和功能分化。
基因家族中共有的基序(motif)可能是该基因家族保守结构域序列,暗示其是基因家族基础功能核心序列。利用MEME(http://meme-suite.org/)在线工具对番木瓜的LysM-RLK 基因家族成员进行保守结构域鉴定(图1B,表2)。结果表明番木瓜LysM-RLK 蛋白的motif 长度最小为15,最大为50。在MEME 鉴定得到的10 个motif中,motif2 的保守性得分最高,并且按照一致的顺序排布(图1B)。
2.3 LysM-RLK 基因家族进化关系及染色体位置分布特征
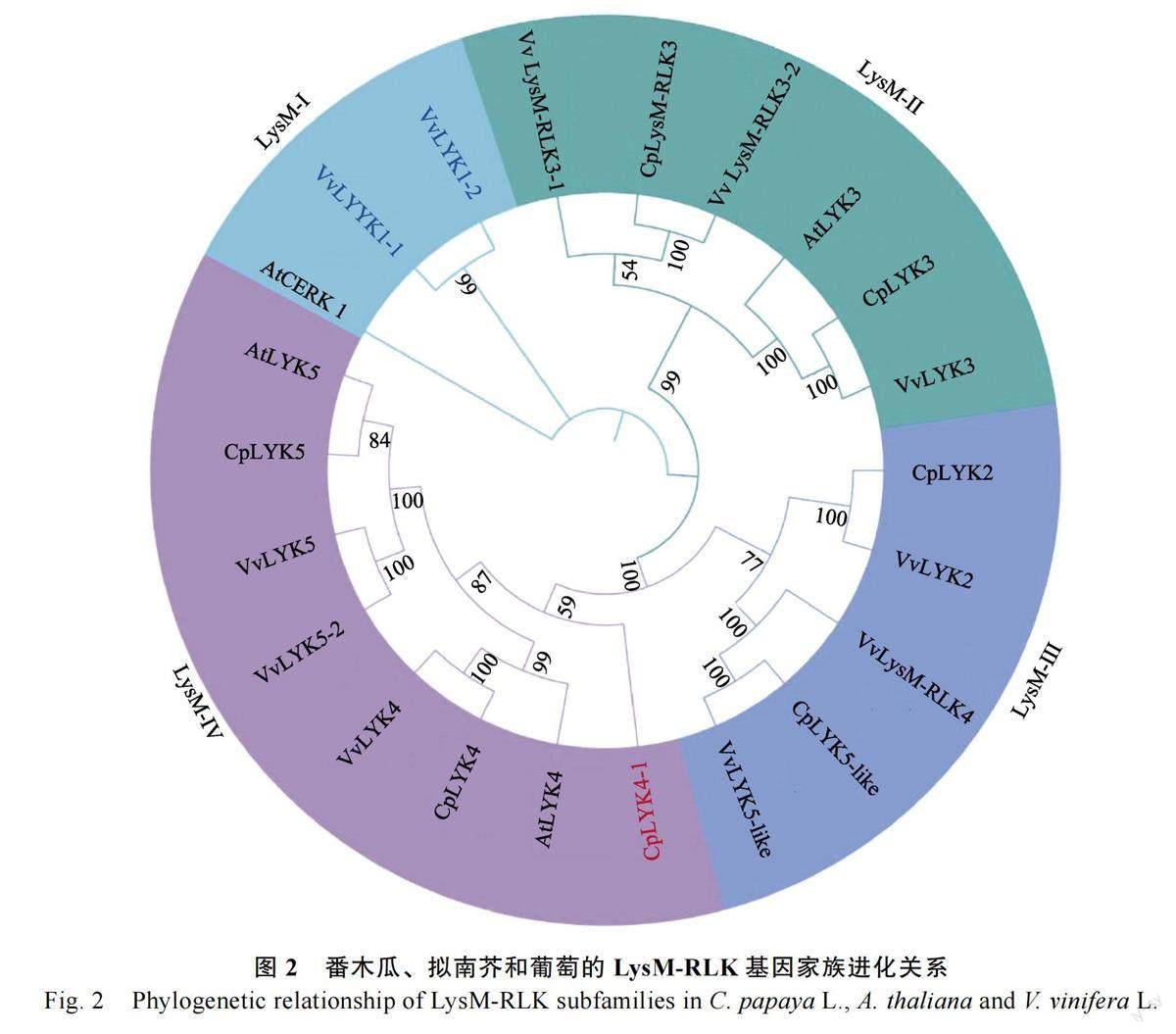
为了揭示LysM-RLK 基因家族成员的进化关系,本研究利用极大似然法构建了葡萄、番木瓜和拟南芥的LysM-RLK 基因家族系统发育树(图2)。结果表明番木瓜的LysM-RLK 基因家族成员分成3 个独立分支(LysM-Ⅱ~LysM-IV),其中分支LysM-Ⅱ中含有2 个番木瓜LysM-RLK 基因,分支LysM-Ⅲ中含有2 个番木瓜LysM-RLK基因,分支LysM-IV 中含有3 个番木瓜LysM-RLK基因,暗示其在进化过程中产生了功能分化。
解析LysM-RLK 在番木瓜基因组上分布特征,结果表明番木瓜的7 个LysM-RLK 家族基因主要分布在chr02、Chr04、chr07 和chr09 染色体上(图3)。CpLYK5-like 分布在2 号染色体的远端粒区(chr02: 37 470 447~37 472 556 bp)。CpLYK2(chr04: 4 182 588~4 189 453 bp)、CpLYK5(chr04:32 118 333~32 120 412 bp) 、CpLYK4-1 ( chr04:34 635 116~34 637 111 bp)分别位于4 号染色体远端粒区域。CpLYK3(chr07: 9 452 026~9 505 502 bp)、CpLYK4(chr07: 15 723 626~15 726 091 bp)分布在7号染色体的远端粒区域。CpLysM-RLK3(chr09:7 478 070~7 487 382 bp)分布于9 号染色体的远端粒区域。
2.4 早期基因复制事件驱动番木瓜LysM-RLK家族的形成
已有研究表明基因复制是导致植物基因家族扩张的重要进化驱动力,促进基因家族内部同源基因之间功能分化,为植物的遗传多样性提供重要支撑[33]。基因复制分析发现番木瓜LysM-RLK家族中5 个基因均来源于dispersed 类型复制(表3),表明基因复制对其家族成员形成具有重要贡献。番木瓜与葡萄、拟南芥一样经历了大约1.2亿年前的一次真双子叶植物共有的祖先全基因组三倍化事件(γ-WGT)[34-35]。然而,本研究未发现由全基因组复制事件(whole genome duplication,WGD)对番木瓜LysM-RLK 基因家族的贡献(表3),暗示LysM-RLK 基因家族的基因复制可能发生在γ-WGT 事件之后。因而,本研究进一步评估了基因复制发生的时间(表3)。结果发现番木瓜LysM-RLK 家族的基因發生复制的时间大约在1.83 百万年~3.00 百万年之间,远远晚于真双子叶γ-WGT 事件发生时间。推测祖先基因组三倍化事件(γ-WGT)产生的LysM-RLK 复制基因(wgd-type duplicated genes)可能在番木瓜基因组进化过程中被丢失[33, 35],而番木瓜基因组中新的基因复制促进了番木瓜LysM-RLK 家族的形成。
为了明确重复基因的位点关系,在番木瓜基因组上用红线将LysM-RLK 复制基因对相连(图4)。结果发现4 号染色体上含有3 个基因参与复制,2 号染色体和9 号染色体上都含有1 条基因参与复制。在番木瓜的7 个LysM-RLK 基因中有5 个基因被鉴定为基因复制来源基因。LysM-RLK基因家族中,位于2 号染色体的基因CpLYK5-like是LysM-RLK 基因家族中最早出现基因复制的基因,并分化出基因CpLYK2 和基因CpLYK4-1 两个基因,推测4 号染色体的CpLYK2、CpLYK4-1可能来自2 号染色体CpLYK5-like 内部的基因复制事件。CpLysM-RLK3 由CpLYK5 复制得到,推测9 号染色体的CpLysM-RLK3 可能来自4 号染色体CpLYK5 的基因复制事件。
2.5 番木瓜LysM-RLK 家族基因启动子区域的顺式作用元件预测
本研究将番木瓜LysM-RLK 基因5?UTR 上游2000 bp 的序列作为启动子序列。通过PlantCARE软件分析启动子区域的顺式作用元件。发现番木瓜LysM-RLK 基因启动子区域的包括组织特异性元件、非生物胁迫相关元件、激素响应元件和功能相关元件4 类顺式作用元件(图5)。其中CpLYK4 和CpLysM-RLK3 含有参与低温响应顺式元件。CpLYK5、CpLYK4-1 和CpLYK4 含有参与水杨酸反应的顺式作用元件。部分基因的启动子序列中包含包括多种激素响应、低温应答及逆境响应等生物学过程相关的顺式作用元件。上述结果暗示LysM-RLK 基因可能参与调控番木瓜的抗逆防御和生长发育等重要生物学过程。
2.6 LysM-RLK 基因在番木瓜不同组织和生物学过程中表达模式
为了研究番木瓜中LysM-RLK 家族潜在的生物学功能,本研究系统地解析其在番木瓜生物胁迫、非生物胁迫条件下及不同组织中的基因表达模式(图6A)。通过对84 个转录组数据进行表达定量分析,发现番木瓜LysM-RLK 基因家族成员明显地分成高表达和低表达2 个模式。CpLYK4-1 和CpLYK5-like 基因整体表现出低表达的趋势,而CpLYK2、CpLysM-RLK3、CpLYK4、CpLYK5 和CpLYK3 倾向于高表达。值得注意的是CpLYK4-1 和CpLYK4 在不同病毒和炭疽病侵染条件下(ANT, AIN1, PAPMV, SIN2, G20, Y61)显著差异表达,并且相对于对照组其表达量明显上调,暗示它们在番木瓜抗病响应中具有重要生物学功能。相对于其他组织,CpLYK5-like 在正常的根组织中特异性高表达,并且在干旱胁迫条件下表达量明显下调,表明其在根组织中负调控干旱胁迫。转录组数据分析表明,干旱胁迫过程(0~20 d)中,CpLYK4 在叶片组织表达量逐渐上调,在根组织表达量逐渐下调。同时,CpLYK4 在番木瓜炭疽病侵染过程中高表达量,并且随着侵染时间延长(0、24、48 h)表达量逐渐上调。以上结果表明CpLYK4 同时参与响应叶片干旱胁迫和炭疽病侵染过程。CpLYK5 和CpLYK3 两个基因在不同组织、不同发育过程、生物胁迫和非生物胁迫条件下整体呈现高表达现象,暗示它们的功能对番木瓜生长发育和胁迫响应至关重要。CpLYK3 在WMV 病毒侵染和花粉组织中不表达,表明其不参与WMV 病毒侵染过程和花粉发育。
为了解析复制基因之间功能差异,本研究重点关注鉴定得到的7 对复制基因的表达情况(图6B)。發现CpLYK5-like/CpLYK2、CpLYK5-like/CpLYK4-1、CpLYK2/CpLYK5、CpLYK4-1/CpLYK2和CpLysM-RLK3/CpLYK5 五对复制基因在不同组织、生物胁迫和非生物胁迫条件下表现出明显的基因表达量分化现象。其中约3 百万年前产生的复制基因CpLYK5-like、CpLYK5 和CpLYK4-1 之间出现明显的表达量分化。CpLYK5 在不同组织、生物胁迫和非生物胁迫条件下显著高表达,而其复制基因CpLYK5-like 和 CpLYK4-1 则表现出低表达量,暗示复制基因在进化过程中出现了功能分化现象。
2.7 LysM-RLK 家族的功能结构域和蛋白序列三级结构解析
根据表达分析结果,推测复制基因对CpLYK5-like/CpLYK5 和CpLYK5-like/CpLYK4-1 之间表达分化可能引起功能变化。因此对CpLYK5-like、CpLYK5 和CpLYK4-1 三个基因的蛋白功能结构域和蛋白质三维结构进行了比较分析。结构域分析结果发现3 个LysM-RLK 基因都含有典型胞外LysM 结构域,CpLYK5-like 和CpLYK5 分别包含1 个跨膜结构域和1 个胞内蛋白激酶结构域,属于典型的LysM 型受体激酶,而CpLYK4-1 跨膜结构域缺失(图7A)。为了解析这3 个复制基因之间蛋白空间结构变化,本研究利用人工智能网络算法AlphaFold2 进行了蛋白三维结构预测(图7B)。结果发现LysM 结构域和跨膜区均存在-螺旋结构且基因CpLYK5-like 的LysM结构域包含β-折叠,然而它们的蛋白三维空间结构已经表现出明显差异。结合其在不同转录组中的基因表达分化,本研究认为番木瓜复制基因CpLYK5-like、CpLYK5 和CpLYK4-1 在长期进化过程中已经表现明显的基因功能分化。
2.8 番木瓜基因LysM-RLK3 加权基因共表达网络分析(WGCNA)
为了进一步揭示3 个复制基因(CpLYK5-like、CpLYK5 和CpLYK4-1)的转录调控网络,本研究对基于4 个不同胁迫条件下[炭疽病、番木瓜畸形花叶病毒(PLDMV)、禾生素(CTS)、干旱等]的转录组数据构建的差异表达基因的共表达网络发现,CpLYK5(Cpa04g020240)位于plum1 共表达模块。选取模块内连接度最高的前27 个基因作为该模块的核心基因,构建了核心共表达网络。基因表达热图(图8A)表明,这些核心基因在不同胁迫条件下表达模式出现明显的表达差异,尤其是在炭疽病侵染过程中表达量显著下调,而在PLDMV 病毒侵染过程中表达量明显上调,暗示这些核心基因协同参与不同生物和非生物胁迫响应。Cpa01g017940 、Cpa02g003800 和Cpa04g021650 分别为编码膜结合蛋白苏氨酸激酶(CpPHOT2)、糖转运蛋白(CpSWEET1)、3-酮基-CoA合成酶6(CpKCS6)的基因,其在炭疽病侵染的果实和干旱胁迫的茎组织中表达量下调,而在番木瓜畸形花叶病毒(PLDMV)和禾生素(CTS)处理叶片组织中表达量上调。CpLysM-RLK3 是拟南芥AtLYK5 的同源基因,属于主要的几丁质受体,可与几丁质激发子受体激酶(AtCERK1)结合形成几丁质介导的复合物,诱导植物免疫。在核心共表达网络中(图8B),CpLysM-RLK3 与膜结合蛋白苏氨酸激酶(CpPHOT2)、糖转运蛋白(CpSWEET1)、3-酮基-CoA 合成酶6(CpKCS6)等核心基因表现出强共表达关系,暗示这些核心基因通过相互之间的转录调控协同响应植物不同逆境胁迫。CpLYK5-like、CpLYK5 和CpLYK4-1不在同一个核心共表达网络,为复制基因之间的功能分化提供新的证据,其具体功能差异需要后续进行更加深入的研究。
3 讨论
LysM 型类受体蛋白激酶基因在植物生长发育及逆境胁迫中发挥重要功能,已成为当今植物中基因功能研究的热点之一[36]。本研究采用生物信息学方法对番木瓜基因组中的LysM-RLK 家族基因进行系统鉴定、分类及理化特征评估。同时比较基因组学角度来阐明番木瓜LysM-RLK 家族形成的演化历史,明确近期的基因复制对其家族形成重要贡献。
本研究鉴定了番木瓜7 个LysM-RLK 家族基因,LysM-RLK 家族成员数多于拟南芥(4 个),小于葡萄(11 个)。高梅等[36]研究的小立碗藓(Physcomitrium patens)是早期登陆的植物代表,其LysM-RLK 家族成员数量多于拟南芥和水稻,推测该家族成员在小立碗藓中可能存在基因功能的冗余。随着不断进化发展,一些高等植物中LysMRLK家族成员数量得到扩展,意味着该家族新功能的引入。
通过系统进化分析,将番木瓜LysM-RLK 基因分为3 个亚组(LysM-Ⅱ、LysM-Ⅲ和LysM-Ⅳ),它们均与拟南芥和葡萄的部分成员聚为一类,而高等植物中LysM-RLK 家族分为4 个亚组,推测番木瓜中LysM-RLK 家族成员的功能相对单一[37]。
顺式作用调控元件作为一个重要的分子开关,如王东东等[37]发现大多数LysM-RLK 基因的启动子序列中富含多种激素相关的作用元件,如水杨酸(salicylic acid, SA)响应元件TCA-element(S)、茉莉酸甲酯(methyl jasmonate, MeJA)响应元件CGTCA-motif(M)等,但不同基因之间的元件含量和种类均不相同,表明LysM-RLK 家族不同成员能对不同激素发生响应且响应程度不同[38]。本文预测的番木瓜顺式作用调控元件表明LysM-RLK 参与各种环境因素(干旱、低温等)、光响应和植物激素[生长素(auxin,IAA)、脱落酸(abscisic acid,ABA)、水杨酸(salicylicacid,SA)、茉莉酸甲酯、赤霉素(gibberellins,GAs)等],与前人研究一致。
植物胁迫反应机制的一个潜在创新来源是基因复制,ZOU 等[38]对复制基因参与应激调节的启动子顺式作用DNA 调节元件的分析表明,祖先应激反应的不对称分配可能部分归因于DNA 调控元件的差异;失去大部分顺式作用元件的重复基因不参与应激反应,但可能参与其他反应。因此,失去顺式作用元件的复制基因可能形成新功能而保留下来,拟南芥重复基因之间的顺式调节元件部分解释了为什么重复基因对胁迫有不同的应答反应。
左存武等[39]发现LysM-RLK 在苹果腐烂病发生前后,发生差异表达的基因较多推测部分苹果LysM-RLK 基因可能在部分苹果真菌病害发生的过程中起重要的感受和调控,秦春晓[40]研究表明星星草(Borago officinalis)Put LysM 基因可能参与种子萌发与根的盐应答调控过程, 表明LysM-RLK 与抗病抗逆相关,并参与组织发育。番木瓜基因表达谱分析表明LysM-RLK 广泛参与生物胁迫(肯尼亚不知名病毒、PapMV 和PRSV协同处理、PRSV 和PapMV 协同处理、PapMV、PLDMV、炭疽病)、非生物胁迫(低温胁迫、乙烯处理、1-甲基环丙烯、干旱胁迫、冻融处理)和不同组织发育(胚珠、花粉、雄蕾、叶、根、茎、雌花、雄花和不同发育时期的果实)。
本研究在转录组水平上挖掘番木瓜抗病和抗逆相關的LysM-RLK 基因,揭示LysM-RLK 基因参与番木瓜抗病和抗逆反应。为番木瓜的遗传改良和育种提供了必要的LysM-RLK 基因资源。
