髓源性生长因子对高糖环境BMSCs成骨分化的影响及其机制
2023-07-09赵喜强逯文华尚利强党瑞杰
赵喜强,逯文华,尚利强,党瑞杰,安 然,何 鑫
据不完全统计,全球范围内糖尿病患者约为5.37亿,预计到2030年将达到6.43亿[1]。糖尿病状态下由于炎症因子、高血糖等因素的影响,常导致骨代谢紊乱,严重影响缺牙患者的口腔种植修复[2]。在糖尿病的高糖环境下,骨髓间充质干细胞(bone-marrow mesenchymal stem cells,BMSCs)的干性和成骨功能会受到抑制,引起口腔种植体周围骨的重塑障碍[3]。因此,寻找一种能够改善高糖抑制BMSCs成骨能力的药物是目前亟待解决的问题。
髓源性生长因子(myeloid-derived growth factor,MYDGF)来源于单核巨噬细胞,在心血管疾病、骨质疏松症、糖尿病等多种疾病模型中表现出良好的治疗效果[4-7]。Wang等[6]发现,MYDGF能够通过促进胰高血糖素样肽1的分泌来维持糖尿病小鼠的血糖稳态。刘翠等[8]体外研究发现,正常糖状态下MYDGF能够增强糖尿病小鼠 BMSCs的成骨分化能力。以上预示着MYDGF可能是糖尿病骨代谢事件的保护因子。然而,MYDGF在高糖环境中对BMSCs成骨分化的作用及具体机制尚不清楚。本实验初步探讨MYDGF对高糖环境中BMSCs成骨分化的影响及其分子机制。
1 材料与方法
1.1 材料与仪器 24 h内SD大鼠乳鼠(SPF级,北京斯贝福公司)10只;重组 MYDGF蛋白(百奥莱博,中国);α-MEM培养液、裂解液(赛维尔,中国);胎牛血清(Gibco,美国);成骨诱导培养液(赛业,中国);碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(碧云天,中国);Trizol、PVDF膜、ECL发光液(普利莱,中国);兔单抗 β-actin、鼠单抗 β-catenin(Proteintech,美国);兔多抗 p-GSK3β(Abcam,美国);CD11b-FITC、CD29-FITC、CD45-FITC、CD90-FITC抗体(BD Biosciences,美国);引物序列(上海生工,中国)。细胞培养箱、超净工作台(博科,中国);恒温水浴锅(玛瑞特,中国); 低速离心机(中科中佳,中国);电泳仪、转膜仪(六一,中国)。
1.2 BMSC分离、培养 超净工作台中分离SD乳鼠双侧股骨,剪开骨髓腔后通过α-MEM 培养液稀释骨髓,骨髓液离心(1000 r/min,5 min)后弃上层脂肪组织及上清。重悬管底细胞沉淀,接种到细胞培养瓶中,细胞培养箱中培养。待细胞生长汇合至80%时,传代并继续培养。
1.3 BMSCs鉴定 取P3代BMSCs并将其密度调整为1×106个/ml,按照1 ml/管的方法分装至EP管。向EP管中加入5 μl的荧光标记抗体或PBS,抗体包括CD11b、CD29、CD45、CD90。4 ℃条件下孵育40 min,离心后重悬BMSCs,上机检测BMSCs表面标记物。
1.4 ALP活性检测 细胞分组:(1)NG组 (BMSCs培养于成骨诱导培养液);(2)HG组(成骨诱导培养液中加入44 mmol/L葡萄糖)[9];(3)MYDGF组(在HG组基础上加入100 ng/ml MYGDF)[8],每组设3复孔。各组细胞成骨诱导7 d后,裂解提取上清。根据ALP检测试剂盒说明书方法分别加入检测缓冲液、标准品和细胞裂解液。37 ℃条件下孵育10 min后加入终止液,酶标仪测定吸光度OD值(波长405 nm)。
1.5 RT-qPCR检测成骨相关基因 细胞分组同上。通过RT-qPCR检测各组细胞的成骨细胞特异性转录因子(osterix,OSX)、Runt相关转录因子(runt-related transcription factor 2,RUNX2)及Ⅰ型胶原(collagen type Ⅰ,COL-Ⅰ)mRNA表达情况。各组细胞成骨诱导7 d后,提取细胞总RNA并测定RNA 纯度,随后逆转录RNA合成cDNA,按照 95 ℃反应10 min(预变性),95 ℃反应15 s、60 ℃ 反应1 min的顺序进行40个循环的PCR扩增。数据处理时以NG组为参照。
1.6 Wnt/β-catenin信号通路检测 细胞分组如下:NG组,HG组,MYDGF组,MYDGF+Dkk1组(在MYDGF组基础上加入10 μg/ml 通路抑制剂Dkk1)[10],每组设3复孔。各组细胞成骨诱导7 d后,提取细胞总蛋白,将蛋白变性后加样,电泳结束后转膜,室温下封闭1 h,将膜浸入一抗孵育,4 ℃过夜后再将膜浸入二抗封闭,最后于膜上滴加ECL发光液显影,曝光。使用 Image-J定量分析曝光后的条带。
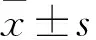
2 结 果
2.1 BMSCs的分离培养和鉴定 贴壁法提取BMSCs,BMSCs形态多呈梭形及纺锤形,旋涡状生长。BMSCs高表达间充质干细胞表面抗原为CD29(91.6%)、CD90(94.2%),低表达造血干细胞表面抗原为CD11b(0.75%)、CD45(1.55%)。
2.2 MYDGF促进高糖环境中BMSCs的ALP活性 各组细胞成骨诱导7 d后,与NG组相比,HG组ALP活性显著降低[(0.169±0.018)vs.(0.078±0.012);P<0.05];与HG组相比,MYDGF组ALP活性显著升高[(0.141±0. 019)vs.(0.078±0.012);P<0.05],而NG组和MYDGF组的ALP活性差异无统计学意义[(0.169±0.018)vs.(0.141±0.019)]。
2.3 MYDGF促进高糖环境中BMSCs的成骨相关基因表达 细胞成骨诱导7 d后,与NG组相比,HG组OSX、RUNX2、COL-I的mRNA水平均明显降低(P<0.05);与HG组相比, MYDGF组OSX、RUNX2、COL-I的mRNA水平均显著升高(P<0.05,表1)。

表1 不同处理组BMSCs成骨相关基因表达水平
2.4 MYDGF激活Wnt/β-catenin信号通路 各组细胞成骨诱导7 d后,Western blot结果如图3和表 2所示:与NG组相比,HG组p-GSK3β和 β-catenin 蛋白水平显著降低(P<0.05);与HG组相比,MYDGF组的p-GSK3β和β-catenin蛋白水平明显上升(P<0.05);在加入Dkk1后,MYDGF促进p-GSK3β和β-catenin蛋白表达的作用受到抑制(P<0.05,表2)。

表2 不同处理组BMSCs的p-GSK3β和β-catenin蛋白表达水平
3 讨 论
种植修复已成为缺牙患者恢复正常牙列的重要选择,高血糖会影响种植体周围的骨愈合及种植体的稳定性,还会在种植体骨结合过程中损害骨质量,增加种植体周围炎的发生风险,最终可能导致口腔种植的失败[11,12]。
越来越多的研究表明,骨骼除具有结构作用和造血功能外,还可以作为内分泌器官调节机体的糖代谢[6,13,14]。MYDGF 是一种骨髓来源的细胞因子,能有效维持机体的糖稳态,有望成为糖尿病治疗的新药物[6]。研究表明,MYDGF能够缓解高糖诱导的H9C2细胞的损伤,对心脏功能具有保护作用[15],能增强糖尿病小鼠 BMSCs的成骨功能[8],但MYDGF对于高糖诱导的BMSCs细胞的影响未见报道。因此本实验通过高糖诱导BMSCs,探讨MYDGF对高糖环境中BMSCs成骨分化的影响。
BMSCs是存在于骨髓组织的多能成体干细胞,在骨代谢过程中发挥重要作用[16]。当骨组织受到损伤后,机体分泌的细胞因子会聚集到BMSCs周围,刺激其增殖和分化为成骨细胞,从而促进骨组织的愈合和修复[17]。与健康人的BMSCs相比,糖尿病患者的BMSCs的成骨分化能力明显降低[18]。因此,提高BMSCs的骨向分化能力是促进糖尿病患者种植体骨整合的关键要素。研究表明,MYDGF能够通过抑制破骨细胞的形成和促进成骨细胞的分化来保护骨量[7]。本实验的研究结果同样表明,MYDGF能够促进高糖环境中BMSCs的成骨分化。
本实验证实了MYDGF能够显著升高高糖环境中BMSCs的ALP活性。作为早期成骨标志物,ALP活性的增高说明BMSCs正在向成骨细胞分化[19]。OSX是成骨细胞特异性表达的转录因子,RUNX2是早期成骨标志物;而COL-I参与调控成骨过程中细胞外基质的分泌和矿化,是OSX和RUNX2成骨过程中的下游调控靶点[20, 21]。因此,本实验选择OSX、RUNX2和COL-I作为BMSCs的靶基因,来验证各组BMSCs的成骨分化水平。本实验RT-qPCR结果表明,高糖环境能够下调BMSCs 的成骨相关基因(OSX、 RUNX2和COL-I)的表达,而加入MYDGF后,OSX、 RUNX2和COL-I的mRNA表达水平均出现上调,说明MYDGF能够弥补高糖环境对BMSCs成骨分化的负面影响。
Wnt/β-catenin信号通路是参与骨形成的重要调控通路[22]。GSK3β是经典Wnt通路上游的负性因子,GSK3β磷酸化水平在Wnt 通路被激活时升高,从而抑制 β-catenin 的降解,导致β-catenin在胞质中堆积,随后积聚入核后调控基因的转录[23]。对于糖尿病机体而言,局部组织细胞处于高糖环境下,Wnt/β-catenin信号通路在其中仍有重要作用。Zhang等[24]研究发现,高糖环境能够抑制β-catenin,从而影响干细胞的增殖、迁移等能力。此外,Deng等[25]研究表明,Exendin-4抑制糖尿病小鼠骨丢失的能力与Wnt/β-catenin信号通路有关。本实验结果表明,高糖环境下p- GSK3β和β-catenin的蛋白表达水平降低,而MYDGF显著增加了高糖环境中p-GSK3β和β-catenin的蛋白水平;在添加通路抑制剂Dkk1后,MYDGF促进p-GSK3β和β-catenin的蛋白表达能力下降,表明Wnt/β-catenin信号通路受到抑制。进一步证实MYDGF促进高糖环境中BMSCs的成骨分化作用可能与Wnt/β-catenin信号通路的激活有关。
综上所述,本实验发现MYDGF在体外能够促进高糖环境中BMSCs的成骨分化,且这一效应可能与Wnt/β-catenin信号通路的激活有关,但其具体机制尚需进一步研究。
