铁苋菜对RAW 264.7细胞NLRP3及炎症因子表达的影响
2023-07-08樊艺萌王惠茹魏媛媛张艳楠郝智慧
尕 玉,樊艺萌,王惠茹,魏媛媛,张艳楠,郝智慧
(中国农业大学 动物医学院,北京 100193)
溃疡性结肠炎 (ulcerative colitis,UC) 是一种以腹泻、脓血便、腹痛、发热和体质量减轻为临床症状的慢性非特异性肠道炎症性疾病,主要发生于结肠的黏膜层和黏膜下层[1]。肠道免疫系统失调及肠屏障功能改变可能是导致UC发生的主要原因[2],但其发病机制尚未明确。目前针对UC还没有特异性的治疗措施,临床用药,包括皮质类固醇、氨基水杨酸盐和抗生素[3-4],以缓解症状为主要原则,这些药物不仅成本较高,且患者使用后常出现不良反应,不能根治及杜绝溃UC的复发。中药(Chinese traditional medicine,CTM)具有成分多样、疗效稳定、作用温和持久及毒性和不良反应小等优点,使得CTM在治疗一些顽疾方面往往具有西药不可替代的优势。网络药理学是一种基于药物、疾病的相关靶点基因以及蛋白质相互作用网络的系统分析方法。能够从整体角度揭示药物的作用机理、协同作用和动态特征,这些特征与中医治疗整体理论的特征相一致,为中药药理的发展提供理论指导。
铁觅菜(AcalyphaaustralisL.,AAL)为大戟科铁觅菜属铁觅菜的干燥全草,性凉、味苦涩,具有抗炎镇痛活性[5]。《内经》云:“苦能燥湿”“涩能固泻”,故民间常用于止血、止痢、止泻。现代药理学研究表明其具有抗腹泻、抗UC、抗菌、抗病毒、止血、止咳祛痰、平喘等多种作用[6-7]。AAL常用于腹泻的治疗,但其抗UC的药理、药效及机制的研究极少。已有研究表明,AAL水提物可以减轻TNBs诱导的大鼠UC模型中腹泻与便血率,降低炎性细胞浸润和MPO酶、SOD的水平[8-9],且通过抑制iNOS基因的表达减少NO过量生成[10-11]。
因此,本研究采用中药网络药理学结合脂多糖(lipopolysaccharide,LPS)诱导RAW 264.7细胞炎症模型的方法共同探讨AAL治疗UC的作用机制。以LPS刺激RAW 264.7巨噬细胞增殖,构建体外炎症模型,研究AAL对炎症小体NLRP3和炎症因子的影响。通过检测炎症因子、NLRP3相关蛋白和mRNA表达水平,探讨AAL治疗UC可能参与的信号通路与分子机制。
1 材料与方法
1.1 主要试剂AAL,2021年8月采自浙江丽水,经中国医学科学院药用植物研究所鉴定为大戟科铁苋菜属植物铁苋菜(AcalyphaaustralisL.);盐酸小檗碱 (国药准字:H61021392),陕西颐生堂药业有限公司,规格0.1 g/片;DMEM高糖培养基 (A1370801)、胎牛血清 (16140071),LPS (L8880,纯度>98%)、Calcein-AM/PI试剂盒 (CA1630)、总蛋白提取试剂盒(强) (BC3710)、BCA蛋白浓度测定试剂盒 (PC0020 )均购自北京索莱宝科技有限公司;GoScriptTM反转录试剂盒 (A6001,00987373) 购自普洛麦格(北京)生物技术有限公司;预染蛋白Marker (26617)购自赛默飞世尔科技(中国)有限公司;ECL 显影液 (GNWB-006,202307)购自北京京北日晟生物有限公司;TaKaRa Custom Oligo DNA/RNA (5015)购自TaKaRa Bio Inc (Japan)有限公司。
1.2 主要仪器倒置荧光显微镜 (Olympus公司,型号:DP74);CO2培养箱 (上海亿恒科学仪器有限公司,型号:BPN-80CRH(UV));PCR仪 (Bio Red公司,型号:T100TM);实时荧光定量PCR系统 (BIO-RAD公司,型号:CFX96TM);垂直电泳转印系统 (BIO-RAD公司,型号:PowerPacTMBasic);凝胶成像仪 (Cytiva公司,型号:Image Quant 800);多功能酶标仪 (Tecan公司,型号:INFINITE M NANO)。
1.3 AAL及UC相关靶点的获取通过阅读文献获得AAL中含有的化学成分,根据化源网 (https://www.chemsrc.com/) 进行CAS号的转换。将转换所得的唯一CAS号输入PubChem数据库 (https://pubchem.ncbi.nlm.nih.gov/),收集相应的2D结构图及SMILES号。再通过结构图及SMILE号进行ADME (http://www.swissadme.ch/) 筛选,获得活性化合物,筛选条件为肠胃吸收(gatrointestinal absortion;GIabsortion)为 “High”,且5种类药性预测 (Lipinski、Ghose、Veber、Egan、Muegge) 结果中有2个及以上为 “Yes”。在 SWISS Target Prediction (http://www.swisstargetprediction.ch/) 平台对活性化合物进行靶点预测,最终获得铁苋菜的相关靶点。
使用人类基因数据库 (GeneCards,https://www.genecards.org/) ,OMIM数据库(https://omim.org/),药物靶点数据库(DRUGBANK,https://go.drugbank.com/) 和治疗靶点数据库(TTD,http://db.idrblab.net/ttd/)以 “ulcerative colitis” 为关键词获得UC相关的靶点。
利用VENNY 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)对以上获得的中药靶点与疾病靶点取交集,获得的靶点被认为是AAL在治疗UC中的潜在靶点,并绘制韦恩图(Venn)图,然后利用Cytoscape 3.8(http://www.cytoscape.org/)软件分析获得Degree值,绘制“铁苋菜-成分”网络图。
1.4 蛋白质-蛋白质相互作用(PPI)将交集靶点输入STRING数据库 (https://string-db.org/),来识别可能的蛋白质间相互作用。为了提高所获得数据库的可靠性,对蛋白质-蛋白质相互作用进行了进一步过滤,最小交互作用得分为0.40,筛选后的蛋白质-蛋白质相互作用用于网络构建和分析。使用Cytoscape构建PPI网络,使用网络分析仪计算 “度” (degree) 等参数。
1.5 GO功能富集分析和KEGG途径富集分析根据Cytoscape构建的PPI网络,按Degree大小排序,取前20个靶点作为核心靶点,进行KEGG和GO分析。将核心靶点导入基因注释和分析数据库(David,https://david.ncifcrf.gov/) 中,将Analysis as species设置为H.sapiens,保存AAL治疗UC的GO分析和KEGG通路分析结果。通过筛选获得GO分析和KEGG通路分析中排名前20的结果,并绘制富集气泡图以及柱状分析图。
1.6 细胞培养、LPS配制及AAL处理RAW 264.7巨噬细胞用含10% FBS、1%双抗的DMEM高糖培养液于37℃、5% CO2的细胞培养箱中培养,并取对数生长期时的细胞用于实验。LPS用磷酸缓冲盐溶液(phosphate buffered saline,PBS)配成可稳定保存的质量浓度为1 g/L的均匀溶液,并用不含有10% FBS的完全培养液稀释到1 mg/L用于后续试验。选用LPS刺激RAW 264.7巨噬细胞建立的焦亡炎性增殖模型作为本次的试验模型。
选取新鲜的铁苋菜,除去根茎,洗净晾干,在超净工作台内紫外线照射20 min。取一干净、灭菌的研钵,放入少许灭菌处理过的石英砂,将紫外线处理后的AAL放入研钵中充分研磨,用4层纱布挤压过滤得到AAL滤液(表1),得到的滤液浓度定义为1 g/mL,经0.22 μm水膜过滤后,保存于-20℃,取不含有10%FBS的细胞培养液进行后续稀释。
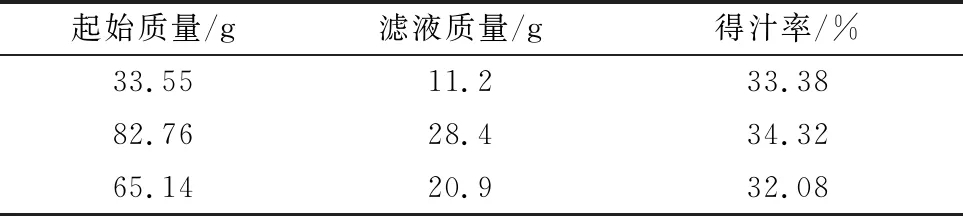
表1 AAL得汁率
1.7 细胞分组与处理将RAW 264.7细胞分为空白对照组(C)、LPS组(LPS)、阳性药物组(B)、AAL高剂量组(AAL-H)、AAL中剂量组(AAL-M)、AAL低剂量组(AAL-L)。待细胞长至80%~90%汇合状态时,各组进行如下处理:对照组,加入维持培养基(10% FBS)作用于细胞24 h;LPS组,加入1 mg/L 的LPS作用于细胞24 h;阳性药物组,同时加入1/2 体积1 mg/L 的LPS和1/2 体积20 mg/L 小檗碱(BBR)作用于细胞24 h;铁苋菜给药组,同时加入1/2 体积1 mg/L 的LPS和1/2 体积不同质量浓度的AAL作用于细胞24 h。
1.8 CCK8法检测细胞活力将细胞按照每孔1×104/个接种于96孔培养板中,每孔100 μL,并分为空白对照组和不同浓度LPS组,每个组设置6个重复孔。各组细胞培养24 h后,弃去上清,除空白对照孔外,其余每孔加入100 μL不同质量浓度LPS溶液(10.0,5.0,1.0,0.5,0.1 mg/L),继续培养24 h。每孔加入100 μL CCK8溶液(10%),避光孵育2.5 h 后,酶标仪上于波长450 nm处测定各孔吸光度(D450)值。
将细胞按照每孔1×104/个接种于96孔培养板中,并分为对照组和不同浓度AAL+LPS组(LPS浓度根据CCK8实验结果选择),每组设置6个复孔。药物处理组分别同时加入50 μL不同质量浓度AAL(900,800,700,500,400,200,100,50,10,1 mg/L)及50 μL 1 mg/L的LPS培养24 h。每孔加入100 μL CCK8溶液(10%),避光孵育2.5 h后,酶标仪上于波长450 nm处测定各孔吸光度(D450)值。重复以上试验3次。
1.9 Calcein-AM/PI活/死细胞染色法检测细胞活力将RAW 264.7细胞按照每孔1×105/个接种于24孔板中,每孔500 μL。用1× Assay Buffer充分清洗细胞2~3次,之后每孔加入500 μL染色工作液。工作液配法:取5 μL钙黄绿素-AM(Calcein-AM)溶液和15 μL碘化丙啶(PI)溶液加入5 mL 1× Assay Buffer,37℃孵育15 min,荧光显微镜下使用(490±10)nm 激发滤片同时检测活细胞(黄绿色荧光)以及死细胞(红色荧光)。
1.10 RT-qPCR检测细胞中NLRP3、GSDMD、Caspase-1、ASC、IL-1β、IL-18、MUC-2和OCLN的mRNA的表达将RAW 264.7细胞按照每孔1×106/个接种于6孔板中,每孔2 mL,细胞分组及处理同1.7;用PBS清洗3次,每孔加入500 μL TRIzol,室温裂解5 min,收集细胞裂解液于1.5 mL无酶离心管中;向离心管中加入200 μL氯仿,振荡30 s,室温静置3 min;12 000 r/min离心10 min,取上清;加入等体积异丙醇,混匀,室温静置10 min;12 000 r/min离心10 min,弃上清;加入1 mL预冷75%乙醇;10 000 r/min离心5 min,弃上清;将离心管倒扣5 min,加入20~50 μL无菌水,获得RNA。按照逆转录试剂盒说明书,以RNA为模板进行反转录,得到cDNA。用表2中引物进行扩增。扩增程序:95℃预变性120 s;95℃变性5 s,64℃退火30 s;40个循环。以GAPDH为内参照基因,采用2-ΔΔCt法计算NLRP3、GSDMD、Caspase-1、ASC、IL-1β、IL-18、MUC-2和OCLN mRNA的相对表达量。重复以上试验3次。

表2 RT-qPCR引物与探针序列相关信息
1.11 Western blot检测细胞中NLRP3、GSDMD、Caspase-1和ASC蛋白的表达将RAW 264.7细胞按照每孔1×106/个接种于6孔板中,每孔2 mL。收集细胞提取蛋白并用BCA蛋白定量检测试剂盒测定蛋白质量浓度。通过SDS-PAGE分离蛋白,将蛋白转移至PVDF膜上,用5%的脱脂奶粉封闭液在室温下封闭2 h,分别孵育NLRP3、GSDMD、Caspase-1、ASC和β-actin(1∶1 000)抗体,4℃过夜。用TBST缓冲液洗膜3次,每次15 min,在室温下孵育相对应的二抗2 h,用TBST缓冲液洗膜3次,每次15 min,用ECL化学发光法曝光。使用Image J软件分析条带灰度值。重复以上试验3次。
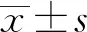
2 结 果
2.1 AAL中药活性成分和靶点筛选文献报道的AAL成分共66个,经ADME筛选保留其中29个活性成分,对以上成分进行靶点预测时发现,共有6个成分 ((-)-Epicatechin,(-)-Gallocatechin,Cianidanol,(+)-Gallocatechin,(-)-Epicatechin,(+)-Epicatechin)无法预测靶点,其余23个成分共预测出359个靶点。构建“AAL-有效成分”网络图(图1A),将有效成分按Degree值排序,前4分别为槲皮素,5,7,4c-三羟(基)黄酮、黄芩素和柚皮素。
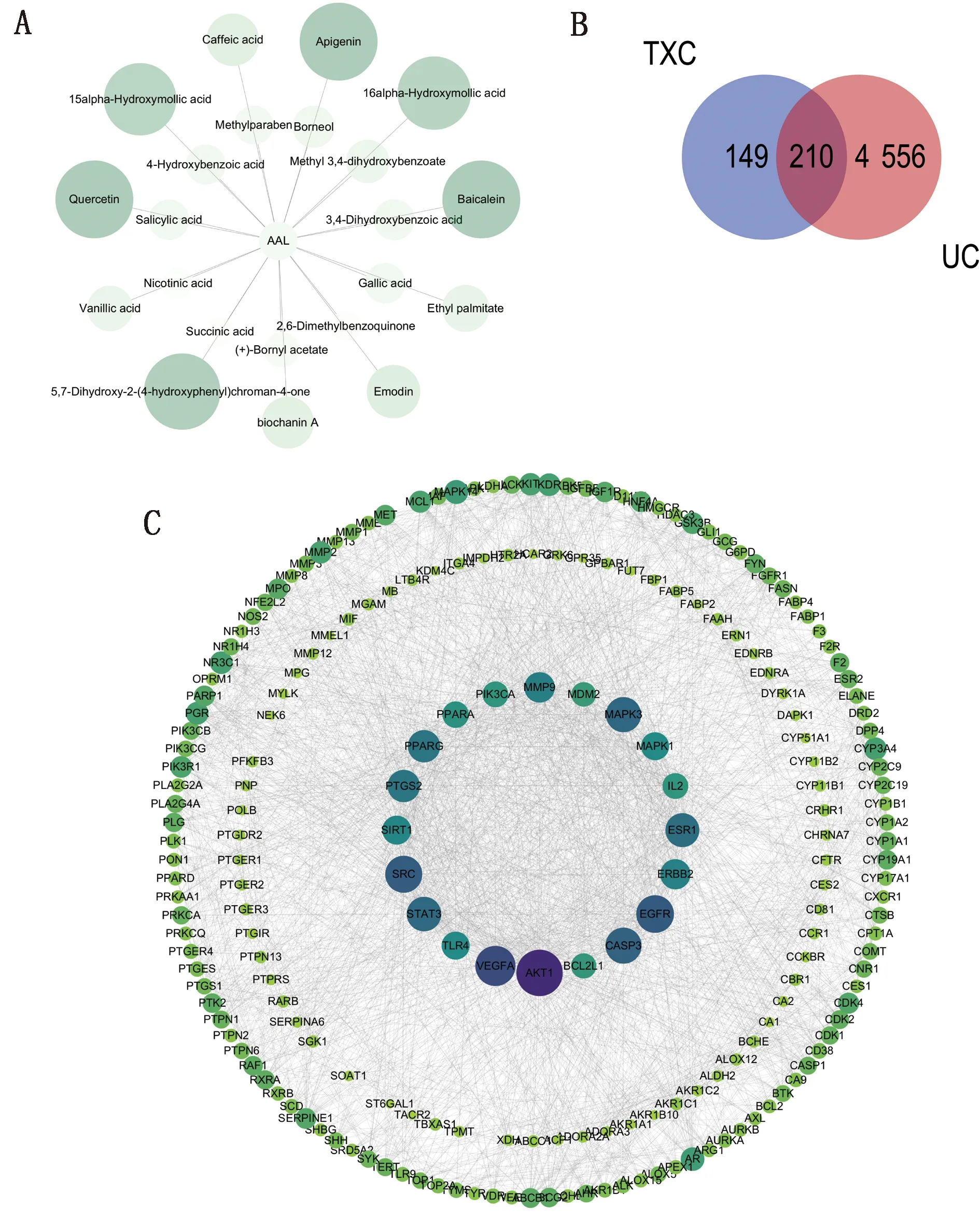
图1 AAL治疗UC的潜在靶点分析
通过疾病数据库一共获得4 766个UC相关靶点,取交集后获得210个交集靶点(图1B)。由PPI网络图(图1C)可知AAL最有可能通过交集靶点中的AKT1,VEGFA,EGFR,SRC,CASP3,MAPK3等发挥抗UC的作用。
2.2 AAL治疗UC的靶点GO及KEGG分析将AAL治疗UC的核心靶点导入David数据库进行功能分析与通路富集分析,进行GO功能分析,共获得生物过程(biological process,BP)247个,主要涉及:RNA聚合酶Ⅱ启动子转录的正调控,凋亡过程的负调控,基因表达的正向调节,细胞增殖的正向调节,DNA模板转录的正调节,信号传输;细胞组份(cellular component,CC)27个,主要涉及:细胞质,细胞核,核浆,质膜;分子功能(molecular function,MF)45个,主要涉及:蛋白结合,相同蛋白结合,酶结合。将各功能排名前10的BP、CC及MF绘制成柱状图(图2A)。根据富集程度和显著性,筛选出了排名前20的KEGG信号通路(图2B),主要涉及癌症中的通路,癌症中的蛋白聚糖,癌症中的微小核糖核酸,脂质和动脉粥样硬化,人巨细胞病毒感染,PI3K-Akt信号通路等与治疗UC有关的通路。并通过Cytoscape构建“中药-靶点-信号通路-疾病”网络图(图2C)。
图2 AAL治疗UC的GO、KEGG分析及“中药-靶点-信号通路-疾病”网络图
2.3 AAL抑制LPS诱导的RAW 264.7巨噬细胞活力的增加与空白对照组相比,RAW 264.7细胞受到LPS (10,5,1 mg/L) 刺激后,细胞活力均显著升高 (P<0.01),证明炎症模型造模成功。后续试验中选择最低有效质量浓度1 mg/L作为造模剂量。
如图3所示,与对照组相比,AAL给药组呈现低浓度促进RAW 264.7细胞增殖,高浓度抑制RAW 264.7细胞增殖的效果,其中给予900,800,700 mg/L AAL处理后,RAW 264.7细胞活力下降(P<0.01),表明巨噬细胞增殖受到显著抑制。后续试验中选用有效抑制浓度900,800,700 mg/L分别作为AAL高、中、低剂量组给药浓度。
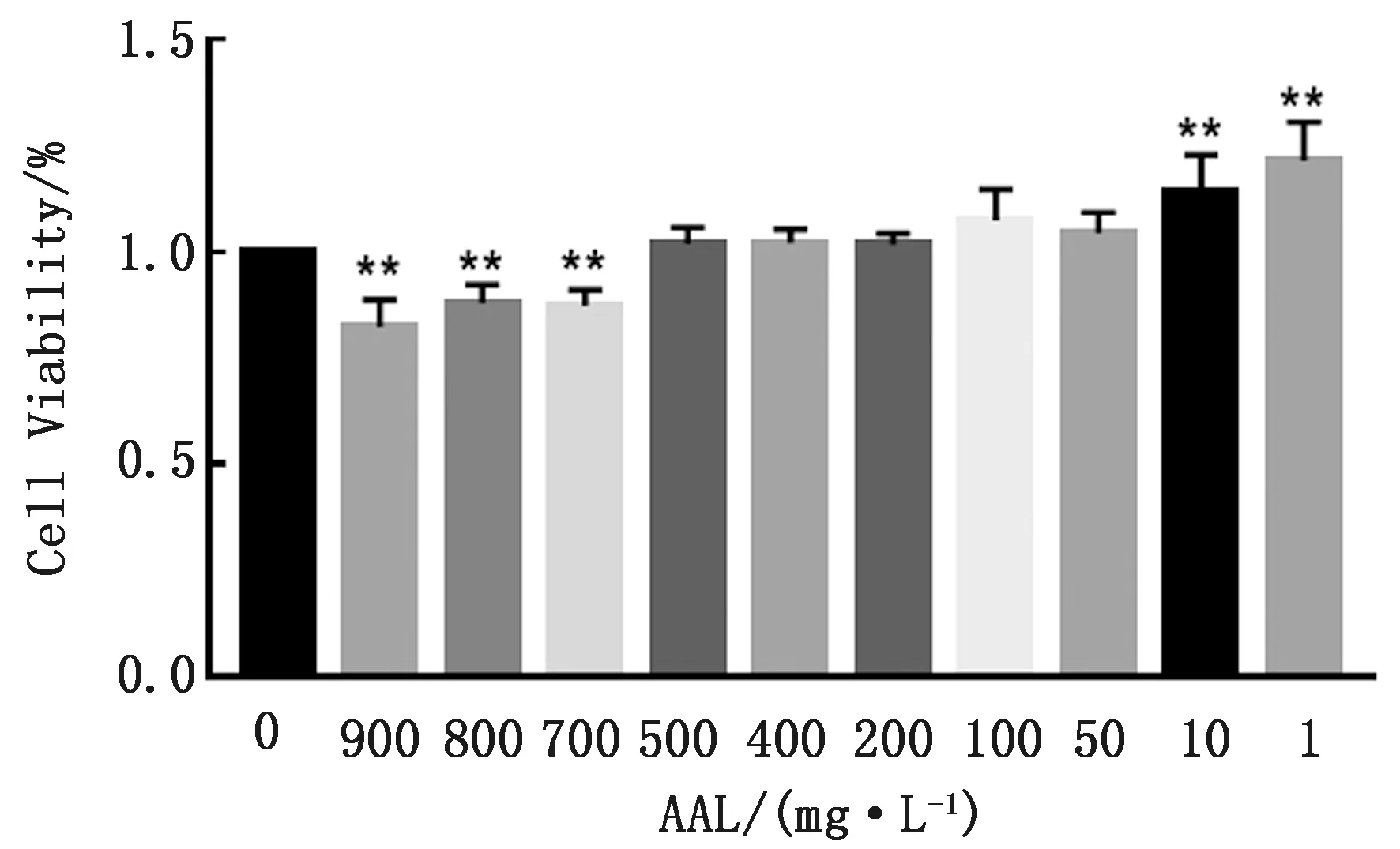
图3 不同浓度AAL与LPS处理后的RAW 264.7细胞活力
2.4 AAL降低LPS诱导的细胞的凋亡采用Calcein-AM/PI活/死细胞染色法测定活细胞比率,其中红色荧光代表凋亡细胞,绿色荧光代表活细胞。结果如图4所示,与空白对照组相比,LPS组红色荧光增多,活细胞比率显著降低,证明LPS可诱导细胞大量凋亡。与LPS组相比,小檗碱组和AAL低、中、高剂量组的红色荧光明显减少,绿色荧光增多,表明盐酸小檗碱与AAL均可以恢复由LPS造成的细胞凋亡(P<0.01),并且AAL对凋亡的抑制作用呈剂量依赖性增强。
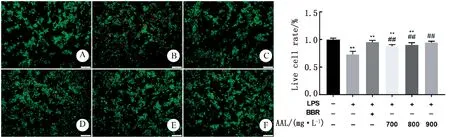
A.对照组;B.LPS处理组;C.BBR组; D~F.分别为AAL低、中、高剂量组。柱状图是对图A~F中活细胞比率的定量分析结果。**P<0.01,与空白对照组差异极显著;##P<0.01,与LPS组差异极显著。下同
2.5 AAL对LPS诱导的RAW 264.7巨噬细胞IL-1β和IL-18的mRNA 表达的影响与对照组相比,LPS造模组IL-1β和IL-18-RNA所表达水平均显著升高 (P<0.01);与LPS组相比,AAL低、中、高剂量的IL-1β和IL-18 mRNA水平显著下降 (P<0.01)(图5)。
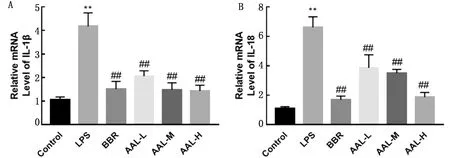
图5 AAL对LPS诱导RAW 264.7巨噬细胞IL-1β(A)和IL-18(B) mRNA 表达的影响
2.6 AAL对LPS诱导的RAW 264.7巨噬细胞NLRP3,GSDMD,Casp1和ASC的mRNA表达的影响RAW 264.7细胞中炎症小体NLRP3相关基因 (NLRP3,GSDMD,Casp1和ASC)的表达结果见图6。与对照组相比,模型组中RAW 264.7巨噬细胞NLRP3、GSDMD、Casp1和ASC的mRNA表达显著升高 (P<0.01);盐酸小檗碱及高、中、低剂量AAL处理后以上基因表达量与模型组相比均显著降低 (P<0.01)。
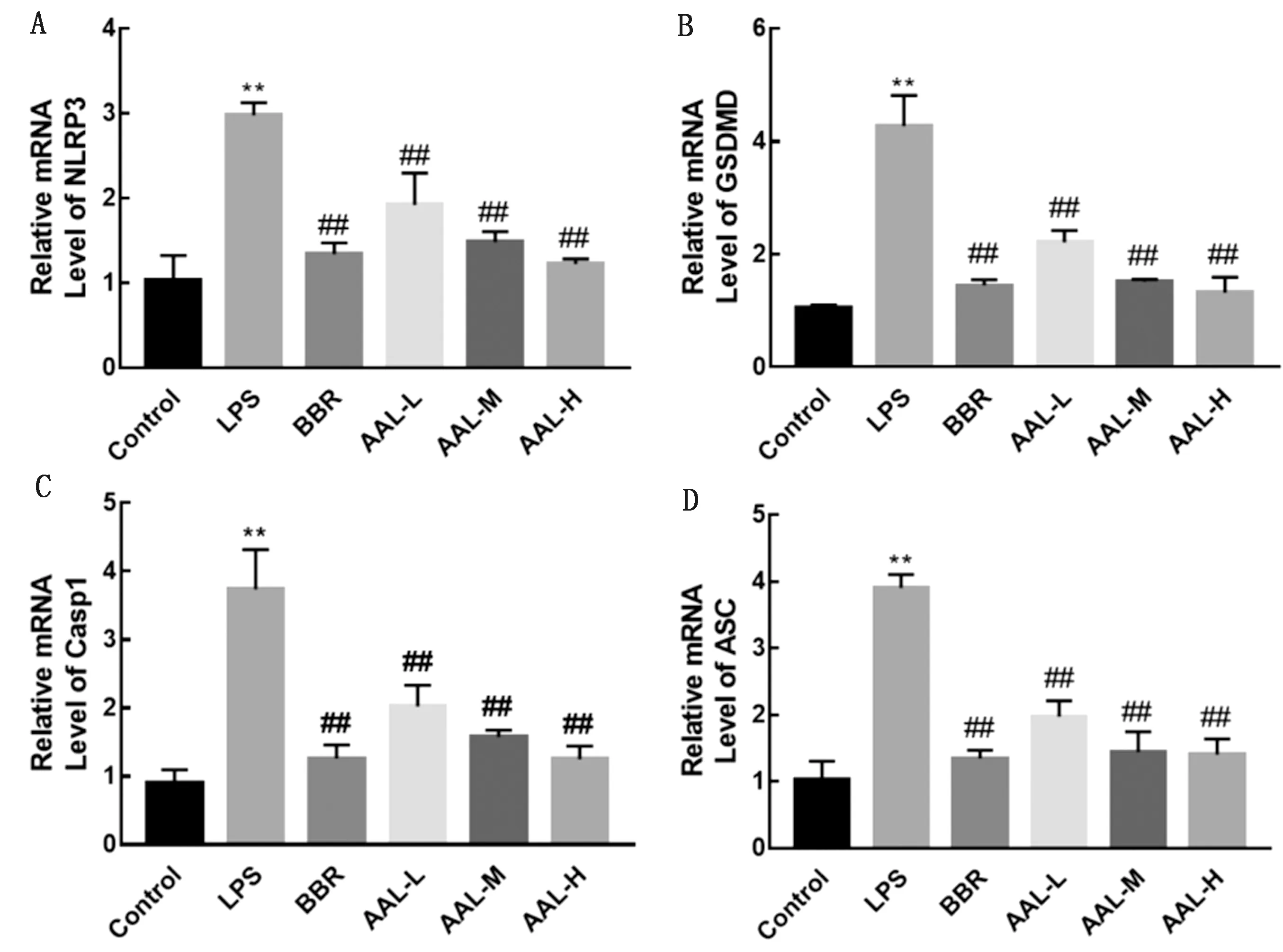
A~D.NLRP3、GSDMD、Caspase-1和ASC的mRNA 表达水平
2.7 AAL对LPS诱导RAW 264.7巨噬细胞NLRP3,GSDMD,Caspase-1,Pro-caspase-1和ASC蛋白表达的影响基于以上试验结果,对aal对LPS诱导RAW 264.7巨噬细胞NLRP3、GSDMD、Caspase-1、Pro-caspase-1和ASC蛋白表达的影响进行了研究。与对照组比较,LPS组NLRP3、GSDMD、Caspase-1、Pro-caspase-1和ASC的蛋白表达水平均显著升高 (P<0.01);小檗碱组和AAL低、中、高剂量组与LPS造模组比较,以上指标均显著下调 (P<0.01)(图7)。
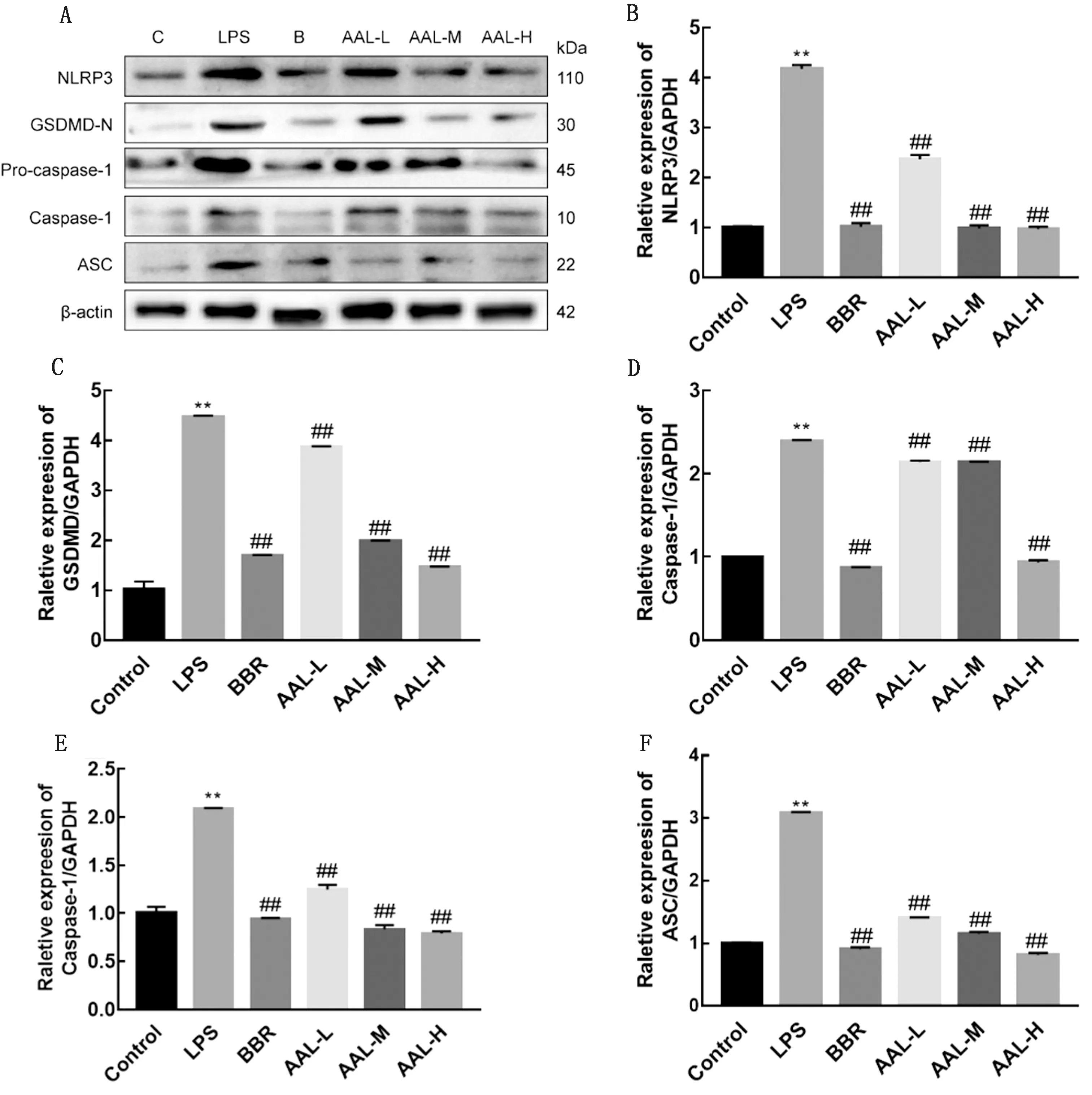
A.NLRP3、GSDMD-N、Pro-caspase-1、Caspase-1和ASC的蛋白表达水平;B~F.分别为NLRP3、GSDMD、Caspase-1、Pro-caspase-1和ASC 蛋白表达量化结果
2.8 AAL对LPS诱导RAW 264.7巨噬细胞OCLN和MUC-2 mRNA 表达的影响从MUC-2和OCLN 2个蛋白的基因角度研究了AAL是否可以调节LPS诱导的肠屏障损伤。LPS组与对照组相比,OCLN和MUC-2的mRNA表达均显著下降 (P<0.01);小檗碱组和低、中、高剂量AAL组与LPS造模组比较,以上指标均显著升高 (P<0.01)(图8)。

图8 AAL对LPS诱导RAW 264.7巨噬细胞OCLN(A)和MUC-2(B)mRNA 表达的影响
3 讨论
AAL广泛分布于美洲、非洲和亚洲的热带和亚热带地区的路边和农田[12],国内常将其用于止血、止痢、止泻,且发现AAL对治疗慢性结肠炎具有较好的效果[13-14]。据报道,AAL治疗人慢性结肠炎的总有效率达到96.4%[4]。但其中的具体机制尚不明确。通过网络药理学分析发现AAL治疗UC潜在活性成分主要为槲皮素、5,7,4c-三羟(基)黄酮、黄芩素、柚皮素等。有关研究发现槲皮素可通过上调SIRT1表达,抑制NLRP3促炎反应,提高M2型巨噬细胞介导的抗炎和促神经恢复作用,改善实验性巨结肠大鼠结肠炎性损伤[15]。按照DPPH方法测试5,7,4c-三羟(基)黄酮的自由基清除活性(FRSA),结果显示其抗氧化活性呈剂量依赖性[16]。黄芩素通过miR-192-5p/TXNIP轴抑制NLRP3/Caspase-1通路减轻高脂血症性胰腺炎的细胞焦亡和炎症[17]。柚皮素通过miR-22抑制NLRP3炎症小体并减轻UC大鼠模型肠屏障损伤[18]。在PPI蛋白互作结果中可知,AKT1,VEGFA,EGFR,SRC,CASP3,MAPK3的节点较大,推测这些节点可能是治疗UC的主要靶点。通过David数据库进行GO以及KEGG富集分析,主要涉及凋亡过程的负调控及PI3K-Akt信号通路等过程。提示AAL治疗UC的潜在作用机制多集中在影响细胞增殖、转移以及凋亡等生物过程。
小檗碱是一种异喹啉类生物碱,从传统中药黄连中提取而来[19],早在1977年就有报道称小檗碱能抑制霍乱毒素所致的炎症反应[18],近年来研究表明小檗碱可以通过多种信号途径发挥其抗炎作用并且效果显著[20-21]。故在本研究中,利用LPS诱导体外炎症模型,并使用小檗碱作为阳性对照药物,初步确定了AAL抗炎作用的效果以及通过NLRP3炎症小体发挥抗炎作用的机制。
巨噬细胞作为炎症反应中的关键细胞,通过释放多种促炎细胞因子和介质防止病原体入侵。LPS是常见的炎症介导因子,通过诱导巨噬细胞中许多促炎介质的表达而充当炎症的有效引发剂[13]。在LPS诱导的巨噬细胞炎症模型中,细胞外LPS被Toll样受体4(toll like receptor 4,TLR4)识别,导致大量促炎因子产生,诱导炎症反应[22-23]。本研究发现,使用10.0,5.0,1.0,0.5 mg/L的LPS处理小鼠RAW 264.7细胞后,细胞活力均显著升高 (P<0.05),这与研究报道结果一致[23-24],表明LPS诱导不同程度的炎症反应,本试验选用最低有效浓度1 mg/L作为后续试验造模浓度。使用900,800,700 mg/L 的AAL滤液处理可以显著降低经LPS处理后的细胞活力 (P<0.01),减轻LPS刺激的RAW 264.7巨噬细胞炎症反应。同时本研究通过Calcein-AM/PI染色发现,与对照组相比,LPS处理后活细胞比率下降,AAL预处理后活细胞比率升高,表明LPS在刺激巨噬细胞增殖的同时会造成细胞损伤死亡,而AAL可以逆转这一现象。这可能与LPS激活NLRP3炎症小体有关。因此本研究通过检测NLRP3炎症小体相关mRNA及蛋白表达,进一步探究了AAL滤液减轻炎症的分子机制。
炎症小体包括NLRP1、NLRP3、NLRC4、AIM2、NLRP6等亚型,其中NLRP3是研究最为全面的亚型之一,正迅速成为肠道内稳态和肠道炎症反应的重要调节因子。巨噬细胞识别病原体相关分子模式 (pathogen-associated molecular patterns,PAMPs) 信号,并通过模式识别受体 (pattern recognition receptor,PRR) 启动炎症反应,TLR4通过识别LPS进一步激活NLRP3,NLRP3受到损伤相关分子模式 (damage associated molecular patterns,DAMPs) 信号刺激,与ASC和Pro-caspase-1组装成活性NLRP3炎症小体复合物,释放成熟的Caspase-1,后者将GSDMD切割为C端和N端,GSDMD-N端片段与质膜结合诱导细胞焦亡,死亡细胞大量释放IL-1β和IL-18,导致炎症发生[25-27]。本研究发现,与空白对照组相比,LPS处理后小鼠RAW 264.7巨噬细胞中NLRP3、GSDMD-N、ASC、Pro-caspase-1、Caspase-1的mRNA水平和蛋白表达水平显著上升,IL-1β和IL-18的mRNA水平显著增加,与JIE等[27]研究结果一致,提示NLRP3/Caspase-1通路的异常激活参与LPS诱导的炎症。用不同浓度的AAL预处理细胞,研究AAL对NLRP3炎症小体和炎症的影响,发现AAL可以降低Caspase-1焦亡途经中关键基因的mRNA和蛋白表达水平,提示AAL可能通过抑制NLRP3/Caspase-1信号通路抑制细胞焦亡,降低炎性细胞因子水平,发挥抗炎作用。
在各类炎症反应中,肠道炎症参与多种疾病进展。肠黏膜屏障对于维持肠道内稳态、抵御病原微生物入侵有关键作用。MUC-2由杯状细胞分泌,是小肠黏液的主要成分之一,对肠上皮细胞有保护和润滑作用。Occludin是一种紧密连接蛋白,对于维持肠道屏障的完整性和功能具有重要意义[28-29]。本研究发现,与对照组相比,LPS处理显著下调了OCLN和MUC-2的mRNA表达水平,AAL处理后显著提高了MUC-2和OCLN的mRNA表达水平,表明AAL可以减轻LPS诱导的肠黏膜屏障损伤,提示AAL可以通过维持肠黏膜屏障减轻炎症反应。
综上所述,通过LPS建立的体外炎症模型中,AAL具有显著抗炎作用,其作用机制可能与抑制NLRP3/Caspase-1信号通路的关键基因有关,从而降低炎症因子的释放。表明AAL可以为炎症性疾病提供新的治疗策略。
