ROCK2-shRNA转染对VaD大鼠海马神经元的保护作用*
2023-07-07向军军秦红玲卢健锋杨璧璘邓秋媚陈炜胡跃强
向军军 秦红玲 卢健锋 杨璧璘 邓秋媚 陈炜 胡跃强
(1.广西中医药大学第一附属医院,广西 南宁 530023;2.南宁市第一人民医院,广西 南宁 530023;3.广西贺州市中医医院,广西 贺州 530023;4.广西中医药大学,广西 南宁 530023)
血管性痴呆(Vascular dementia,VaD)已成为了继阿尔茨海默病后最常见的痴呆类型[1-2],然其具体发病机制尚未明了,目前认为神经元和突触可塑性损伤可能是导致学习、记忆及认知功能障碍的关键因素[3]。
研究[4-6]表明,Ras同源基因实验成员(Ras homolog gene family member A, RhoA)/Rho关联卷曲螺旋蛋白激酶2(Rho-associated coiled coil-forming protein kinase 2,ROCK2)通路是参与大脑神经轴突再生和神经功能恢复的关键通路,而ROCK2表达变化与炎症诱导的突触可塑性损伤密切相关。因此,干预ROCK2基因表达有望成为治疗VaD的新靶点。使用腺相关病毒(Adeno-associated virus,AAV)载体表达短发夹架构RNA(Short hairpin RNA,shRNA)能够长效敲低基因,具有特异、高效等优点,且通过血脑屏障效率高,逐渐成为神经系统疾病实验研究的新热点[7]。本研究探讨AAV9-ROCK2-shRNA对VaD大鼠海马神经元的保护作用,探索一个适宜的腺相关病毒注射滴度,以期实现对VaD的精准治疗。
1 材料与方法
1.1 试验试剂及器材 腺相关病毒原液AAV9-ROCK2-shRNA(由上海吉满生物科技有限公司提供);水合氯醛(天津市大茂化学试剂厂,批号302-17-0);苏木精-伊红染色试剂盒由索莱宝有限公司提供;Morris 水迷宫视频分析系统(上海软隆科技发展有限公司,型号BW-MMM101);光学显微镜(日本Olympus公司,IX73型)大鼠脑立体定位仪(日本成茂公司)。
1.2 实验动物及分组 成年SPF级健康雄性SD大鼠40只,体重250±50g,由湖南斯莱克景达物实验动物有限公司提供,动物许可证号:SCXK湘2019-0004。随机分为:正常组、PBS对照组(PBS液体代替病毒制剂)、低滴度组、中滴度组和高滴度组,每组8只,各组大鼠正常喂养,术后4周取材。实验过程中动物喂养及取材等操作均遵守实验动物管理和保护的有关规定。
1.3 方法
1.3.1 腺相关病毒稀释 AAV9-ROCK2-shRNA腺相关病毒原液的滴度为1.14E+13 VG/mL,按照2倍及10倍稀释,滴度分别为5.07E+12 VG/mL、1.14E+12 VG/mL。
1.3.2 脑立体定向注射 参照文献[8],采用双侧颈总动脉永久性结扎法制备VaD模型。造模后第2 d评估模型成功后,立即进行立体定位手术,给予注射低滴度、中滴度、高滴度腺相关病毒4 μL,持续5 min。注射位置:坐标(以前囟为0点)-皮质(前):向前1.0 mm,右侧旁开2.0 mm,深度1.2 mm;皮质(后)向后3.0 mm,右侧旁开1.5 mm,深度1.2 mm;海马:向后3.5 mm,右侧旁开2.5 mm,深度3.0 mm。PBS对照组则以生理盐水代替注射。
1.3.3 实验动物取材及处理 脑立体注射术后4周,以4%多聚甲醛经心脏灌流固定后,取海马组织,每组中4只行石蜡切片,用于HE染色和Nissl染色观察大鼠海马神经元形态改变及尼氏小体数量;另4只进行免疫组化观察炎症因子IL-1β蛋白表达情况及绿色荧光蛋白(Green fluorescent protein,GFP),并通过Image Pro Plus 6.0软件测量分析荧光强度。
1.3.4 转染效率计算 荧光显微镜下直接观察绿色荧光蛋白GFP)的表达,每张切片随机取10个100倍视野,计算GFP阳性细胞数占总细胞数的百分比,即为估算的转染效率。

2 结果
2.1 各组大鼠学习记忆能力比较 术前各组大鼠潜伏期及跨越平台次数比较,差异无统计学意义(P>0.05)。术后1周,与正常组比较,PBS对照组潜伏期显著延长、跨越平台次数明显减少(P<0.05);PBS对照组与低、中、高滴度相互之间比较差异无统计学意义(P>0.05)。术后4周,与正常组比较,PBS组潜伏期显著延长及跨越平台次数明显减少(P<0.05);与PBS组比较,中滴度组潜伏期缩短、跨越平台次数增加(P<0.05),低、高滴度组潜伏期及跨域平台次数差异无统计学意义(P>0.05);与中滴度组比较,低、高滴度组潜伏期延长、跨越平台次数减少(P<0.05)。与术前比较,术后1周的正常组潜伏期缩短、跨越平台次数增加(P<0.05),PBS对照组、低滴度、高滴度组潜伏期与跨越平台次数无明显差异(P>0.05);与术后1周比较,术后4周正常组、中滴度组潜伏期时间缩短、跨越平台次数明显增加(P<0.05),而PBS对照组、低滴度及高滴度组差异均无统计学意义(P>0.05)。术后1周与术前比较差异无统计学意义(P>0.05)。见表1。
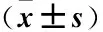
表1 各组大鼠Morris水迷宫跨越平台次数比较Table 1 Comparison of crossing platform times in Morris water maze in each group
2.2 各组HE染色比较 正常组海马区神经元排列紧凑、饱满、圆润,细胞核清晰;PBS对照组海马区神经细胞神经细胞排列散乱、稀疏,可见细胞核肿胀破裂,部分胞浆浓缩;低滴度组大鼠海马区神经元形态有明显改善,但细胞结构不清晰,可见胞膜破裂,仍稍有肿胀;中滴度组大鼠海马区神经元饱满、圆润,胞体较大且胞质丰富,细胞核清晰,排列紧凑;高滴度组海马组织区域结构出现明显异常增生及条索化,出现核固缩染色加深。见图1。

图1 4周后各组大鼠海马组织HE染色(100×)Figure 1 HE staining was performed on the hippocampal tissues of each group after 4 weeks注:A.正常组;B.PBS对照组;C.低滴度组;D.中滴度组;E.高滴度组。

图2 4周后各组大鼠海马组织Nissl染色(200×)Figure 2 After 4 weeks, Nissl staining was performed on the hippocampus of each group注:A.正常组;B. PBS对照组;C.低滴度组;D.中滴度组;E.高滴度组。
2.3 各组Nissl染色比较 正常组海马组织中尼氏小体结构排列整齐、紧密,且结构清晰;PBS对照组组织中尼氏小体排列散乱、尼氏小体数较正常组明显减少(P<0.05);与PBS组比较,低滴度组神经元仍稀疏松散、尼氏小体数量少差异均无统计学意义(P>0.05);与低滴度组比较,中滴度组中神经元结构完整、排列整齐,可见丰富的尼氏小体;与中滴度组比较,高滴度组海马神经元损伤程度增加、组织结构不清晰,尼氏小体变小,数目较中滴度明显减少(P<0.05)。
2.4 各组海马组织IL-1β表达情况比较 IL-1β阳性细胞胞浆呈棕黄色,背景为淡黄色。正常组海马区IL-1β棕色表达量少;与正常组比较,PBS对照组海马组织IL-1β蛋白含量高,在海马各区阳性表达多(P<0.001)。与PBS对照组比较,低、中、高组IL-1β表达明显减少(P<0.05);与中滴度比较,低、高滴度IL-1β表达增加,差异有统计学意义(P<0.05)。见图3。

图3 4周后各组大鼠海马区IL-1β表达情况(100×)Figure 3 Four weeks after each rat hippocampus IL-1 beta expression注:A.正常组;B. PBS对照组;C.低滴度组;D.中滴度组;E.高滴度组。
2.5 绿色荧光蛋白在海马组织中的表达 不同滴度的腺相关病毒转染脑组织4周后,均可在针道周围观察到少量GFP表达,其中阳性表达为相应荧光素标记的绿光。而在PBS对照组中则未见GFP表达。按照转染率计算法可得出:低滴度组腺病毒转染效率为(19.79±6.55) %,明显低于中、高滴度注射组(P<0.05);而与中滴度(28.55±4.22) %比较,高滴度注射组(22.52±8.94)%的转染效率较低,可见有细胞核破裂,形态不规则,差异有统计学意义(P<0.05)。见图4。
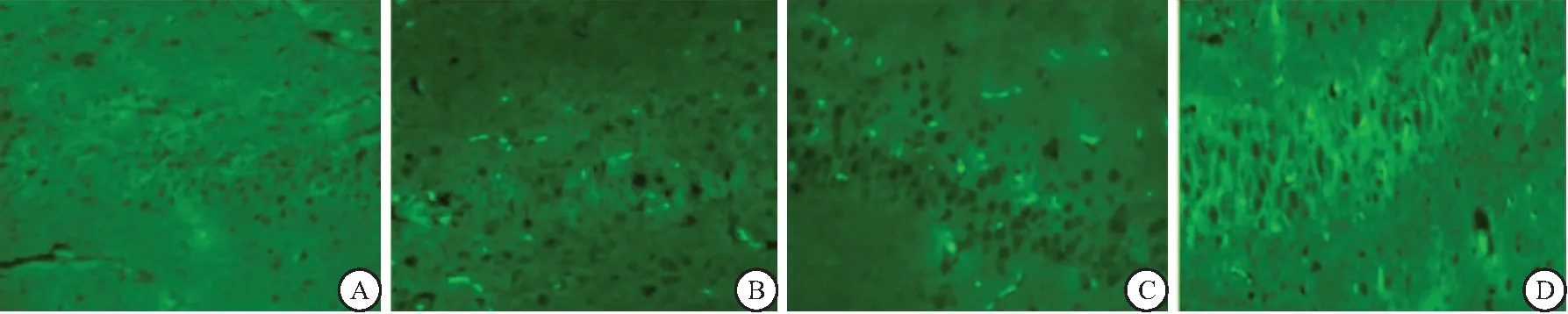
图4 各观察组转染后4周缺血脑组织GFP表达(荧光显微镜100×)Figure 4 Expression of GFP in ischemic brain tissue 4 weeks after transfection注:A. PBS对照组;B.低滴度组;C.中滴度组;D.高滴度组。
3 讨论
海马神经元炎症损伤作为VaD发生、发展的重要因素,已得到普遍认可[9];其中IL-1β作为炎症级联反应的重要因子,正常生理情况下,其在脑组织内的表达水平极低,而其高表达在神经炎症发生、发展和免疫反应中起重要作用[10]。研究[11]表明,在颅脑内IL-1β不仅参与中枢神经系统的发育和生长调节,也参与病理状态下的神经系统的损伤过程,如脑缺血、脑损伤、阿尔茨海默病等。大量分泌的IL-1β可通过多个环节参与神经元损伤,最主要是启动多种细胞因子级联反应[12]。文献[13]报道,增加的IL-1β可能参与大鼠记忆障碍和抑制长时程突触传递增强造成学习、记忆及认知障碍。有的研究[14-15]证实,IL-1β的释放受ROCK2的调控,因此,敲减或者沉默ROCK2的表达有可能抑制IL-1β的分泌,从而起到保护神经元的作用。本研究结果也证实ROCK2-shRNA中剂量组能显著减少IL-1β阳性细胞,改善大鼠智能。
AAV载体具有较高的安全性、低免疫原性、可持续表达等特性,近年来逐渐成为神经系统研究以及基因治疗的重要工具之一[16]。但由于载体转导效率的限制、脱靶和给药后中和抗体的产生等阻碍其进入靶细胞,降低转基因的表达效率,而高浓度的AAV病毒颗粒又可引发蛋白酶体介导的细胞降解和病毒颗粒的损失,降低其转染效率。除此之外,AAV在体内转导的表达时间也会对实验研究观察周期带来影响。因此,探索具有转染率高、安全性好、毒副作用少的适宜滴度是当前亟需解决的问题[17-19]。本研究采用低、中、高3种不同滴度的AAV9-ROCK2-shRNA进行观察,发现术后4周,各病毒注射组行为学、神经功能缺损及各项监测指标均有所改善,而以中滴度组疗效最为明显。这与周斌等[20]采用AVV9病毒观察对神经元保护作用的影响的研究结果有相似之处。
本研究结果提示,可知适宜的腺相关病毒滴度是影响转染效果的关键因素之一;当滴度太低,会造成转染不充分,造成转染率太低,影响效果;当滴度太高时,细胞会因毒性太大而出现神经元及周围组织损伤。本研究采用3种滴度证实不同滴度存在的效果差别,筛选出中滴度可作为适宜的注射滴度,并且在一定程度上证实AAV9-ROCK2-shRNA成功转染后可有效发挥其对海马神经元的保护功能,为后续研究RhoA/ROCK2信号通路对VaD大鼠的神经保护作用及机制提供了实验基础。
4 结论
中滴度AAV9-ROCK2-shRNA能高效、稳定、低毒地转染大鼠海马组织,对VaD大鼠海马神经元保护作用最优。
