茶树铝吸收和铝耐受研究进展
2023-07-06邱子豪宋钒孙彬妹刘少群郑鹏
邱子豪 宋钒 孙彬妹 刘少群 郑鹏
摘要:茶树(Camellia sinensis (L.) O. Kuntze)生长在热带和亚热带地区酸性(pH 4.0~5.5)土壤中,与大多数作物不同,它能够在高铝(Al)含量的土壤中存活,而且生长过程中需要吸收Al元素,因此被认为是一种能够超富集Al的植物。文章对茶树根部的Al吸收、Al在茎中的运输及叶片的贮存等相关过程进行了全面综述,同时分析了不同部位和細胞组成在Al富集方面的特性及茶树的多种Al耐受机制,并对未来的研究方向进行了展望,旨在为茶叶产业的可持续发展提供重要的理论依据和实践指引。
关键词:铝;茶树;土壤酸化;富集性;耐受性
中图分类号:S571.1 文献标识码:A 文章编号:1000-3150(2023)06-01-9
Abstract: Tea plant (Camellia sinensis (L.) O. Kuntze) prefers to grow in acidic (pH 4.0-5.5) tropical and subtropical regions. Unlike most crops, it is able to survive in soils with high aluminum content and requires aluminum uptake during its growth, thus being considered an aluminum hyperaccumulator. This article provided a comprehensive review of the aluminum uptake by tea plant roots, transportation in stems, and storage in leaves. It also analyzed the characteristics of aluminum accumulation in different parts and cellular components of the plants as well as multiple aluminum tolerance mechanisms employed by tea plants. Furthermore, the article proposed future research directions, aiming to offer important theoretical foundations and practical guidelines for the sustainable development of tea industry.
Keywords: aluminum, Camellia sinensis, soil acidification, accumulation ability, tolerance
土壤酸化是影响世界农业生产力的重要因素之一[1-3]。酸化土壤环境中铝离子(Al3+)通常会过量积累,导致必需矿质元素如钙(Ca)、镁(Mg)、磷(P)和锰(Mn)等缺乏的问题[1]。铝(Al)是地球上第三富集的金属元素,在非酸性土壤中通常以硅酸铝的形式存在[4]。而当土壤pH低于5.5时,硅酸铝会转化为Al(H2O)63+或Al3+,被植物过量吸收后会造成细胞成分的损伤,并影响DNA的复制和细胞分裂,进而引起根系生长的停滞,营养吸收与运输的抑制,甚至导致植物死亡[4-5]。当前,已经有很多研究与实践探索了该问题,例如通过调节土壤pH、添加土壤改良剂、筛选适应性更强的品种等方式,其中,利用生物技术手段培育适应酸性土壤环境的Al耐受作物也被证明是一种有效的解决方法[6-9]。虽然这些方法可以在一定程度上提高作物的Al耐受能力,促进作物正常生长,但这只是在土壤中添加土壤改良剂或筛选适应性更强的品种等方面进行改良,而作物本身并没有获得对抗Al侵害的能力。因此,需要更深入地研究那些超富集Al植物,探索其如何适应酸性土壤的特殊环境,以便进一步提高作物对Al侵害的适应性和耐受性。
茶是一种多年生的木本植物,属于山茶科[10],主要分布在热带和亚热带地区,具有“喜酸喜铝怕碱”的特点,这种特性是由于茶树在这种气候条件下的长期适应而形成的[11]。茶树在pH为4.0~5.5的酸性土壤中生长良好,这与其对Al元素的富集与耐受性密切相关[4]。近年来,学者们广泛关注茶树对Al的富集和耐受机制。研究发现,茶树能将大量的Al富集在叶片中,老叶中Al的含量高达30 000 mg/kg,比最耐Al的水稻和荞麦等单子叶植物叶子中的含量高100倍左右,而这些植物本身的耐Al性为小麦、高粱或玉米的2~7倍。并且Al浓度会随叶龄增加而增加,老叶中Al的浓度至少是幼叶的10倍[12]。上述研究表明,茶树具有极强的Al富集性以及耐受性。此外茶树在生长过程中需要吸收Al元素来维持正常生长[13]。初期研究认为Al对茶树是一种有益元素,随着研究的深入,发现Al3+对茶树根系生长和发育具有至关重要的作用,通过维持分生细胞中的DNA完整性促进了根系的生长。这一重要结论表明,Al不仅是对茶树有益的元素,更是茶树根系发育必需的元素[5,11,14-15]。因此,了解茶树如何吸收与耐受Al元素,有助于进一步理解茶树“喜酸怕碱”的生理特性,为茶树的生态栽培模式提供一定的参考价值。
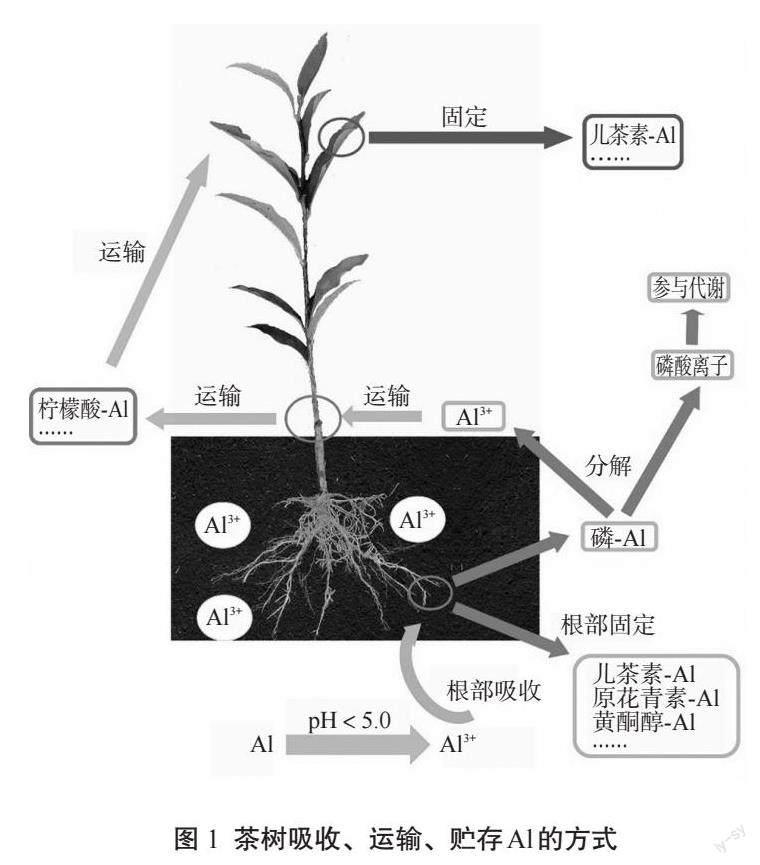
1 茶树吸收、运输、贮存Al的方式
茶树的Al元素吸收、运输和贮存是一个复杂的生理过程(图1)。通常情况下,茶树通过根系吸收土壤中的Al3+,主要是在根部進行吸收作用[16]。茶树的根毛能够通过质膜上的离子通道和转运蛋白对土壤中的Al3+进行筛选、选择性地吸收,以保证其所需Al元素的充分供应。此外,另一部分被吸收的Al元素会进入茶树的茎部。在茎的内部,Al3+主要处于螯合状态,形成了不同的络合物,并且被茎向上运输到茶树的叶片中[13]。在茶树叶片中,Al元素的吸收量较大。茶树能够利用其叶片组织上的离子通道和气孔,将吸收的Al元素快速转运并积累在叶片中[16]。
1.1 Al在茶树根部的吸收
据众多学者的研究表明,Al元素对于茶树的根系生长具有重要影响[17-18]。如在0.1~2.0 mmol/L浓度范围内,Al元素可显著促进茶树根系中主根、侧根和根毛的生长,尤其是白色新根的生成量明显增加[15]。这一生长促进作用与Al元素在酸性土壤中所形成的三价阳离子(Al3+)与果胶、半纤维素和多酚等物质的结合密不可分[17]。茶树根部对Al元素的吸收是一个复杂的过程,主要包括两个方面。首先,在茶树根系中,水溶性Al3+可以通过与有机酸和多酚类化合物形成稳定的螯合复合物,并以黄酮醇-Al、原花青素-Al和草酸盐-Al等偶联物的形式存在[5,15,19]。随后,这些螯合物经过细胞壁甲基化修饰作用,被果胶、半纤维素和纤维素等成分固定,从而固定在细胞壁中或以结合状态储存在液泡中[20-21]。这种Al元素的吸收方式不仅高效而且具有选择性,同时有效避免了过量Al元素对茶树生理代谢的影响。另一部分的Al元素通过Al-P络合物形式被茶树根部吸收,但不会在根部积累。进入茶树根系后,Al-P络合物首先分解为Al3+和磷酸离子两种组分。磷酸主要参与茶树代谢活动并具有直接效应,而Al3+则主要与柠檬酸、苹果酸等多种酸类物质结合于根部并形成A1-柠檬酸复合物,最终进入茎部[22-23]。因此,Al元素对茶树根系的生长和发育具有关键作用,但其积累和耐受机制还需进一步深入研究。
1.2 Al在茶树茎中的运输
当前,关于Al元素在茶树茎中的运输存在两种主流观点,即Al-柠檬酸复合体运输和Al-F复合物运输。据研究表明,在Al元素被运载进入木质部后,其配体从草酸盐逐渐向柠檬酸转化,形成Al-柠檬酸络合物,并且二者的比例通常为1∶1[13,24]。实际上,在超积累Al元素的植物中,柠檬酸是其中较为常见的一种有机酸。其已被证实为植物长距离运输Al元素的主要配体,在绣球属(H. macrophyla)、白羽扇豆(Lupinus albus L.)和茶树等植物中均有发现[25-27]。据此,Al-柠檬酸络合物被认为是茶树木质部汁液中Al元素的关键化学形式。氟离子(F-)以被动吸收的形式被茶树根吸收并转运至幼叶,过量的F-可与Al3+形成复合物,在随后的过程中被运输至老叶[20]。在酸性土壤溶液中,F-与Al3+常形成如AlFx的化合物,包括AlF2+、 AlF2+、AlF4-和AlF3等多种类型。在茶树吸收和运输过程中,以AlF2+和AlF2+为例,这两者是F元素的主要存在形式[20]。在进入根细胞后,游离的Al3+可能与草酸和PA等化合物发生螯合,并在木质部中转化为Al-F复合物进行转运[19]。然而,早期研究人员Morita等[13]发现,在茶树茎的木质部汁液中,Al-柠檬酸络合物是主要的Al元素形式,而F元素则主要以F-状态存在,A1-F络合物极少。因此,从根部向叶片运输过程中,A1-F络合物的解离作用可能较为普遍,但具体的A1-F络合物转运机制尚需进一步探究。
1.3 Al在茶树叶片中的贮存
茶叶作为茶制品的重要原料,其叶片含有丰富的Al元素,这一特性受到广泛关注[16,28]。先前的研究表明,茶树叶片的成熟程度与细胞壁的厚度密切相关,这也直接影响了Al含量的变化趋势[17]。Al在茶树叶片中存在多种不同的结合形式,其中老叶中的Al-F络合物(包括AlF2+、AlF3和AlF4-)同时存在且Al3+浓度随着叶龄的增长而逐渐升高[22]。以干质量为基础,老叶的Al含量至少是幼叶的10倍[12]。
目前,研究人员采用了多种技术手段来探究茶树中Al元素的化学形态,其中27铝核磁共振波谱技术(27Al NMR)是最为常用的一种[19,29-30]。研究人员发现茶树叶片中存在着复杂多样的络合物,例如Al-儿茶素、Al-EGCG、Al-有机酸和Al-酚酸等[30]。其中27Al NMR观察到叶片中儿茶素-Al复合物的信号,最终在老叶中重新转化为Al-儿茶素或Al-EGCG复合物进行积累。因此Al-儿茶素与Al-EGCG被认为是茶树叶片中主要的贮存Al的形式[29]。儿茶素-Al的合成过程简单来说,由Al-柠檬酸复合物从木质部运输至叶细胞并卸载时,在其他配体替代反应的作用下,Al-儿茶素复合物被生成并贮存于叶液泡中[24]。
目前学术界普遍认为[16,18,20],茶树叶片高积累Al元素的原因可能在于其具备一种将Al元素结合到细胞壁并高效转运至液泡内部的机制。此外,茶树叶片还表现出快速信号转导和高抗氧化能力,这些特性有助于减缓Al元素对其细胞组织的不利影响。
2 茶树富集Al的特性
2.1 不同部位的富集
茶树主要由根、茎和叶3个器官组成。Al在茶树内的流动性较高,不会被保留在根部,而会一直被输送到叶片上。因此,在茶树中,叶片是积累Al最重要的器官[28]。随着种植年限的增加,茶树叶片的Al含量也会逐渐增加。在茶树的不同器官中,Al的含量大致为叶>根>茎[31],通常情况下,老叶中的Al含量是嫩叶中的10倍以上[12]。由于根、茎、叶这3个器官具有不同的形态和生理机能,它们对Al元素的吸收和积累也略有不同。尽管不同茶树品种之间的Al积累存在较大差异[32-33],但同一茶树的不同部位其Al含量排列顺序大致相同:第六叶=落叶=第五叶 > 第四叶 > 第三叶 > 根 > 一芽二叶 > 茎=枝[34]。据报道,在老叶中可积累Al含量高达30 000 mg/kg,老叶和落叶中的Al含量大约是根中的30倍,茎中的50倍。此外,一芽二叶中的Al含量明显低于第三至第六叶,这可能是一些低等级茶叶中Al含量高的主要原因,因为它们大多以老叶,特别是第三叶为原料[34-35]。这与Fung等[28]使用我国香港市场茶叶产品与印度茶树品种Al含量比较的结果一致。总体而言,茶树对Al的富集在不同部位具有差异性,其在茶树的生长和养分吸收方面扮演着重要的角色,同时也是茶叶产生多样性的基础之一。
2.2 不同细胞组分的富集
茶树中的Al在不同细胞组成中存在一定的富集特性,其中细胞壁>细胞质>细胞器,并且Al的主要定位在叶表皮细胞的细胞壁中[20,36]。赵强[37]对茶树根尖与叶片细胞组织进行了Al含量测试,结果显示,细胞壁中Al的含量分别为108.05 μg/g、160.19 μg/g,细胞质中分别为34.61 μg/g、37.72 μg/g,细胞器中分别为12.07 μg/g、15.09 μg/g。能量色散型X射线分析(EDXMA)的调查也表明,在老叶中,Al主要积累在细胞壁上,然而,在嫩叶中,EDXMA不够敏感,难以定位或检测细胞质中的Al[38]。而X射线荧光光谱(LEXRF)是植物组织中Al可靠定位的强大工具,使用低能量LEXRF的研究发现,老叶中Al的主要定位在表皮细胞的细胞壁中[39]。Hajiboland等[40]采用激光共聚焦扫描显微镜检测,发现茶树细胞壁中荧光信号比其他细胞组分更明显。研究表明,茶树叶片和根中检测到总Al的含量分别为75.2%和69.8%,均主要存在于细胞壁中。此外,细胞壁中螯合的Al元素的73.2%被果胶和半纤维素成分固定[20]。果胶是细胞壁中一种高电负性半乳糖醛酸多糖,易与Al形成配位键,从而使得Al能够被有效地固定在细胞壁中[41]。值得注意的是,当果胶被去除后,Al含量降低了51.8%,相应的,细胞壁残基中Al的吸附量也呈现出明显下降趋势。这些结果清晰地证明了茶树根细胞壁中的果胶成分具有非常强的固定外源性Al3+的能力[20]。此外,在原生质体中,88.3%的Al3+储存在液泡中[20]。有趣的是,经过Al处理后,细胞壁中的Al含量增加了近29倍;而相应的,在细胞核的含Al量变化相对较小,仅为原先的58.3%[36]。
综上,可以得出结论:茶树主要以细胞壁富集Al3+,其次是液泡,而细胞核中的Al具有较高的稳定性。从研究结果可以看出,Al在茶树的生长过程中得到了有效的富集和固定,但其对植物生长和发育的影响仍然需要深入研究。因此,深入了解Al在细胞水平上的富集是必要的。通过探究Al在茶树细胞壁和液泡中的分布及其对植物生理代谢、膜通透性等方面的影响,可以为生产实践提供有效的理论依据和科学指导。此外,结合现代生物学技术手段,如基因工程和代谢组学等技术,也可以为解决茶树栽培中的相关问题提供更具针对性的技术手段。
3 茶树对Al的耐受机制
3.1 细胞壁固定与液泡隔离
茶树有一种机制,能够有效地将Al3+结合到细胞壁上,并将多余的Al3+转移到液泡内部[16]。其中细胞壁是由半纤维素、果胶多糖和结构蛋白质基质中的纤维素组成的动态结构[42]。亚细胞定位表明,茶树根中69.8%的Al固定在细胞壁中,其中73.2%被果胶和半纤维素成分所固定[20]。通常认为,细胞壁中主要的Al结合位点是果胶多糖,它具有带负电荷的羧基团,因此对Al3+表现出高亲和力[13]。果胶甲基酯酶(PME)的调节能够影响果胶的甲基化程度,从而有助于将Al固定在果胶中。据报道,PME参与细胞壁的发育,在茶树的耐Al性中扮演重要角色[21]。其中CsPMEs基因的表达存在组织特异性,并在不同的Al处理条件下表现出不同的模式。有研究在66个CsPME基因中发现了叶片中有8个基因表达,在根系中有15个基因表达。并且这两部分的基因在不同的Al处理条件下,Al含量和PME活性的变化趋势相同[43]。另外有研究表明,在茶树的Al耐受性中,木葡聚糖内转糖苷酶/水解酶(XTH)扮演着关键角色。通过控制CsXTH基因的表达来调节CsXTH活性,从而影响茶树对Al的耐受力。这些基因的分子功能需要在今后的研究中进一步阐明[17]。另一方面,液泡是一种重要的细胞器,能够储存大量金属离子和有机酸等代谢产物,其中包括Al3+[44]。为减轻Al3+对细胞质的损害,茶树通过调节液泡数量和液泡膜的厚度来隔离这些离子。此外,液泡中的特殊分子如寡聚糖和寡聚肽可与Al3+结合形成稳定的复合物,进而增强其耐受性[18]。茶树在受到Al胁迫后表现出特异性的ABC转运蛋白等基因表达,以增强液泡与胞浆之间的膜运输功能,提高液泡的隔离能力[44]。此外,Al3+可与柠檬酸、草酸等有机酸发生螯合反应,形成稳定的Al-柠檬酸盐和Al-草酸盐等复合物,这也有助于消减液泡中的Al[20]。总之,茶树通过细胞壁和液泡对Al3+的耐受性的调节,以适应Al胁迫环境,其机制非常复杂,仍需进行进一步深入研究。
3.2 有机酸络合
大多数植物都具备类似的应对Al胁迫的机制。其中,根系释放的有机酸(如苹果酸盐和柠檬酸盐)用于螯合和缓解多余的Al,并将Al隔离到液泡中,这是一种有效的机制[22]。茶树在高Al酸性环境中仍能良好生长,因此有机酸可能在增强茶树耐受Al3+方面发挥了关键作用[44]。一般认为,茶树适应酸性土壤的方法是通过分泌有机酸清除外部的Al,并将Al3+固定在根系中以支持其耐受机制。在茶树的根部,主要分泌草酸、苹果酸和檸檬酸等有机酸,它们占总有机酸量的85%~93%。随着Al3+浓度的提高,草酸的分泌也会增加,从而帮助茶树平衡根系中的Al3+浓度[45]。除此之外,茶树的木质部和根汁中也发现了许多有机酸与Al形成的复合物,如柠檬酸铝和草酸铝-草酸盐复合物[29]。目前尚不清楚这些有机酸对于茶树耐受Al的贡献以及具体的耐受机制是什么。MATE和ALMT基因能够对抗重金属胁迫,包括Al3+,并刺激植物根部分泌柠檬酸和苹果酸。MDH基因的过度表达增加了MDH酶的活性,有助于合成更多有机酸[22]。这些基因的表达被认为是许多植物中主要的Al耐受机制之一[13,44]。此外,Peng等[22]的转录组数据还表明,在Al胁迫条件下,CsMATE和CsALMT基因的表达上调。与有机酸分泌有关的转运蛋白以及其他假定的Al耐受基因也对Al产生了显著反应。两个转运蛋白CsALMT1和CsALS8表现出Al耐受性,这一点已经通过对其在酵母中异源表达的功能测试得到证实[44]。
总的来说,Al能够与柠檬酸、草酸和其他有机酸结合形成配合物,并通过根系快速分泌苹果酸盐(ALMT家族)、柠檬酸盐(MATE家族)以及草酸离子等有机酸阴离子,有效地结合Al并防止其进入根尖。在这些过程中,茶树根系中的草酸复合物发挥着至关重要的作用,能够调节其他生物过程,如根系中的钙离子摄取、质膜通透性和细胞壁松弛等,从而进一步提高茶树对Al的耐受适应能力。
因此,深入了解草酸在茶树中的分布、结构、功能和分子机制,有助于探究茶树Al耐受机制的分子基础,为茶树栽培和农业生产提供重要的科学依据。
3.3 酚类物质络合
尽管有机酸在螯合和缓解多余的Al中扮演关键角色,但无法完全解释茶树展现出的高度Al耐受性。越来越多的证据表明,酚类物质的分泌在茶树Al耐受机制中发挥着重要作用[16,18]。茶树可以在各种组织和器官中积累大量的酚类化合物,其中由茶多酚形成的复合物对于茶树的Al耐受性至关重要[19]。茶多酚是一类化学成分,可以按主要成分分为儿茶素类、黄酮类、花青素类和酚酸类四大类物质[46]。其中,儿茶素含量最高,占茶多酚的60%~80%[47]。在茶树中,儿茶素与Al3+结合形成复合物,并储存在细胞质中。研究人员Nagata等[30]发现,茶叶中大部分Al3+与儿茶素结合,这为茶树的高Al耐受性提供了强有力的基础。Huang等[16]则认为,茶树通过形成稳定的Al-儿茶素复合物来表现出一种有效的螯合系统。此外,单体儿茶素中尤其是EGCG 在叶子中约占儿茶素总量的60%,EGCG-Al复合物可以降低Al3+的流动性,从而增加了对Al3+的耐受性[19]。花青素在一定程度上也可缓解植物受重金属胁迫的情况,例如绣球花的蓝色萼片就是由胞内花青素的Al络合物形成的,使Al3+以花青素-A13+的形式存在,从而增加了对Al的耐受性[48]。类似的机制也已在茶树中观察到。此外,茶树老根和嫩根中分别含约8%和2%的花青素络合物(PAs)。多项研究表明,一些R2R3-MYB转录因子和非生物因子能够诱导茶树中多酚的积累[49-50]。此外,在嫩叶中,低浓度的Al可激活参与花青素积累的基因[27]。
黄酮类化合物是一种具有常见的C6-C3-C6结构的化合物,其A、B、C环上含有多个羟基,与Al3+具有很好的结合能力[15,51]。然而,不同的黄酮类化合物对Al3+结合能力是不同的,这可能与它们的结构有关,相比黄烷醇,黄酮醇可以与更多的Al3+结合,并且试验结果表明,黄酮醇和黄酮具有更强的与Al结合的能力。黄酮醇与Al结合形成的化合物能够增强茶树积累Al的能力[15]。
综上,花青素复合物在茶树的老根和嫩根中所占比例的差异也增加了我们对不同部位茶叶的特点及内部机制的认识。同时,黄酮类化合物也显示出一定的与Al3+结合的能力,这为探究不同茶树品种中Al积累的差异提供了新视角。期待未来能有更多的研究揭示更多的关于茶树和Al之间相互作用的分子生物学机制。
3.4 抗氧化酶与转运蛋白
高Al环境中,茶树采取了多种机制来对抗Al胁迫。一方面,一种最重要的机制是提高抗氧化酶的活性和表达[52]。Al诱导的抗氧化酶活性增加能够刺激茶树生长,进而增强膜完整性,延缓木质化和衰老,提高抗氧化防御和光合作用速率[1,53]。一些研究表明,Al在低浓度下会诱导茶树细胞中的抗氧化酶活性,从而提高膜完整性和延迟木质素合成,这能够维持细胞超微结构的完整性,有效清除ROS并保护细胞免受自由基损伤,可能是Al促进茶树生长的原因之一[18]。相反,当茶树在高浓度的Al中生长时,抗氧化酶的活性降低,木质素含量降低,这可能解释了这些物种在高浓度Al环境中生长增强的原因。Al还能够诱导茶树根中抗氧化酶,如抗坏血酸过氧化物酶、过氧化氢酶和谷胱甘肽S-转移酶(GST)和柠檬酸盐的积累[52]。GST基因的表达和活性与茶树的抗逆性和生长发育密切相关。许多研究报告显示,GST与茶树的多种活動密切相关,包括对Al响应的抗氧化酶的表达上调[54-55]。
另一方面,茶树可以通过调节转运蛋白的表达和功能来减少Al3+在细胞内的积累。这些转运蛋白包括营养元素吸收相关的转运蛋白如亚硝酸盐转运蛋白、锌转运蛋白、铜转运蛋白等,以及ABC转运蛋白和MATE、ALMT转运蛋白等逆境诱导的转运蛋白[16,56-57]。通过转录组分析发现,大量的转运蛋白在高Al条件下差异表达,其中亚硝酸盐转运蛋白、锌转运蛋白、铜转运蛋白等在Al处理中得到了上调[16]。Fan等[21]的研究表明,适量的Al(0.2、0.4、0.6 mmol/L)处理能够增强P和K的吸收,同时减少Ca和Mg的吸收。具体而言,K转运蛋白HAK5得到了显著上调,增强了K+的内流;磷转运蛋白PHT3的表达也得到了上调,增强了对P的吸收;而镁转运蛋白NIPA8则在0.4 mmol/L Al的处理下具有了最高的表达量[21]。这些结果表明,通过上调相关基因的表达,是Al促进根系生长和分裂的重要途径之一。茶树中的抗氧化酶和转运蛋白也被认为对其耐受Al3+具有重要贡献。尽管这些潜在基因的具体作用机制还需要进一步研究探明,但它们很可能是茶树展现高度Al耐受性的关键因素之一。
4 展望
当前,世界土壤酸化的现状十分严峻,这会对农作物生长和发展造成严重影响,并导致土壤中微生物及植物营养元素等资源的损失。此外,酸化还会对生态系统产生深远影响,因此未来种植耐酸性植物将成为趋势。
一些植物已在自然环境下表现出耐酸性的特征,以茶树为代表具有参考意义。了解茶树在生长过程中对酸性土壤和Al3+的响应和适应能力是研究茶树耐酸耐铝机制的基础。通过比较与茶树相关的同科、同属或同系植物的生长和生理特征,可以分析和发现茶树在耐酸耐铝方面的优势和特殊之处,进而探寻类似植物中可能存在的耐酸耐铝机制。幸运的是,组学技术的发展为茶树富集、耐Al机制研究提供了更多的机遇。使用基因组、转录组、代谢组、蛋白质组等技术进行分析,通过比较茶树品种间基因表达的差异和突变位点,结合不同生长阶段和不同处理条件下的基因表达数据,分析代谢产物和蛋白质的变化,从而研究Al对茶树代谢过程和蛋白质功能的影响,揭示茶树耐Al的分子机制。
綜上所述,通过深入研究茶树吸收与耐受Al元素的机制,可以更好地理解茶树“喜酸怕碱”的生理特性,为茶树的生态栽培模式提供更具有科学性和可持续性的指导。在生态种植方面,可以利用研究成果为茶园的建设和管理提供科学的技术支持,如优化土壤pH值、选择适宜的区域和土壤类型进行茶树种植等,从而实现茶树的高效生长和稳定产量。
此外,研究茶树对Al元素的吸收和耐受机制还能够为其他作物的育种和改良提供参考,促使农业生产更加环保和可持续。总之,茶树吸收和耐受Al元素的研究将在茶园生态栽培、农业生产、环境保护等领域发挥重要的作用,为推动可持续发展作出新的贡献。
参考文献
[1] HIROTO Y, YUSUKE F, SHIORI Y, et al. Tissue ionome response to rhizosphere pH and aluminum in tea plants (Camellia sinensis L.), a species adapted to acidic soils[J]. Plant‐Environment Interactions, 2020, 1(2): 152-164.
[2] SHWETA S, DURGESH K T, SWATI S, et al. Toxicity of aluminium on various levels of plant cells and organism: A review[J]. Environmental and Experimental Botany, 2017, 137: 177-193.
[3] SHU W J, ZHOU Q H, XIAN P Q, et al. GmWRKY81 encoding a WRKY transcription factor enhances aluminum tolerance in soybean[J/OL]. International Journal of Molecular Sciences, 2022, 23(12): 6518. https://doi.org/10.3390/ijms23126518.
[4] DING Z J, SHI Y Z, LI G X, et al. Tease out the future: How tea research might enable crop breeding for acid soil tolerance[J/OL]. Plant Communications, 2021, 2(3): 100182. https://doi.org/10.1016/j.xplc. 2021.100182.
[5] KRISHNAMONI B, DIBYENDU S, KABERIJYOTI K, et al. Disentanglement of the secrets of aluminium in acidophilic tea plant (Camellia sinensis L.) influenced by organic and inorganic amendments[J]. Food Research International, 2019, 120: 851-864.
[6] RAJPAL S, CHIRUPPURATHU S N V, NAGABOVANALLI B P, et al. Aluminum toxicity in plants and its possible mitigation in acid soils by biochar: A review[J/OL]. Science of the Total Environment, 2020, 765: 142744. https://doi.org/10.1016/j.scitotenv.2020.142744.
[7] RAHMAN M A, LEE S H, JI H C, et al. Importance of mineral nutrition for mitigating aluminum toxicity in plants on acidic soils: Current status and opportunities[J/OL]. International Journal of Molecular Sciences, 2018, 19(10): 3073. https://doi.org/10.3390/ijms19103073.
[8] YANG G, QU M, XU G L, et al. pH-Dependent mitigation of aluminum toxicity in pea (Pisum sativum) roots by boron[J/OL]. Plant Science, 2022, 318: 111208. https://doi.org/10.1016/j.plantsci.2022.111208.
[9] DAWOOD M F A, TAHJIB U A M, SOHAG A A M, et al. Fluoride mitigates aluminum-toxicity in barley: Morpho-physiological responses and biochemical mechanisms[J]. BMC Plant Biology, 2022, 22(1): 1-17.
[10] HUANG F Y, DUAN J H, LEI Y K, et al. Metabolomic and transcriptomic analyses reveal a MYB gene, CsAN1, involved in anthocyanins accumulation separation in F1 between 'Zijuan' (Camellia sinensis var. assamica) and 'Fudingdabaicha' (C. sinensis var. sinensis) tea plants[J/OL]. Frontiers in Plant Science, 2022, 13. https://doi.org/10.3389/fpls.2022.1008588.
[11] 李勇, 唐澈, 趙华, 等. 茶树耐铝聚铝特性及其机理研究进展[J]. 茶叶科学, 2018, 38(1): 1-8.
[12] YANG H J, CHEN Y, SHIDO J M, et al. Potential health risk of aluminum in four Camellia sinensis cultivars and its content as a function of leaf position[J/OL]. International Journal of Environmental Research and Public Health, 2022, 19(19): 11952. https://doi.org/10.3390/ijerph191911952.
[13] AKIO M, HIDEKI H, YOUSUKE F, et al. Chemical forms of aluminum in xylem sap of tea plants (Camellia sinensis L.)[J]. Phytochemistry, 2004, 65(20): 2775-2780.
[14] SUN L L, ZHANG M S, LIU X M, et al. Aluminium is essential for root growth and development of tea plants (Camellia sinensis) [J]. Journal of Integrative Plant Biology, 2020, 62(7): 984-997.
[15] FU Z P, JIANG X L, KONG D X, et al. Flavonol-aluminum complex formation: Enhancing aluminum accumulation in tea plants[J]. Journal of Agricultural and Food Chemistry, 2022, 70(43): 14096-14108.
[16] HUANG D J, GONG Z M, CHEN X, et al. Transcriptomic responses to aluminum stress in tea plant leaves[J/OL]. Scientific Reports, 2021, 11(1): 5880. https://doi.org/10.1038/s41598-021-85393-1.
[17] WU Z C, CUI C L, XING A Q, et al. Identification and response analysis of xyloglucan endotransglycosylase/hydrolases (XTH) family to fluoride and aluminum treatment in Camellia sinensis[J]. BMC Genomics, 2021, 22(1): 1-16.
[18] MUKHOPADYAY M, BANTAWA P, DAS A, et al. Changes of growth, photosynthesis and alteration of leaf antioxidative defence system of tea [Camellia sinensis (L.) O. Kuntze] seedlings under aluminum stress[J]. Biometals, 2012, 25(6): 1141-1154.
[19] FU Z P, JIANG X L, LI W W, et al. Proanthocyanidin-aluminum complexes improve aluminum resistance and detoxification of Camellia sinensis[J]. Journal of Agricultural and Food Chemistry, 2020, 68(30): 7861-7869.
[20] GAO H J, ZHAO Q, ZHANG X C, et al. Localization of fluoride and aluminum in subcellular fractions of tea leaves and roots[J]. Journal of Agricultural and Food Chemistry, 2014, 62(10): 2313-2319.
[21] FAN K, WANG M, GAO Y Y, et al. Transcriptomic and ionomic analysis provides new insight into the beneficial effect of Al on tea roots' growth and nutrient uptake[J]. Plant Cell Reports, 2019, 38(6): 715-729.
[22] PENG A Q, YU K K, YU S W, et al. Aluminum and fluoride stresses altered organic acid and secondary metabolism in tea (Camellia sinensis) plants: Influences on plant tolerance, tea quality and safety[J/OL]. International Journal of Molecular Sciences, 2023, 24(5): 4640. https://doi.org/10.3390/ijms24054640.
[23] 黄丹娟, 毛迎新, 陈勋, 等. 茶树富集铝的特点及耐铝机制研究进展[J]. 茶叶科学, 2018, 38(2): 125-132.
[24] MORITA A, YANAGISAWA O, TAKATSU S, et al. Mechanism for the detoxification of aluminum in roots of tea plant (Camellia sinensis (L.) Kuntze)[J]. Phytochemistry, 2008, 69(1): 147-153.
[25] ZHOU Y P, NEUH?USER B, NEUMANN G, et al. LaALMT1 mediates malate release from phosphorus-deficient white lupin root tips and metal root to shoot translocation[J]. Plant, Cell & Environment, 2020, 43(7): 1691-1706.
[26] CHARLOTTE P, SILVIA B, JUAN B. How plants handle trivalent (+3) elements[J/OL]. International Journal of Molecular Sciences, 2019, 20(16): 3984. https://doi.org/10.3390/ijms20163984.
[27] ROSER T, SOLEDAD M, ROGHIEH H, et al. Aluminium alters mineral composition and polyphenol metabolism in leaves of tea plants (Camellia sinensis) [J/OL]. Journal of Inorganic Biochemistry, 2020, 204(C): 110956. https://doi.org/10.1016/j.jinorgbio.2019.110956.
[28] FUNG K F, CARR H P, POON B H T, et al. A comparison of aluminum levels in tea products from Hong Kong markets and in varieties of tea plants from Hong Kong and India[J]. Chemosphere, 2009, 75(7): 955-962.
[29] ZENG L T, ZHOU X C, LIAO Y Y, et al. Roles of specialized metabolites in biological function and environmental adaptability of tea plant (Camellia sinensis) as a metabolite studying model[J]. Journal of Advanced Research, 2021, 34: 159-171.
[30] NAGATA T, HAYATSU M, KOSUGE N. Identification of aluminium forms in tea leaves by 27Al NMR[J]. Phytochemistry, 1992, 31(4): 1215-1218.
[31] FUNG K F, ZHANG Z Q, WONG J, et al. Aluminium and fluoride concentrations of three tea varieties growing at Lantau Island, Hong Kong[J]. Environmental Geochemistry and Health, 2003, 25(2): 219-232.
[32] 鐘秋生, 林郑和, 郝志龙, 等. 氟铝互作对茶树叶片叶绿素荧光特性的影响[J]. 茶叶科学, 2019, 39(5): 537-546.
[33] 吴志丹, 江福英, 张磊. 茶树品种及采摘时期对茶叶铝含量的影响[J]. 茶叶学报, 2016, 57(1): 13-17.
[34] SHU W S, ZHANG Z Q, LAN C Y, et al. Fluoride and aluminium concentrations of tea plants and tea products from Sichuan province, PR China[J]. Chemosphere, 2003, 52(9): 1475-1482.
[35] WONG M H, FUNG K F, CARR H P. Aluminium and fluoride contents of tea, with emphasis on brick tea and their health implications[J]. Toxicology Letters, 2003, 137(1/2): 111-120.
[36] 潘根生, MASAKI T, 小西茂毅. 茶根尖细胞各胞器分部的分离及其铝的分布[J]. 浙江农业大学学报, 1991(3): 33-36.
[37] 赵强. 氟/铝在茶树叶片和根部的累积与分布规律研究[D]. 合肥: 安徽农业大学, 2013.
[38] CARR H P, LOMBI E, K?PPER H, et al. Accumulation and distribution of aluminium and other elements in tea (Camellia sinensis) leaves[J]. Agronomie, 2003, 23(8): 705-710.
[39] TOLR? R, VOGEL-MIKU? K, HAJIBOLAND R, et al. Localization of aluminium in tea (Camellia sinensis) leaves using low energy X-ray fluorescence spectro-microscopy[J]. Journal of Plant Research, 2011, 124: 165-172.
[40] HAJIBOLAND R, C P. Localization and compartmentation of Al in the leaves and roots of tea plants[J]. Phyton-International Journal of Experimental Botany, 2015, 84(1): 86-100.
[41] SAFARI M, GHANATI F, SAFARNEJAD M R, et al. The contribution of cell wall composition in the expansion of Camellia sinensis seedlings roots in response to aluminum[J]. Planta, 2018, 247: 381-392.
[42] LI C X, YAN J Y, REN J Y, et al. A WRKY transcription factor confers aluminum tolerance via regulation of cell wall modifying genes[J]. Journal of Integrative Plant Biology, 2020, 62(8): 1176-1192.
[43] HUANG D J, MAO Y X, GUO G Y, et al. Genome-wide identification of PME gene family and expression of candidate genes associated with aluminum tolerance in tea plant (Camellia sinensis)[J]. BMC Plant Biology, 2022, 22(1): 1-13.
[44] HAO J, PENG A Q, LI Y Y, et al. Tea plant roots respond to aluminum-induced mineral nutrient imbalances by transcriptional regulation of multiple cation and anion transporters[J]. BMC Plant Biology, 2022, 22(1): 1-20.
[45] CHEN H B, YU F, KANG J X, et al. Quality chemistry, physiological functions, and health benefits of organic acids from tea (Camellia sinensis)[J/OL]. Molecules, 2023, 28(5): 2339. https://doi.org/10.3390/molecules28052339.
[46] ZHAO T T, LI C, WANG S, et al. Green tea (Camellia sinensis): A review of its phytochemistry, pharmacology, and toxicology[J/OL]. Molecules (Basel, Switzerland), 2022, 27(12): 3909. https://doi.org/10.3390/molecules27123909.
[47] HAN L, PENG X, CHENG Y, et al. Effects of catechin types found in tea polyphenols on the structural and functional properties of soybean protein isolate-catechin covalent complexes[J/OL]. LWT, 2023, 173: 114336. https://doi.org/10.1016/j.lwt.2022.114336.
[48] CHEN H X, WANG D H, ZHU Y L, et al. Integrative transcriptomics and proteomics elucidate the regulatory mechanism of hydrangea macrophylla flower-color changes induced by exogenous aluminum[J/OL]. Agronomy, 2022, 12(4): 969. https://doi.org/10.3390/agronomy12040969.
[49] LI J Y, LIU S Q, CHEN P F, et al. Systematic analysis of the R2R3-MYB family in Camellia sinensis: Evidence for galloylated catechins biosynthesis regulation[J/OL]. Frontiers in Plant Science, 2022, 12: 782220. https://doi.org/10.3389/fpls.2021.782220.
[50] MEI X, ZHANG K K, LIN Y G, et al. Metabolic and transcriptomic profiling reveals etiolated mechanism in huangyu tea (Camellia sinensis) leaves[J/OL]. International Journal of Molecular Sciences, 2022, 23(23): 15044. https://doi.org/10.3390/ijms232315044.
[51] SHEN N, WANG T F, GAN Q, et al. Plant flavonoids: Classification, distribution, biosynthesis, and antioxidant activity[J/OL]. Food Chemistry, 2022, 383: 132531. https://doi.org/10.1016/j.foodchem.2022.132531.
[52] XU Q S, WANG Y, DING Z T, et al. Aluminum induced physiological and proteomic responses in tea (Camellia sinensis) roots and leaves[J]. Plant Physiology and Biochemistry, 2017, 115: 141-151.
[53] EMANUEL B Q, CAMILO E M, ILEANA E M, et al. Aluminum, a friend or foe of higher plants in acid soils[J/OL]. Frontiers in Plant Science, 2017, 8: 1767. https://doi.org/10.3389/fpls.2017.01767.
[54] CAO Q H, L? W Y, JIANG H, et al. Genome-wide identification of glutathione S-transferase gene family members in tea plant (Camellia sinensis) and their response to environmental stress[J]. International Journal of Biological Macromolecules, 2022, 205: 749-760.
[55] DE CASTRO, LA?SA M R, VINSON, et al. Molecular and physiological aspects of plant responses to aluminum: what do we know about Cerrado plants[J]. Brazilian Journal of Botany, 2022, 45(2): 545-562.
[56] XU X H, TIAN Z Q, XING A Q, et al. Nitric oxide participates in aluminum-stress-induced pollen tube growth inhibition in tea (Camellia sinensis) by regulating CsALMTs [J/OL]. Plants, 2022, 11(17): 2233. https://doi.org/10.3390/plants11172233.
[57] CHANDRA J, KESHAVKANT S. Mechanisms underlying the phytotoxicity and genotoxicity of aluminum and their alleviation strategies: A review[J/OL]. Chemosphere, 2021, 278: 130384. https://doi.org/10.1016/j.chemosphere.2021.130384.
