大球盖菇多糖的体外模拟消化研究
2023-07-05金明枝黄千里
金明枝, 黄千里, 陈 辉, 叶 明
(1.合肥工业大学 食品与生物工程学院,安徽 合肥 230601; 2.上海市农业科学院食用菌研究所,上海 201403)
多糖是单糖经糖苷键连接而成的一种聚合糖高分子化合物,通常以聚集体的形式存在于水溶液中。多糖在人体的肠道中会被分解吸收,并通过血液输送至体内需要营养的组织、器官[1]。但由于人体实验成本昂贵且存在伦理争议,而体外模拟消化模型所需样品少、操作简便快速且具有可重复性,使其逐渐成为消化研究的首选方法[2]。但体外消化易受外界环境的影响,影响多糖体外消化的因素主要有以下2个方面:① 多糖自身因素,包括组成成分、分子量、糖苷键与构象等[3];② 环境因素,包括消化液pH值、糖水解酶、温度和消化介质等[4]。因此每种多糖的结构差异使其消化率均各不相同。
大球盖菇(Strophariarugosoannulata)是联合国粮食及农业组织向发展中国家推荐种植的新菌种[5-6],目前在中国已实现人工种植[7]。大球盖菇含有多种活性成分,其中多糖含量较为丰富,具有抗氧化及抗肿瘤、降血糖血脂等活性[8-9]。然而,关于不同消化阶段对大球盖菇多糖(SP-1a)的理化性质和生物活性的影响研究较少。本文利用体外模拟消化系统研究大球盖菇多糖的消化特性,为大球盖菇多糖的功能活性提供科学依据,促进其成为功能性食品或治疗药物。
1 材料与方法
1.1 材料与仪器
材料为大球盖菇子实体,由上海市农业科学院食用菌研究所提供。
胃蛋白酶(3 000 U/mg,猪源)、胰蛋白酶(250 U/mg,猪源)、胰酶均购于BioFroxx (GER);DPPH购于阿拉丁试剂(上海)有限公司。其他试剂均为分析纯。
仪器有:LC-10A高效液相色谱仪(high performance liquid chromatography,HPLC)(日本Shimadzu公司);Nicolet 67 傅里叶变换红外(Fourier transform Infrared,FTIR)光谱仪(美国尼高力仪器公司);Gemini 500热场发射扫描电子显微镜(field emission scanning electron microscope,FESEM)(德国卡尔蔡司);STA449F3同步热分析仪(德国耐驰公司);CARY5000紫外-可见近红外分光光度计(安捷伦科技有限公司)。
1.2 体外唾液消化阶段
收集3名健康志愿者(年龄20~30岁,近3个月未摄入抗生素)的唾液,收集好的唾液离心(4 500 r/min,10 min)以去除细胞,取上清液备用。随后将10 mL SP-1a溶液(4 g/L)与10 mL人唾液加入试管中并于37 ℃孵育进行消化,分别在5、15、30 min取样5 mL,于沸水浴灭活15 min,离心(4 500 r/min,10 min)收集上清液,同时将消化30 min后剩余的含SP-1a唾液消化液透析冻干得SP-1a-S。
1.3 体外胃液消化阶段
参考文献[4]的方法制备胃消化液。将30 mL SP-1a(4 g/L)溶液与30 mL人工胃液加入管中混匀,于37 ℃的摇床中孵育进行消化,分别在30、60、120、240、360 min取样5 mL,沸水浴中灭活15 min,随后离心(4 500 r/min,10 min)收集上清液,同时将消化360 min后剩余的含SP-1a胃消化液透析冻干得SP-1a-G。
1.4 体外肠液消化阶段
参考文献[10]的方法制备肠消化液。通过NaHCO3溶液(1 mol/L)调节SP-1a胃消化液pH值至7.0。将9 mL人工肠液与30 mL含SP-1a的胃消化液加入试管中,在37 ℃摇床中孵育,分别在30、60、120、240、360 min取5 mL消化样品,于沸水浴中灭活15 min,随后离心(4 500 r/min,10 min)收集上清液,同时将消化360 min后剩余的含SP-1a肠消化液透析冻干得SP-1a-I。
1.5 化学表征
参考文献[2]的方法使用高效液相色谱仪测定SP-1a消化产物的分子量;参考文献[11]的方法测定SP-1a消化产物的单糖组成;3,5-二硝基水杨酸法用于测定不同时段SP-1a消化液中的还原糖摩尔分数[12]。
1.6 FTIR分析
使用FTIR光谱仪进行红外光谱采集。将SP-1a及其消化样品粉末放在平台的检测窗上进行检测,扫描范围为4 000~500 cm-1。
1.7 表观形态分析
将SP-1a及其消化样品涂金粉后,通过SEM以400倍放大率观察样品形貌,以获得样品的微观形态。
1.8 热特性测定
采用同步热分析仪测定SP-1a消化产物热特性。测试温度范围为25~500 ℃,速率为5 ℃/min。吹扫气体的氮气流速为50 mL/min。
1.9 多糖消化产物的体外抗氧化活性
1.9.1 ·OH清除作用
参考文献[13]的方法,分别取1.0 mL磷酸盐缓冲液和0.5 mL邻二氮菲(2.5 mmol/L)于试管中,再加入SP-1a消化液、硫酸亚铁(2.5 mmol/L)、H2O2(20 mmol/L)各0.5 mL,混匀后在37 ℃水浴中反应60 min,用蒸馏水调零,在536 nm波长处测定各组吸光度值,以蒸馏水代替样品溶液的空白组吸光度为A0,以蒸馏水代替H2O2溶液的对照组吸光度为A1,样品组吸光值为A2。·OH清除率(H)的计算公式为:
(1)
1.9.2 DPPH自由基清除作用
参考文献[14]的方法,取1 mL SP-1a消化液与1 mL DPPH-乙醇溶液混合,在室温黑暗条件下保持30 min,用蒸馏水调零,随后在517 nm波长处测定各组吸光度值,以蒸馏水代替样品溶液的空白对照组吸光度值为A0,以乙醇代替DPPH-乙醇溶液的对照组吸光度值为A3,样品组吸光度值为A4。DPPH清除率(D)的计算公式为:
(2)
1.9.3 还原力
参考文献[15]的方法,分别取0.8 mL SP-1a消化液、0.4 mL PBS(0.2 mol/L) 与0.4 mL 1%K3[Fe(CN)6]于试管中,50 ℃水浴反应20 min,取出待冷却后,加入0.4 mL 10%三氯乙酸,随后离心(4 500 r/min,5 min)取上清液1.5 mL,加入1 mL去离子水和0.4 mL 0.1%的三氯化铁,静置5 min,于700 nm测定各组吸光度值,以蒸馏水替代样品作为空白组的吸光度值为A0,样品组吸光度值为A5。还原力(R)的计算公式为:
R=A5-A0
(3)
1.10 结果处理
所有实验均重复3次,实验数据以(平均值±标准差)表示。使用SPSS26.0软件对实验数据进行统计分析,单向方差分析(ANOVA)用于测定各组之间的显著性差异。P<0.05表示不同组间存在显著性差异。
2 结果与讨论
2.1 还原糖质量浓度分析
糖苷键的断裂会引起还原糖质量浓度的增加[9],因此还原糖质量浓度的变化可作为判断多糖是否被降解的依据。SP-1a在消化过程中还原糖质量浓度的变化见表1所列。从表1可以看出,在唾液消化阶段还原糖质量浓度未发生显著性变化,而在模拟的胃肠消化中,还原糖质量浓度随着消化时间增加而逐渐增多,尤其是在肠液消化360 min后,还原糖质量浓度显著增加(P<0.05),达到了(0.525±0.060) mg/mL,结果与文献[3]研究结果一致。结果表明在胃肠消化中,SP-1a可被降解吸收,这可能是由于胃肠液中的环境易引起糖苷键断裂,从而使还原糖质量浓度逐渐增多[16]。
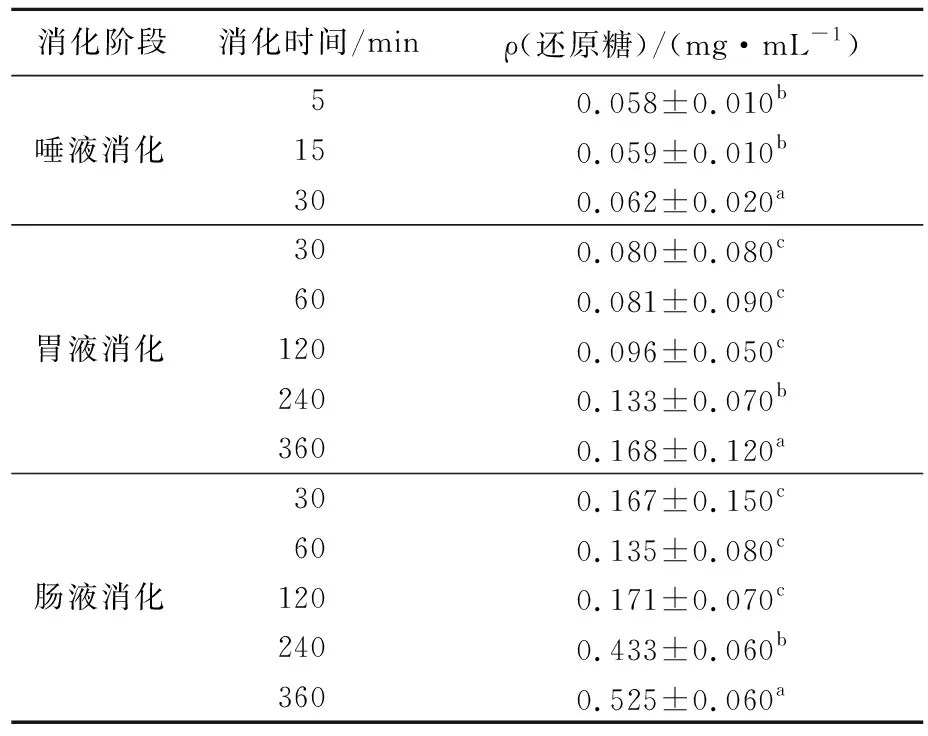
表1 不同消化阶段SP-1a的还原糖质量浓度
2.2 分子量与单糖摩尔分数分析
多糖的生物活性与其分子量和单糖组成紧密相关。根据标准品校准曲线lgMw=-0.182 8t+11.895与出峰时间,可计算出SP-1a及消化产物的分子量。SP-1a及其消化产物的高效凝胶渗透色谱图(high performance gel permeation chromatography,HPGPC)如图1所示。

图1 SP-1a及其消化产物的HPGPC谱图
从图1可以看出,经过唾液消化后SP-1a的分子量未明显变化,而经模拟胃液和肠液各孵育360 min后,SP-1a的分子量分别为18.493、17.594 kDa,此结果表明,SP-1a在胃肠中可被降解吸收,且SP-1a在胃中的分子量变化大于肠液中的变化,这可能是由于胃液中的酸性环境更容易导致分子量减小[17]。结合还原糖质量浓度结果表明,SP-1a糖苷键的断裂主要在肠液中发生,而胃液消化主要引起SP-1a聚集体的破坏,这与RosaroxburghiiTratt多糖的消化结果类似[3]。此外单糖组成及其摩尔分数见表2所列。由表2可知,在各消化阶段,单糖的组成有所差异,其中葡萄糖的摩尔分数逐渐降低,这可能是由于葡萄糖间的糖苷键在胃肠液中更易于断裂,这与文献[1]中的Inonotusobliquus多糖在胃肠中单糖结果相似。

表2 SP-1a及其消化产物中单糖组成及其摩尔分数 %
2.3 FTIR结果分析
SP-1a及其消化产物的FTIR谱图如图2所示。从图2可以看出:SP-1a、SP-1a-S、SP-1a-G和SP-1a-I的红外吸收峰基本稳定;经过消化后SP-1a特征吸收峰未消失,在1 356、1 148 cm-1处的弱吸收峰分别由C—H的弯曲振动和C—O的伸缩振动引起[18-19];在1 016 cm-1处的吸收峰表明SP-1a的消化产物依然具有吡喃糖环。而SP-1a及其消化产物红外图谱在1 644~1 022 cm-1范围内,此范围内各产物的吸收峰强度不同,结合单糖组成的结果可知,可能是由于消化前后SP-1a发生降解导致单糖组成不同所引起的[6]。
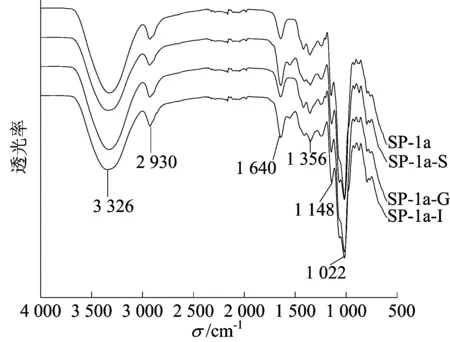
图2 SP-1a及消化产物的FTIR谱图
2.4 SP-1a的表观形态特性分析
SP-1a及其消化产物的微观形态如图3所示。从图3可以看出:未经消化的SP-1a呈片状,且表面光滑平整[18];经过唾液消化后,其消化产物SP-1a-S显示有细杆状出现;而经胃肠消化后,SP-1a-G形状变为表面多孔的聚集体,特别是在肠消化360 min后,其消化产物SP-1a-I的分子变小且分布松散,这与分子量和还原糖质量浓度结果一致,表明SP-1a在胃肠道中可被降解。文献[10]显示Holothurialeucospilota多糖在胃肠消化时由于降解微结构发生了变化,这与本文研究结果一致。

图3 SP-1a及其消化产物的SEM图
2.5 热特性分析
差示扫描量热法(differential scanning calorimeter,DSC)可用来研究多糖的热物理性质。SP-1a及其消化产物的DSC曲线如图4所示。

图4 SP-1a及消化产物的热分析
从图4可以看出SP-1a在25~500 ℃范围内有2个热解峰:第1个吸热峰在67 ℃左右,这可能是由于SP-1a中的水分蒸发所致[2];第2个吸热峰在284 ℃左右,这可能是SP-1a的熔点。经过消化后,唾液消化产物SP-1a-S的热解趋势与SP-1a一致,而胃液消化产物SP-1a-G和肠液消化产物SP-1a-I各有1个吸热峰和1个放热峰,前者与SP-1a结果一致,是水分蒸发引起的热解峰,后者可能是由于SP-1a被降解成小分子而产生了不同的热解反应,具体机制还有待进一步研究。
2.6 抗氧化活性分析
2.6.1 SP-1a消化产物对·OH的清除作用
·OH可以与人体中多种分子进行结合从而对人体造成危害,是危害最大的一种自由基[19]。SP-1a在不同消化阶段对·OH清除作用如图5所示。从图5可以看出:SP-1a的唾液消化产物对·OH的清除作用未发生显著性改变;在胃液消化过程中,其清除率呈上升趋势,在240 min时其·OH清除率达到88%并趋于稳定;而在肠消化过程中,清除率较为稳定,在360 min达到最大值约78.67%。结果显示,胃肠消化产物能够有效清除·OH,这可能是多糖被降解提供了氢原子,从而与·OH结合达到清除效果[20]。图5中,不同字母表示P<0.05具有显著性差异,下同。
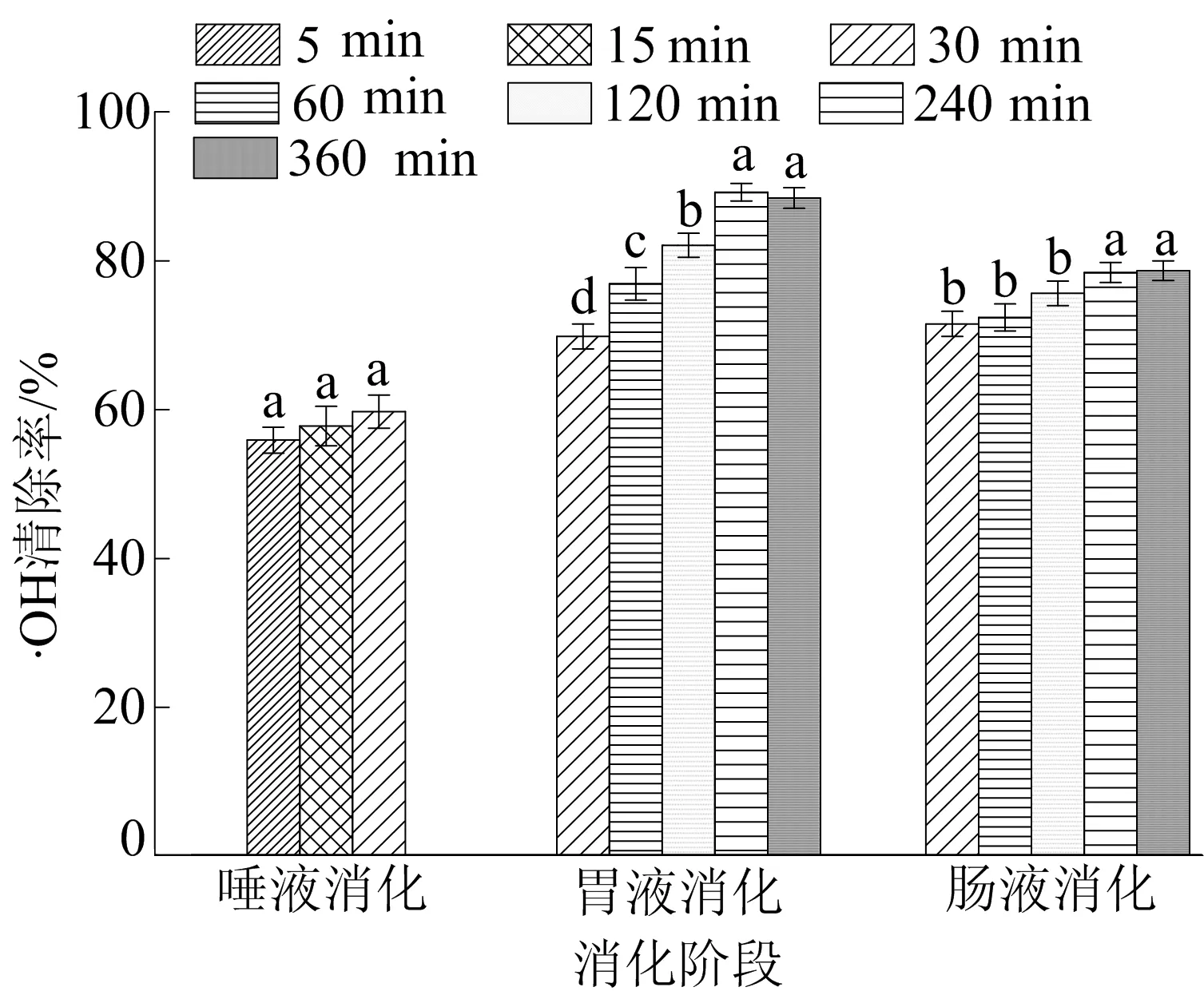
图5 SP-1a在不同消化阶段对·OH的清除作用
2.6.2 SP-1a消化产物对DPPH 的清除作用
DPPH是一种稳定的自由基,常用来评估抗氧化活性。SP-1a在不同消化阶段对DPPH自由基的清除作用如图6所示。
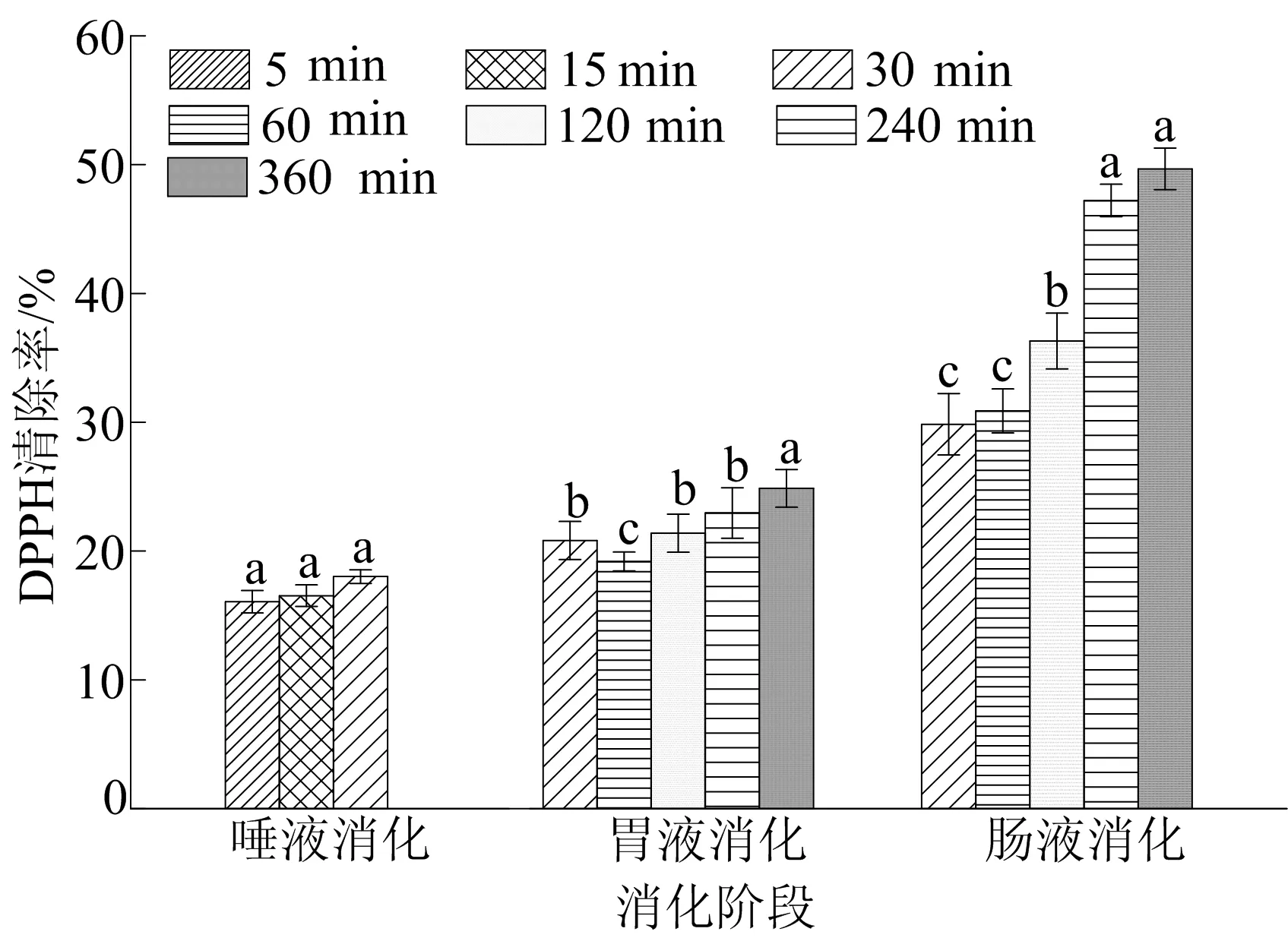
图6 SP-1a在不同消化阶段对DPPH自由基的清除作用
从图6可以看出:唾液消化产物的DPPH自由基清除率没有显著变化,胃消化产物对DPPH自由基清除率随消化时间的增加而呈增强趋势,360 min后达到了约25%;在肠液消化过程中,其对DPPH自由基的清除率不断增强,在240 min时,DPPH自由基清除率显著增强(P<0.05),达到47%,在消化360 min后最高达到50%。这表明多糖经过胃肠消化后具有较强的DPPH自由基清除作用。
2.6.3 SP-1a消化产物的还原力
还原力也是抗氧化活性的检测指标之一,其反应液在700 nm处具有最大吸光值[21]。SP-1a消化产物还原力如图7所示。由图7可知:SP-1a经唾液消化后还原力较为稳定,约为0.110;胃消化产物的还原力逐渐上升并趋于稳定,在360 min时达到0.165左右;在肠消化过程中,可能是SP-1a消化产物被稀释,开始时的还原力低于胃消化产物,而后还原力逐渐上升,在360 min后达到0.268左右。结果显示,SP-1a经胃肠消化后具有较强的还原力,并显著高于唾液和胃消化液的还原力(P<0.05)。
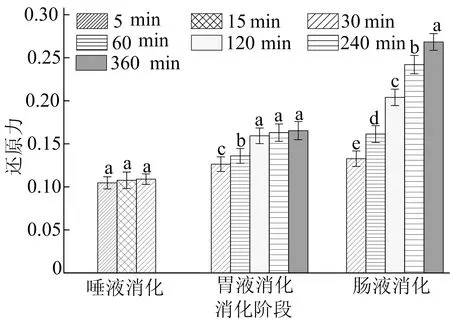
图7 SP-1a在不同消化阶段的还原力
在胃肠消化过程中,多糖可能受温度、pH值、酶等因素的影响发生降解,使其化学性质与结构等发生改变,从而引起多糖抗氧化活性的变化。文献[1]报道Inonotusobliquus多糖的胃肠消化产物具有显著的抗氧化和酶抑制活性,有助于防止氧化应激和高血糖;文献[10]研究发现胃肠消化对Holothurialeucospilota多糖的抗氧化活性有显著增强影响;文献[13]显示ArtocarpusheterophyllusLam.多糖经过胃肠消化后,具有较高的自由基清除活性。这些结果与SP-1a消化后的抗氧化活性相似,表明胃肠降解有利于提高多糖的生物活性。
3 结 论
本研究经过从大球盖菇子实体中提取分离得到分子量为22.907 kDa的均一组分SP-1a。其在体外唾液消化阶段,分子量、单糖组成与还原糖质量浓度均无明显变化;而在模拟胃液和肠液消化后分子量减小至17.594 kDa,还原糖质量浓度也显著增加,并且其微观形态由片状变为网状聚集体,这表明SP-1a主要在胃肠消化中发生降解,且SP-1a胃肠消化液具有较强的·OH和DPPH自由基清除能力和还原力,尤其是肠消化液具有更强的抗氧化活性。因此,本研究为探索大球盖菇多糖在体内的降解吸收和生物活性提供了理论依据。
