经冠状静脉标测与消融心外膜特发性室性心律失常的研究进展
2023-07-05林加锋李进陈延茹
林加锋 李进 陈延茹
特发性室性心律失常(idiopathic ventricular arrhythmias,IVAs)是最常见的心律失常之一,多数患者无结构性心脏病[1],IVAs 包括特发性室性期前收缩(premature ventricular contractions,PVCs)和特发性室性心动过速(idiopathic ventricular tachycardias, IVTs)。近年来,经心内膜途径射频导管消融(下称消融)治疗IVAs 逐年增加,推荐级别越来越高[2]。既往认为冠状静脉系统(coronary venous system, CVS)及其邻近部位起源的IVAs 少见,但近年研究显示该部位起源的IVAs 已达9%~15%[3-4]。部分IVAs 经心内膜消融无效,而经心外膜消融获得成功[5],并已证实冠状静脉是标测与消融心外膜(毗邻CVS)起源IVAs 的有效替代途径[5-6]。近年来国内有学者报道经CVS 成功消融IVAs,其中笔者团队做了系列研究,对CVS 及其毗邻部位起源的IVAs 心电图特征进行了系统性分析[7-12]。本文拟对CVS 的解剖、毗邻结构、心电图特征及消融治疗进行归纳总结,旨在指导术者更好地理解和运用此技术,提高其安全性及有效性,推进此项技术的健康发展。
1 适应证与禁忌证
适应证与禁忌证参照“2020 室性心律失常中国专家共识”标准[13]。此外,(1)对比剂过敏;(2)冠状静脉畸形、缺如、闭塞等亦列为禁忌证。
2 冠状静脉解剖
CVS 解剖复杂,走形曲折,分支众多,变异度较大,可行冠状静脉造影术(coronary vein angiography, CVG)明确其解剖特征[14],通常包含以下主要分支[15]:(1)冠状静脉窦(coronary sinus, CS);(2)心大静脉(great cardiac vein,GCV)及其分支;(3)心中静脉(middle cardiac vein, MCV);(4)心小静脉(small cardiac vein, SCV);(5)心前静脉;(6)心最小静脉[16]。冠状静脉大部分汇集成数条静脉,注入CS,开口于右心房,部分细小的静脉直接开口于各心腔。CS 位于冠状沟的后部,长约3~5 cm。CS 的主要属支有:GCV 为CS 的延伸,位于冠状沟,其远端位于邻近二尖瓣环前间隔心外膜,经冠状沟向左,再绕过心左缘至心后面注入CS 的左端,GCV 远端(distal great cardiac vein, DGCV)分为2 个分支,其中一支向前下行走于前室间沟与冠状动脉左前降支(left anterior descending artery,LAD)伴行者为前室间静脉(anterior interventricular vein, AIV),另一支为起源于DGCV 与AIV 交点,为冠状静脉延伸继续向右行走于右心室流出道(right ventricular outflow tract, RVOT)与左心室流出道(left ventricular outflow tract, LVOT)间隔之间者为左心室顶部穿间隔静脉(Summit-CV),GCV 由后向前又分出3 个分支,分别为后侧静脉(posterior lateral vein, PLV)、侧静脉(lateral vein,LV)及前侧静脉(anterolateral vein, ALV),并将GCV 分为近、中、远3 段,DGCV 又分为DGCV2(与AIV 交界处)和DGCV1(其余部位)。MCV 位于后室间沟,向上注入CS 右端,毗邻右冠状动脉(right coronary artery,RCA)。SCV 行于右冠状沟内,绕过心右缘向左注入CS 右端。左心房斜静脉(marshall vein, MV)在左心房后面斜行向下,注入CS 左侧端。另外,还有心前静脉2~3 支,起于右心室前壁,越过冠状沟,直接开口于右心房。数目甚多的心最小静脉从心肌层直接注入各心腔(图1)。

图1 CVS 各主要分支X 线影像、实体解剖及其示意图(A、B:CVS 各主要分支X 线影像;C:CVS 实体解剖;D:CVS 示意图)
冠状静脉一般无瓣膜,仅在大支血管汇入处偶见成对的瓣膜。Thebesian 瓣常位于右心房后壁,覆盖于冠状窦口的上或下部,其面积较小,但有26.7%~30.7%面积较大,可遮盖CS 口,约6%与下腔静脉瓣融合,部分呈条索或网格状(各5.3%),这些均增加了导管自右心房进入CS 的操作难度[17-18]。Vieussens 瓣常见于MV 口部,位于心脏左缘,为CS 与GCV 交点,为光滑、纤细的嵴状结构,约15%较为粗大,可阻碍导管深入[19],此处操作不当可引起冠状静脉破裂甚至心包压塞,需外科修复[20]。
CVS 位于心外膜,毗邻结构较复杂,主要包括:LAD、冠状动脉左旋支等、主动脉瓣-二尖瓣连接处(aorto-mitral continuity, AMC)、RVOT、心外膜脂肪垫等[21]。研究显示,CVS 成功消融的心外膜IVAs 最早激动靶点与各毗邻结构的距离较近:与冠状动脉、心包及左心室心内膜的平均距离分别为(8.1±3.6)、(9.7±3.7)及(7.7±2.7)mm[3,22]。故术前必须明确消融靶点与毗邻解剖,尤其与冠状动脉的距离,避免并发症[22-24]。此外,左心室Summit 区(left ventricular summit,LVS)[25]是一个新的解剖学概念,其在左心室心外膜呈三角形,内缘为LAD,外缘为左旋支,三角形底部为前降支第一穿间隔支与左旋支的连线,DGCV 和AIV 横跨其间,将LVS 分为上下两部分。上方区域毗邻冠状动脉,常被心外膜脂肪组织覆盖,消融导管操作严重受限,故为“消融不可及区”;下方区域行心外膜导管消融相对容易,为“消融可及区”。
3 CVS 起源IVAs 的心电图特征
3.1 CVS 起源IVAs 的心电图特征概述 已有研究提出了心外膜起源IVAs 的心电图判断标准。Ito 等[26]提出QaVL/QaVR>1.4 及V1的S 波≥1.2 mV 有助于心外膜IVAs的判断。Berruezo 等[27]指出假性δ 波时间>34 ms,类本位曲折时间(intrinsicoid deflection time,IDT)>85 ms,RS 波时间(胸导联最早R 波起始点至第1 个S 波最低点的时间)>121 ms 高度提示心外膜起源,但Li 等[11]指出假性δ 波时间在GCV/AIV、RVOT、左心室内膜、主动脉窦起源的IVAs 之间无显著差异。Daniels 等[28]证实最大偏转指数(maximum deflection index,MDI,MDI=IDT/QRS 波时间)>0.55 可鉴别心外膜和主动脉窦起源的IVAs。然而,Yamada 等[29]研究了起源于左冠状窦、AMC 及心外膜(DGCV/AIV)的IVAs,发现MDI 在鉴别起源于主动脉窦和心外膜IVAs 的可信度低,可能与优势传导通路、心肌内部激动及样本选择及误差等因素有关。
笔者对171 例CVS 消融成功的患者进行研究,将患者分为两组:(1)邻近二尖瓣环心外膜组169 例(98.83%),其中邻近二尖瓣环前壁心外膜(DGCV 移行区)156 例(92.31%)占绝大多数,在DGCV1、DGCV2、前室间静脉近段(pAIV)及Summit-CV 标测到“最早”心室电位并消融成功分别为90.00%(27/30)、90.14%(64/71)、77.78%(28/36)及78.95%(15/19);邻近二尖瓣环后壁心外膜8 例(占4.73%),在CS、MCV 及PLV 近段分别为100.00%(1/1)、80.00%(4/5)及50.00%(1/2);邻近二尖瓣环侧壁心外膜5 例(2.96%),在GCV 近中段及PLV 近段分别为50.00%(1/2)及66.67%(2/3)。(2)远离二尖瓣环组2 例(1.17%),其中在前室间静脉中段及后侧静脉中段消融成功各1 例。
CVS 不同部位的心电图特征及其演变有一定的规律(图2):(1)邻近二尖瓣环组主要分布于DGCV 移行区、GCV 近中段、CS 及其他分支近段,由pAIV(Summit-CV)→DGCV2→DGCV1→GCV→CS,即从邻近二尖瓣环心外膜的前间隔→前壁→前侧壁→侧壁→后壁,其心电图特征及变化趋势如下:①pAIV 及Summit-CV 在V192.73%(51/55)有S 波呈Rs、RS 或rS型,7.27%(4/55)无S 波呈R 型;其他部位则相反,91.23%(104/114)无S 波呈R 型,8.77%(10/114)有S 波呈Rs 型(P<0.01);②V5~V6在邻近二尖瓣环后壁、侧壁及DGCV1以近(包括DGCV1)的前侧壁区域81.40%(35/43)呈Rs 型,18.60%(8/43)呈R 型,而DGCV2、Summit-CV 及pAIV92.06%(116/126)呈R 型,7.94%(10/126)呈Rs 型(P<0.01);③下壁导联R 波高度递减而S 波深度递增,由R→Rs(rs)→QS 型;而aVR 与aVL则相反,由QS(其深度递减)变为R 型;④Ⅰ由rs→qs→rs→R 型,Summit-CV 及邻近二尖瓣环后侧壁74.07%(20/27)以正向波为主呈R、Rs 及r 型,25.93%(7/27)以负向波为主呈rS、rs、qr、qs 或QS 型,其他区域则相反,97.18%(138/142)以负向波为主呈rS、rs、qr、qs 或QS 型,仅2.82%(4/142)以正向波为主呈R、Rs 及r 型(P<0.01);(2)远离二尖瓣环组仅2 例,其中mAIV 1例,心电图特征与pAIV 类似,但Ⅰ的QS 波更深,V1~V2呈QS 型是其特征;另1 例在mPLV 消融成功者下壁导联呈QS 型,Ⅰ呈rs 型,aVR 与aVL 呈R 型,V1呈R型,在V5~V6呈Rs 及rS 型。
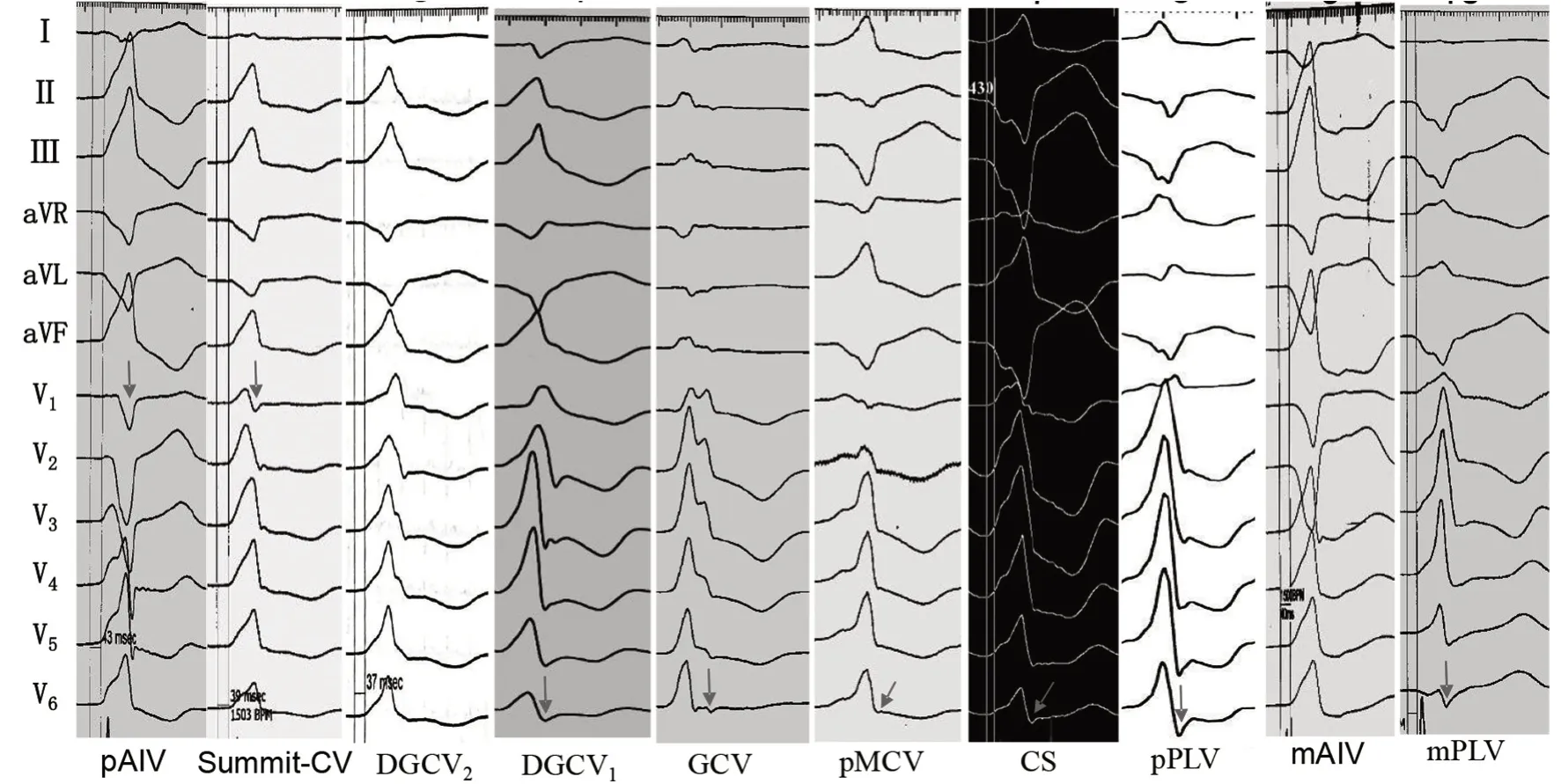
图2 邻近冠状静脉不同部位起源PVCs 体表心电图特征
3.2 CVS 不同部位IVAs 心电图特征的差异 为进一步明确CVS 不同部位IVAs 心电图特征的差异,笔者对5 例消融导管能到达冠状静脉主支及mAIV、后侧静脉中远段(m-dPLV)的患者行CVS 不同部位起搏研究,其12 导联心电图特征见图3。
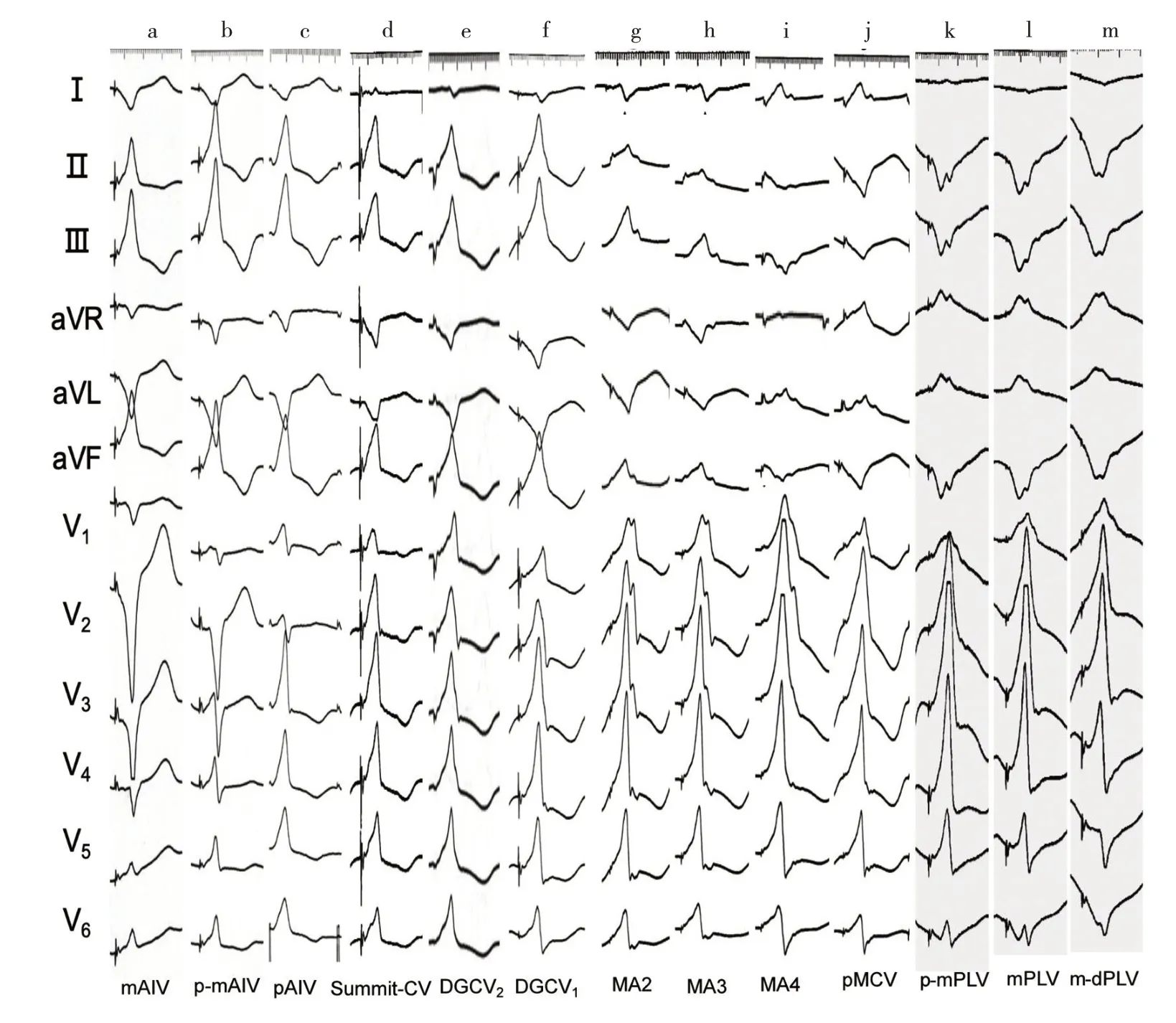
图3 CVS 不同部位起搏的12 导联心电图特征
上述不同部位的心电图演变有以下规律:(1)由pAIV→p-mAIV→mAIV,Ⅰ的S 波深度递增,右胸导联的R 波高度递减,由Rs 变为QS 型,其中在pAIV 及pmAIV 可表现为RV1>RV2(图3a-c);(2)由Summit-CV→DGCV2→DGCV1,Ⅰ的S 波深度递增,r 波高度递减,V1~V2由Rs 变为R 型(s 波消失),在DGCV1V5~V6由R 型变为Rs 型(图3d-f);(3)由MA2→MA3→MA4→pMCV(相当于MA6),Ⅰ由rS 变为R 型,下壁导联由R型(高度较AIV、Summit-CV 及DGCV 低)变为QS 型,V5~V6亦有s 波呈Rs 型,V1~V2亦呈R 或Rs 型(图3gj);(4)由p-mPLV→mPLV→m-dPLV,I 的S 波深度递增,由r 变为rs 或QS 型,V5~V6的R 波高度递减,S 波深度递增,由Rs 变为RS 甚至QS 型(图3k-m)。
3.2.1 CS 近端/MCV 起源(basal crul area)IVAs 的心电图特征 MCV 或CS 近端IVAs,因其位于心底部且相对偏右,故下壁导联呈QS 波;SⅡ>SⅢ,Ⅰ、aVL 呈R 或Rs 型。V1正向,V5~V6呈R 或Rs 型(图2-4)[30-32]。
3.2.2 DGCV 起源IVAs 的心电图特征 因DGCV 位于房室沟较高的位置且偏左,除极向量更多指向Ⅲ,故下壁导联呈高大的R 波;RⅢ>RⅡ,aVL 和aVR 呈QS 型(QSaVL>QSaVR);Ⅰ呈rS 或qs 形;除极的初始向量指向V1并呈R 波。与DGCV2比较,DGCV1更靠左侧,向左除极的向量变小,故前者V4~V6呈Rs 型而后者呈R 型(图2-4)。既往研究显示V1R 波时间>75 ms 为该部位起源的可能[3]。此外,RⅢ升降支双切迹(“尖顶军盔”征)为预测该部位起源的高度特异性指标[12]。Li 等[33]提出Ⅰ呈“w”型提示IVAs 起源于DGCV,其机制可能是该部位在左心室侧上壁,心外膜异位激动产生后向心内膜传导,整体激动顺序自上而下,自左向右,导致QRS 波顿挫明显。
3.2.3 AIV 起源IVAs 的心电图特征 pAIV 起源下壁导联呈高振幅R 波,RⅢ>RⅡ;Ⅰ呈qr 或rS 型为主;aVL、aVR 呈QS 型,QSaVL>QSaVR,且其比值>1.1[33],由于AIV 移行于前室间沟内,靠近V2,故其R 波振幅相对偏低,若RV1>RV2,高度提示AIV 起源;V5~V6呈R 型;胸导联常在V2~V3移行[11,35]。从pAIV→mAIV,即向前向下移动,故下壁、胸导联及Ⅰ的R 波振幅递减,S 波振幅递增,V1~V2呈QS 型(图2-4)。
3.2.4 Summit-CV 起源的心电图特征 因Summit-CV位于心脏上部相对偏右;下壁导联呈R 波,RⅡ>RⅢ[11],aVL 和aVR 呈QS 型;因其毗邻左心室前间壁,故Ⅰ为负向波为主,但在其中远段可呈正向R 波(图4),V1呈r 波或rs 型,r/s 比值为0.67±0.33;移行区在V3之前;V5~V6呈R 型[35]。

图4 CVS 各主要分支特征性心电图
4 消融导管到位方法及消融
4.1 消融导管的标测与消融 建议遵从以下心脏标测顺序:先在RVOT、LVOT 或左心室心内膜进行标测,无理想靶点或试消融无效,最后经CVS 不同区域进行标测与消融[17],以确定IVAs 心室激动的“最早”部位。在手术过程中,优选在三维电解剖标测系统(强生公司CARTO 或圣犹达NavX)下行详细的激动顺序标测,同时进行起搏标测以捕捉最早激动部位的心室肌[36-37]。结合起搏标测,根据IVAs“最早”激活时间选择合适的消融靶点。
将CVS 视为IVAs 的起源时,需对CVS 行精细标测。对于CVS 起源IVAs 的导管操作,可采用两种方法即传统方法和Swatz 鞘支撑法进行[38]。此外,对可能Summit-CV 起源的IVAs,因其血管极细,可尝试使用2F 微导管协助标测[39]。
双极导管标测到领先的长程多峰碎裂的心室前电位提示可能为潜在消融靶点[38,40]。对IVAs 是否起源于壁内,可通过激动标测联合CVS 内冷盐水灌注协助判断,若自发IVAs 一过性消失,壁内起源可能性大(灵敏度90%,特异度88%)[41]。因存在优势传导[42],起搏标测可能受限,即使激动标测明显提前或成功消融位点,起搏与自发IVAs 的形态也未必吻合。近年来,一些新的标测技术逐渐兴起,心磁图联合CT 的标测方式具有非接触、准确度高等特点,当传统标测技术难以锁定靶点时可予尝试[42]。少数可经剑突下穿刺至心包腔进行心外膜标测[43]。
消融前均行冠状动脉造影明确靶点与冠状动脉的关系,放电过程中连续透视观察消融导管位置,一旦移位,立即停止放电,消融成功后再次行冠状动脉造影了解其血运状况。此区域阻抗很高,常为200~300 Ω,故选择盐水灌注导管,预设温度43 ℃,预置能量25~35 W,阻抗300 Ω(如放电困难则关闭),盐水流速30~60 ml/min,有效靶点定义为放电15 s 内IVAs 终止,或放电中出现与自发IVAs 形态相同的频发PVCs或短阵室性心动过速并很快消失。有效靶点继续放电60~90 s,消融后观察30 min,以IVAs 消失,电刺激及异丙肾上腺素静脉滴注等原先诱发IVAs 的方法不再诱发为消融终点。如试放电15 s 后IVAs 未终止则重新标测。
4.2 消融操作的解剖学障碍 对于CVS 的消融,了解CVS 解剖结构至关重要,除上文所述的Thebesian 瓣和Vieussens 瓣之外,还应注意以下结构:(1)GCV 沿二尖瓣外侧部延伸至二尖瓣环前外侧心外膜处的DGCV,弯曲的GCV 形态可能限制导管的前行。(2)DGCV 在左心室顶部的主动脉瓣尖下方转变为AIV,AIV 与DGCV2的夹角具有很大的个体变异性。若其呈锐角则消融导管难以到达pAIV。(3)交通静脉是指位于GCV和圆锥支之间非常细的静脉,流向SCV,而Summit-CV是一种独特的冠状静脉,位于DGCV 和AIV 之间过渡区远端的主动脉环和肺动脉环之间,与LVS 的上部密切相关。(4)Summit-CV 的管壁很薄,限制了其详细标测和消融。总之,静脉瓣膜的阻碍、GCV 的偏斜、DGCV 和AIV 之间的锐角、Summit-CV 薄的管壁都是阻碍DGCV-AIV IVAs 导管消融的潜在解剖因素。
4.3 典型病例 患者男性,77 岁。心悸、胸闷半年。心电图示持续性室性心动过速,RR 间期0.35 s(频率171 次/min),其QRS 波群在下壁导联呈QS 型,在Ⅰ、aVR 及V1~V6呈R 或Rs 型,aVL 呈qr 型(图5A,见插页),考虑邻近二尖瓣环后侧壁室性心动过速。结果在邻近二尖瓣环后侧壁标测到“最早”V 波领先体表心电图QRS 波-43ms(图5B,见插页),单极标测呈QS 型,此处起搏与自发PVC 的QRS 波95.6%相似(图5C,见插页),拖带标测其起搏后间期=31 ms,预设温度43 ℃,能量35 W,阻抗150 Ω,盐水流速17 ml/min 试消融,反复多次持续放电约30 s,室性心动过速的频率从171 次/min 下降至159 次/min,但不能终止;此时考虑其对应心外膜起源可能,故经冠状静脉进行标测,结果在pLV 标测到“最早”V 波领先体表心电图QRS 波达-58 ms,单极标测呈QS 型(图5D,见插页),此处起搏未能夺获心室,X 线影像及三维标测提示在PLV(图5E,见插页),此处预设温度43 ℃,能量30 W,阻抗300 Ω,盐水流速60 ml/min 试消融约15 s 室性心动过速终止(图5F 及E 红点,见插页),巩固放电90 s,观察30 min再次电生理检查未诱发室性心动过速。术后随访1 年半无复发。
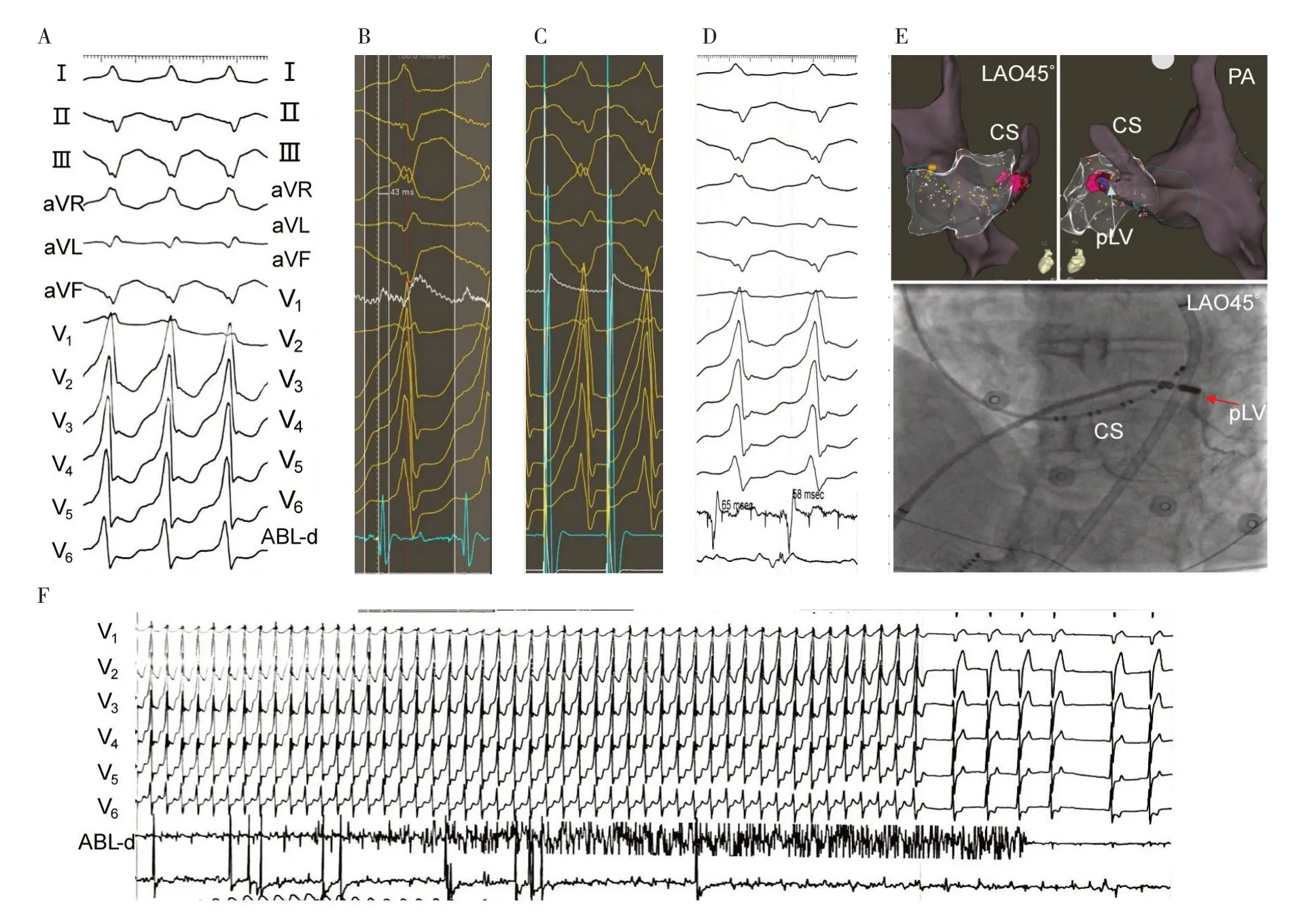
图5 典型病例经后侧静脉标测与消融左心室心外膜PVC 的心电图(A:特发性室性心动过速发作时体表12 导联心电图;B:邻近二尖瓣环心内膜后侧壁“最早”激动点标测腔内电图;C:邻近二尖瓣环心内膜“最早”激动点起搏标测结果;D:后侧静脉激动标测腔内电图;E:有效靶点三维标测及X 线影像;F:有效靶点放电时的反应)
5 有效靶点腔内双极电图特征
笔者曾对243 例心室流出道心外膜不同区域IVAs的有效靶点腔内双极电图进行观察。根据IVAs 时有效靶点或“最早”激动点腔内双极电图V 波特征、是否存在特殊电位及其时程和振幅,将其定义为以下几种类型。(1)初始短程碎裂电位:为V 波前的多峰(2~3波峰)短程碎裂电位,时程<V 波时间的30%并与V 波初始融合;(2)初始高幅尖峰电位:为V 波起始部的高幅尖峰(单峰)电位;(3)长程丛集和稀疏碎裂电位:为多峰碎裂电位,时程占V 波时间≥50%。波峰数目>5个,最大间距<2 mm 为丛集碎裂电位;波峰数目≤5个,最大间距≥2 mm 为稀疏碎裂电位;(4)前序尖峰电位:为V 波前的尖峰(单峰)电位,与V 波间有等电位线。上述特殊电位波幅≤2 mm 为低幅而>2 mm 为高幅电位,可伴或不伴电位翻转(窦性心律时特殊电位在V 波后部,PVC 时翻转至V 波之前)。(5)其他:除V波外,未见其他特殊电位。结果发现心室流出道心外膜不同区域IVAs 有效靶点腔内双极电图特殊电位的类型有差异[38,40,43]。(1)DGCV 组表现为或高幅长程丛集或稀疏碎裂电位,明显高于PSC 组及ASC 组;(2)ASC组表现为初始短程碎裂电位,明显高于DGCV 组及PSC 组;(3)PSC 组表现为初始高幅尖峰或多峰电位,明显高于DGCV 组及ASC 组;(4)PSC 组伴电位翻转,明显高于ASC 组及DGCV 组。
DGCV 移行区有效靶点腔内双极电图常见特征见图6,表现为长程高幅多峰丛集或稀疏碎裂电位。
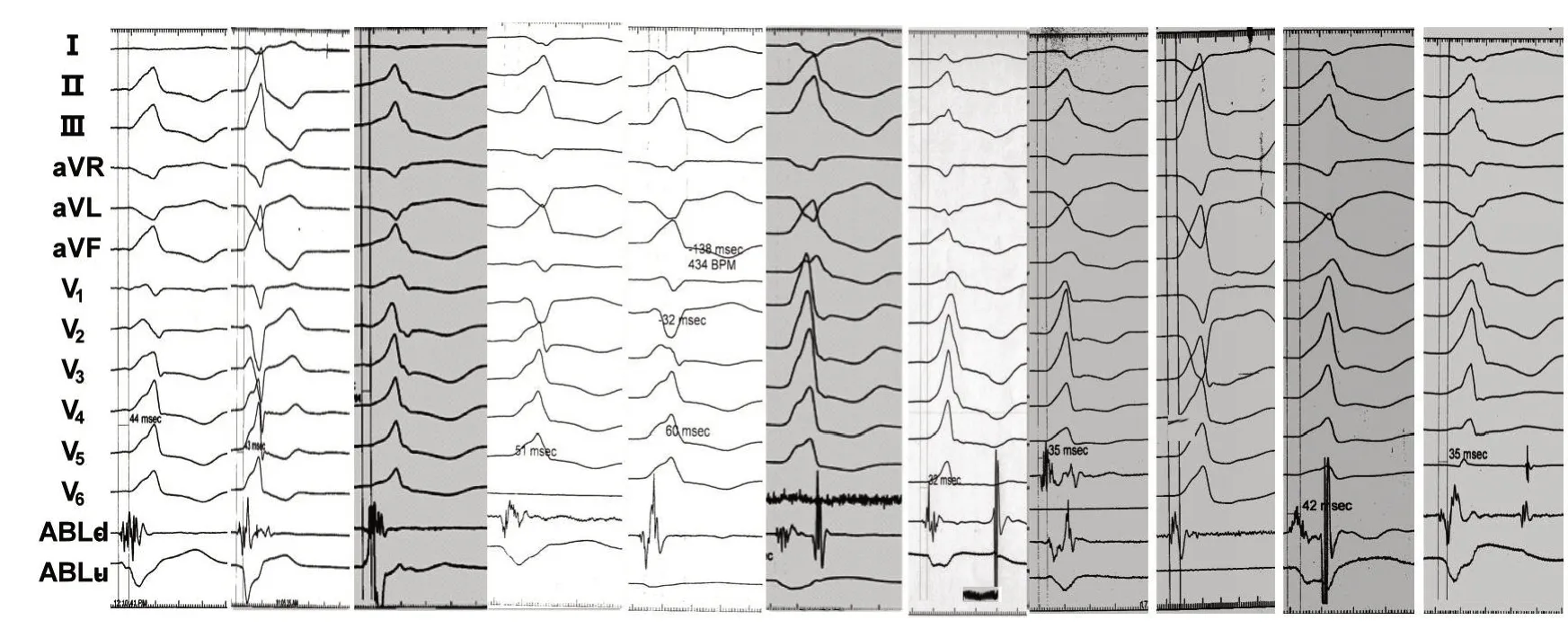
图6 DGCV 移行区有效靶点腔内双极电图常见特征,表现为长程高幅多峰丛集或稀疏碎裂电位
6 CVS 不同部位阻抗变化及高阻抗处理策略
因冠状静脉主支(从CS 至DGCV)管腔内径较大,血流速度较快,消融时一般不产生较高的阻抗。随着冠状静脉向远端移行,管腔逐渐变小,血流速度逐渐变慢,普通电极导管放电后局部阻抗快速升高,难以达到额定功率[4],无法经心室肌透壁传递足够的消融能量,进而影响消融成功率。
6.1 CVS 阻抗变化特征 CVS 阻抗较高,其部位、初始阻抗、盐水流速和消融仪不同等多种因素对消融术中的阻抗均有影响。试消融前(盐水流速30~60 ml/min)阻抗均较初始(盐水流速2 ml/min)明显下降,且初始阻抗越高,降幅越大。进一步研究发现,在使用同种消融仪而盐水流速不同时,其阻抗降幅随盐水流速的增加而递增;反之,盐水流速相同而消融仪不同时,SES(Stockert ep shuttle,美国强生公司)的阻抗均高于T11 组(IBI-1500T11,美国雅培公司)。
6.2 CVS 高阻抗的对策 冠状静脉远端移行区行消融首选冷盐水灌注消融导管,其能更均匀冷却消融电极,有效提高功率输出并减少血栓形成。动物研究发现,在心外膜使用4 mm 的冷盐水灌注导管较普通导管能产生更深的心肌损伤[(6.7±1.7)mm 比(3.7±1.3)mm,P<0.05][44]。采用温控模式,能量设置为15~50 W,电极-心肌组织温度范围为43~48 ℃,盐水流速为15~60 ml/min[4,12,45]。因高阻抗,笔者术中采用以下几种分级处理策略:(1)重置消融仪上限阻抗为300 Ω;(2)加快盐水流速至30~60 ml/min;(3)上述处理后若放电前阻抗仍>300 Ω,或可降至300 Ω 以下,但放电后迅速攀升>300 Ω,且难以持续放电,则关闭阻抗;(4)若仍因高阻抗放电困难,则将消融仪由SES 更换为T11,并重复上述各种方法行试消融;(5)盐水由泵注改为手推,以加快其灌注流速;(6)若仍失败,则最后上调消融仪上限温度至45 ℃甚至更高(最高48 ℃)。
7 其他消融策略
近年来一项前瞻性多中心研究已证实半生理盐水能在低流量灌注速度下成功消融IVAs,远期效果良好[46]。此外,对于单极消融效果不佳的难治性IVAs 可尝试双极消融[47-48]。
8 放电时注意事项
经冠状静脉进行标测与消融IVAs 时应注意:(1)CVS 解剖结构复杂,管壁较薄且毗邻冠状动脉,直接到位较困难,多数需要Swatz 鞘支撑及CVG 引导方可到位。(2)因消融导管的直径与DGCV 及分支类似,血流缓慢,阻抗很高,是影响有效放电及消融成功率重要因素。(3)试消融靶点的选择与RVOT 起源IVAs 相似,除注意心室电位领先程度(一般≥30 ms)外,腔内双极电图应选择小A 大V 波(A:V≤1,但DGCV 因其前方比邻左心耳,靶点常呈大A 小V)。(4)因管壁较薄有导致冠状静脉破裂甚至心包压塞的风险,故导管操作宜轻柔。(5)Swatz 鞘需在消融导管的引导下移动,以防冠状静脉穿孔及心包压塞。(6)消融时应注意患者是否有胸痛等症状或心电监护提示ST 段抬高,需警惕冠状动脉损伤、痉挛或血栓栓塞。
